2014秋季分析化学期中考试
- 格式:doc
- 大小:42.50 KB
- 文档页数:2

江苏省无锡市2014届高三上学期期中调研考试化学试题第I卷选择题(共40分)注意事项:1.本试卷满分120分,考试时间100分钟。
2.请将答案填写在答题卷上,凡填写在试卷上一律无效;交卷只需交答题卷。
可能用到的相对原子质量:H-1 C-12 O-16 K-39 Fe-56 Mn-55单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个选项符合题意。
1.2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。
能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是A.点燃,能燃烧的是矿物油B.测定沸点,有固定沸点的是矿物油C.加入水中,浮在水面上的是地沟油D.加入足量氢氧化钠溶液共热,不分层的是地沟油【答案】D【解析】地沟油(加工过的餐饮废弃油)是油脂,矿物油(汽油、煤油、柴油等)是碳氢化合物,则A.点燃,二者均能燃烧,错误;B.二者均为混合物,均没有固定沸点,错误;C.二者密度都比水小,加入水中,都浮在水面上,错误;D.加入足量氢氧化钠溶液共热,地沟油水解不分层,正确。
2.下列有关化学用语表示正确的是A.中子数为20的氯原子:20Cl B.NH3分子的电子式:17C.铝原子的结构示意图: D.聚丙烯的结构简式为【答案】C【解析】A、该氯原子质量数为37,错误;B、氮原子最外层漏写了一对孤对电子,错误;C、核内质子数等于核外电子数,正确;D、甲基不会在主链节上,其连接只有两个碳原子,错误。
3.常温下,下列各组离子在指定的水溶液中一定能大量共存的是A.使甲基橙变红的溶液:K+、Al3+、SO42-、NO3—B.c(H+)=1×10—13mol·L—1的溶液:Na+、NH4+、SO42-、CO32-C. c(Fe2+)=1.0 mol·L—1的溶液:H+、K+、Cl-、NO3—D.含有大量Fe3+的溶液:Mg2+、Na+、SCN—、Cl—【答案】A【解析】A.使甲基橙变红的溶液呈酸性,均能存在,正确;B.c(H+)=1×10—13mol·L—1的溶液呈碱性则NH4+不存在,错误;C.Fe2+与H+、NO3—发生氧化还原反应不共存,错误;D. Fe3+与SCN—能反应不共存,错误。

2014年秋季化学期中考试总结2014年秋季化学期中考试总结高一期中考试按计划已圆满地结束了。
从考试的结果看,考试前让学生做的一些事情都或多或少有了一定的效果。
现将考前考后的一些做法做一小结,以便以后教学中参考。
考试的内容:本次考试主要考查内容为高中化学必修1第一、二章以及第三章第一节的内容。
从卷面上看,第I卷为选择题部分,共 20小题,共六十分,每题三分。
其中,4、9、10、11、15、 17 题对学习能力差的同学较难。
第 4 题、第 17 题涉及实验部分知识点考察,可能因为平时实验做得较少,因此学生对涉及实验现象的内容理解不到位,正确率较低。
第 II 卷非选择 4 道小题,其中,21题为实验题,配制一定物质的量浓度的溶液,题型常规比较,但学生答题术语不够准确,答案不够精准而十分。
针对该题要将基础知识继续巩固加强,保证会就要对,要拿分。
第22,23为涉及到离子方程式的书写:体现学生读题不细,理解能力欠缺。
学生将离子方程式写成化学方程式,对题目解读不正确而做错。
要提高学生的理解和应用能力。
第24题为计算题,计算题一直以来是学生的一大弱点,要加强基础知识的巩固,对公式,化学方程式一定要求学生掌握。
从成绩来看,这学期我教两个班,成绩基本反映出学生近期的学习状态,也基本上是班级情况的反映,当然也存在一些不真实的情况。
其中,高一(26)班,近一段时间整体气氛比较浮躁,课堂效果有所下降,成绩也下降了。
高一(25)班,虽然成绩还不是很理想,但无论是整体成绩还是化学单科成绩都成上升趋势,有所进步,学生们也为进步而高兴,也对未来充满信心,这段时间状态较好。
我觉得在接下来的实习工作中应该做好以下这几项工作:第一必须每天都扎实在做好备课与辅导工作。
上课时间少了,只有从课堂效率上入手,课前将学生定时定量应知应会的东西整理好,在课堂上比较流畅的讲解,适当控制好学生的学习行为。
想尽一切办法,提高学生在课堂上的学习效率。
第二辅导工作要加强,高中课程比较重,课余时间较少,两次周内的辅导就成了加强学习的重要时刻,因此在晚自习辅导时要尽可能的调动学生学习的积极性。

第Ⅰ卷选择题(共44分)本题共有22小题,每小题2分,每小题只有一个选项符合要求。
1、金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生命金属”之称。
下列有关4822Ti和5022Ti 的说法中正确的是()A.4822Ti和5022Ti中均含有22个中子B.4822Ti和5022Ti核外均有4个电子层C.分别由4822Ti和5022Ti组成的金属钛单质互称为同分异构体D.4822Ti和5022Ti的性质完全相同2、图1为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,下说法中不正确...的是()图1A.原子半径大小顺序是c>b>d>aB.d的氢化物比a的氢化物稳定C.a和d的原子结合可以形成带3个负电荷的阴离子D.a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a3.下列各组物质熔点高低的比较,正确的是( )A.晶体硅>金刚石>碳化硅B.MgO>KCl>NaClC.Al>Mg>Na D.Cl2>Br2> I24、许多国家十分重视海水资源的综合利用。
下列不需要化学变化就能够从海水中获得的物质是( )A.氯、溴、碘B.食盐、淡水C.烧碱、氢气D.钠、镁、铝5、合金与纯金属制成的金属材料相比,合金的优点是()①合金的硬度一般比它的各成分金属的硬度大②一般地,合金的熔点比它的各成分金属的熔点更低③改变原料的配比、改变生成合金的条件,得到有不同性能的合金④合金比纯金属的导电性更强⑤合金比纯金属的应用范围更广泛A .①②③⑤B .②③④C .①②④D .①②④⑤6、图表归纳是学习化学的一种常用方法,某同学表中归纳的内容与图2对应正确的是( )图27、常温下,下列各组离子在指定溶液中一定能大量共存的是A .使甲基橙变红色的溶液:Mg 2+、K +、SO 42- 、NO 3-B .使酚酞变红色的溶液:Na +、Cu 2+、HCO 3- 、NO 3-C .0. 1 mol·L -1AgNO 3 溶液:H +、K +、SO 42- 、I -D .0. 1 mol·L -1NaAlO 2 溶液: H +、Na +、Cl -、SO 42-8、下列离子方程式书写正确..的是 A .铝粉投入到NaOH 溶液中:2Al+2OH -══ 2AlO 2-+H 2↑B .AlCl 3溶液中加入足量的氨水:Al 3++ 3OH - ══ Al(OH)3↓C . 三氯化铁溶液中加入铁粉 ++=+232FeFe Fe D . FeCl 2溶液跟Cl 2反应:2Fe 2++Cl 2=2Fe 3++2Cl -9、 在常温下发生下列反应:(1)16H ++10Z -+2XO -4===2X 2++5Z 2+8H 2O (2)2A 2++B 2===2A 3++2B -(3)2B -+Z 2===B 2+2Z -根据上述反应,判断下列结论中错误的是( )A .溶液中可能发生反应:Z 2+2A 2+===2A 3++2Z -B.Z2在(1)、(3)反应中作还原剂C.氧化性强弱顺序为:XO-4>Z2>B2>A3+D.X2+是XO-4的还原产物10、在下列变化:①工业制盐酸;②工业制漂白粉;③实验室制氯气中,按氯元素被氧化、被还原、既被氧化又被还原的顺序排列,正确的是()A.①②③B.②①③ C.③①②D.①③②11、下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是①NaHCO3②Al2O3③Al(OH)3④AlA.③④B.②③④ C.①③④D.全部12、有关纯碱和小苏打的叙述正确的是()A.等质量的Na2CO3、NaHCO3分别与足量稀盐酸反应,NaHCO3产生的CO2多B.等质量的Na2CO3、NaHCO3分别与足量的同种盐酸反应,NaHCO3消耗的盐酸多C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中加入Ba(OH)2 溶液出现白色沉淀D.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应13、二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(如图)。
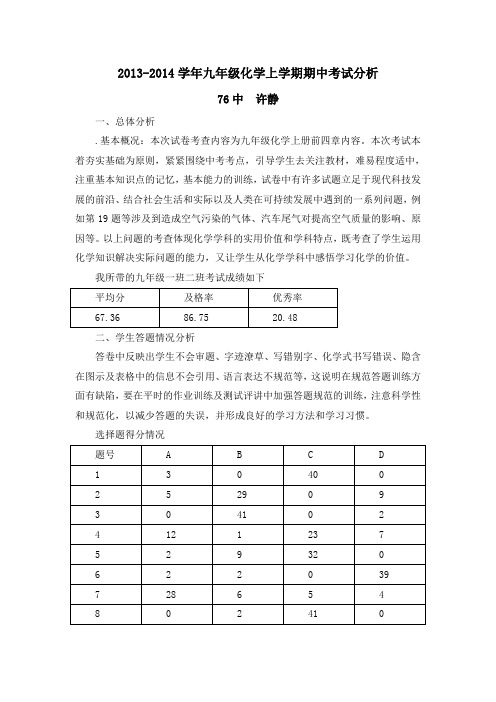
2013-2014学年九年级化学上学期期中考试分析76中许静一、总体分析.基本概况:本次试卷考查内容为九年级化学上册前四章内容。
本次考试本着夯实基础为原则,紧紧围绕中考考点,引导学生去关注教材,难易程度适中,注重基本知识点的记忆,基本能力的训练,试卷中有许多试题立足于现代科技发展的前沿、结合社会生活和实际以及人类在可持续发展中遇到的一系列问题,例如第19题等涉及到造成空气污染的气体、汽车尾气对提高空气质量的影响、原因等。
以上问题的考查体现化学学科的实用价值和学科特点,既考查了学生运用化学知识解决实际问题的能力,又让学生从化学学科中感悟学习化学的价值。
我所带的九年级一班二班考试成绩如下平均分及格率优秀率67.36 86.75 20.48二、学生答题情况分析答卷中反映出学生不会审题、字迹潦草、写错别字、化学式书写错误、隐含在图示及表格中的信息不会引用、语言表达不规范等,这说明在规范答题训练方面有缺陷,要在平时的作业训练及测试评讲中加强答题规范的训练,注意科学性和规范化,以减少答题的失误,并形成良好的学习方法和学习习惯。
选择题得分情况题号 A B C D1 3 0 40 02 5 29 0 93 0 41 0 24 12 1 23 75 2 9 32 06 2 2 0 397 28 6 5 48 0 2 41 09 10 11 2 2010 36 1 3 3从得分情况上看失误的题主要集中在2、4、7、9上就这几道失误较多的题分析如下。
第二题错误选项主要集中在“D无色无味的氧气在高压下变成蓝色的液体”学生错误的原因是化学反应的实质没弄清楚,误以为有颜色变化的就是发生了化学反应。
第4题错误主要集中在C排水法收集气体上。
其实学生主要是对滴定管的使用方法不清楚,忘记了公用滴定管要洗,而配套使用的滴定管不需要清洗,错误的原因是这个知识点的回顾不够,复习时没有做为重点复习。
第7题B、C、D各选项均有学生错选,主要是学生对物质的构成不理解,不知道那些物质是由分子构成的,哪些是由分子构成的,化学式表达的意义掌握的还可以。


2014届高三上学期期中考试化学试卷一、单项选择题:本题包括10小题,每小题2分,共计20分.每小题只有一个选项符合题意.1.(2分)化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法正确的是()①用高效半导体照明灯取代白炽灯,有利于节能减排②研发安全特效药物,有利于抵御人类疾病③规范食品添加剂生产和科学使用,有利于保障人体健康和生命安全④推广城市生活垃圾处理的减量化、资源化、无害化技术,有利于环境保护和资源的充分利用分子的电子式:铝离子结构示意图:比例模型电子式为,=0.09mol8.(2分)短周期元素W、X、Y和Z的原子序数依次增大.金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的10.(2分)类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质.但类二、不定项选择题:本题包括5小题,每小题4分,共计20分.每小题只有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分.12.(4分)A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.则下列说法正确的是()+2Fe+2Al13.(4分)锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3+3O2+6Fe Sb4O6+6FeS ②Sb4O6+6C4Sb+6CO↑14.(4分)(2011•广东)下列实验现象预测正确的是()15.(4分)某同学设计如下实验测量m g铜银合金样品中铜的质量分数:下列说法中不正确的是()铜的质量分数为:,所以合金中银的质量为×三、非选择题16.(16分)(2012•浙江模拟)大气中SO2和NO x是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl﹣、SO32﹣、SO42﹣、NO3﹣和NO2﹣等.某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH 溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.已知:K sp(Ag2SO4)=1.20×10﹣5请回答下列问题:(1)该酸雨中肯定存在的离子有SO42﹣、NO3﹣、NH4+;肯定不存在的离子有SO32﹣、NO2﹣,说明其不存在的理由:SO32具有较强的还原性,酸性条件下,与NO3不能共存;若有NO2﹣,能使酸性KMnO4溶液褪色.(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:6I﹣+2NO3﹣+8H+=3I2+2NO↑+4H2O.(3)设计实验方案,检验该试液中是否存在Cl﹣:取少量试液,滴加足量的Ba(NO3)2溶液,静置;取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl.(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2、NO2+SO2=SO3+NO,再喷射适量蒸馏水即得硫酸型酸雨.说明NO的作用:催化剂.17.(12分)(2011•镇江模拟)工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是铁表面被钝化.(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.①甲同学认为X中除Fe3+外还可能含有Fe2+.写出生成Fe2+所有可能的离子反应方程式:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+.若要确认其中有Fe2+,应选用d(选填序号).a.KSCN溶液和氯水b.铁粉和KSCN溶液c.浓氨水d.酸性KMnO4溶液②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:SO2+Br2+2H2O=2HBr+H2SO4.然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为66.7%.=的体积分数:18.(12分)实验室里可用如图一所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质.图一中①为氯气发生装置;②的试管中盛有15mL 30%的KOH溶液,并置于水浴中;③的试管中盛有15mL 8%的NaOH溶液,并置于冰水浴中;④的试管中加有紫色石蕊试液;⑤为尾气吸收装置.(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸(填写试剂名称).(2)为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有b(选填字母编号)的净化装置.a.碱石灰b.饱和食盐水c.浓硫酸d.饱和碳酸氢钠溶液(3)本实验制取次氯酸钠的离子方程式是Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.(4)比较制取氯酸钾和次氯酸钠的条件,两者的差异是反应的温度不同、反应物浓度不同.(5)反应完毕经冷却后,②的试管中有大量晶体析出,图二中符合该晶体溶解度随温度变化规律的曲线是M(选填字母);从②的试管中分离该晶体的操作是过滤(填写实验操作名称).(6)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为红色,原因是氯气与水反应生成酸使石蕊显红色;接着溶液逐渐变为无色,是因为氯气与水反应生成次氯酸将石蕊氧化为无色.19.(14分)(2011•安徽)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下(1)第①步加稀H2SO4时,粗MnO2样品中的MnO和MnCO3(写化学式)转化为可溶性物质.(2)第②步反应的离子方程式:5Mn2++2ClO3﹣+4H2O=5MnO2+Cl2↑+8H+.(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有NaCl(写化学式).(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下载),则在第②步反应中至少需要0.02mol mol NaClO3.20.(12分)焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.其制备工艺流程如下:已知:反应Ⅱ包含2NaHSO3Na2S2O5+H2O等多步反应.(1)反应I的化学方程式为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl,反应Ⅰ进行时应先通入NH3气体.(2)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,目的是增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率.在上述工艺流程中可循环使用的物质是CO2、H2O.(3)反应Ⅱ中需控制参加反应的气体与固体的物质的量之比接近2:1,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低.(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O5+2H=2SO2↑+H2O.3321.(14分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:(1)Y在元素周期表中的位置为第二周期第ⅥA族.(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3、Cl2(写出其中两种物质的化学式).(4)X2M的燃烧热△H=﹣a kJ•mol﹣1,写出X2M燃烧反应的热化学方程式:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l),△H=﹣2aKJ•mol﹣1.(5)ZX的电子式为;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.故答案为:;。
唐河县2014年秋期期中九年级学业水平测试化学试题参考答案注意事项:1.答出其他合理答案,请参照评分标准给分。
2.没有特别要求写化学式的,写化学式或名称均得分。
二、填空题(每个化学方程式2分,其它每空1分,共30分)21.O N 2 Hg Mg 2+4CO 2、 O 2 22.略23.(1)混合物 肥皂水 煮沸或蒸馏(2)ABCD (漏选不得分)(3)CD (漏选不得分)(4)2H 2O = 2H 2↑ +O 2↑ 24.3 B 8 MgCl 2 25. 氮气 2CO+2NON 2+2CO 226.(1)E 滴管(2)坩锅钳(3)F 27.(1)①②③⑤(1)2C 8H 10 +21O 2点燃16CO 2 +10H 2O (3)密封保存,严禁烟火三、简答题(共23分)28. (6分)(1)3Fe +2 O 2 点燃Fe 3O 4 (2)CH 4 +2O 2 点燃CO 2 +2H 2O (3)Zn+2HCl=ZnCl 2+H 2↑ 29.(4分)(1)目的:探究分子是在不断地运动的。
(2)说明:空气中的分子不能使酚酞变红,氨分子才能使酚酞变红,这是一个对比试验。
(合理即可)30.(4分)(1)分子在不断运动 (2)分子构成不同 (3)水分子的间隙随温度的升高而增大 (4)二者都是由水分子构成31. (3分)(1)C +H 2OCO +H 2(2)化学变化中,分子可分而原子不可分(或分子是由原子构成的;化学反应前后,原子的种类、数目不变等)32.(6分)(1)4P+5O 2 2P 2O 5 (2) 1/5 (3)红磷不足(或装置漏气等合理答案即可)(4)不能。
因为碳燃烧生成二氧化碳气体,压强变化不大,进入水量减少。
四、综合应用题(本大题包括2个小题,共17分) 33.(3分)(1)三 (2) 10:3:12 (3) 0.634.(1) 试管 长颈漏斗(2) BC 或 BE 或BF 2H 2O 2 2H 2O+O 2↑ (3) 先把导管移出水槽,再熄灭酒精灯 a(4) 2 KClO 3 2KCl + 3O 2↑ 分解反应高温 通电MnO 2△MnO 2(5)将带火星的木条伸到集气瓶中,木条复燃即可验证。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Al-27 K-39 Ca-40Mn-55 Fe-56 Ag-108选择题(共44分)一、单项选择题:本题包括22小题,每小题2分,共计44分。
每小题只有一个选项符合题意。
1、我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。
实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。
这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。
下列说法正确的是A.“钴酞菁”的小分子没有胶体粒子的性质;B.纳米材料可以应用于所有化工领域;c.现在纳米器件都是无所不能的胶体D.此工作实现了利用局域的化学反应来改变和控制分子的物理性质2、判断下列有关化学基本概念的依据正确的是A.溶液与胶体:本质不同的原因是能否发生丁达尔效应B.共价化合物:是否含有共价键C.强弱电解质:溶液的导电能力大小D.氧化还原反应:元素是否发生电子转移3、传统的自来水消毒常采用漂白粉等强氧化剂,但其产生的有机氯对人体有一定的危害。
一种新型的消毒剂——高铁酸盐(如Na2FeO4或K2FeO4)能有效地杀灭水中的细菌和病毒,同时其产物在水中经过变化后能除去水中的微细悬浮物。
在以上变化过程中不可能...涉及的变化有A . 电离 B. 水解 C. 置换反应 D. 氧化还原反应4、元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。
下列有关推测正确的是A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XYB.XYZ3是一种微溶于水的盐,且Y与Z可形成共价化合物化合物YZ或YZ2C.XYZ3是一种易溶于水的盐,且X与Z可形成离子化合物XZD.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ35、化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式不正确的是A.过氧化氢跟酸性高锰酸钾溶液反应:5H218O2+2KMnO4+3H2SO4==5 18O2↑+K2SO4+2MnSO4+8H2O酸或碱B.乙酸乙酯水解:CH3CO18OCH2CH3+H2O CH3COOH+CH3CH218OHC.铝粉跟NaOH的D2O溶液反应:2Al+2OH-+6D2O==2Al(OD)3(OH)-+3D2↑D.氯酸钾跟浓盐酸混合:K37ClO3+6HCl==K37Cl+3Cl2↑+3H2O6、下列叙述正确的是(N A为阿伏伽德罗常数)A.标况下,22.4L苯的分子数为N AB.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4 N AC.0.5 mol·L-1 CuCl2溶液中含有0.5N A个Cu2+D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2N A7、亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2LiNH2+LiH,下列有关说法正确的是A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂C.Li+和H-的离子半径相等D.此法储氢和钢瓶储氢的原理相同8、用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。
一、填空题(每空? 分,共? 分)1、用适当的化学用语或文字填空:(1)2个氨分子 (2)氧化钙中钙元素显+2价 (3)FeCl 2名称(4)2OH —含义 (5)铝离子____________ (6)3个硝酸根离子___________2、指出下面数字的含义3S 2—(1)“3” (2)“2”(3)P 2O 5中“5”____________________3、在宏观、微观和符号之间建立联系是化学学科的特点。
(1)下图中甲是___________。
(2)在①汞②氮气③氯化钠④氦气⑤二氧化碳五种物质中,由分子构成的是________,由原子构成的是 ,由离子构成的是 。
(填序号)(3)下图为某化学反应的微观模拟图,①丙中C 、H 、O 元素原子个数比为 ; ②该反应的基本类型是 ;③甲在物质的分类里面属于纯净物中的__________。
4、水是一种重要的自然资源。
(1)污水很远就能闻到臭味,是因为_____________________。
(2)水厂处理水时,有时会向水中加明矾,此过程发生的是_________(选填“物理”或“化学”)变化。
日常生活中,降低水硬度的方法是_______。
(3)高铁酸钠(Na 2FeO 4)是净水剂,高铁酸钠中铁元素的化合价为 。
(4)净化水过程中活性炭起_________作用。
(5)既要杀灭细菌,又要得到纯净的水,可以通过 操作来实现。
(6)电解水时,在水中加硫酸钠的目的是_______________。
(7)右图所示是水的电解实验,试管A 中收集的气体是__________,试管B 中收集的气体可用 来检验 5、下表是元素周期表的一部分,据此回答下列问题。
(1)表中12号元素的名称是 ,该元素的原子在化学反应中易 (填“得到”或“失去”)电子,形成离子,其离子符号是。
(2)从原子结构入手,找出第三周期元素为什么处于同周期______________。
(3)原子序数为8和13的两种元素组成的化合物是 (写化学式)(4)右上图是元素锶(Sr)的原子结构示意图,则x=,锶元素的氧化物的化学式为。
2013—2014学年初三上学期期中考试化学试卷班级:姓名:(全卷满分100分,考试用时100分钟)可能用到的相对原子质量:H—1 C—12 N—14 O—16 P—31 K—39第Ⅰ卷选择题请注意:请将..第Ⅰ卷的....,填在......第Ⅰ卷选择题的答案..答案栏中.........填写第...3.页的试卷上..!...无效一、选择题(下列各题只有一个选项符合题意,共22题,每小题2分,共44分)1.下列各组日常生活中发生的变化,属于化学变化的一组是A、水变蒸气B、瓷碗破碎C、菜刀生锈D、灯泡发光2.下列实验操作错误..的是3..空气的成分中,体积分数约占78%的气体是A.氮气B.氧气C.二氧化碳D.稀有气体4.实验室用高锰酸钾制取氧气时有如下操作步骤:①点燃酒精灯,②检查装置的气密性,③装药品,④用排水集气法收集,⑤把导气管撤离水面,⑥熄灭酒精灯,⑦连接仪器,⑧把试管固定在铁架台上。
其中操作顺序正确的是A、②⑦③⑧①④⑥⑤B、⑦②③⑧①④⑤⑥C、⑤⑦⑧③②①④⑥D、⑦③①⑧②④⑥⑤5.水是生命之源,保护水资源、节约用水是我们义不容辞的责任。
下列做法不能节约用水的是6.家庭装修材料中的有害物质会影响人体的健康。
如某些花岗岩石材中就含有放射性元素氡。
若一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为()A. 50B. 86C. 136D. 2227.下列实验现象的描述中,不正确...的是A.木炭在氧气中剧烈燃烧,发出白光,放出热量,倒入澄清石灰水变浑浊B. 硫粉在氧气中燃烧更旺,火焰呈明亮的蓝紫色,生成有刺激性气味的气体,放出热量C. 红磷在氧气中燃烧更旺,发出白光,产生大量的白烟,放出热量D. 铁在氧气中剧烈燃烧,火星四射,生成四氧化三铁,放出热量8.下列操作或现象与分子对应的特性不一致的选项是9.下列粒子在人体中起着重要的作用,其中属于阴离子的是+8 2 6 +11 2 8 +12 2 8 +17 2 8 8A B C D10.元素周期表是学习化学的重要工具,下图是元素周期表中的一格,下面从该图获取的信息中,正确的是A.该元素的原子序数为52B.该元素属于非金属元素C.该元素原子的质量为52.00gD.该元素的原子核外有24个电子11.区分硬水和软水的最佳方法是A、观察是否澄清、透明进行区分。
2014年秋季分析化学期中考试
一、单选题
1.用浓度为0.10mol/L 的盐酸滴定同浓度NaOH 的溶液,pH 值突跃范围是9.7~4.3。
用浓度为0.010mol/L 的盐酸滴定同浓度的NaOH 溶液时,pH 值突跃范围是( )
A 9.7~4.2
B 9.7~5.3
C 8.7~4.3
D 8.7~5.3
2.按照质子理论,下列物质属于两性物质的有( )
A H 2CO 3
B 氨基乙酸盐酸盐
C 氨基乙酸
D 氨基乙酸钠
3.某弱酸型指示剂在pH 2.5时呈红色, pH 4.5时呈黄色,此指示剂得离解常数约为( )
A 3.2⨯10-3
B 3.2⨯10-4
C 3.2⨯10
-5 D 3.2⨯10-6 4.在pH =5.0时用铬酸钾法滴定Cl -的含量,分析结果( )
A 正常
B 偏低
C 偏高
D 难以判断
5.某吸附指示剂pKa=4.0,以吸附指示剂法测定卤素离子时,适宜的pH 为( )
A pH<4
B 4<pH<10
C pH>4
D pH<10
6.EDTA 与金属离子形成配位化合物时,其配位比一般为( )
A 1:1
B 1:2
C 1:4
D 1:6
7.现要用EDTA 滴定法测定某水样中Ca 2+
的含量,常用于标定EDTA 的基准物质应为( )
A CaC03
B Na 2C03
C Pb(NO 3)2
D Zn
8.EDTA 漓定金属离子,准确滴定(TE <0.1%)的条件是:( )
A 6lg ≥'MY M K C
B 6lg ≥'MY K
C 6lg ≥MY M K C
D 6lg ≥MY K
9.用相关电对的电极电位可判断氧化还原反应的一些情况,但用它不能判断( )
A 氧化还原反应的方向
B 氧化还原反应的次序
C 氧化还原反应的速度
D 氧化还原滴定突跃的大小
10.下列有关偶然误差的叙述中不正确的是( )
A 偶然误差在分析中是不可避免的
B 偶然误差正负误差出现的机会相等
C 偶然误差具有单向性
D 偶然误差由一些不确定的偶然因素造成
二、配位题
A 淀粉
B 甲基橙
C 铬黑T
D 苯胺酸磺酸钠
E 自身作为指示剂 为下列1-6滴定选择合适的指示剂:
1. 以HCl 溶液滴定Na 2CO 3( )
2. 以EDTA 溶液滴定Mg 2+( )
3. KBrO 3基准物标定Na 2S 2O 3( )
4. 以K 2Cr 2O 7标准溶液滴定Fe 2+( )
5. KMnO 4标准溶液滴定C 2O 42-( )
A H 2SO 4
B 中性
C 弱碱性
D 弱酸性
E HCl 酸性
为下列7-10的测定选择适宜的滴定条件
6. KMnO 4法测定铁含量( )
7. K 2Cr 2O 7法测定铁含量( )
8. 直接碘量法测定As 2O 3( )
9. 间接碘量法测定CuSO 4含量( )
10. 直接KBrO 3法测定Sb 2O 3( )
三、简答题:
1.对下列划线部分进行解释
取在120℃干燥至恒重的基准K 2Cr 2O 7约0.2,精密称定,置碘量瓶中,加蒸馏水25mL 使溶解,加入KI 3g ,溶解后加蒸馏水25mL ,HCl (1﹕2)溶液5mL ,密塞、摇匀、水封、暗处放置10min ,用50mL 蒸馏水稀释,Na 2S 2O 3溶液滴定至近终点(淡黄色)时,加淀粉指示液2mL ,继续滴定至蓝色消失而显亮绿色,即为终点,平行测定三次。
2. .对下列划线部分进行解释
KMnO 4溶液的标定:取于105~110℃干燥至恒重的Na 2C 2O 4基准物约0.14g ,精密称定,置于250mL 锥形瓶中,加新蒸馏水约100mL 使溶解,再加2moL/L H 2SO 4溶液20mL ,迅速滴加0.02moL/L KMnO 4标准溶液15mL ,加热至65℃,待褪色后,继续滴定至溶液呈粉红色并保持30秒不褪,即为终点。
3. 对下列划线部分进行解释
0.02moL/L EDTA 溶液的标定:精密称取无砷锌粒0.86—0.92g 于小烧杯中,加入7ml 浓盐酸溶解,定量转移至250ml 容量瓶中,加水至刻度摇匀,即得约0.05mol/L 氯化锌标液。
精密吸取25.00ml 氯化锌标液至锥形瓶中,加水30ml ,加入氨试液使刚产生白色混浊,加入10ml NH 3·H 2O-NH 4Cl 缓冲液和铬黑T 指示剂少许,用0.02moL/L EDTA 液滴定至溶液由紫红色变为纯蓝色,即为终点,平行测定三次。
4.用铁铵矾指示剂法测定氯化物时,为了防止沉淀的转化可采取哪些措施?为什么?
5.用吸附指示剂法测定卤化物时,为什么需加入糊精溶液?
四、计算题
1.取工业碱(可能是32CO Na 、3NaHCO 、NaOH 中的1~2种)1.000g 溶于水,并稀释至
100mL,取其中25.00mL,以酚酞为指示剂,用HCl 滴定,消耗HCl 液(0.1015mol/L)24.76mL 。
另取25.00mL ,以甲基橙为指示剂,消耗同浓度的HCl43.34mL 。
(1)该工业碱有哪几种碱?
(2)计算各种碱的百分质量分数。
2. 取葡萄糖酸钙(C 12H 22CaO 14·H 2O )0.5172g ,加水100mL ,微温使溶解,加氢氧化钠试液15mL 与钙紫红素指示剂0.1g ,用0.05103mol/LEDTA 滴定液滴定至溶液自紫红色转变为纯蓝色,共消耗EDTA 滴定液22.16mL 。
求葡萄糖酸钙的百分质量分数。
已知每1mLEDTA 滴定液(0.05mol/L)相当于22.42mg 的C 12H 22CaO 14·H 2O 。
3.称取中药牡蛎0.4226g ,用适量HCl 溶解后加入过量(NH 4)2C 2O 4溶液使牡蛎中Ca 2+沉淀,沉淀经过滤、洗涤后用H 2SO 4溶解,再用0.05012mol/LKMnO 4液滴定溶液中的2-24C O ,消耗KMnO 4液23.78mL ,求试样中CaCO 3的百分含量(3CaCO M 100.01g/mol )。