可逆电池测验
- 格式:ppt
- 大小:93.00 KB
- 文档页数:9
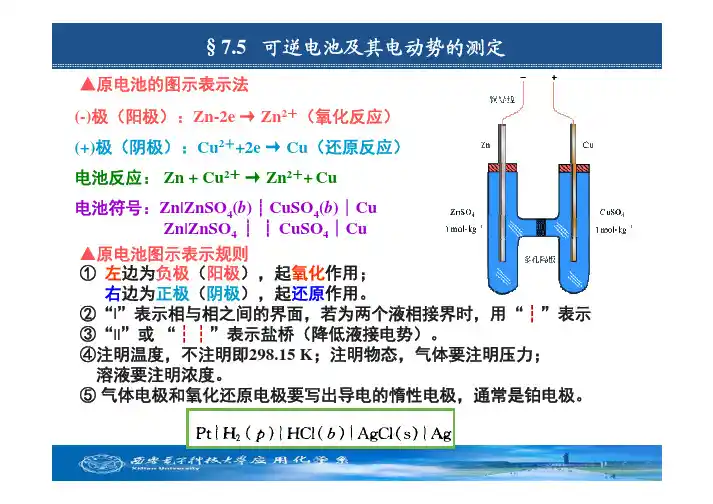
§7.5 可逆电池及其电动势的测定▲原电池的图示表示法 (-)极(阳极):Zn-2e → Zn2+(氧化反应) (+)极(阴极):Cu2++2e → Cu(还原反应) 电池反应: Zn + Cu2+ → Zn2++ Cu 电池符号:Zn|ZnSO4(b)┊CuSO4(b)∣Cu Zn|ZnSO4 ┊ ┊ CuSO4∣Cu ▲原电池图示表示规则 ① 左边为负极(阳极),起氧化作用; 右边为正极(阴极),起还原作用。
②“|”表示相与相之间的界面,若为两个液相接界时,用“┆”表示 ③“||”或 “┆┆”表示盐桥(降低液接电势)。
④注明温度,不注明即298.15 K;注明物态,气体要注明压力; 溶液要注明浓度。
⑤ 气体电极和氧化还原电极要写出导电的惰性电极,通常是铂电极。
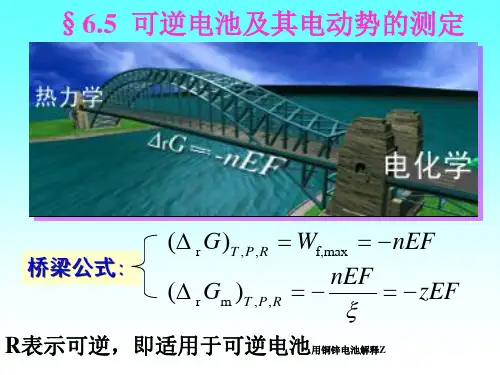
§7.5 可逆电池及其电动势的测定 1、 可逆电池 可逆电池满足的条件: (1)化学可逆性:电极及电池中的化学反应必须可逆, 即充放电反应互为可逆 (2)热力学可逆性:即能量可逆 电池在接近平衡状态下工作,即I→0的状态下工作 (3)实际可逆性:电池工作时,无其他不可逆过程(如扩散) 存在1、 可逆电池 可逆电池1、 可逆电池可逆电池 (负极)(正极)1 H 2 ( p ) + AgCl ( s ) 2放电 充电Ag(s) + H + ( b ) + Cl − ( b )1、 可逆电池 Zn, Cu棒插入H2SO4中构成的电池 Zn|H2SO4 |Cu 不可逆电池 原电池(放电)反应: (-)Zn → Zn2+ + 2e 阳极,氧化 (+)2H+ + 2e → H2↑ 阴极,还原 总反应:Zn + 2H+ → Zn2+ + H2↑ 电解池(充电)反应: (-) 2H+ + 2e → H2↑ 阴极,还原 (+) Cu → Cu2+ + 2e 阳极,氧化 总反应:2H+ + Cu → Cu2++ H2↑充电和放电时的电池反应不同——不可逆电池2、韦斯顿标准电池 正极:汞和硫酸亚汞的糊状物, 负极:含镉(Cd)12.5%的镉汞齐, 两极之间盛以CdSO4的饱和溶液负极(阳极): Cd (汞齐)= Cd 2++ 2eCd 2++SO42-+ 8/3H2O(l) →CdSO4 · 8/3H2O(s) Cd+SO42-+8/3H2O(l) →CdSO4 · 8/3H2O(s) + 2e正极(阴极):Hg2SO4(s) +2e-→2Hg(l)+SO42电极反应可逆,没有液接电势 在I→0时是高度可逆的电池电池反应: Cd (汞齐)+ Hg2SO4(s) + 8/3H2O(l) → 2Hg(l)+ CdSO4· 8/3H2O(s) Cd(汞齐)|CdSO4·8/3H2O(s) |CdSO4饱和溶液|Hg2SO4(s) |Hg(l) 优点:电动势稳定,随温度改变很小 用途:配合电位计测定原电池的电动势 20℃时ES,20 = 1.0186V, ES = 1.0186/V – 4.06×10-5(T/℃-20)– 9.5×10-7(T/℃ -20)23、电池电动势的测定 必须在电流→零的条件下测量,常采用对消法。





测定可逆电池电动势的方法嘿,咱今儿个就来聊聊测定可逆电池电动势的那些事儿!你说这可逆电池电动势,就好像是一个神秘的小宝藏,得用合适的方法才能把它给挖出来。
那都有啥方法呢?有一种常见的方法叫对消法。
这就好比是在一场拔河比赛中,我们要找到两边力量平衡的那个点。
通过一个能产生稳定电压的装置,和我们要测的可逆电池对着干,直到它们俩的力量相互抵消,这时候我们就能准确地知道这个电动势是多少啦!你想想,是不是挺有意思的?还有电位差计法呢!就好像是给这个电动势来个精准的“量身定制”。
电位差计就像是一把超级精确的尺子,能把电动势的大小给量得清清楚楚。
它能让我们更直观地了解这个神秘小宝藏的具体数值。
咱再说说盐桥法。
这就好像是给电池搭了一座小桥,让里面的离子能顺畅地流动,减少了阻碍,从而让我们能更好地测定电动势。
这桥搭得好呀,测定起来就更轻松啦!你可别小看这些方法,每一种都有它的独特之处呢!就像我们每个人都有自己的拿手好戏一样。
它们能帮助我们揭开可逆电池电动势的神秘面纱,让我们对电的世界有更深入的了解。
在实际操作中,那可得小心谨慎,就跟走钢丝似的,一点差错都不能有。
稍有不慎,可能测出来的结果就不靠谱啦!所以呀,一定要认真对待,就像对待宝贝一样。
测定可逆电池电动势的方法就像是打开电世界大门的钥匙,有了它们,我们才能在这个充满奥秘的领域里畅游。
我们能更好地理解电池的工作原理,说不定还能发明出更厉害的电池呢!那时候,我们的生活可就变得更加便捷和精彩啦!总之,这些方法各有千秋,我们要根据实际情况选择最合适的那个。
就像我们挑鞋子一样,得合脚才行呀!让我们一起好好利用这些方法,去探索可逆电池电动势的奇妙世界吧!。

可逆电池测试一,单项选择(20分)1, 关于"电动势"的说法中正确的是(A) 电动势就是两个店基建的电势差(B) 电动势等于电池的开路电压(C) 电动势等于电池中所有界面电势差的代数和(D) 电动势是电池工作时两极之间的端点压2,若一电池的过程热为正值,则肯定(B)(A)(D)(C)3,对消法测电动势时,必须使用(A)甘汞电极(B)玻璃电极(C)标准电极(D)标准电池4, 有下列电池(1) Pt|H2(P1)|HCl(a)|Cl2(P2)|Pt(2) Pt|H2(P1)|H+(a1)||Ag+(a2)|Ag(s)(3) Ag(s)|Agl(s)|l-(a1)||Cl-(a2)|AgCl(s)|Ag(s)(4) Pb(s)|PbSO4(s)|SO42-(a1)||Cu2+(a2)|Cu(s)它们对应的一下反应中正确的是(A) H2(P1)+Cl2(P2)( 2HCl(a)(B) 2Ag(s)+2H+(a1)( H2(P)+2Ag+(a2)(C) AgCl(s)+I-(a1)( AgI(s)+Cl-(a2)(D) Pb(s)+Cu(a2)+SO42-(a1)( PbSO4(s)+Cu(s)5, 电池反应(1)1/2H2(P)+AgCl(s)=Ag(s)+HCl(m1);E1(2)H2(P)+2AgCl(s)=Ag(s)+2HCl(m1);E2下列关系正确的是:(A)E1=1/2E2 (B)E1>E2 (C)E1<E2 (D)E1=E26, 电极 Pt|Cl2(P)|Cl-(a)的电极反应为 1/2Cl2(P)+e-(Pt) ( Cl-(a),其电极反应的相界面有(A)1个(B)2 个(C) 3个(D)均相7, 电池的电动势不能用伏特计测量,因为(A) 伏特计测的结果不准确(B) 伏特计要并联在电路中,检流计要串联在此两者的要求不能同时满足(C) 适用伏特计是电池内有电流通过,测得的不是电动势(D) 用伏特计精确度达不到要求8, 下面的电极中标准电极电势最大(正)的是(A) Pt|H2(P)|H+(a)(B) Pt|H2(P)|OH-(a)(C) Zn(s)|Zn2+(a)(D) Cd(s)|Cd2+(a)9, 下面的电极种可作为参比电极的是(A)Pt|I2|I- (B)Ag|AgCl(s)|Cl-(C)Pt|Hg(l)|Hg2SO4(s)|SO42- (D)Cd(Hg)|CdSO4·H2O|CdSO410, 与反应 Pb2++SO42- ( PbSO4(s)对应的电池是(A) Pb(s)|PbO2(s)|PbSO4(s)|SO42-(a)|PbSO4(s)|Pb(s)(B) Pb(s)|PbSO4(s)|SO42-(a)|PbSO4|PbO2(s)|Pb(s)(C) Pb(s)|Pb2+(a1)||SO42-(a2)|PbSO4(s)|Pb(s)(D) Pb(s)|PbSO4(s)|SO42-(a1)||Pb2+(a2)|Pb(s)二,多项选择(27分)1, 一电池,温度系数为-8.54×10-4V·K-1,298.15K时,电动势E=1.230V,反应时,迁移的电子为2mol,由此得到的下列结果中正确的是.(A) 过程热为49.140kJ·mol-1 (B) 熵变为-165J·K-1·mol-1(C) 可作的最大功237.390kJ·mol-1 (D) 等压反应热效应为+49.140kJ·mol-1 (E) 焓变为-188.250 kJ·mol-12,下面属于第二类电极的是(A) Pt|O2(P)|H2O,OH-(a)(B) Zn|ZnCl(a)(C) Hg(l)|Hg2Cl2(s)|KCl(a)(D) Sb(s)|Sb2O3(s)|OH-(a)(E) Pt|Cu2+(a1)|Cu+(a2)3, 下列电极的名称和符号不相符的是(A)伏打电池:Zn(s)|HCl(m)|Cu(s)(B)单尼尔电池:Zn(s)|ZnSO4(a1)||CuSO4(a2)|Cu(C)韦斯顿电池Pt|Hg(l)|Hg2SO4(s)|CdSO4(饱和溶液)|CdSO4·8/3H2O(s)|Cd(Hg)(12.5%)(D)铅酸蓄电池:Pb|PbO2|H2SO4(20%)|Pb(E)碱性锌-空气电池:Zn(s)|KOH(30%)|O2(空气)|4, 可逆电池要满足能量可逆的条件是(A) 满足ΔrGm = -zEF(B) 电池放电的速度无限慢(C) 化学能完全转化为电能,没有其它功的损失(D) 电路中电阻无限大,因而电流很小(E) 电池内组趋近于零5, 下列电池反应与SO42-无关的是(A) Pt|Hg(l)|HgSO4(s)|Na2SO4(a1)||CuSO4(a2)|Cu(s)(B) Zn(s)|ZnSO4(0.01)||Cu(0.01)|Cu(s)(C) Zn(s)|H2SO4(a)|Cu(s)(D) Pb(s)|PbSO4(s)|H2SO4(a)|Zn(s)(E) Pb(s)|PbSO4(s)|H2SO4(a)|PbO2(s)|Pt6, 关于浓差电池的下列说法中正确的是(A) 任一浓差电池标准电动势均为零.(B) 浓差电池反应没有平衡常数(C) 浓差电池电动势与温度无关(D) 浓差电池中两极的化学反应相同(E) 浓差电池可能是自发性的,也可能是非自发性的7, 对铅酸电池的电极反应的反应物,下面说法中正确的是(A)负极为PbO2(s)(B)正极为Pb(s),SO42-(C)正极为PbSO4(s),H+,SO42- (D)负极为Pb(s),SO42-(E)正极 PbSO4(s),H2O8, 对电池中"盐桥"的要求,下面说法中不正确的是(A) 盐桥电解质与电极物质没有相同的离子(B) 盐桥电解质正、负离子的运动速度应很接近(C) 盐桥电解质不与电极物质发生反应(D) 盐桥电解质的浓度应尽可能大(E) 盐桥电解质溶液与电极溶液的接触面大9, 对可逆原电池反应,下列说法正确的是(A) ΔrSm>0,表明反应时吸热(B) QR>0,表明反应放出的化学能只有一部分转化为电能(C) >0,表明反应放出的化学能与电能从环境吸收的热均转化为电能。

实验十六可逆电池电动势的测定一、实验目的测量铜-锌原电池的电动势,计算反应的热力学函数。
了解电动势的测量原理和方法。
二、实验原理电池反应中,摩尔吉布斯函数[变]、摩尔熵[变],反应热分别为(1)(2)(3)(4)可见,只要测出某一电池反应的电动势E及其温度系数(∂E/∂T),,就可算出热力学函数。
可逆电池的电动势数据可用于热力学计算。
可逆电池电动势的测量条件除了电池反应可逆和传质可逆外,还要求在测量回路中电流趋近于零。
测定电动势不能用伏特计。
因为电池与伏特计相接后会有电流通过,电池中电极被极化,电解液组成也会发生变化。
所以伏特计只能测得电池电极间的电势降,而不是平衡时的电动势。
利用对消法可使我们在测量回路中电流趋于零的条件下进行测量,所测得的结果即为可逆电池的电动势。
对消法电路如图8-1所示。
acBa回路由工作电源、可变电阻和电位差计组成。
工作电源的输出电压必须大于待测电池的电动势。
调节可变电阻使流过回路的电流为某一定值,在电位差计的滑线电阻上产生确定的电势降,其数值由已知电动势的标准电池Es校准。
另一回路abGExa由待测电池Ex、检流计G和电位差计组成。
移动b点,当回路中无电流通过时.电池的电动势等于a、b两点的电势差。
对消法测电动势是一个接近热力学可逆过程的例子。
为了尽可能减小电池中溶液接界外因扩散产生的非平衡液接电势,两电极间用盐桥连通。
三、仪器试剂直流电势差计一台;光点反射检流计一台;标准电池一个;于电池(1.5V)两节;铜电极、锌电极(带电极池)各一支;超级恒温器一台;0.100mol·dm-3硫酸铜和硫酸锌溶液若干;饱和氯化钾溶液;2.00mol·dm-3硫酸溶液;6.00mol·dm-3硝酸溶液;丙酮试剂(A.R.);小烧杯;金相砂纸。
四、实验步骤先对电极进行预处理。
用金相砂纸把电极片抛光,用水冲洗后在丙酮液中浸洗数分钟,再用稀硫酸和稀硝酸浸洗。
然后将电极用蒸馏水冲洗于净。

可逆电池电动势的测定实验报告实验报告:可逆电池电动势的测定一、实验目的1.掌握可逆电池电动势测定的原理和方法。
2.学习使用电位差计测量电池电动势。
3.理解可逆电池电动势与反应物质、温度等因素的关系。
二、实验原理可逆电池是指在一定条件下,能够完全逆向恢复到初始状态的电池。
可逆电池的电动势是指电池在开路状态下正负极之间的电位差,是电池反应的重要参数之一。
本实验采用标准电池和待测电池进行电动势的测量,通过比较两者的差异,可以得到待测电池的电动势。
三、实验步骤1.准备实验器材:电位差计、标准电池、待测电池、电阻箱、恒温水槽、温度计、电解质溶液等。
2.将电位差计与标准电池和待测电池连接,调整电阻箱阻值,使得电位差计指示为零。
3.将标准电池和待测电池放入恒温水槽中,记录温度。
4.根据实验原理,计算标准电池的电动势E0(已知)。
5.按照相同条件,测量待测电池的电动势E1。
6.根据测量结果,计算待测电池的电动势E1(未知)。
7.分析实验数据,得出实验结论。
四、实验结果与数据分析1.标准电池的电动势E0=1.018V(已知)。
2.待测电池的电动势E1=1.015V(未知)。
3.比较标准电池和待测电池的电动势,发现两者相差较小,说明待测电池的电动势较为准确。
4.分析实验数据,发现可逆电池的电动势与反应物质、温度等因素有关。
随着反应物质浓度的降低或温度的升高,电动势会相应减小。
这表明可逆电池的反应速率与电动势密切相关。
5.通过本实验,我们掌握了可逆电池电动势的测定方法,学会了使用电位差计进行电动势的测量,加深了对可逆电池工作原理的理解。
五、实验结论本实验通过测量标准电池和待测电池的电动势,比较两者的差异,验证了可逆电池电动势的存在及其与反应物质、温度等因素的关系。
实验结果表明,随着反应物质浓度的降低或温度的升高,电动势会相应减小。
这表明可逆电池的反应速率与电动势密切相关。
通过本实验,我们进一步加深了对可逆电池工作原理的理解,掌握了可逆电池电动势的测定方法。

可逆电池电动势的测定实验报告实验目的:掌握利用可逆电池的电动势进行测定的方法,探究电动势与浓度、温度的关系。
实验器材:标准氯化银电极、0.1mol/L AgNO3溶液、电解池、热水槽、温度计、万用表、导线等。
实验原理:可逆电池是指电极间反应完全可逆的电池,在理想状况下,可逆电池的电动势与电极间的化学势差相等。
因此,可逆电池可以用来测量其他电池电动势或溶液中离子的标准电位。
实验步骤:1.将标准氯化银电极置于电解池中,并将电解池连接至万用表的正负极。
2.将电解池中注入0.1mol/L AgNO3溶液,使电极完全浸没其中。
3.将电解池置于热水槽中,通过热水槽中的温度计调节溶液的温度。
记录温度。
4.在稳定温度的条件下,打开万用表的电源开关,等待电动势稳定后记录电动势。
5.将温度调节至不同的数值,重复步骤4并记录相应的电动势和温度。
实验结果:温度(℃)电动势(V)200.78300.80400.82500.84600.86实验分析:根据实验结果,我们可以发现随着温度的升高,电动势的数值也逐渐增加。
这是因为随着温度的升高,反应速率也加快,更多的电子参与了氯化银的还原,从而增加了电池的电动势。
实验结论:根据实验结果,我们可以得出结论:电动势与温度呈正相关关系。
这一结论在工业应用中具有重要意义,因为在实际使用电池的过程中,温度的变化会影响电动势的稳定性,从而对电池的性能产生影响。
实验中可能存在的误差:1.离子浓度的变化未考虑。
溶液中的Ag+浓度可能随着反应过程发生变化,影响电动势的测量结果。
2.极化现象的影响。
在实验过程中,电解池可能发生了极化现象,导致电极反应不完全,并影响电动势的测定结果。
3.万用表的误差。
万用表的精度限制了电动势测量结果的准确性。
为减小误差,可以采取以下措施:1.在实验过程中定期检查溶液中的Ag+浓度,保持其稳定。
2.进行电化学预处理,减小电解池的极化现象。
3.使用高精度的电位计或泳报仪进行电动势测量,提高测量结果的准确性。
实验可逆电池电动势的测定-V1
实验可逆电池电动势的测定
在化学和物理实验中,电动势是一个非常重要的参数,它可以用来衡量电化学反应的能量变化。
可逆电池是一个用于精确测量电动势的设备,下面是测定可逆电池电动势的实验步骤。
步骤一:实验器材准备
首先要准备好实验器材。
这包括:
1.可逆电池
2.毫伏计
3.电极(通常是铂电极)
4.桥接指示灯
步骤二:为可逆电池创建一个电路
将可逆电池与铂电极相连。
使用电线连接电池和电极,然后将电极放在溶液中。
这个溶液应该与可逆电池的反应物相关。
步骤三:调整桥接指示灯
将桥接指示灯与电路相连。
根据桥接指示灯的指示,调整电路的平衡状态,使得指示灯不亮或亮得非常微弱。
步骤四:通过毫伏计测定电动势
连接毫伏计,使用它来测定电路的电动势。
将毫伏计连接在电路的两端,并记录下读数。
这个读数就是可逆电池的电动势。
步骤五:反转电池
将电池反转,使得电极原来的正极变成了负极,反之亦然。
再次进行上述步骤,测量电路的电动势。
这个电动势应该与之前测得的电动势相反,证明了可逆电池的性质。
通过这个实验,我们可以对可逆电池的性质有更加深入的理解,同时也可以掌握测量电动势的实验方法。
实验可逆电池电动势的测定(1)实验可逆电池电动势的测定1. 实验介绍可逆电池是指在反应进行过程中,反应物与生成物之间的浓度或压强的变化对电动势没有影响,且可逆方向与正方向的电动势相等的电池。
本实验主要研究几种可逆电池的电动势的测量方法及原理。
2. 实验材料与设备- 在常温(25℃)下工作的比色皿、三角搅拌棒、移液管、容量瓶、50ml烧杯、电子天平;- 物质:氧化还原剂、还原剂溶液及其他用品;- 电池:阳极和阴极为铜/铜离子电极的Cu/CuSO4电池,钬/钬离子电极和PbO2/PbSO4电池等。
3. 实验步骤1)用容量瓶测量CuSO4溶液的第一小于0.1电位电动势,记录浓度,即Cu2+Molar2)将新制备的0.1mol/L AgNO3溶液定容于50ml烧杯中3)在容量瓶中加入5mg的活性炭,并加足够的去离子水。
将瓶子摇匀,然后倒入烧杯中,使其变成混浊状态。
4)在另外一个50ml烧杯中加入3~4g的CuSO4.5H2O,加足够的去离子水,搅拌至溶解。
5)将Cu2+溶液慢慢倒入另一个50ml烧杯中。
待溶液保持稳定后,取10ml分别装入两个比色皿中6)在1ml单质铜管中加入一只Cu/Ni电池片,将其插入电路中7)等待30秒后,将铜管取出,用三角搅拌棒搅动烧杯中的溶液8)将大约5~6mg的道盖盖住肉眼可见的溶液4. 实验结果结论:通过本实验,我们测定了Cu/CuSO4、PbO2/PbSO4、钴/钴离子电池的电动势,得到了可逆电池的准确测量,并给出了它们的数据表。
5. 实验结论通过本实验,我们得出了可逆电池的电动势的正确测量方法,提高了测量结果的准确度,进一步深化了我们对实验过程原理的理解和掌握。
实验报告一、数据记录和处理1. 室温时各电池的电池电动势测定T室温=表1 室温时各电池的电池电动势2. 数据处理1写出a、b、c、d各被测电池的表达式、电极反应和电池反应;a. 电池的表达式:Hg│Hg2Cl2 s│KCl饱和‖AgNO3 mol/L│Ag电极反应: Hg + Cl-饱和+ Ag + = 1/2 Hg2Cl2 + Ag负极:Hg + Cl-饱和= 1/2 Hg2Cl2 + e-正极:Ag + + e- = Agb. 电池的表达式:Hg│Hg2Cl2 s│KCl饱和‖Q,QH2,H+│Pt电极反应: C6H4O2醌+ 2H+ + 2e- = C6H4OH2氢醌负极:2Hg+ 2Cl- - 2e- →Hg2Cl2正极:Q + 2H+ + 2e- →QH2c. 电池的表达式:Hg│Hg2Cl2s│KCl饱和‖AgNO3 mol/L│Ag电极反应: Hg + Cl -饱和 + Ag + = 1/2 Hg 2Cl 2 + Ag 负极:Hg + Cl -饱和= 1/2 Hg 2Cl 2 + e - 正极:Ag + + e - = Agd. 电池的表达式:Ag │AgCl s │HCl mol/L ‖AgNO 3 mol/L │Ag 电极反应: Ag + + Cl - = Ag负极:Ag + Cl - - e - → AgCl 正极:Ag + + e - → Ag2由电池a 的电动势计算银电极电势;根据能斯特公式计算银电极的标准电极电势;与文献值比较,求相对误差已知1-⋅kg mol 溶液的离子平均活度系数±γ=;饱和甘汞电极电势和银电极的标准电极电势文献值见附表9-17;查附表9-17计算饱和甘汞电极的电极电势和银电极的标准电极电势:=饱和甘汞ϕ VθϕAgAg+= V由饱和甘汞ϕϕ-=+AgAg E 得:=+AgAgϕ V再由能斯特方程+++-=Ag AgAg AgAg F RT αϕϕθ1ln得θϕAg Ag + θϕAgAg+= + 96500ln1/ = V并计算银电极标准电极电势的相对误差:相对误差=3由电池b 的电动势求醌氢醌电极的电极电势和缓冲溶液pH;醌氢醌电极的标准电极电势见附表9-17;根据缓冲溶液的浓度和醋酸的电离常数查附表9-15,计算缓冲溶液pH 的理论值,与上面用电动势法测得的pH 相比较,求相对误差;已知25℃时3-⋅dm mol 的离子平均活度系数±γ=;查附表9-17计算醌氢醌电极的标准电极电势:=θϕ2QHQ – t -25 = V由饱和甘汞2ϕϕ-=QH Q E 得:2QH Q ϕ= + = V再由+-=H QH Q QH Q F RT αϕϕθ122ln 得缓冲溶液的pH pH = – 96500/=根据缓冲溶液浓度和醋酸的电离常数查附表9-15,计算缓冲溶液pH 的理论值 查附表9-15得醋酸的电离常数ϑa K =10-5 再由NaAcHAca pK pH ααϑlg-= pH=-lg10-5- =并计算醋酸溶液pH 的相对误差: 相对误差=/100%=% 4由电池c 的电动势计算0. 10001-⋅kg mol AgNO 3溶液的离子平均活度系数;银电极标准电极电势用附表9-17中的关系式求得;由饱和甘汞ϕϕ-=+AgAg E 得:=+AgAgϕ + = V再由银电极的能斯特方程+++-=Ag AgAg AgAg F RT αϕϕθ1ln得+Ag α +Ag α=RTF Ag Ag AgAg e)(||++--ϕϕθ=15.289314.8)74777.0807730.(96500⨯--e=由()⎪⎭⎫ ⎝⎛⋅===±±±+ϑγαααb b AgNO AgNO Ag 233, 则3AgNO ,±γ == 5由电池a 、c 的电动势计算下列浓差电池()()Ag kg mol AgNO kg mol AgNO Ag 13131000001000--⋅⋅..的电动势,与用能斯特公式计算结果相比较,0. 10001-⋅kgmol AgNO 3溶液的±γ=;由饱和甘汞ϕϕ-=+aAg Ag a E ,得:=+a Ag Ag ,ϕ V饱和甘汞ϕϕ-=+c Ag Ag c E ,得:=+c Ag Ag ,ϕ V再由a Ag Ag cAg Ag E ,,++-=ϕϕ浓差= V该浓差电池的负极反应:Ags - e - → Ag +aq 正极反应:Ag + aq + e - → Ags 电池反应:Ag +·Kg -1 → Ag +·Kg -1 由浓差电池的能斯特方程求浓差E浓差E =)(,|)(|l F RT a Ag Ag c Ag Ag n ++αα=9623.001.0734.01.0l 96500289.158.314⨯⨯⨯n= V 6由电池d 的电动势计算氯化银溶度积ϑsp K ;已知1-⋅kg mol 溶液离子平均活度系数±γ=;由电池d 的电池反应写出能斯特方程求氯化银的ϑsp K :-+⋅-=cl Ag F RT E E ααθln ϑθspK FRT E ln -= 由于θαθE RTF K ln =此电池反应的标准平衡常数为氯化银溶度积的倒数 θαθspK 1K =经简化得ϑsp K ln = E RTF)(ln -⋅-+cl Ag αα = 0.443925289.158.31496500)796.01.0734.01.0(ln ⨯⨯-⨯⨯⨯=K= ×10-10所以ϑsp二、回答问题及讨论1.测定电池电动势为什么要用补偿法本实验的测定过程中,在找到光点不偏转的位置之前,仍有电流通过被测定电池,对测量会带来什么影响如何减少这些影响答:热力学可逆电池的条件之一就是必须非常接近平衡状态,即通过的电流无限小,所以因此要用补偿法来削减电流,使待测电池工作在可逆状态;影响:有电流通过时会使电极极化,使测得的电动势偏小;措施:减少电流通过电池的时间,可以实现预估电池电动势的大小,然后迅速调节;C'段电阻中有无电流2.在测量时找到平衡点后即检流计光点不偏转时,附图4-3中CC'段线路中有无电流通过电流方向如何通过电流方向如何BGCC'段无电流通过;答:CC’段有电流通过,方向由C到C’, BGC3.UJ25型电位差计中Ⅰ~Ⅳ测量盘线路见附图4-4对应附图4-3中的哪部分线路4.答:对应CC’段电阻;5.若检流计光点只向一边偏转,因而找不到光点不发生偏转的平衡点,试分析可能的原因是什么答:待测电池的正负极接反了;工作电池的电压太低;6.盐桥的作用是什么一般物理化学教科书中介绍的比较理想的盐桥用电解质是KCl与NH4NO3;本实验中为什么不用这两种电解质,而用饱和KNO3溶液制备盐桥答:盐桥作用:降低液面接触电势,并且连通电路;本实验中由于Cl-及NH4+都会与Ag+发生反应,分别生成沉淀和络合物,影响电极电势测定,故选用饱和KNO3溶液制备盐桥; 7.检流计的使用及维护中最重要的注意事项是什么标准电池及工作电池的作用有什么不同使用标准电池时应注意哪些问题答:检流计注意事项:①检流计使用时不能剧烈震动;②通过检流计的电流在额定的范围内并且时间尽量短;③检流计使用后将量程调节至短路档位;标准电池作用:电位差测量实验中的标准量具,在直流电位差实验中提供标准的参考电位差;工作电池作用:在实验中为实验电路提供工作电压,充当工作电源;使用标准电池时应注意:①避免震动和倒置;②通过标准电池的电流严格限制在范围内;③绝对避免两极短路或者长时间与外电路通电;④温度不超过40℃,不低于0℃;。