磺化反应
- 格式:doc
- 大小:1.15 MB
- 文档页数:4
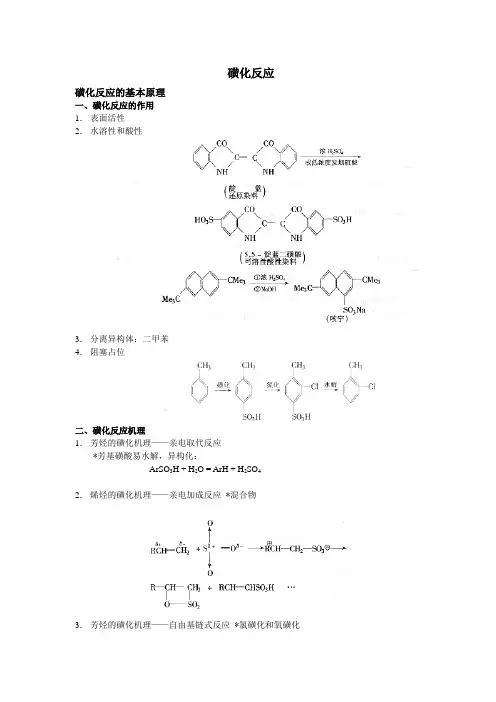
磺化反应磺化反应的基本原理一、磺化反应的作用1.表面活性2.水溶性和酸性3.分离异构体:二甲苯4.阻塞占位二、磺化反应机理1.芳烃的磺化机理——亲电取代反应*芳基磺酸易水解,异构化:ArSO3H + H2O = ArH + H2SO42.烯烃的磺化机理——亲电加成反应*混合物3.芳烃的磺化机理——自由基链式反应*氯磺化和氧磺化三、影响磺化反应的主要因素1.被磺化物的性质(1)饱和烷烃较难磺化,芳烃较易磺化(2)芳烃取代基:电子效应:苯>氯苯>溴苯>对硝基苯甲醚>对硝基甲苯>硝基苯空间效应:邻二甲苯>甲苯>乙苯>异丙苯>叔丁苯2.反应温度(1)对反应速率的影响: T↑—r↑—t↓(低温长时)(2)对磺酸基引入位置的影响甲苯:低温——对位,邻位;升高温度——间位产物增多萘:低温——α位;高温——β位(动力学-热力学:水解-再磺化-异构化)(3)对多磺化的影响T↑——利于多磺化3.磺化催化剂和磺化助剂(1)促使反应易于进行——吡啶,邻氯苯甲醛(2)改变磺酸基引入位置(3)抑止副反应HAc、Na2SO4——抑止砜的生成硼酸(与羟基形成硼酸酯)——阻止氧化反应常用磺化剂及其磺化方法一、硫酸:稀硫酸、浓硫酸,发烟硫酸1.使用高浓度过量的酸∴ C ↑则X↓2.脱水物理脱水法:(1)共沸(2)高温β-萘磺酸:160℃,过量40%化学脱水法:BF3, SOCl2: H2O+ SOCl2→2HCl ↑+ SO2↑3.硫酸的浓度与其它物理性质的关系(熔点,密度,比热,溶解度,电阻)20~25%,60~65%4.操作方法:向被磺化物仲缓慢加入磺化剂优点:平稳,易于传质、传热,副反应少缺点:残渣,后处理困难二、三氧化硫——优点:不生成水,反应速度快,活性高,理论量即可完成反应缺点:物料粘度高,传质困难,副反应多1.SO3在室温下易聚合——γ型加稳定剂:0.1%硼酐,二苯砜,(CH3)2SO42.SO3具有强氧化性——控制温度,加入稀释剂SO3(气):N2, SO2; SO3(液): SO2(液),CCl4 (防止爆炸-强放热)三、氯磺酸ClSO3H (SO3·HCl )活性强,价格高,HCl腐蚀:制备芳磺酸或磺酰氯,N-磺化(甜蜜素)(1)分批加料:将有机物加入氯磺酸中(减少砜的生成)(2)稀释剂:二氯苯,四氯乙烷,硝基苯四、氯磺化和氧磺化氯磺化:Cl2+SO2氧磺化: O2+SO2注意:(1)仲碳磺酸盐(2)氯磺化:采用SO2过量(SO2:Cl2=3:1),低转化率(50~70%)的方法控制副反应(氯化,多磺化)五、烘焙磺化法。

磺化反应●概述●磺化剂的种类●磺化反应历程●磺化反应的影响因素●磺化方法●磺化后处理一、概述1,目的Ar-H + H2SO4 → Ar-SO3H①使产物具有水溶性、酸性、表面活性或对纤维的亲和力如产物表面活性②将-SO3H 转变为-OH,-NH2,-CN,-X等,从而制成系列中间体基团置换§2.1概述③利用磺酸基的水解性,完成特定的反应后,再将其水解安定蓝B 色基2,磺化方法(引入SO3H的方法)过量硫酸法共沸去水法(溶剂法)三氧化硫法氯磺酸(Cl SO3H )磺化法亚硫酸盐磺化法(NaHSO3)二、磺化剂的种类1,SO 3---最有效的磺化剂SO32,H 2SO 4和发烟硫酸H2SO4和发烟硫酸 3,氯磺酸氯磺酸 4,亚硫酸钠或亚硫酸氢钠 三、磺化反应历程 ● 磺化动力学 ● 反应历程 1、磺化动力学可能的磺化质点是不同溶剂化的SO 3分子 , a, 在发烟硫酸中主要的磺化质点为SO 3,b, 在较浓的硫酸中的质点为H 2S 2O 7,它是SO 3和H 2SO 4溶剂化的形式C,在较低浓度的硫酸中(80%-85%)主要是H 3SO 4+,它是SO 3和H 3O +溶剂化形式磺化反应动力学SO 3+H 2SO 4H 2S 2O 7SO 3+H 3O+H 3SO 4+133333]][)[()(SO ArH SO k SO v HArSO SO ArH K k=−→←+-+2、反应历程四、磺化反应的影响因素●被磺化有机物的性质●磺基的水解●磺化温度●磺化剂的浓度和用量●添加剂的影响1、被磺化物的性质磺化反应是亲电取代,已有取代基是给电基团,使反应易进行;已有取代基为吸电基团使反应难进行 常见有机物磺化反应难易程度2、 磺基的水解磺基的水解规律● 有吸电子基的芳磺酸,芳环上的电子云密度较低,磺基难 水解 ● 有给电子基的芳磺酸,芳环上的电子云密度比较高,磺 基容易水解● 介质中H +3O 的浓度越高,水解速度越快,因此磺酸的水解都采用中等浓度的硫酸● 磺化和水解的速度与硫酸温度有关,每升高10℃,磺化速度增加2倍,水解速度增加2.5-3.5倍。



磺化反应知识点总结一、磺化反应的机理磺化反应的机理主要包括三个步骤:磺酸酯或磺酰氯的亲核取代、醇解和亲核加成。
1. 磺酸酯或磺酰氯的亲核取代磺化反应通常以磺酸酯或磺酰氯作为试剂,它们在反应中起到亲核取代的作用。
当磺酸酯或磺酰氯与化合物中的氢原子发生交换时,产生磺化产物。
这个过程可以用下面的化学方程式表示:R-OH + R'-OSO2Cl → R-OSO2R' + HCl其中,R和R'分别是有机基团,可以是烷基、芳基等。
2. 醇解醇解是磺化反应中的一个重要步骤,它是指磺酸酯或磺酰氯与醇在碱性条件下发生反应,生成磺酸盐。
具体的化学方程式如下:R-OSO2R' + H2O → R-OH + R'-OSO3H3. 亲核加成在一些特殊的情况下,磺酸酯或磺酰氯也可以与烯烃或炔烃等化合物发生亲核加成反应,生成磺酸酯或磺酰氯。
这个过程可以用下面的化学方程式表示:R-OSO2R' + R"CH=CH2 → R'-OSO2R"CH-CH2SO2R'以上就是磺化反应的机理,通过以上三个步骤,磺化反应引起了有机物中的氢原子的取代,生成了磺化产物。
二、磺化反应的影响因素磺化反应的速率和选择性受到许多因素的影响,包括试剂的种类、反应条件、溶剂等。
下面具体介绍一下各种影响因素:1. 试剂的种类磺酸酯和磺酰氯是磺化反应中最常用的试剂,它们在反应中起到亲核取代的作用。
不同种类的试剂对反应速率和选择性具有不同的影响,通常情况下,磺酸酯的活性要比磺酰氯高,因此磺酸酯在磺化反应中的应用更为广泛。
2. 反应条件反应条件包括温度、pH值、反应物浓度等,这些条件对磺化反应的速率和选择性有着重要的影响。
通常情况下,较高的温度和碱性条件有利于加速磺化反应的进行,提高产物的产率。
3. 溶剂溶剂在磺化反应中起到溶解反应物和促进反应的作用,不同溶剂对反应速率和选择性也有着一定的影响。

磺化反应的特点磺化反应是一种重要的有机合成反应,在药物、染料、橡胶、塑料等化工领域中广泛应用。
本文将从磺化反应的概念、反应机理、反应条件、应用等方面进行详细阐述,希望对读者有所启发。
一、概念和分类磺化反应是将有机物中的活泼亲核试剂和亚硫酸或其衍生物进行反应,生成含有磺基的化合物的反应过程。
磺化反应可分为直接磺化和间接磺化两种。
间接磺化又分为偶联磺化和氧化磺化。
偶联磺化是指使用碱性条件下的偶联试剂反应,将两个不同的有机化合物偶联生成磺化产物。
氧化磺化则是使用氧化剂将有机化合物氧化成相应的酸,然后与亚硫酸或其衍生物反应生成磺化产物。
二、反应机理磺化反应的机理非常复杂,与反应条件、试剂选择等因素有很大关系。
下面简要介绍一下直接磺化的机理。
对于亚硫酸盐的磺化反应,其机理主要分为两个步骤:首先是有机物中的活泼亲核试剂把亚硫酸盐中的硫酸酯基取代,生成新的硫酸酯,并过渡态消失;生成的新硫酸酯参与亚硫酸盐酯化反应,生成磺化产物和硫酸酯。
总的反应方程式为:(1)ROH+HSO3R'→ROSOR'+H2O三、反应条件溶剂:磺化反应使用的溶剂从极性溶剂到非极性溶剂不一,一般根据反应物和试剂的特性选择合适的溶剂。
如催化剂催化的磺化反应,通常使用极性溶剂如N,N-二甲基甲酰胺(DMF),N-甲基吡咯烷酮(NMP)等。
而直接间接氧化磺化反应需要使用的溶剂则较多,如乙腈、丙酮、二氯甲烷、甲醇等。
反应时间:磺化反应的反应时间与温度、反应物的浓度和反应条件等因素有关。
反应时间一般在几小时到一天左右。
四、应用由于磺化反应的反应条件较为宽松,且反应的产物具有良好的物理化学性质,因此磺化反应在诸多领域有广泛应用。
例如在染料和颜料合成中,一些有机染料和颜料通过磺化反应可以改善其溶解性、抗光、耐污染等物理化学性质。
在医药领域,一些药物和激素也可以通过磺化反应进行改性,提高其生物利用度和药效等方面的性能。
在橡胶和塑料工业中,磺化反应可以增加其抗氧化、抗切断、化学稳定性等方面的性能,使其更有耐久性。


磺化反应苯分子等芳香烃化合物里的氢原子被硫酸分子里的磺酸基(—SO3H)所取代的反应。
1.磺化反应一种向有机分子中引入磺酸基(—SO2H)或磺酰氯基(—SO3Cl)的反应过程。
磺化过程中磺酸基取代碳原子上的氢称为直接磺化;磺酸基取代碳原子上的卤素或硝基,称为间接磺化。
磺化剂通常用浓硫酸或发烟硫酸作为磺化剂,有时也用三氧化硫、氯磺酸、二氧化硫加氯气、二氧化硫加氧以及亚硫酸钠等作为磺化剂。
可分为直接磺化和间接磺化两大类。
直接磺化用硫酸进行磺化是可逆反应,在一定条件下生成的磺酸又会水解。
在很多情况下,磺化温度会影响磺基进入芳环的位置。
例如,萘用浓硫酸在低温下进行磺化,主要生成易水解的萘-1-磺酸,而高温磺化则主要生成难水解的萘-2-磺酸。
磺化是放热反应,低温磺化时需要冷却,而高温磺化则需要加热保温。
根据所用磺化剂的不同而区分为:①过量硫酸磺化大多数芳香族化合物的磺化采用此法。
用浓硫酸磺化时,反应通式为:R*H2m-G'[+H 式中Ar表示芳基。
反应生成的水使硫酸浓度下降、反应速率减慢,因此要用过量很多的磺化剂。
难磺化的芳烃要用发烟硫酸磺化。
这时主要利用其中的游离三氧化硫,因此也要用过量很多的磺化剂。
Ar-H+SO3—→Ar-SO3H②三氧化硫磺化优点是磺化时不生成水,三氧化硫用量可接近理论量,反应快、废液少。
但三氧化硫过于活泼,在磺化时易于生成砜类等副产物,因此常常要用空气或溶剂稀释使用。
主要用于由十二烷基苯制十二烷基苯磺酸钠等表面活性剂的磺化过程。
③共沸去水磺化用于从苯和氯苯制苯磺酸和对氯苯磺酸。
特点是将过量6~8倍的苯蒸气在120~180℃通入浓硫酸中,利用共沸原理由未反应的苯蒸气将反应生成的水不断地带出,使硫酸浓度不致下降太多,此法硫酸的利用率高。
因磺化时用苯蒸气,又简称气相磺化。
④烘焙磺化用于某些芳伯胺的磺化。
特点是将芳伯胺与等摩尔比的浓硫酸先制成固态硫酸盐,然后在180~230℃烘焙,或是将芳伯胺与等摩尔比的硫酸,在三氯苯介质中在180℃加热,并蒸出反应生成的水。


第3章磺化反应
§3-1磺化反应的基本原理
一、磺化反应的作用
1.表面活性
2.水溶性和酸性
3.分离异构体:二甲苯
4.阻塞占位
二、磺化反应机理
1.芳烃的磺化机理——亲电取代反应
*芳基磺酸易水解,异构化:
ArSO3H + H2O = ArH + H2SO4
2.烯烃的磺化机理——亲电加成反应*混合物
3.芳烃的磺化机理——自由基链式反应*氯磺化和氧磺化
三、影响磺化反应的主要因素
1.被磺化物的性质
(1)饱和烷烃较难磺化,芳烃较易磺化
(2)芳烃取代基:电子效应:苯>氯苯>溴苯>对硝基苯甲醚>对硝基甲苯>硝基苯
空间效应:邻二甲苯>甲苯>乙苯>异丙苯>叔丁苯
2.反应温度
(1)对反应速率的影响: T↑—r↑—t↓(低温长时)
(2)对磺酸基引入位置的影响
甲苯:低温——对位,邻位;升高温度——间位产物增多
萘:低温——α位;高温——β位
(动力学-热力学:水解-再磺化-异构化)
(3)对多磺化的影响
T↑——利于多磺化
3.磺化催化剂和磺化助剂
(1)促使反应易于进行
——吡啶,邻氯苯甲醛
(2)改变磺酸基引入位置
(3)抑止副反应
HAc、Na2SO4——抑止砜的生成
硼酸(与羟基形成硼酸酯)——阻止氧化反应
§3-2常用磺化剂及其磺化方法
一、硫酸:稀硫酸、浓硫酸,发烟硫酸
1.使用高浓度过量的酸
∴ C ↑则X↓
2.脱水
物理脱水法:(1)共沸(2)高温β-萘磺酸:160℃,过量40%
化学脱水法:BF3, SOCl2: H2O+ SOCl2→2HCl ↑+ SO2↑
3.硫酸的浓度与其它物理性质的关系(熔点,密度,比热,溶解度,电阻)
20~25%,60~65%
4.操作方法:向被磺化物仲缓慢加入磺化剂
优点:平稳,易于传质、传热,副反应少
缺点:残渣,后处理困难
二、三氧化硫
——优点:不生成水,反应速度快,活性高,理论量即可完成反应
缺点:物料粘度高,传质困难,副反应多
1.SO3在室温下易聚合
——γ型加稳定剂:0.1%硼酐,二苯砜,(CH3)2SO4
2.SO3具有强氧化性
——控制温度,加入稀释剂SO3(气):N2, SO2; SO3(液): SO2(液),CCl4 (防止爆炸-强放热)
三、氯磺酸ClSO3H (SO3·HCl )
活性强,价格高,HCl腐蚀:制备芳磺酸或磺酰氯,N-磺化(甜蜜素)
(1)分批加料:将有机物加入氯磺酸中(减少砜的生成)
(2)稀释剂:二氯苯,四氯乙烷,硝基苯
四、氯磺化和氧磺化
氯磺化:Cl2+SO2
氧磺化: O2+SO2
注意:(1)仲碳磺酸盐(2)氯磺化:采用SO2过量(SO2:Cl2=3:1),低转化率(50~70%)的方法控制副反应(氯化,多磺化)
五、烘焙磺化法。