Acr-Bis(40%:2%)
- 格式:doc
- 大小:44.50 KB
- 文档页数:1
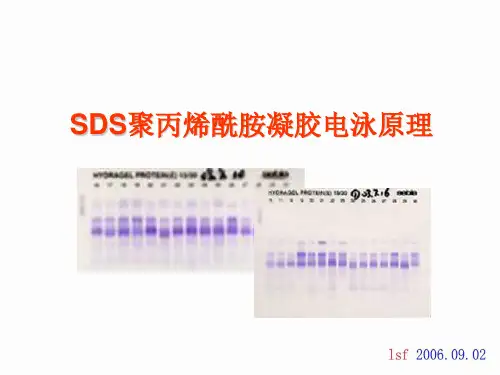
ABO血型基因型检测实验【实验材料】pBR322/Msp I Marker;ABO基因复合PCR扩增产物。
【实验准备】1. 器材:电泳仪、垂直板电泳槽系统、脱色摇床、涡旋混合仪等;2. 试剂:生工PCR试剂盒、引物由生工合成、NEB内切酶AluI和KpnI-HF、DNA加样缓冲液(6×)、10×TBE电泳缓冲液(贮存液)、40%丙烯酰胺预混液(Acr-Bis 液,19∶1)、四甲基乙二胺(TEMED)、10%(M/V)过硫酸铵(APS)、GeneGreen核酸染料等;2.1 染色液:用0.1g AgNO3定溶于100mL超纯水中,现配现用;2.2 显色液:1.2g NaOH,400μL 37%甲醛溶液定容于100mL预冷的超纯水中,现配现用;2.3 固定液:10%冰乙酸,10mL冰乙酸定容于100mL超纯水中。
【实验步骤】一、ABO血型基因多重PCR扩增技术多重PCR反应混合体系配制(表1、表2):在冰上放置0.2mL PCR管,根据总体积(50μL)加入无菌ddH2O,将PCR试剂解冻后置于冰上操作,可按体积由大到小顺序依次加入相关成分,配制反应混合体系;表1 多重PCR引物引物序列碱基数浓度预计产物1:5'-CACCGTGGAAGGATGTCCTC-3' 20bp 5μM200bp (A和B等位基因)2:5'-AATGTCCACAGTCACTCGCC-3' 20bp 5μM199bp (O等位基因)3:5'-GTGGAGATCCTGACTCCGCTG-3' 21bp 5μM159bp (A、B和O等位基因) 4:5'-CACCGACCCCCCGAAGAA-3' 18bp 5μM表2 多重PCR混合体系(50μL)组别DNA模板10×buffer MgCl2dNTPs 引物1 引物2 引物3引物4Taq酶ddH2O 实验组5μL5μL3μL4μL2μL2μL1μL1μL0.3μL26.7μL 对照组—5μL3μL4μL2μL2μL1μL1μL0.3μL31.7μL 终浓度20~500ng 1× 1.5mM 0.2mM 0.2μM0.2μM0.1μM0.1μM 1.5U —将配制好的混合液轻轻混匀并轻微离心,在PCR扩增仪上按下表编入程序(表3):表3 PCR程序设定参数预变性变性退火延伸延伸保存温度95℃95℃60℃72℃72℃4℃时间2min 30s 30s 30s 3min 备用循环数 1 30 1 ∞编完反应程序后,置PCR管于PCR扩增仪反应孔中,开动机器。



碱性蛋白质活性胶的配置Shmily2012逍遥居士各种蛋白质分子由于所含的碱性氨基酸和酸性氨基酸的数目不同,因而有各自的等电点。
凡碱性氨基酸含量较多的蛋白质,等电点就偏碱性,如组蛋白、精蛋白等。
反之,凡酸性氨基酸含量较多的蛋白质,等电点就偏酸性,人体体液中许多蛋白质的等电点在pH5.0左右,所以在体液中以负离子形式存在。
从某种意义上来讲,碱性蛋白质也就是其等电点大于7.0,在碱性范围内。
所以,碱性蛋白质活性胶电泳,我们应该用酸性缓冲液的活性胶,因为在酸性缓冲液下,碱性蛋白质带正电荷,从电泳槽的阳极向阴极移动。
分离碱性蛋白时候,要利用低pH凝胶系统,分离酸性蛋白时候,要利用高pH凝胶系统。
酸性蛋白通常在非变性凝胶电泳中采用的pH是8.8的缓冲系统,蛋白会带负电荷,蛋白会相阳极移动;而碱性蛋白通常电泳是在微酸性环境下进行,蛋白带正电荷,这时候需要将阴极和阳极倒置才可以电泳。
碱性蛋白质活性胶即酸性缓冲液的活性胶---低pH的缓冲液系统。
配方如下:β-Ala NH2CH2CH2COOH=89.09甲基绿Methyl Green分子式:C27H35Cl4N3Zn分子量:608.78酸性非变性电泳工作液配制:40%胶贮液(Acr:Bis=29:1)4×分离胶Buf(pH4.3,0.24M KOH-HAc):1.346g KOH,以HAc调pH至4.3,Milli-Q 定容至100ml。
4×堆积胶Buf(pH6.8,0.24M KOH-HAc):1.346g KOH,以HAc调pH至6.8,Milli-Q 定容至100ml。
5×电泳Buf(pH4.4,β-Ala-H Ac):35.64gβ-Ala,以HAc调pH至4.4,dH2O定容至1L。
即0.4M的丙氨酸缓冲液,1×buffer的为0.08M。
2×甲基绿上样Buffer:1ml1×(pH4.4,β-Ala-HAc)电泳缓冲液,3ml甘油,1ml0.4g/L 甲基绿,5ml dH2O;-20℃贮存。
western-blot实验流程:一、裂解细胞:1、收集细胞。
1000rpm,5min.弃上清,加1ml PBS,混匀,移至EP管。
2、4℃,1000rpm,5min。
弃上清,加1ml PBS,4℃,1000rpm,5min再洗一次。
3、配制裂解液(见附录一):WB buffer 500μlNa3VO4 5μl配方一:Na4P2O7 5μlPMSF 5μlCocktail 5μl1×107/ml裂解液,冰上孵育15min(每隔3~5分钟混匀一次),13000rpm(或16000rpm),4℃,离心10min.分装上清液(裂解蛋白),-20℃保存。
(一般另取5μl,作蛋白定量用)配方二:RIPA配方三:Nuc Buster TM protein extraction Kit二、蛋白定量(BCA法,Bio-Rad):1、工作液的准备每ml A试剂中加入20ul的S试剂(此工作液在1周之内稳定,但在配制1天后会形成沉淀。
若有沉淀形成,加热并旋涡混匀使沉淀溶解,勿用Tip吸取沉淀)若样品中不含去垢剂,此步骤可省略,直接使用试剂A。
2、将蛋白标准液稀释,浓度从0.2mg/ml至1.5mg/ml。
稀释液与样品的溶解液相同。
3、待测蛋白做相应的稀释。
(一般稀释2.5或5倍)4、每孔加入5ul标准蛋白溶液和待测蛋白溶液。
5、每孔加入25ul的试剂A或试剂A’6、每孔200ul试剂B,轻轻混匀,室温放置15分钟,650-750NM检测吸光度。
三、配胶:10% (10ml,1小板) 8% (50ml,1大板) 分离胶:40% Acr-Bis 2.5ml 10. ml1.5M Tris-HCl PH8.82.5ml 12.5 mlH2O 4.8ml 26.5 ml10%SDS 100ul 500ul10% AP(H2O现配)100ul 500ulTEMED 4ul 30ul 注:大板——> 0.3cm梳子(大齿)50ml;0.5cm梳子(小孔)65ml.浓缩胶:(5ml, 1小板)40% Acr-Bis 625ul1.0M Tris-HCl PH6.8 625ulH2O 3.7ml10%SDS 50ul10%AP 50ulTEMED 5ul四、样品处理:配方一:sample buffer:0.5M Tris-HCl, PH6.8 1.0ml5×Glyceral 0.8ml(8ml)10%SDS 1.6ml二巯基乙醇0.4ml0.05%溴酚兰(用水配)0.4mlH2O 3.8ml配方二(常用):电泳样品:25μg/孔。

五种电泳技术的比较SDSPAGE名词解释:相对迁移率(Rf)问答题:1.简述SDS-PAGE的基本原理。
2.影响SDS电泳的关键因素有哪些?AGE名词解释1.迁移率2.电渗3.电泳问答题1.影响电泳迁移率的因素有哪些?2.试述琼脂糖凝胶电泳分离脂蛋白的原理。
CAME1.CAME的基本原理是什么?2.CAME分离血清蛋白电泳时应注意哪些问题?PAGE名词解释1.凝胶总浓度2.交联度问答题1.与CAME相比,PAGE有哪些特点。
2.试比较CAME与PAGE操作的区别。
3.简述不连续PAGE的原理。
1.琼脂糖凝胶电泳Agarose Gel ElectrophoresisGel Electrophoresis :由琼脂、琼脂糖、淀粉胶及聚丙烯酰胺等物质作支持体的电泳。
特点(characteristic):1.可以制成非常均匀的凝胶,带电质点在凝胶的孔中泳动。
2. 电泳操作方法简便,电泳速度快。
3. 分辨率高,重复性好,电泳图谱清晰。
4. 适用于生化,免疫等定性定量测定。
(一)优点(advantage)1.因不含硫酸根和羧基,几乎消除了琼脂的电渗。
2.对蛋白质吸附极微,故无拖尾现象。
3.凝胶结构均匀,孔径较大,可用来分离酶的复合物、核酸、病毒等大分子物质。
4.透明度较好,可直接或干燥成薄膜后进行染色。
5.不吸收紫外光,可直接利用紫外光吸收法作定量测定。
6.有热可逆性。
(二)缺点(disadvantage)1.机械强度差,易破碎,浓度不能太低。
2.易被细菌污染,不易保存,临用前配制。
3.琼脂糖支持层上的区带易于扩散,电泳后必须立即固定染色。
4.与PAGE相比,分子筛(molecular sieve)作用小,区带少。
应用1. 适用于大分子的核酸、核蛋白等的分离、鉴定及纯化2. 临床生化检验中常用于LDH、CK等同工酶的分离与检测3. 为不同类型的高脂蛋白血症、冠心病等提供生化指标影响迁移的因素the size of the moleculeconformation of the moleculethe agarose concentration of a gelVoltage百分浓度和分辨率限制Most agarose gels are made with between 0.7% (good separation or resolution of large 5–10kb DNA fragments) and 2% (good resolution for small 0.2–1kb fragments) agarose dissolved in electrophoresis buffer.Up to 3% can be used for separating very tiny fragments but a vertical polyacrylamide gel 聚丙烯酰胺is more appropriate in this case.Low percentage gels are very weak and may break when you try to lift them. High percentage gels are often brittle and do not set evenly. 1% gels are common for many applications.琼脂糖凝胶分离血浆脂蛋白原理:血清脂蛋白经饱和苏丹黑B预染后,以琼脂糖凝胶为支持介质,在pH8.6巴比妥缓冲液中电泳,根据各脂蛋白的组成、大小、形状分离成不同区带。

根据电泳图谱判断胶体分子量的大小直接用环状的质粒跑电泳是很难判断其分子量的。
一般来说要先找到上面的一个相应的酶切位点(这个酶在这个质粒上只有一个识别域).把质粒完全切开后再跑琼脂糖凝胶电泳,配合适当的marker就可以比较准确的判断质粒的分子量.常用的标准凝胶是指浓度为7.5%的凝胶,大多数生物体内的蛋白质在此凝胶中电泳,能获得满意的结果。
为了在使用凝胶做实验时有较高的重现性,制备凝胶所用的Acr浓度,Bis和Acr的比例、催化剂的浓度、聚合反应的溶液pH值、聚胶所需时间等能影响泳动率的因子都必须保持恒定。
快离子很快移动到最前面,原来它停留在那部分地区则形成了低离子浓度区,即低电导区。
低电导区有较高的电位梯度,就引起了电位梯度的突变。
这种高电位梯度又使蛋白质阴离子和甘氨酸阴离子在此区域加速前进,追赶快离子。
当快离子和慢离子的移动速度相等的稳定状态建立以后,快离子和慢离子之间造成一个不断向正极移动的界面。
夹在快、慢离子间的样品蛋白质阴离子的移动界面就在这个追赶中逐渐被压缩,聚集成一条狭窄的区带。
浓缩效应可使蛋白质浓缩数百倍。
凝胶的pH值明显增加,并导致甘氨酸的大量解离,有效泳动率增加.甘氨酸的分子量远小于蛋白质,它将赶上并超过各种蛋白质分子直接在氯离子后移动.这时,由于凝胶孔径变小,使蛋白质分子的迁移率减小,于是蛋白质分子在均一的电压梯度和pH环境中泳动,分子迁移速度与分子量大小和形状与其迁移率密切相关,分子量小且为球形的蛋白质分子所受阻力小,移动快,走在前面.一、基本原理免疫电泳法是将供试品通过电泳分离成区带的各抗原,然后与相应的抗体进行双向免疫扩散,当两者比例合适时形成可见的沉底弧。
将沉淀弧与已知标准抗原、抗体生成的沉淀弧的位置和形状进行比较,即可分析供试品中的成分及其性质。
二、类型一)流免疫电泳(counter immunoelectrophoresis,CIEP)即双扩+电泳技术,用途:同双扩,优点:快、敏感性高,缺点:分辨力低二)火箭免疫电泳(roket immunoelectrophoresis,RIE)即:单扩+电泳用途:定量抗原优点:快缺点:影响因素多,不常用三)免疫电泳(immunoelectrophoresis,IEP)即:电泳后进行双相琼脂扩散实验用途:定性实验,主要用于纯化抗原和抗体成分的分析及正常和异常免疫球蛋白的识别和鉴定。
产品信息产品描述Acr-Bis常用于配制丙烯酰胺凝胶(PAGE胶),包括SDS-PAGE胶等,可以用于蛋白或核酸的分离。
聚丙烯酰胺凝胶是由丙烯酰胺(acrylamide,简称Acr)和交联剂甲叉双丙烯酰胺(N,N’-methylene bisacrylamide,简称Bis )在催化剂的作用下,通过自由基引发聚合反应,形成不带电荷、且具有分子筛性质的网状结构。
其孔径大小由聚合链的长度和交联度(交叉连接的程度)所决定。
聚合链的长度与丙烯酰胺的浓度有关,交联度由Acr 与Bis的相对比例决定,调节单体丙烯酰胺与交联剂(Bis)的浓度比例,可形成具有不同交联度的网状聚合物。
其中Bis的浓度愈低,凝胶的孔径愈大,适用于分离较大的分子;Bis的浓度愈高,网孔越小,分辨率越高,越有利于分离较小的分子。
40% Acr-Bis(19:1)即为含40% acrylamide-bisacrylamide的水溶液,其中acrylamide和bisacrylamide的比例为19:1。
40% Acr-Bis(29:1)即为含40% acrylamide-bisacrylamide的水溶液,其中acrylamide和bisacrylamide的比例为29:1。
40% Acr-Bis(37.5:1)即为含40% acrylamide-bisacrylamide的水溶液,其中acrylamide和bisacrylamide的比例为37.5:1。
运输与保存方法冰袋(wet ice)运输。
4℃避光保存。
注意事项1)Acr-Bis具有一定神经毒性,使用时请注意适当防护。
2)为了您的安全和健康,请穿实验服并戴一次性手套操作。
The Polyacrylamide MatrixThe polymerization of a polyacrylamide matrix withmethylenebisacrylamide cross-linking.Polyacrylamide gels are formed by the polymerization of acrylamide in aqueous solution in the presence of small amounts of a bifunctional crosslinker. The crosslinker is usuallymethylene:bisacrylamide (bis, or MBA). The copolymerization of acrylamide with methylenebisacrylamide produces a mesh-like network in three dimensions, consisting of acrylamide chains with interconnections formed from the methylenebisacrylamide. A variety of crosslinkers are available in addition to bis. These include piperazine diacrylate (PDA), N,N'-bisacrylylcystamine (BAC), and N,N'-diallyltartardiamide (DATD). PDA is used to reduce silver stain backgrounds in SDS-PAGE gels. BAC and DATD are both disruptable cross-linkers which enable gels to be solubilized.BAC, DATD, and Piperazine diacrylate are sometimes usedas the cross-linkers in polyacrylamide gels to vary thephysical or chemical properties of the gel.For discussions of the composition of polyacrylamide gels, a standard nomenclature has been widely adopted. In this nomenclature, T represents the total percentage concentration (w/v) of monomer (acrylamide plus crosslinker) in the gel. The term C refers to the percentage of the total monomer represented by the crosslinker. For example, an 8%, 19:1 (acrylamide/bisacrylamide) gel would have a T value of 8% and a C value of 5%.Upon the introduction of catalyst, the polymerization of acrylamide and methylene bisacrylamide proceeds via a free-radical mechanism. The most common system of catalytic initiation involves the production of free oxygen radicals by ammonium persulfate in the presence of the tertiary aliphatic amine N,N,N',N'-tetramethylethylenediamine (TEMED). Another catalytic system involves the generation of free radicals via a photochemical process using a very small amount of riboflavin in the presence of TEMED. In both catalytic systems, the presence of excess oxygen will inhibit the polymerization elongation process and can lead to shorter average chain length. For this reason, if the casting solution has been excessively agitated, deaeration under vacuum with a magnetic stirrer is suggested prior to addition of initiators.For certain applications, polyacrylamide has definite advantages compared to agarose. In an agarose gel, the pore size is large, so molecular sieving, i.e. separation by size, will not occur for smaller DNA fragments and most proteins. Additionally, by altering the total concentration of monomer in the gel and the ratio of acrylamide to bis, the pore size with a polyacrylamide gel can be altered in a reproducible manner. The small and reproducible pore size in polyacrylamide gels results in superior resolution: a 0.1% difference in size (1 base difference in a 1kb molecule) can be detected. Also, because acrylamide and bis are synthetic chemicals, there are virtually no batch to batch differences (It should be mentioned that batch to batch differences with agarose are overcome with the highest quality agaroses, such as National Diagnostics' AquaPor agaroses).Control of the pore size of a polyacrylamide gel is accomplished by changing the T and C values. With increasing T, the pore size decreases in a nearly linear relationship. Higher percentage gels (higher T), with smaller pores, are used to separate smaller molecules. The relationship of C to pore size is more complex. Generally, the minimum pore size occurs when C is about 5% (a 19:1 gel). Decreasing C results in a more open pore structure because there are fewer crosslinker molecules. Increasing C beyond 5% also increases the pore size. This appears to be because of nonhomogeneous bundling of strands in the gel.Researchers have settled on C values of 5.0% (19:1 acrylamide/bis) for most forms of denaturing DNA and RNA electrophoresis and 3.3% (29:1) for most native DNA and RNA gels. For SDS-PAGE electrophoresis of proteins, the standard C value that has been adopted is 2.6% (37.5:1). The table below gives recommended acrylamide/bis ratios and gel percentages for different molecular size ranges.。

Western bolt一、实验目的通过实验了解western blot技术的原理和操作。
二、实验原理SDS-PAGE是最常用的定性分析蛋白质的电泳方式,特别是用于蛋白质纯度检测和测定蛋白质分子量。
PAGE能有效的分离蛋白质,主要依据其分子量和电荷的差异,而SDS-PAGE的分离原理则仅根据蛋白质的分子量的差异。
SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X 为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
硝酸纤维素膜(nitrocellulose filter membrane,简称NC膜),在胶体金试纸中用做C/T线的承载体,同时也是免疫反应的发生处。
NC膜是生物学试验中最重要的耗材之一。
第一抗体就是能和特异性抗原特异性结合的蛋白。
第二抗体是能和抗体结合,即抗体的抗体,其主要作用是检测抗体的存在,放大一抗的信号。
化学发光HRP底物(辣根过氧化物酶底物,也常被称为ECL试剂)是目前Western blot检测中最为灵敏的试剂。
显影液的A液主要成分为鲁米诺(Luminol)及发光增强剂,B液主要成分为过氧化物溶液。
二抗上含有HRP(辣根过氧化物酶),可以催化A液和B液反应发光。
三、实验器材1.电泳槽,胶板架子2.转膜仪3.NC膜4.电泳电源5.滤纸6.摇床7.X射线摄影暗匣8.X射线胶片9.塑料薄膜四、实验试剂1.runningbuffer5xrunningbuffer(1L)Tris 15.1gGlycine 94.0gSDS 5.0gddH2O 定容至1L使用前稀释5倍2.Transfer buffer10×Transfer buffer(1L)Tris 30.3gGlycine 144.0gddH2O 定容至1L使用前稀释10倍,加入1/4体积的甲醇3.TBS10×TBS(500mL)Tris 12.1gNacl 40.0gddH2O 定容至500mL用HCl调节溶液的pH值至7.64.TBST(1L)1×TBS:Tween-20=1000:1ddH2O定容至1L5.5%的脱脂奶粉溶液(50ml)脱脂奶粉 2.5gTBST 定容至50ml6.一抗溶液7.二抗溶液8.显影液现配现用,溶液A:溶液B=1:1配置。
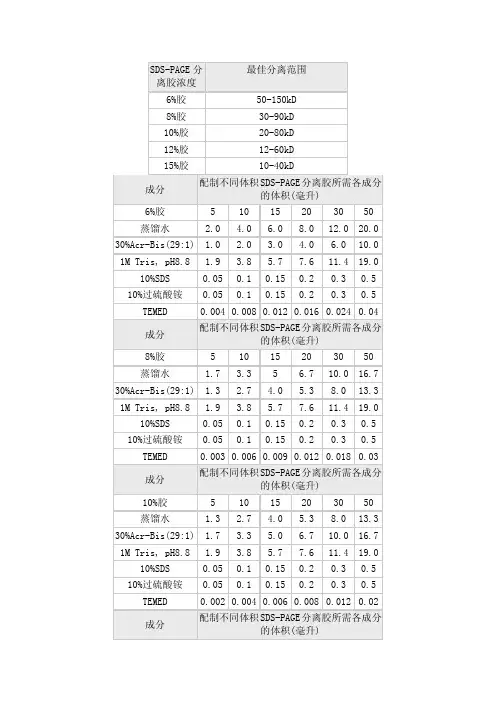
(1)Acr-Bis液(丙烯酰胺溶液)500 mL:于800 mL洁净的烧杯中,依次称取双丙烯酰胺4 g,丙烯酰胺146 g,缓慢倒入双蒸水约350 mL,以玻璃棒缓慢搅拌促进溶解。
注意,双丙烯酰胺粉末易漂浮在空气中,所以要称重时注意周围空气流速,称取丙烯酰胺时可以将烧杯中的双丙烯酰胺掩盖。
玻璃棒搅动幅度不要太大以免溶液底部的双丙烯酰胺浮起并扩散到空气中。
完全溶解的溶液应清澈无色透明。
待溶解完全后补加双蒸水至500 mL,倒入无色玻璃试剂瓶中,4℃冰箱可保存10个月。
(2)4×分离胶缓冲液,500 mL:于500 mL洁净的量筒中,依次加入375 mL 2 M Tris-HCl (实测pH 8.9±0.1,25℃),100 g/L SDS 溶液(冰箱取出后可微波加热促进储存液的溶化)20 mL,最后加入适量双蒸水至500 mL。
倒入无色玻璃试剂瓶中,4℃冰箱最少可保存12个月。
有时冰箱温度过低会使储存液混浊,微波略微加热使其澄清后即可使用。
(3)100 g/L 过硫酸铵溶液(ammonium persulfate, AP)20 mL:2g过硫酸铵加20 mL 双蒸水,倒入无色塑料试剂瓶中,4℃冰箱最少可保存10个月。
注意配胶时不要交叉污染TEMED,可以以5 mL分装到4个无色塑料试剂瓶中分别保存。
(4)TEMED 成品液:购买后分装成2或5 mL小管装使用可避免母液受到污染。
(5)5×样品缓冲液,100 mL:依次加入50 mL 75%(v/v)甘油,20 mL 100 g/L SDS 溶液,10 mL 10 g/L 溴酚蓝溶液,5 mL 2 M Tris-HCl (实测pH8.9±0.1,25℃),5 mL巯基乙醇,9 mL 双蒸水。
混合母液倒入无色玻璃试剂瓶中,4℃冰箱至少可保存12个月。
可分装成10 mL 使用,不会使母液受到蛋白污染。
(6)10×电泳缓冲液,1000 mL:称取10 g SDS,30 g Tris base,144g 甘氨酸(事先要明确甘氨酸溶液的颜色,选用溶解后澄清无色的产品)于1000 mL的烧杯中,加水约700 mL 溶解,可微波炉加热(< 80℃)以促进溶解,注意不要使其沸腾,加热至烧杯烫手即可,间歇用玻璃棒搅拌。
北京雷根生物技术有限公司
Acr-Bis(30%,37.5:1)
简介:
丙烯酰胺:亚甲基双丙烯酰胺溶液又称Acr-Bis ,最常用的是30%Acr-Bis(29:1)即为含30% Acrylamide-Bisacrylamide 的水溶液,其中Acrylamide 和Bisacrylamide 的比例为29:1,丙烯酰胺的总比例为30%。
Leagene Acr-Bis(30%,37.5:1)中Acrylamide 和Bisacrylamide 的比例为,丙烯酰胺总量为,常用于配制丙烯酰胺凝胶(PAGE 胶),如SDS-PAGE 胶等,可以用于蛋白或核酸的分离。
组成:
操作步骤(仅供参考):
1、因具体实验而异,可以参考SDS-PAGE 凝胶配制的说明。
注意事项:
1、 Acr-Bis(30%,37.5:1)对人体有一定神经毒性,请注意适当防护。
2、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:12个月有效。
相关:
编号 名称 PE0122 Storage Acr-Bis(30%,37.5:1) 500ml 4℃ 避光 使用说明书
1份 编号 名称
DH0006 苏木素伊红(HE)染色液
NR0001 DEPC 处理水(0.1%)
PE0025 SDS-PAGE 蛋白加样缓冲液(5×)
PE0080 Tris-HCl 缓冲液(1mol/L,pH6.8)
PE0103 Acr-Bis(30%,29:1)
PT0001 BCA 蛋白定量试剂盒
PW0111 Super ECL Plus 超敏发光液
TC0713 葡萄糖检测试剂盒(GOD-POD 比色法)。
小麦麦谷蛋白的SDS-PAGE电泳实验操作步骤(一)试剂配制编号名称浓度PH值终体积/ml 所需药品量加水量/ml1 Tris-Hcl 1M 8.8 250 30.275g 2202 Tris-Hcl 1M 6.8 100 12.11g 803 SDS 10% 50 5.0g4 40%Acr-Bis 100 0.52gBis,39.48gAcr 705 样品缓冲液 6.8 50 12ml甘油,0.757gTris4Gsds,6mg溴酚蓝366 10×电泳缓冲液8.3 1000 30gTris,10gSDS144g甘氨酸80807 蛋白提取液60 27ml 5号溶液3mlβ-巯基乙醇308 10%过硫酸氨(Aps):用2.0ml的离心管,在1.5mlddH2O中加入0.15gAPS 充分振荡溶解,稍离心后置冰箱-20℃中保存,用时提前溶化。
9 染色液配制:称取0.1g考马司斯亮蓝R-250溶解于100ml甲醇和冰乙酸的混合水溶液中,混合液的比例为:水:甲醇:冰乙酸=53:40:7(V/V)。
染色液要用磁力搅拌器充分搅拌后使用。
(二)麦谷蛋白的提取取粉碎的小麦粉20mg 放于1.5ml 离心管里加入300ul 蛋白提取液,摇匀,静置30 min,沸水浴加热3~5 min,取出后8000rpm离心,抽取上清液于新管,冰箱4℃保存备用。
(三)10%分离胶和4%浓缩胶的配制溶液 10%分离胶 4%浓缩胶1M Tris-Hcl(PH8.8) 13.65ml1M Tris-Hcl(PH6.8) 1.56ml40% Acr/Bis 9ml 1.2ml10% SDS 0.36ml 120μlddH2O 12.6ml 9ml10% APS 0.36ml 120μlTEMED 30μl18μl总体积 36ml 12ml(四)电泳待胶凝好后,先轻轻摇动试样格,然后小心拔出。
如果加样槽不正或断裂,可用长针头扶正。
北京雷根生物技术有限公司
Acr-Bis(40%,29:1)
简介:
丙烯酰胺:亚甲基双丙烯酰胺溶液又称Acr-Bis ,最常用的是30%Acr-Bis(29:1)即为含30% Acrylamide-Bisacrylamide 的水溶液,其中Acrylamide 和Bisacrylamide 的比例为29:1,丙烯酰胺的总比例为30%。
Leagene Acr-Bis(40%,29:1)中Acrylamide 和Bisacrylamide 的比例为, 丙烯酰胺总量。
常用于配制丙烯酰胺凝胶(PAGE 胶),包括SDS-PAGE 胶等,可以用于蛋白或核酸的分离。
组成:
操作步骤(仅供参考):
1、因具体实验而异,可以参考SDS-PAGE 凝胶配制的说明。
注意事项:
1、 Acr-Bis(40%,29:1)对人体有一定神经毒性,请注意适当防护。
2、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:6个月有效。
相关:
编号 名称 PE0126 Storage Acr-Bis(40%,29:1) 500ml 4℃ 避光 使用说明书
1份 编号 名称
DH0006 苏木素伊红(HE)染色液
NR0001 DEPC 处理水(0.1%)
PE0080 Tris-HCl 缓冲液(1mol/L,pH6.8)
PE0103 Acr-Bis(30%,29:1)
PT0001 BCA 蛋白定量试剂盒
PT0013 考马斯亮蓝快速染色液
TC0699 植物总糖和还原糖检测试剂盒(硝基水杨酸法)。
丙烯酰胺/甲叉双丙烯酰胺预混液(30% Acry-Bis, 40% Acry-Bis, 19:1, 29:1, 37.5:1)
同义名:
30% Acrylamide/Bis Solution, 29:1;40% Acrylamide/Bis Solution, 29:1;
30% Acrylamide/Bis Premix 29:1;40% Acrylamide/Bis Premix 29:1;
30% Acr-Bis(29:1);40% Acr-Bis(29:1);Acrylamide/Bis-Acrylamide (29:1 ratio) (T=30%);
Acrylamide/Bis-Acrylamide (29:1 ratio) (T=40%);
工作原理:
聚丙烯酰胺凝胶(Polyacrylamide Gels,PAGE)是常用的电泳介质,根据大小来分离蛋白质和核酸。
该凝胶介质是由丙烯酰胺(Acrylamide, Acry)和共单体交联剂甲叉双丙烯酰胺(Bisacrylamide,Bis)经TEMED(N,N,N’,N’-四甲基乙二胺)催化过硫氨酸(APS)还原产生的自由基的存在下,引发聚合反应,形成不带电荷、且具有分子筛性质的网状结构。
凝胶的孔径由两个参数决定:
单体总浓度(%T):
交联剂比重(%C):
比如,T=20%凝胶是由20% Acry-Bis配制而成。
%T越高,凝胶孔径越小;比如,T=20%,C=5%凝胶是由20% Acry-Bis配制而成,Bis所占的质量比重是5%。
产品类型:
我司提供两种不同浓度(30%,40%),3种不同比例的丙烯酰胺/甲叉双丙烯酰胺预混液。
北京雷根生物技术有限公司
Acr-Bis(40%:2%)
简介:
丙烯酰胺:亚甲基双丙烯酰胺溶液又称Acr-Bis ,最常用的是30%Acr-Bis(29:1)即为含30% Acrylamide-Bisacrylamide 的水溶液,其中Acrylamide 和Bisacrylamide 的比例为29:1,丙烯酰胺的总比例为30%。
Leagene Acr-Bis(40%:2%)中Acrylamide 和Bisacrylamide 的比例为, 丙烯酰胺总量为,常用于配制丙烯酰胺凝胶(PAGE 胶),如SDS-PAGE 胶等,可以用于蛋白或核酸的分离。
组成:
操作步骤(仅供参考):
1、因具体实验而异,可以参考SDS-PAGE 凝胶配制的说明。
注意事项:
1、 Acr-Bis(40%:2%)对人体有一定神经毒性,请注意适当防护。
2、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:12个月有效。
相关:
编号 名称 PE0130 Storage Acr-Bis(40%:2%) 500ml 4℃ 避光 使用说明书
1份 编号 名称 DH0006 苏木素伊红(HE)染色液 NR0001
DEPC 处理水(0.1%) PE0025
SDS-PAGE 蛋白加样缓冲液(5×) PE0080
Tris-HCl 缓冲液(1mol/L,pH6.8) PT0001
BCA 蛋白定量试剂盒 PT0013
考马斯亮蓝快速染色液 TC0699 植物总糖和还原糖检测试剂盒(硝基水杨酸法)。