含氮和含磷有机化合物
- 格式:ppt
- 大小:11.38 MB
- 文档页数:36



第十章含氮和含磷有机化合物I学习要求1.熟悉伯、仲、叔胺与伯、仲、叔醇和伯、仲、叔卤代烃的区别。
2.掌握胺、酰胺、硝基化合物、重氮盐和偶氮化合物的命名。
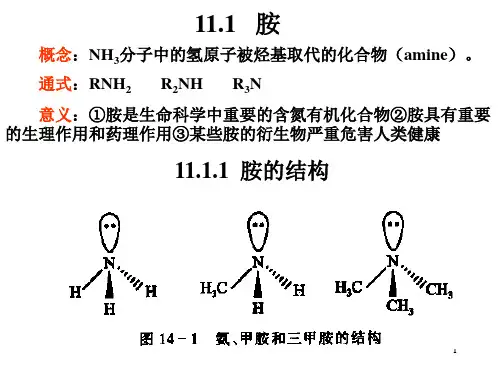
3.熟悉氨、脂肪胺及芳香胺的结构。
掌握氨、胺和铵的区别以及磷和膦的区别4.熟练掌握胺、酰胺、硝基化合物和重氮盐的化学性质及胺的分离提纯方法。
5.掌握氨基的保护及在合成中的应用。
II内容提要一. 胺的定义、分类和命名(略)应当注意伯、仲、叔醇指的是羟基分别与伯、仲、叔碳原子相连的醇,而伯、仲、叔胺指的是氮原子与一个、两个、三个烃基相连的胺,与氮原子所连碳的种类无关。
如(CH3)3COH是叔醇,而(CH3)3CNH2是伯胺。
二. 胺的性质1.碱性:在水溶液中,胺的碱性强弱顺序为:脂肪胺>氨>芳香胺。
脂肪胺在气相或非水溶液中的碱性与电子效应结果相一致:叔胺〉仲胺〉伯胺。
脂肪胺在水溶液中的碱性受多种因素影响,一般情况下,仲胺表现出较强的碱性。
就甲胺、二甲胺、三甲胺来说,其碱性强弱顺序为:二甲胺〉甲胺〉三甲胺。
芳香胺的碱性强弱顺序与电子效应、溶剂效应、位阻效应相一致。
即苯胺〉二苯胺>三苯胺。
2.烷基化反应:1)RX1)RXRX -AgO+_RNHRNHRN"22)OH-22)OH-37'」"H2O43.酰基化反应:汽RNH2I RCCl—RNHCR严R2NH+R'CCl—R2N-C-R'酰胺是结晶固体,可通过测熔点确定原来的胺,叔胺无此反应,可用于定性鉴定伯胺和仲胺,也可用于叔胺与伯胺和仲胺的分离。
酰胺在酸碱催化下水解得到原来的胺,可用酰基化反应保护氨基。
如:[O] NHCOCH3H_OOH-NHCOCH3H3NH2 CH3COCl-H3 OOH OOHNH2I24.磺酰化反应:RNH 2+匚-SO 2C1R 2NH 0~SO 2C^JNaOHN -RNa +(溶于NaOH 溶液)R 3N +.__SO 2C1该反应可用于鉴别和分离伯、仲、叔胺。

环磷酰胺的化学结构
环磷酰胺是一种重要的有机化合物,其化学结构包含磷和氮元素。
具体来说,
环磷酰胺是通过磷酸和胺类化合物之间的缩合反应得到的环状产物。
它的分子结构通常表现为一个含氮的环与一个含磷的环相连,形成一个磷-氮键连接的环状结构。
环磷酰胺的化学结构使其具有许多重要的化学性质和应用。
首先,磷-氮键的
存在赋予环磷酰胺较高的反应活性,使其在有机合成中被广泛应用。
环磷酰胺可以通过开环反应生成氮化合物或磷酸酯,从而参与到各种有机合成反应中。
其次,环磷酰胺还具有较好的溶解性和稳定性,使其成为许多聚合物和胶体材料的重要组成部分。
另外,环磷酰胺还被广泛用作农药、医药和功能材料的中间体。
例如,环磷酰
胺可以被用作杀虫剂的原料,通过改变其侧链结构可以调控其杀虫活性和环境友好性。
在医药领域,环磷酰胺及其衍生物被用作抗肿瘤药物、抗生素和抗病毒药物的合成中间体,具有重要的药理活性。
此外,环磷酰胺还可以作为材料表面改性剂、离子交换树脂的功能单体等领域的重要应用。
总的来说,环磷酰胺的化学结构和性质决定了其在有机合成、聚合物材料、医
药和功能材料领域的重要应用。
随着研究的深入,环磷酰胺的化学结构和功能还有待进一步挖掘和应用,为更多领域的发展提供新的可能性。






第15章含氮含磷化合物一、学习基本要求1、了解硝基化合物的分子结构,掌握硝基化合物的主要化学性质,理解硝基对芳环上亲电取代反应的致钝作用及对环上其他基团性质的影响等。
2、熟悉胺的分子结构和碱性的关系,掌握胺的主要化学反应,理解氨基对芳环上亲电取代反应的致活作用。
3、了解芳香族重氮盐的生成;了解重氮偶联反应。
4、了解偶氮化合物的生成及应用。
5、了解磷原子的成键特点,了解这些特点对其物理和化学性质的影响,熟悉有机磷化合物的基本化学性质及有机磷农药的基本类型。
二、重点和难点1、重点:硝基化合物的应用。
胺的化学性质,有机磷的分类。
2、难点:影响胺的碱性强弱的因素,芳香族重氮盐的化学反应。
三、知识要点(一)基本概念1.硝基化合物:烃分子中的氢原子被硝基取代后所形成的化合物称为硝基化合物。
2.胺:胺可以看作为氨的烃基衍生物,氨分子中的氢原子逐个被烃基取代得到伯胺、仲胺、叔胺。
3.重氮化合物:是指重氮基(-N=N-或N≡N-)一端与芳香烃基,另一端与其它非碳原子或原子团相连,或与一个二价烃基直接相连的化合物。
4.偶氮化合物:是指-N=N-的两端直接与两个烃基相连的化合物。
5.偶联反应:重氮盐在低温下与酚或芳胺作用,生成有色的偶氮化合物的反应,称为偶联反应。
6.有机含磷化合物:有机化合物的化学结构中包含有C―P键(膦),或含有C―O―P、C―S―P、C―N―P键,称为有机含磷化合物,简称有机磷。
(二)基本知识1.结构特征(1).硝基化合物的结构特征杂化理论认为,硝基(N O)中的氮原子为sp2杂化,3个sp2杂化轨道分别与2个氧原子和1个碳原子形成3个σ键,氮原子上没有参加杂化的p轨道上的一对未成键的电子,与2个氧原子的另一轨道形成具有4个离域电子的共轭体系。
由于形成了p -π共轭体系,氮氧键的键长出现了平均化,2个氮氧键是等同的。
硝基是强吸电子基,使硝基化合物的α-碳原子上电子云密度降低,α-氢原子解离趋势增大,使脂肪族硝基化合物的α-H具有一定的酸性。