2015年度药品审评报告
- 格式:docx
- 大小:344.65 KB
- 文档页数:12

2015 年6 月CDE 药品审评报告Insight - China Pharma Data2015 年7 月2015 年6 月CDE 药品审评报告——丁香园Insight 数据库6 月看点∙国内第一个 1.1 类 DPP-4 抑制剂申报上市∙ 3.1 类首家抢仿扎堆丙肝领域∙吉利德 Sofosbuvir / GS-5816 二联复方首次在中国申报∙海正、人福、扬子江等企业收获 1.1 类临床批件∙赛诺菲、辉瑞新型生物制品首次在中国申报_______________________________________________________________________________________根据丁香园Insight - China Pharma Data 数据库最新统计,2015 年6 月CDE 共承办新的药品注册申请有783 个(以受理号计,下同),与5 月份(797 个)几乎持平。
2015 年上半年已经走完,至此我们来回顾下2015 年上半年CDE 承办药品注册申请的数量情况:Insight 系列报告以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:6 月份CDE 共承办新的化药注册申请以受理号计684 个。
其中各个申请类型的具体数据如下所示:1. 新药(1)1.1 类新药国内第一个1.1类DPP-4抑制剂申报上市根据Insight 数据库统计,6 月份CDE 共承办化药1.1 类新药申请以受理号计有13 个,涉及6 个品种,其中,江苏恒瑞的磷酸瑞格列汀申请上市,其余为临床申请。
具体数据如下所示:SPH3127片是上海医药近五年来的第一个 1.1 类新药,并且属于重大专项审评品种。
目前该品种处于 IND 序列药学和药理毒理专业审评中,而排在 SPH3127 前后的非重大专项品种还处在排队审评中。
江苏恒瑞的瑞格列汀片剂于 2015 年 6 月初申报上市,这是国内企业研发的第一个处于上市申请阶段的DPP-4抑制剂,恒瑞继续当仁不让地领跑国内药品研发。

2015 年 7月CDE 药品审评报告Insight - China Pharma Data2015 年 8 月2015 年 7 月 CDE 药品审评报告——丁香园 Insight 数据库7 月热点•CFDA 发布 2 项公告,以解决药品审评问题•7 个 1.1 类新药品种申报临床•3.1 类首家抢仿集中神经系统领域•7 个进口化药首次在中国申报临床•百济神州、江苏恒瑞等收获 1.1 类新药获批临床_______________________________________________________________________________________对于药品研发和注册人员来说,7 月注定是骚动的一个月。
7 月 22 日,国家食品药品监督管理局( CFDA)发布公告,要求 1622 个受理号的申请注册人开展药物临床试验数据自查核查工作,如不能确保临床试验数据的真实性、可靠性和完整性,则需自主撤回注册申请。
7 月31 日,CFDA 再次发布公告,向社会征求解决药品注册申请积压问题的意见,欲提高仿制药审批标注,同时优化和改变生物等效性试验审评程序,并解决积压的同品种、注册申报造假行为等问题。
CFDA 连续出台政策,下定决心整改药品注册审评,但目前效果如何尚不可知。
在临床试验自查核查结果以及征求意见水落石出之前,我们一起来回顾下 7 月的药品审评情况。
根据丁香园 Insight - China Pharma Data 数据库最新统计, 2015 年 7 月 CDE 共承办新的药品注册申请有 845个(以受理号计,下同),与 6 月份(783 个)相比有所增长,增长量主要来源于化药。
以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:7 月份 CDE 共承办新的化药注册申请以受理号计 757 个。
其中各个申请类型的具体数据如下所示:Insight 系列报告1.新药(1)1.1 类新药7 个 1.1 类新药品种申报临床根据 Insight 数据库统计,7 月份 CDE 共承办化药 1.1 类新药申请以受理号计有 23 个,涉及 7 个品种,均为临床申请。

药品采购质量评审档案二〇一五年十二月档案目录一、药品采购质量评审计划二、首次会议记录及会议签到单三、药品采购质量评审方案四、药品采购质量评审实施情况表五、与我单位合作的供货单位六、供货单位药品采购情况评审七、品种采购情况评审八、整改通知书九、问题改进和措施跟踪记录十、风险评估及风险防范十一、末次会议记录及会议签到单十二、药品采购质量评审报告药品采购质量评审方案一、审核目的坚持“质量第一”的原则,诚实守信,依法经营。
禁止任何虚假、欺骗行为,保障公司经营行为的合法性。
坚持“按需采购、择优采购”原则,有效控制药品采购质量,把好药品采购质量关,定期进行质量评审,对供货单位进行筛选,选择产品质量佳、信誉好的供货单位。
通过对供货单位提供的药品质量的评定,采购文件的管理控制及售后质量跟踪验证,掌握药品采购质量情况,优化采购渠道,保证所药品采购的合法性和质量安全性,确保本公司药品采购全过程的控制管理,进行全面评审,满足GSP要求,以达到药品安全有效的目的。
二、审核依据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药品经营质量管理规范》及附录、本公司的相关制度程序和国家的相关法律法规、行政规章,国家食品药品监督管理总局发布的《质量公告》。
三、审核标准药品采购质量评审实施情况表四、审核范围与本公司有业务来往的供货单位和本公司所有采购品种收货、验收、养护等相关环节五、审核要点及方式按质量评审实施情况表的内容要求进行,采用资料检查、现场检察、询问相结合等方法进行检查考核。
六、审核人员组长:成员:七、评审时间二0一五年十二月八、评审小组完成评审小结,提交评审报告。
药品采购质量评审计划编制人:日期:年月日会议签到单会议名称: 药品采购质量评审首次会议会议日期: 201年12月28日药品采购质量评审报告一、评审目的坚持“质量第一”的原则,诚实守信,依法经营。
禁止任何虚假、欺骗行为,保障公司经营行为的合法性。

2015年第四季度临床合理用药监测结果及整改建议为提高处方质量,促进合理用药,保障医疗安全,根据等级医院验收标准、《医院处方点评管理规范(试行)》和《医疗机构药事管理规定》的要求,我院对2015年第四季度门急诊处方和归档病历医嘱进行处方点评和不合理用药分析,现将工作开展情况、取得成绩及存在问题总结如下:一、门急诊处方点评情况从2015年10-12月份各门诊处方中,随机抽取100张进行分析评价,以了解处方的合格情况,处方合理用药、抗生素使用等情况。
本季度共抽查门、急诊处方300张,不合格处方共6张,其中不规范处方6张。
本次抽查处方合格率:98%,门急诊抗菌药物处方使用比例是22.49%。
不规范处方主要存在问题和分析:1、处方诊断书写不规范;2、抗菌药物使用不符合规定;3、处方超7日用量为注明理由。
检查中发现,个别医生对需做皮试的药物未标明皮试结果。
门、急诊处方在正常情况下,处方不超过7日量和3日量,超过须注明理由,本季检查中医生超日程使用药物不注明理由的情况始终依然存在。
处方点评中处方书写不规范不完整的情况依然存在,希望医院加强对医院不合格处方的监管,信息科完善信息系统,提高我院的处方质量。
二、出院病历点评情况根据《处方点评管理规范(试行)》规定的每月点评出院病历绝对数不应少于30份,结合我院实际情况,2015年10-12月,我科从适应症、用药疗程、药物选择、单次剂量、给药频次等方面共点评出院病历90份,存在不合理用药为26份,占26.67%。
其中不合理用药病历主要存在问题及原因分析如下主要存在问题为1、时间依赖性抗生素使用不合理,每日给药次数不足;2、某些药物的用量超说明书用量或不足;3、给药途径不适宜;4、开具的药物与诊断不符;主要原因为1、医生在输入时缺乏责任心,对系统中的错误用量未进行及时修改;2、对药品的用法用量不熟悉;3、根据自己的经验,用药情况与说明书不符。
三、全院抗菌药物使用及基药使用情况2015年第四季度门急诊处方18009张,其中抗菌药物处方数3152张,抗菌药物使用率17.50%。



2015年四季度抗菌药物临床应用监测评估报告根据卫生部《抗菌药物临床应用指导原则》、《卫生部办公厅关于抗菌药物临床应用管理有关问题的通知》(卫办医政发[2009] 38号)、师卫发[2011]37号文《关于做好兵团抗菌药物临床应用专项整治活动的通知》等文件精神及《***医院抗菌药物管理规定》的要求,药剂科对2015年四季度出院患者及门诊处方抗菌药物应用情况进行了调查评价,结论:抗菌药物使用强度指标不符合规定,与去年同期相比明显改善。
现将具体情况汇总如下:2015年四季度抗菌药物临床应用情况相关目标值汇总表抽样时间段 2015年10月01日 00:00:00至2015年12月31日 23:59:59编制床位数 558张 开放床位数 558张 当月出院人次 7619 平均住院天数 8.51住院患者抗菌药物使用比例(%) 42.27非限制使用级抗菌药物使用比例(%) 22.54限制使用级抗菌药物使用比例(%) 23.13特殊使用级抗菌药物使用比例(%) 0.61住院患者抗菌药物使用强度(DDD/百人天) 38.69住院患者非限制使用级抗菌药物使用强度(DDD/百人天) 14.01住院患者限制使用级抗菌药物使用强度(DDD/百人天)24.00住院患者特殊使用级抗菌药物使用强度(DDD/百人天) 0.68抗菌药物品种数(个) (按通用名计算)35抗菌药物品规数(个) (按实际采购和使用规格计算) 33抗菌药物使用金额 2000671抗菌药物占总药物使用金额的比例(%) 7.29%抗菌药物占西药使用金额的比例(%) 9.66%非限制使用级抗菌药物占抗菌药物使用金额的比例(%) 43.63%限制使用级抗菌药物占抗菌药物使用金额的比例(%) 49.43%特殊使用级抗菌药物占抗菌药物使用金额的比例(%) 6.95%门诊抗菌药物处方比例(%) 5.81%急诊抗菌药物处方比例(%) 18.84%儿科抗菌药物处方比率(%) 37.18%住院患者抗菌药物使用率(%) 42.27%住院患者特殊使用级抗菌药物使用率(%) 0.61%清洁(I类)切口手术抗菌药物预防使用率(%) 5.14清洁(I类)切口手术平均预防用药天数(天) 0.09介入诊疗手术抗菌药物预防使用率(%) 0.00介入诊疗手术平均预防用药天数(天) 0.00接受抗菌药物治疗的住院患者抗菌药物使用前微生物检验样本送检率(%) 72.92%接受限制使用级抗菌药物治疗的住院患者抗菌药物使用前微生物检验样本送检率(%) 73.94%接受特殊使用级抗菌药物治疗的住院患者抗菌药物使用前微生物检验样本送检率(%) 96.23%1、 抗菌药物品种、剂型、规格四季度采购抗菌药物目录的品种数为35种,实际使用33种,不同规格及剂型共48种,将莫西沙星纳入采购目录,本季度临时采购利奈唑胺注射液1人次,符合卫生部的规定(35)种。

行业研究/2016年06月05日总局发布《2015年度药品检查报告》监管加强利好品牌药企[Table_Summary]投资要点:事件:●2016年6月3日,总局发布《2015年度药品检查报告》,对全年药品检查情况及检查发现主要问题进行了阐述。
点评:●总局药品检查力度超预期,制药产业监管趋严,升级整合迹象显现。
2015年,国家食品药品监督管理总局食品药品审核查验中心秉持客观、公正、廉洁、高效的原则,依法依规、科学严格开展药品检查。
共检查企业/品种数698家,派出检查组数682次,派出人次达到2082次。
对检查发现的违法违规行为进行严厉查处,药品GMP认证整改率、飞行检查不通过率均明显提高,显示总局监管趋严。
我们认为,药品生产质量监管力度仍将继续加强,“小散乱差”的药企将逐渐退出,产业升级整合迹象显现。
(图1)●药品GMP认证检查数量同比降低,但监管力度明显加强,整改率提高近一倍。
2015年总局共接收药品GMP认证申报资料221份,涉及201家药企,认证检查任务较2013、2014年数量明显降低,但整改复核17家,占7.7%,同比提高近一倍,总局监管力度明显加强。
(图2)2015年对114个品种进行药品注册生产现场检查,较2014年小幅降低,包括化学原料药31个、化学制剂56个、中药8个、生物制品15个、血液制品4个。
最终完成审核件108个,其中通过103个,不通过5个。
2015年药品GMP跟踪检查计划271家次,全年实际检查181家次,以注射剂和预防类生物制品为主。
●飞行检查力度空前,通过率仅32%,中药饮片成重灾区。
全年共派出49个检查组对59个企业进行了飞检,其中中药饮片14组19家企业,银杏叶提取物及制剂5组8家企业。
(图3)现场检查通过的19家,不通过39家,1家待处理,通过率仅32%。
共有22家被收回药品GMP证书,6家被吊销GMP证书,3家立案查处。
(图4)●中药材生产规范化、规模化和现代化仍需提升。

我院2015年基本药物使用情况及处方点评分析王海容【摘要】目的:通过处方点评,促进我院基本药物的合理使用.方法:随机抽取我院2015年1月-2015年12月的门诊处方,参照《国家基本药物目录》(2012年)、《处方管理办法》、《抗菌药物临床应用指导原则》、药品说明书及我院的处方评价制度等,对我院抽查处方进行筛查和分析.结果:2000张处方合理用药处方1870张、占93.50%,不合理用药处方130张、占6.50%;处方平均用药2.55种,国家基本药物使用率35.02%,主要不合理用药类型为适应证不适宜(11.53%)、无确切理由不首选国家基本药物(16.15%)等.结论:我院基本药物处方使用符合相关规定,但临床仍应总结经验,进一步提高基本药物处方水平.【期刊名称】《黑龙江医药》【年(卷),期】2017(030)005【总页数】3页(P995-997)【关键词】基本药物;处方点评;合理用药【作者】王海容【作者单位】盐城市第二人民医院盐城224002【正文语种】中文【中图分类】R969.3“基本药物”是世界卫生组织在20世纪70年代提出的概念,是最重要、基本、不可缺少、满足人民所必需的药品,并将基本药物公平可及作为人的基本健康权.1982年我国公布了第一批国家基本药物目录,到2012年进行了多次调整。
2009年,深化医药卫生体制改革启动后,根据我国实际情况并结合WHO基本药物理念,将基本药物定义为剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。
为了规范处方管理,提高我院处方质量,盐城市第二人民医院根据《处方管理办法》,2007年开始进行处方点评工作。
基本药物的使用情况可作为反映医疗机构合理用药情况的一项指标,2010年我院将基本药物使用情况纳入处方点评考核。
为评价我院基本药物使用情况和处方点评情况,笔者对我院2015年部分处方的点评结果进行回归性分析,旨在促进临床合理用药,深化公立医院改革,保障患者用药安全。

2015 年1 月CDE 药品审评报告INSIGHT - China Pharma Data2015 年2 月2015 年1 月CDE 药品审评报告——丁香园Insight 数据库导读∙化药1.1 类新药再添SGLT2 抑制剂∙正大天晴子公司申报克唑替尼∙深圳微芯重大专项抗癌新药西达本胺获得生产批件∙恒瑞申报生物制品1类新药注射用SHR-1210_____________________________________________________________________________________________根据丁香园Insight 数据库最新统计,2015年1月国家食品药品监督管理总局药品审评中心(CDE)共承办新的药品注册申请以受理号计有661个,与去年同期(887个)相比有所减少。
以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:1 月份CDE 共承办新的化药注册申请以受理号计有567 个,涉及256 个品种。
其中各个申请类型的详细数据如下所示:INSIGHT 系列报告1. 新药新药的申请量近乎是仿制药的两倍,有反常态在以往月份中,新药与仿制药的申请量总是大体持平,而 1 月份CDE 新承办的化药新药申请以受理号计有235 个,近乎是仿制药申请量(122 个)的两倍,有反常态。
近年来国家鼓励药物创新,引导制药企业提高创新能力、创仿结合,避免仿制药低水平过度重复,国内制药企业的研发观念也在逐步转变。
(1)1.1 类新药1 月份共有7 个化药1.1 类新药品种申报,又添SGLT2 抑制剂根据丁香园Insight 数据库显示,1 月份CDE 共承办化药 1.1 类新药申请以受理号计有22 个,涉及7 个品种。
其中北京康辰药业的抗肿瘤药物诺拉曲塞为上市申请,其余品种均为首次申报的临床申请。
具体数据,如下所示:其中,上海艾力斯医药科技有限公司申报的艾格列净是国内继江苏恒瑞的恒格列净、山东轩竹的加格列净之后的第三个SGLT2(钠-葡萄糖协同转运蛋白2)抑制剂,用于治疗 2 型糖尿病。
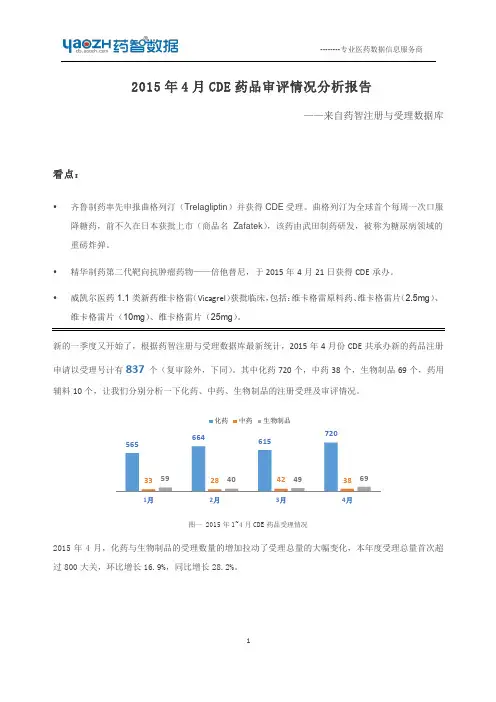
2015 年4 月CDE 药品审评报告Insight - China Pharma Data2015 年5 月2015 年4 月CDE 药品审评报告——丁香园Insight 数据库要点∙ 4 月份药品申报量创今年以来最高点∙正大天晴近4 年来首次申报化药1.1 类新药∙齐鲁制药抢仿迅速∙每周口服一次降糖药曲格列汀遭国内药企抢仿∙GSK 提交多替拉韦进口上市申请∙江苏恒瑞镇痛新药M6G 获批临床_____________________________________________________________________________________________根据丁香园Insight - China Pharma Data 数据库最新统计,2015 年4 月CDE 共承办新的药品注册申请以受理号计有846 个,与 3 月份(719 个)相比增幅约达18%。
其中增量主要集中在化药,这也是今年以来月受理量的最高点。
以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:4 月份CDE 共承办新的化药注册申请以受理号计728 个,涉及327 个品种。
其中各个申请类型的具体数据如下所示:Insight 系列报告1. 新药(1)1.1 类新药8 个化药1.1 类新药申报临床根据Insight 数据库统计,4 月份CDE 共承办化药1.1 类新药申请以受理号计有23 个,涉及8 个品种,且均为新药临床申请。
具体数据如下所示:正大天晴申报的TQ-B3234 具体适应症暂时不详。
这是正大天晴继2011 年申报舒布替尼之后,近4 年来申报的唯一一个化药1.1 类新药。
正大天晴是国内仿制药领域领先的医药企业,但其在创新药物研发领域仍有待加强,其目前还没有获批上市的 1.1 类新药。
丹诺医药申报的TNP-2092 为消化道感染用药。
除了TNP-2092 之外,其研发管道上还有尚未申报的具有不同灭菌机理的双靶标分子新药候选物TNP-2198 和TNP-2500。
2015 年门急诊抗菌药年度处方点评问题及分析汇总2015 年 1 月至 12 月,药剂科处方点评小组自医院内网每月在门急诊抗菌药处方中随机抽取抗菌药处方100 份,共计 1200 份。
依据:《处方管理办法》、《新编药物学》、《中华人民共和国药典临床用药须知》、药品说明书、《医院处方点评管理规范》、《抗菌药物临床应用的基本原则2015 版》及抗菌药相关法律法规等较权威的参考文献,按照相关规定对其医嘱用药进行点评。
点评结果汇总见下列表和图:表 1 2015 年 1 月 -12 月处方点评结果汇总表时间抽取处方数不合理数所占比例( % )2015.01 100 10 10 2015.02 100 35 35 2015.03 100 38 38 2015.04 100 40 40 2015.05 100 42 42 2015.06 100 30 30 2015.07 100 11 2015.08 100 11 2015.09 100 15 15 2015.10 100 77 2015.11 100 22 2015.12 100 22直观图如图 1 所示:图 1 2015 年 1 月 -12 月抗菌药门急诊处方点评结果汇总图100908070数60 抽取处方数50方不合理数处 403020101 2 3 4 5 6 7 8 9 10 11 12 月份表 2 不合理处方统计汇总表点评结果处方数占不合理处方比例 (%) 占已评价处方比例(%)合理处方977 081.42 不合理处方223 100 18.58 不规范处方20.16 用药不适宜处方221 18.42 超常处方000总计 (已点评数 ) 1200直观图如图 2 所示:图 2 不合理处方统计汇总表不规范处方 , 2,1%不规范处方用药不适宜处方用药不适宜处方,221, 99%表 3 点评问题统计汇总表问题代码该问题处方数(1)1-10 4(1)1-14 1(2)1-1 3(2)1-2 1(2)1-3 2(2)1-5 211(2)1-6 2(2)1-7 1(2)1-8 2(2)1-9 1直观图如图 3 如示:图 3 点评问题统计汇总图各问题处方分类汇总250211201510504 1 3 1 2 2(1)1-10 (1)1-14(2)1-1(2)1-2(2)1-3(2)1-5(2)1-6占不合理处方数( 共 223 例 )比例 (%)1.790.451.350.450.9094.620.900.450.900.451 2 1(2)1-7 (2)1-8 (2)1-9具体问题汇总与分析2015 年点评门急诊抗菌药处方共计1200 份,不合理用药处方共计223 份,其中不规范用药 2 份,不适宜用药221 份,涉及到的问题代码共计10 种,现将具体问题归纳如下:一、问题代码:(1)1-10 开具处方未写临床诊断或临床诊断书写不全的:诊断为换药,使用头孢丙烯分散片。
2015 年度药品审评报告国家食品药品监督管理总局药品审评中心2015 年,在国家食品药品监督管理总局的领导下,药品审评中心(以下简称药审中心)紧紧围绕“改革审评制度,解决审评积压,提高审评质量,完善审评体系”,不断推进各项工作,切实维护和促进公众健康。
根据国家食品药品监督管理总局有关工作要求,现将《2015 年度药品审评报告》予以发布。
一、2015 年主要工作措施及进展2015 年,药审中心深化制度改革,加强审评管理,消除审评积压,提升审评效率,确保审评质量,各项工作举措取得积极进展,为更好保障公众用药安全有效,促进公众健康奠定了基础。
(一)推进审评制度改革按照国务院、总局党组关于药品审评制度改革的要求和工作部署,2015 年,药审中心在改革审评管理制度、改进用人机制、强化审评质量管理等方面推出了多项改革举措,以全力推进审评制度改革。
改革审评管理制度。
在对创新药实行一次性批准临床试验、加强后续沟通交流与监管,以及有条件批准临床试验方面取得实质性进展;组织研究肿瘤适应症创新药临床试验备案管理的可行性;完善“立卷审查”快速审评方法,加快淘汰存在重大缺陷的注册申请,并为承接药品注册申请受理工作奠定了基础;强化以临床价值为导向的审评管理,完善适应症团队审评制度,探索建立项目管理人制度;逐步完善有关药品注册申请的优先审评制度,起草了《临床急需儿童用药申请优先审评审批品种评定的基本原则》,并上网征求意见。
改进用人机制。
制定首席审评员招聘方案,探索建立首席专业岗位制度,构建科学化、与国际接轨的审评体系;制定《审评员薪酬管理暂行办法》,探索研究多劳多得、优劳优得的动态评估绩效分配体系,以调动工作人员的创造性和积极性;平稳完成三至七级专业技术岗位设置工作,保证了审评人才梯队建设;起草完成《药审中心解决审评积压尽职免责与违规追责暂行规定》,为稳定与激励审评队伍,不断提高审评质量和效率进行探索;探索引入外部咨询机构和专业人员参与中心的管理制度建设等。
强化审评质量管理。
通过制定各专业领域技术指导原则和翻译转化国外指导原则,进一步推进符合我国药物研发实际的技术指导原则体系建设;以政府购买服务方式,与专业的质量管理咨询公司合作,制定《药审中心审评质量管理体系建设方案》,全面启动了药审中心三年审评质量管理体系建设工作;加大与法律专业机构合作,探索研究法律专业支持技术审评工作的方式,推进依法审评;起草了《药品注册技术审评复审工作管理办法》,并上网征求意见,以推进药品技术审评复审改革。
(二)解决审评任务积压审评任务大量积压已成为实现科学监管和行业良性发展的巨大障碍。
为消除这一障碍,2015 年,药审中心坚持改革制度和消除积压并行,多措并举,全力解决审评任务积压。
开展“专项”审评工作。
贯彻落实改革要求,集中审评力量,严格审评标准,调整审评理念,优化审评流程,针对各类注册申请,采取不同的措施;提前全面梳理技术标准,做好审评工具的储备和质量控制的保障,对化药仿制药生物等效性试验申请和3 类新药验证性临床试验申请集中开展“专项”审评工作;在审评过程中,加强督导和质量控制,做到审评标准不降低,审评质量有保障。
整合审评人力资源。
多渠道扩增审评力量,招聘聘用制审评员51 人,组织形成省(市)局挂职团队6个共95人;继续完善培训机制,强化专业培训,加快新到岗审评人员形成战斗力;药审中心老审评员们充分发挥在解决积压工作中的主力军作用,在完成自身审评任务的同时,带教新审评员和省局团队,加快了中心各类审评人员融合,使新审评员和省局团队成为审评工作的生力军。
发扬药审人精神。
广泛进行思想动员、组织发动,通过中心文化建设和党风建设,积极营造投身改革、牺牲奉献的工作氛围,发扬药审人精神,对完成消除审评积压任务起到了组织保障作用。
经过各方努力,药审中心2015年全年完成审评任务9601件,比去年全年完成量增加了近90%。
审评任务积压由2015年高峰时的22000多个降至2015 年底的不到17000 个,实现了年初确定的工作目标,解决审评积压的各项举措初显成效。
(三)促进行业良性发展2015 年,药审中心立足自身职能,遵循药品注册管理客观规律,积极采取措施推进科学审评,促进行业良性发展,努力做到更好地服务公众。
鼓励创新药研发。
遵循创新药研发规律,对申请临床的创新药审评进行了合理优化,推进创新药尽快进入临床试验,以切实鼓励创新;针对创新药上市申请,重新修订了《化药原料药生产工艺信息表》、《化药制剂生产工艺信息表》及《生产工艺信息表确认书》三个文件的提交模版,提高了申报文件的质量,缩短了新药的审评时间;完善国家“重大新药创制”科技专项立项品种的优先审评机制,以鼓励新药创制。
完善仿制药审评。
配合国家总局构建仿制药BE 备案机制,完成仿制药BE 备案平台构建,并投入使用;制定仿制药审评报告模板和批件模板,突出研发者主体责任,改进审评组织模式,优化审评流程;梳理重复申报严重的仿制药清单,提供总局发布,引导立题依据不科学、剂型或规格不合理、安全有效性存在问题的品种不再申报;积极探索对高质量仿制药和临床急需仿制药实行优先审评。
加强沟通交流。
完善日常咨询制度,进一步通过中心公开审评信息;完善“申请人之窗”沟通交流的申请,以提高沟通交流的效率,全年共组织实施了40 次针对研发和审评过程中重大技术问题的沟通交流;代拟起草了《药品技术审评沟通交流管理办法》,并上网征求意见;召开了肿瘤适应症创新药临床试验备案制度座谈会、中药审评改革专家座谈会、疫苗审评专家座谈会等会议,增进各方协作,共商鼓励创新机制。
推进中药审评改革。
在深入分析当前中药审评面临问题的基础上,结合中药审评工作专家座谈会意见,通过定期制定审评计划、调整主审报告部门、强化适应症团队管理、改进审评报告模板和审评理念、加强专家咨询会管理、加快指导原则制定发布等措施,全面开展中药审评改革,提高中药审评效率和质量,助力中医药创新,促进产业发展。
二、2015 年受理与审评情况2015 年,药审中心全年接收新注册申请8211 个(以受理号计,下同)。
与既往年度接收注册申请的比较情况见图1。
2015年接收注册申请数量较2014年有所回落,但仍处于高位。
其中化药和中药接收量有所下降,生物制品接收量有所增加。
近年来,化药注册申请的接收量约占各年度接收总量的85%。
2015年,药审中心全年完成审评的注册申请共9601个,超过年度接收量1390 个,实现了完成量大于接收量。
其中建议批准临床4676个,建议批准上市391个,建议批准补充申请1183个,建议批准进口再注册143个,建议各类不批准2208个,另有企业撤回等情况的注册申请1000个。
2015年完成审评建议批准上市和批准临床的情况见表1 (不包括补充申请和进口再注册):表1 2015年完成审评建议批准上市和批准临床的各类注册申请情况(一)2015年化药受理和审评情况1. 注册申请的接收情况2015年,化药各序列注册申请接收情况如下:图2龙0庙年接收化药注册申请分类情况」2015年,新接收化药注册申请共7270个。
其中验证性临床、ANDA、补充申请三类注册申请占化药全年接收量的88.6%。
与前三年比较,验证性临床接收量逐年大幅增加,ANDA和补充申请下降较为明显,具体见图3。
3 2015年化药吝类注册申请接收情况2前三年比较屮2. IND各治疗领域接收注册申请情况■如12年W2O13年^2014年琲•郴和倂収IM林杆代•恳題錚鞘・ E^we^w■冷u爭创曲•便龍建五直科话付■両爭亏理魅凉凋•生略*£據祢竹3玉咤監■瞬卅IF“*闵皆H£1萄忑砖料时,图4 201吕年接收到化药珂D由请的治疗领域构成.国产IND申报数量较多的治疗领域有:抗肿瘤药物、消化系统疾病药物、分泌系统药物、风湿性疾病及免疫药物。
国际多中心(含进口IND)申报数量较多的治疗领域主要集中在抗肿瘤药物。
对比国产和进口IND,相同的申报热点是抗肿瘤领域,不同的是国IND申报较多的风湿性疾病及免疫药物、消化系统疾病药物、神经系统药物、抗感染药物等领域,几乎没有进口IND申报。
3. 仿制药重复申报的情况截至2015年底,待审的化药ANDA申请共7411个,占待审任务总量的42.9%, 涉及活性成分1027个。
重复申报较严重的有94个活性成分(待审任务量均在20个受理号以上),涉及注册申请3780个,占化药ANDA总任务量的51%。
其中相同活性成分待审任务超过100个的有埃索美拉唑钠、恩替卡韦、法舒地尔,其中埃索美拉唑钠和恩替卡韦两个活性成分2015年的新申请量仍位列前茅。
表2化药ANDA重复申报情况盍复情祝嗽分涉壽更请重复情况括1F100个申请以上341420-29个E日请481153申请17122110-19TE日请991319 3Q-4对卜审请2E9921Q个申灯3442312截至2015年底,待审的化药验证性临床申请共3590个,占待审任务总量的20.8%,涉及活性成分660个。
重复申报较严重的有40个活性成分(待审任务量均在20国产IND个受理号以上),涉及注册申请1393个,占化药验证性临床总任务量的38.8%。
其中相同活性成分待审任务超过50个的有沃替西汀、阿普斯特、阿考替胺、曲格列汀、阿伐那非、阿法替尼、阿齐沙坦、卡格列净。
表3化药验证性临床重复申报情况4.审评完成情况2015年中心完成化药审评8514个(以受理号计),具体情况见下表。
表4 2015有明确审评结论的注册申请中,批准结论5740个,不批准结论1977个,总体不批准率为25.6%。
图呂2015年化药各类注册申请完成审评逮局数量与前三年比较心图5显示,2105年验证性临床和ANDA(申请临床试验)两个任务序列完成量大幅增加,IND、NDA和进口再注册两个任务序列的完成量平稳增加,补充申请通道完成量下降明显。
(二)2015年中药受理和审评情况1. 注册申请的接收情况2015年,中药各序列注册申请接收情况如下:图6 201吕年接收巾药注刑由谙分类情况门2015年,新接收中药注册申请共374个,各类注册申请接收情况与前三年比较见下图:11如1空年H2DL3年M2014年P2D1E年图孑年中药各类注册申请英收情况与前三年比较d2•审评完成情况2015年中心完成中药审评544个,具体情况见下表。
表5 2015年中药审评完成情况其中批准的仿制及改剂型均为遗留品种。
各类注册申请完成审评情况与前三年比较见下图:“2014 年H2O15 年图8 201弓年中药各类注册申请完成审评送局数量与前三年比较(三)2015年生物制品受理和审评情况1.注册申请的接收情况2015年,生物制品各序列注册申请接收情况如下:图g 2D15年接收生物制品注册申请分类情祝•新接收生物制品注册申请共566个,各类注册申请接收情况与前三年比较见下图:锌.2迫舞-如U年■2015年图L0 20均年生物制品各类注册申请接收情况与前三年比较+WWiWTrt 膏FTrr» -2•审评完成情况2015年中心完成生物制品审评543个,具体情况见下表。