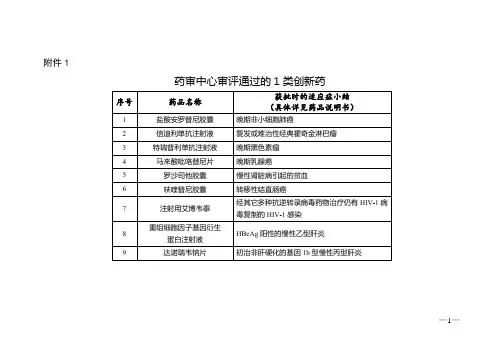
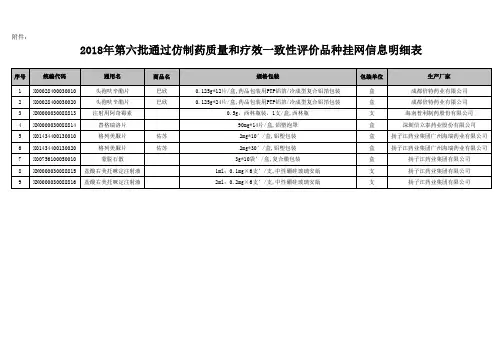
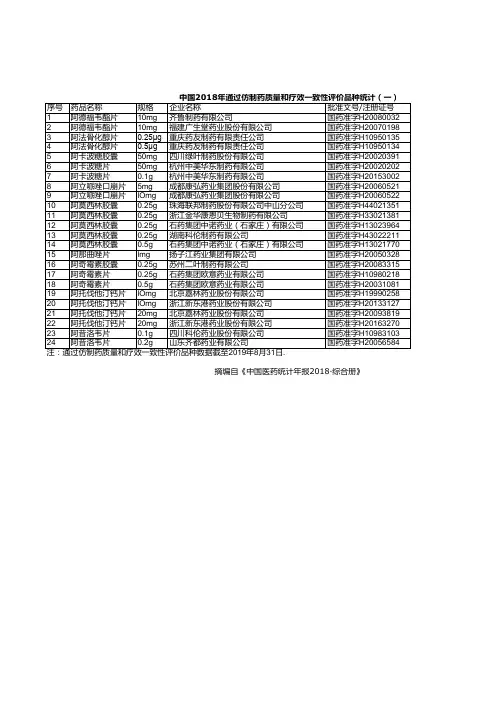
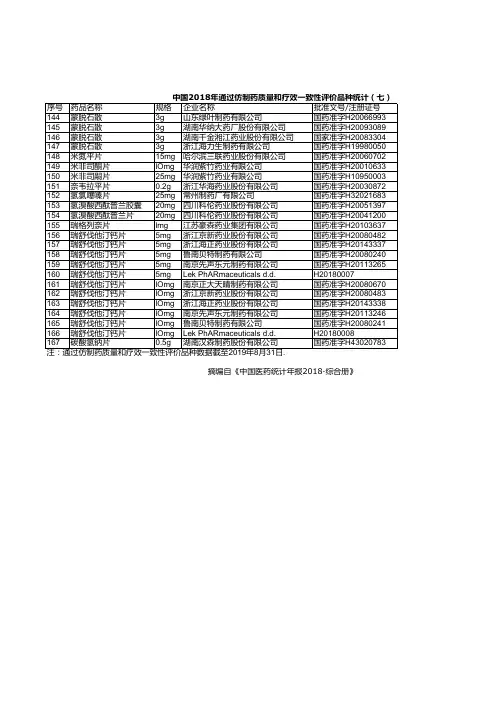
《2018年度药品审评报告》附件3:2018年审评通过的优先审评药品名单
- 格式:docx
- 大小:31.26 KB
- 文档页数:4

2018年,中国批准了这些重磅新药,抗癌药稳站C位!2018年已接近尾声,一大波进口和国产新药借助优先审评快速获批上市,给我们带来一个又一个惊喜,也为广大国内患者带来新的选择与希望。
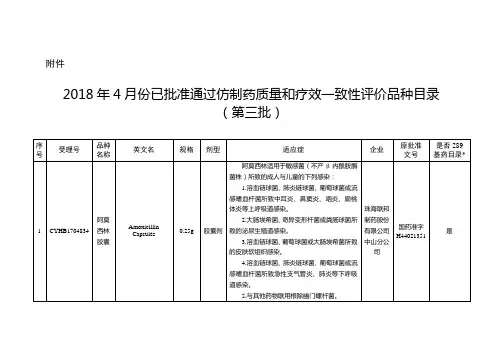
2018年国内到底有哪些重磅新药获批上市?汉鼎好医友为您梳理如下:5月盐酸安罗替尼胶囊:自主研发的1.1类抗癌新药商品名:福可维生产商:正大天晴适应症:非小细胞肺癌盐酸安罗替尼是在同类药物索拉非尼的基础上改构而成,通过抑制肿瘤新生血管生成和生长增殖信号通路发挥抗肿瘤作用。
这是一款100%原研新药,临床实验中明显提高了晚期非小细胞肺癌患者的总生存期。
据悉,该药是正大天晴药业迄今为止投入最大的一个产品,标志着“首仿之王”正大天晴迈出仿制药舒适圈的重要一步,同时也是该公司第一个按照国际研发流程和标准进行研发的创新小分子药。
安罗替尼的面世,将有效填补晚期非小细胞型肺癌三线治疗的空白。
6月纳武利尤单抗注射液:国内上市的首个以PD-1为靶点的单抗药物商品名:Opdivo生产商:百时美施贵宝适应性:二线治疗非小细胞肺癌Opdivo是全球首个上市的PD-1/PD-L1抑制剂,和传统的化疗和靶向治疗不同,主要是通过克服患者体内的免疫抑制,重新激活患者自身的免疫细胞来杀伤肿瘤,是一种全新的抗肿瘤治疗理念.该药于2014年首次获FDA批准用于治疗黑色素瘤,迄今已有包括黑色素瘤、非小细胞肺癌、结直肠癌、肝细胞癌在内的8个适应症获批。
江湖人称“O药”,被不少癌症患者誉为“抗癌神药”。
Opdivo在我国已被批准用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
7月艾博韦泰长效注射剂:我国首个自主研发抗艾新药商品名:艾可宁生产商:前沿生物适应症:抗HIV-1 病毒艾博卫泰,前沿生物药业自主研发的1类新药,同时也是全球第一个长效抗艾滋病药物。

2017年度药品审评报告2017年,国家食品药品监督管理总局(以下简称总局)认真贯彻中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)文件精神,以保证药品有效安全、满足公众临床用药需求为工作目标,在鼓励药物研发创新、提高药品质量方面开展了一系列工作,不断推进审评审批制度改革,坚持依法依规、科学规范审评,切实保护和促进公众健康。
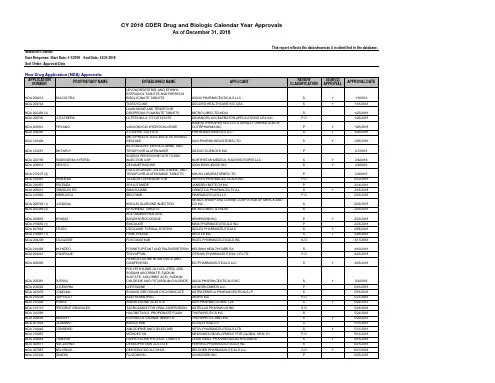
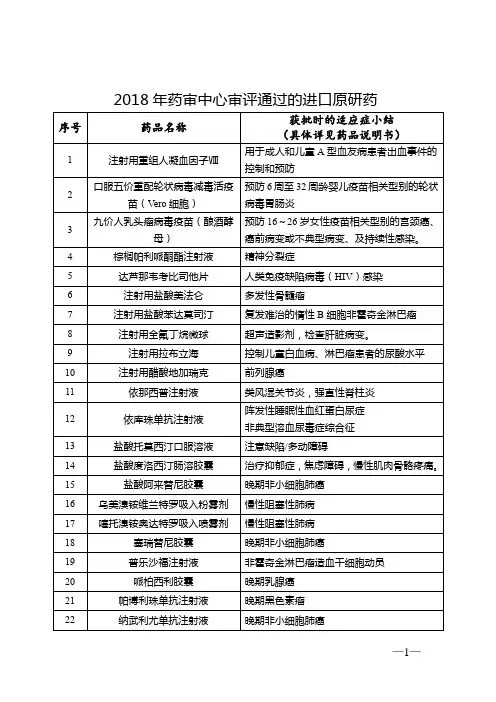
一、药品注册申请审评审批完成情况(一)审评审批总体完成情况1.批准上市药品情况2017年,总局批准上市药品394个(以药品批准文号计),其中化学药品369个,中药民族药(以下简称中药)2个,生物制品23个;国产药品278个,进口药品116个;国产药品中化学新药28个,中药新药1个,生物制品10个,化学仿制药238个,中药仿制药1个;纳入优先审评审批品种53个,占13.5%。
2。
全年审评审批完成情况根据总局《关于调整部分药品行政审批事项审批程序的决定》(局令第31号),在原有技术审评职能的基础上,国家食品药品监督管理总局药品审评中心(以下简称药审中心)承接药物临床试验、药品补充申请和进口再注册3项行政审批决定职能。
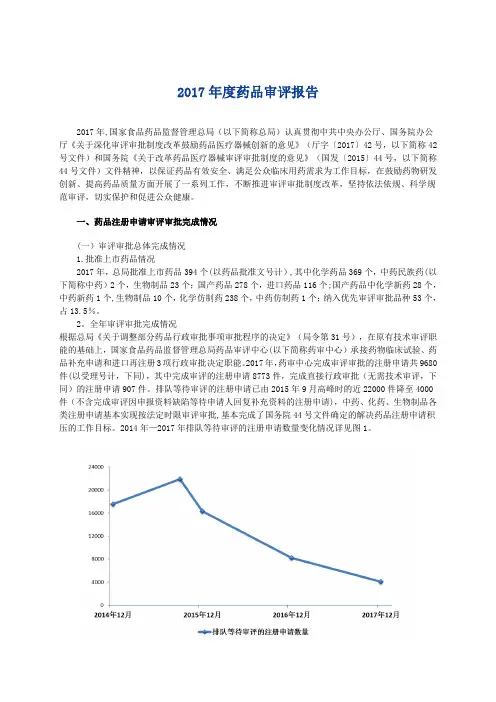
2017年,药审中心完成审评审批的注册申请共9680件(以受理号计,下同),其中完成审评的注册申请8773件,完成直接行政审批(无需技术审评,下同)的注册申请907件。
排队等待审评的注册申请已由2015年9月高峰时的近22000件降至4000件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),中药、化药、生物制品各类注册申请基本实现按法定时限审评审批,基本完成了国务院44号文件确定的解决药品注册申请积压的工作目标。
2014年—2017年排队等待审评的注册申请数量变化情况详见图1。
图1 2014年—2017年排队等待审评的注册申请数量变化情况完成审评的申请中,化药注册申请为7729件,约占全部审评完成量的88%.各类药品注册申请审评完成情况详见图2。
2017年度药品审评报告2018年03月22日发布2017年,国家食品药品监督管理总局(以下简称总局)认真贯彻中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)文件精神,以保证药品有效安全、满足公众临床用药需求为工作目标,在鼓励药物研发创新、提高药品质量方面开展了一系列工作,不断推进审评审批制度改革,坚持依法依规、科学规范审评,切实保护和促进公众健康。
一、药品注册申请审评审批完成情况(一)审评审批总体完成情况1.批准上市药品情况2017年,总局批准上市药品394个(以药品批准文号计),其中化学药品369个,中药民族药(以下简称中药)2个,生物制品23个;国产药品278个,进口药品116个;国产药品中化学新药28个,中药新药1个,生物制品10个,化学仿制药238个,中药仿制药1个;纳入优先审评审批品种53个,占13.5%。
2.全年审评审批完成情况根据总局《关于调整部分药品行政审批事项审批程序的决定》(局令第31号),在原有技术审评职能的基础上,国家食品药品监督管理总局药品审评中心(以下简称药审中心)承接药物临床试验、药品补充申请和进口再注册3项行政审批决定职能。
2017年,药审中心完成审评审批的注册申请共9680件(以受理号计,下同),其中完成审评的注册申请8773件,完成直接行政审批(无需技术审评,下同)的注册申请907件。
排队等待审评的注册申请已由2015年9月高峰时的近22000件降至4000件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),中药、化药、生物制品各类注册申请基本实现按法定时限审评审批,基本完成了国务院44号文件确定的解决药品注册申请积压的工作目标。
2014年-2017年排队等待审评的注册申请数量变化情况详见图1。