细胞培养及材料细胞毒性检测
- 格式:ppt
- 大小:5.89 MB
- 文档页数:48

细胞毒性检测方法总结!细胞毒性(cytotoxic)是由细胞或者化学物质引起的单纯的细胞杀伤事件,不依赖于凋亡或坏死的细胞死亡机理。
有时需要进行特定物质细胞毒性的检测,比如药物筛选。
细胞毒性检测主要是根据细胞膜通透性发生改变来进行的检测,常用以下几种方法:MTT、XTT法:利用线粒体内部酶的活性,可以将特定的四唑盐类进行转化,然后通过酶标仪进行检测一.LDH的方法:通过检测细胞培养上清中LDH的酶活性,来检测细胞毒性其它酶方法:如检测上清中碱性磷酸酶、酸性磷酸酶的活性等细胞增殖能力分析试剂原理:正常细胞代谢旺盛,其线粒体内的琥珀酸脱氢酶,可将四唑盐类物质(如MTT、XTT、WST-1等)还原为紫色的结晶状的物质,沉积在细胞周围,然后通过酶标仪读取OD值,从而检测到细胞增值状态优点:1)快速:96孔培养板形式,可进行高通量检测。
2)灵活:可直接通过显微镜观察,也可通过酶标仪进行定量检测。
二.荧光素发光法细胞生存能力检测原理:腺苷酸激酶(AK)存在于所有真核和原核细胞的胞浆中,AK具有激活ADP 生成ATP。
当细胞受损后,细胞膜发生破损,AK会释放到培养上清中。
该试剂盒利用荧光素酶和荧光素在ATP作用下可以发光,通过化学发光仪可以定量进行检测。
特点: 1)简单、快速。
2)板式检测,可进行高通量。
三.LDH法细胞毒性检测原理:LDH(乳酸脱氢酶)是一种稳定的蛋白质,存在于正常细胞的胞质中,一旦细胞膜受损,LDH即被释放到细胞外; LDH催化乳酸形成丙酮酸盐,和INT(四唑盐类)反应形成紫色的结晶物质,可通过500nm酶标仪进行检测。
通过检测细胞培养上清中LDH的活性,可判断细胞受损的程度特点:1)方法简单,安全,不使用放射性物质2)可进行高通量检测。

CCK_8操作说明及检测步骤CCK-8是一种常用的细胞增殖和细胞毒性检测方法,可以评估药物、毒物和其他试剂对细胞增殖的影响。
本篇文章将介绍CCK-8实验的操作说明及检测步骤。
实验材料:1.细胞培养物:包括细胞培养基和要检测的细胞系。
K-8试剂盒:包括CCK-8试剂和添加剂(如无血清培养基)。
实验步骤:1.细胞预处理:a.将细胞接种在培养皿中,使其达到对数生长期。
b.用PBS洗涤细胞,以去除培养基中的血清和其他杂质。
c.加入细胞培养基(如无血清培养基)孵育一天以适应新的生长条件。
K-8溶液的制备:a.从CCK-8试剂盒中取出所需量的CCK-8试剂。
b.按照试剂盒说明书中的方法,将CCK-8试剂溶解于适当的溶剂中,以获得CCK-8溶液。
3.细胞处理:a.在细胞培养皿中加入适量的处理组(含药物/毒物/试剂)和阴性对照组(不含处理)。
b.孵育细胞以使其与处理组接触,一般孵育24小时。
c.如果需要在不同时间点进行测量,可以设置不同的处理时间。
4.检测步骤:a.将培养皿从孵育器中取出,加入CCK-8溶液。
一般将CCK-8溶液与培养基混合,使浓度为10%。
b.返回孵育器中继续孵育15至60分钟,以使CCK-8溶液充分与细胞相互作用。
c. 使用酶标仪测量细胞的吸光度。
一般使用450nm波长进行检测。
d.记录各处理组的吸光度值。
5.数据分析:a.根据实验要求,选择合适的数据分析方法。
常用的包括比较各示踪实验组与阴性对照组之间的吸光度差异,或者使用半数抑制浓度(IC50)来评估样品对细胞增殖的影响。
b.绘制呈现实验结果的图表和图形。
c.进行统计分析,如t检验或方差分析,并计算显著性水平。
注意事项:1.操作前应严格按照实验室安全规定进行,佩戴实验室所需的个人防护设备。
2.在各步骤中,应尽量避免细胞暴露在环境中的时间过长,以减少细胞的应激反应。
3.操作时要注意使用无菌环境和无菌操作,以防止细胞污染。
4.实验中的所有操作必须根据实验室方法进行,避免任何操作的偏差。

动物细胞培养和细胞毒性测试的研究随着生物技术和医学研究的不断发展,动物细胞培养和细胞毒性测试成为了重要的工具。
动物细胞培养是指将动物细胞从体内分离出来,使其在人工培养条件下维持其生长和分化的一种技术。
细胞毒性测试则是通过对细胞对某种物质的反应,来评估该物质对细胞的危害程度。
在生物医药领域,这两项技术可以用于药物筛选、新药研发、毒性评价等方面。
动物细胞培养的建立动物细胞培养的建立可以追溯到20世纪初。
当时,人们对细胞结构和功能有了初步认识,开始探索不同动物细胞在培养基中的生长情况。
在20世纪50年代,随着细胞培养技术的进一步发展,人们可以培养出越来越多种类的细胞。
培养出的细胞可以在体外维持其特有的生理功能和代谢过程,从而成为了进行细胞毒性测试、植物和动物细胞的研究的重要试验材料。
目前,动物细胞培养技术的发展已经非常成熟。
人们能够在实验室内通过不同的培养条件,培养出多种细胞,包括人类癌细胞、小鼠胚胎细胞、大鼠成纤维细胞等。
这些细胞在培养基中的生长和分化过程与体内相似,能够模拟人体生物学过程,从而成为了生物学、药学和医药领域的重要工具。
细胞毒性测试的意义和流程细胞毒性测试的意义在于评估物质对细胞的毒性程度以及其对人体健康的危害性,一般可以分为以下步骤:第一步是筛选化合物,即考察化合物的生物活性。
这一步通常采用高通量筛选技术,可以同时测试多个化合物的生物活性。
第二步是确定化合物的毒性程度。
在该步骤中,通常使用细胞文化技术,比如细胞增殖检测法和细胞毒性测定法。
这些技术可以测量化合物对细胞的影响,包括它的毒性以及对细胞的增殖、分化和细胞形态的影响。
第三步是确定化合物的毒性机制。
在该步骤中,需要对受影响的细胞进行深入研究,以了解化合物产生毒性的原因。
这些研究可以探讨影响细胞增殖的通路、凋亡机制和细胞信号传导途径等。
细胞毒性测试在医学和药学领域中有重要的应用。
在药物研发的早期阶段,通常会对药物进行细胞毒性测试,以确定药物是否对人体安全。

细胞增殖与毒性检测实验方法及经验总结实验原理:Cell Counting Kit-8(简称CCK-8)试剂可用于简便而准确的细胞增殖和毒性分析。
其基本原理为:该试剂中含有WST-8【化学名:2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐】,它在电子载体1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯(1-Methoxy PMS)的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲瓒产物(Formazan dye)。
生成的甲瓒物的数量与活细胞的数量成正比。
因此可利用这一特性直接进行细胞增殖和毒性分析。
一、用途:药物筛选、细胞增殖测定、细胞毒性测定、肿瘤药敏试验等。
二、优点:1.使用方便,省去了洗涤细胞,不需要放射性同位素和有机溶剂;K-8法能快速检测;K-8法的检测灵敏度很高,甚至可以测定较低细胞密度;K-8法的重复性优于MTT 法,MTT 实验生成的formazan 不是水溶性的,需要使用DMSO 等有机溶剂溶解;5.而本方法产生的formazan 是水溶性的,不仅省去了溶解步骤,更因此而减少了该操作步骤带来的误差;K-8法对细胞毒性小,可以多次测定选取最佳测定时间,与MTT 方法相比线性范围更宽,灵敏度更高;K-8细胞活性检测试剂中为1瓶溶液,毋需预制,即开即用。
三、所需设备及仪器:1. 10ul,100-200ul及多通道移液器2. 酶标仪(带有450nm滤光片)3. 96孔培养板4. 二氧化碳培养箱四、方法及步骤:实验一:细胞增殖分析1、制备细胞悬液:细胞计数。
2、接种到96孔板中:根据合适的铺板细胞数(约1-2×104),每孔约100ul细胞悬液,同样的样本可做4-6个重复。
3、37℃培养箱中培养:细胞接种后贴壁大约需要培养4小时,如果不需要贴壁,这步可以省去。
4、加入10ul CCK8:由于每孔加入CCK8量比较少,有可能因试剂沾在孔壁上而带来误差,建议将枪头浸入培养液中加入且在加完试剂后轻轻敲击培养板以帮助混匀。

细胞毒性实验
细胞毒性实验是一种常用的实验方法,用于评估不同物质对细胞的毒性程度。
在药物研发、化学品评估、环境监测等领域中,细胞毒性实验起着至关重要的作用。
本文将介绍细胞毒性实验的原理、方法和应用。
原理
细胞毒性实验通过将待测物质暴露于不同类型的细胞培养物中,通过观察细胞
生长、代谢活性、细胞形态等指标的变化来评估毒性。
细胞毒性主要分为急性毒性和慢性毒性两种类型,分别用于评估物质对细胞的直接杀伤作用和潜在的长期影响。
方法
1. 细胞培养
首先需要选择适当的细胞系进行实验,常用的细胞系包括HEK293、HeLa、RAW264.7等。
细胞需在灭菌条件下培养,并保持在适宜的培养基中。
2. 暴露实验
将不同浓度的待测物质加入到细胞培养物中,设立对照组和实验组。
根据实验
需要,可以选择不同时间点进行观察。
3. 细胞存活率检测
通过MTT法、CCK-8法等方法检测细胞的存活率,进而评估毒性程度。
此外,也可以观察细胞形态的变化,如细胞凋亡、坏死等。
4. 数据统计分析
将实验结果进行统计分析,绘制图表,评估不同浓度下待测物质的毒性效应。
应用
细胞毒性实验广泛应用于药物筛选、化学品评估、环境毒性检测等领域,为评
估物质对细胞的毒性提供重要依据。
通过细胞毒性实验,可以及时发现有毒物质,减少对人类健康和环境的危害。
综上所述,细胞毒性实验是一种重要的实验方法,具有广泛的应用前景。
加强
对细胞毒性实验的研究和应用,对于促进科学研究和保护人类健康具有积极意义。

生物医用材料生物学评价标准和试验方法生物医用材料是指可以应用于人体内的材料,例如人工关节、生物支架、医用植入材料等。
这些材料需要经过严格的生物学评价来确保其安全性和有效性。
生物学评价标准和试验方法是评估生物医用材料的重要工具,可以帮助制药企业和研究机构准确地评估材料的生物相容性、毒性和应答性。
一、生物学评价标准1. 细胞培养试验细胞培养试验是评估生物医用材料对细胞生长、增殖和凋亡的影响。
通过观察细胞在材料表面的粘附、形态和代谢活性等指标,可以初步判断材料的生物相容性和毒性反应。
2. 动物试验动物试验是评估生物医用材料在体内的生物学行为和反应。
常用的动物模型包括小鼠、大鼠、兔子和猪等。
通过植入材料后观察动物的炎症反应、组织修复和免疫应答,可以全面评估材料在体内的安全性和有效性。
3. 体外毒性试验体外毒性试验是评估生物医用材料对细胞和组织毒性的影响。
常用的试验包括溶菌圈试验、细胞毒性试验和血凝试验等。
通过这些试验可以及早发现材料的潜在毒性风险,确保其在临床应用中不会对患者造成不良影响。
二、试验方法1. 材料表面形貌观察通过扫描电镜和透射电镜等技术,观察生物医用材料表面的形貌和结构特征,可以初步判断材料的表面粗糙度、结晶度和微观结构,为后续的生物学评价提供基础数据。
2. 细胞培养试验通过将生物医用材料表面接触细胞培养,观察细胞的粘附、增殖和凋亡情况,可以评估材料对细胞生物学行为的影响,进而判断其生物相容性和毒性反应。
3. 动物植入试验将生物医用材料植入动物体内,观察材料对组织的影响和动物的生物学应答,可以全面评估材料在体内的生物相容性、组织修复和免疫应答等指标。
4. 体外毒性试验通过体外毒性试验,包括溶菌圈试验、细胞毒性试验和血凝试验等,可以快速评估生物医用材料的潜在毒性风险,为临床应用提供安全保障。
三、个人观点和理解生物医用材料的生物学评价标准和试验方法是确保材料安全性和有效性的重要环节。
通过细胞培养试验、动物试验和体外毒性试验等多种评价手段,可以全面评估材料的生物相容性、毒性和应答性。

一、实验背景癌症作为一种严重威胁人类健康的疾病,其治疗一直是医学界的研究重点。
近年来,随着分子生物学、细胞生物学等领域的不断发展,越来越多的新型抗癌药物被研发出来。
为了评估这些新型抗癌药物的疗效和安全性,细胞实验成为了一种重要的研究手段。
本实验旨在通过细胞实验研究某新型抗癌药物的活性及其对肿瘤细胞的影响。
二、实验材料与方法1. 实验材料(1)细胞:人肺癌细胞A549、人正常肺上皮细胞HepG2(2)抗癌药物:某新型抗癌药物(以下简称药物A)(3)试剂:细胞培养试剂、细胞毒性检测试剂盒、流式细胞仪等2. 实验方法(1)细胞培养:将人肺癌细胞A549和人正常肺上皮细胞HepG2分别接种于96孔板中,置于细胞培养箱中培养。
(2)药物处理:将A549细胞分为对照组、低剂量组、中剂量组和高剂量组。
对照组加入等体积的溶剂,低、中、高剂量组分别加入不同浓度的药物A。
(3)细胞毒性检测:在药物处理24小时后,采用细胞毒性检测试剂盒检测细胞活力。
(4)细胞凋亡检测:采用流式细胞仪检测细胞凋亡率。
(5)数据统计分析:采用SPSS软件对实验数据进行统计分析,比较各组间的差异。
三、实验结果1. 细胞毒性检测结果显示,随着药物A浓度的增加,A549细胞的细胞活力逐渐降低,而HepG2细胞的细胞活力基本保持不变。
这说明药物A对A549细胞具有显著的细胞毒性,而对正常细胞影响较小。
2. 细胞凋亡检测结果显示,随着药物A浓度的增加,A549细胞的凋亡率逐渐升高,而HepG2细胞的凋亡率基本保持不变。
这说明药物A对A549细胞具有显著的诱导凋亡作用。
四、实验讨论1. 药物A对A549细胞的细胞毒性作用实验结果显示,药物A对A549细胞具有显著的细胞毒性作用,这可能与其抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡等作用有关。
此外,药物A对正常细胞影响较小,表明其具有较好的安全性。
2. 药物A对A549细胞的诱导凋亡作用实验结果显示,药物A对A549细胞具有显著的诱导凋亡作用,这可能是其治疗肿瘤的重要机制之一。
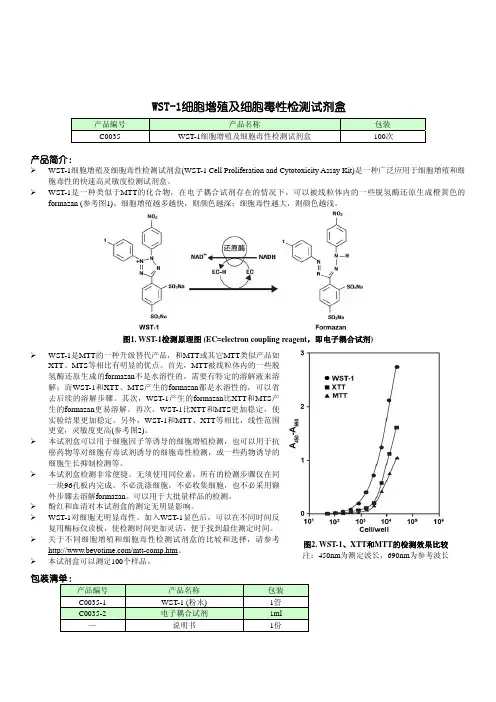
图2. WST-1、XTT 和MTT 的检测效果比较 注:450nm 为测定波长,690nm 为参考波长WST-1细胞增殖及细胞毒性检测试剂盒 产品编号 产品名称 包装C0035 WST-1细胞增殖及细胞毒性检测试剂盒 100次产品简介:WST-1细胞增殖及细胞毒性检测试剂盒(WST-1 Cell Proliferation and Cytotoxicity Assay Kit)是一种广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂盒。
WST-1是一种类似于MTT 的化合物,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的formazan (参考图1)。
细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。
图1. WST-1检测原理图 (EC=electron coupling reagent ,即电子耦合试剂) WST-1是MTT 的一种升级替代产品,和MTT 或其它MTT 类似产品如XTT 、MTS 等相比有明显的优点。
首先,MTT 被线粒体内的一些脱氢酶还原生成的formazan 不是水溶性的,需要有特定的溶解液来溶解;而WST-1和XTT 、MTS 产生的formazan 都是水溶性的,可以省去后续的溶解步骤。
其次,WST-1产生的formazan 比XTT 和MTS 产生的formazan 更易溶解。
再次,WST-1比XTT 和MTS 更加稳定,使实验结果更加稳定。
另外,WST-1和MTT 、XTT 等相比,线性范围更宽,灵敏度更高(参考图2)。
本试剂盒可以用于细胞因子等诱导的细胞增殖检测,也可以用于抗癌药物等对细胞有毒试剂诱导的细胞毒性检测,或一些药物诱导的细胞生长抑制检测等。
本试剂盒检测非常便捷。
无须使用同位素,所有的检测步骤仅在同一块96孔板内完成。
不必洗涤细胞,不必收集细胞,也不必采用额外步骤去溶解formazan 。
可以用于大批量样品的检测。
酚红和血清对本试剂盒的测定无明显影响。

细胞毒性实验报告细胞毒性实验报告细胞毒性实验是一种常见的科学实验方法,用于评估化合物对细胞的毒性作用。
本实验旨在研究不同浓度的化学物质对细胞的影响,并探讨其可能的毒性机制。
实验材料与方法:1. 细胞系:本实验选择了人类肺癌细胞系A549作为研究对象。
这是一种常用的细胞系,具有较高的增殖活性和易于培养的特点。
2. 化学物质:选择了化学品A、B和C作为实验物质,分别为已知对细胞具有不同程度毒性的化合物。
3. 细胞培养:将A549细胞系培养在含有适宜营养物质和生长因子的培养基中,保持在37摄氏度、5%二氧化碳的恒温培养箱中。
4. 细胞处理:将A549细胞分成不同组,每组细胞分别加入不同浓度的化学物质A、B和C,同时设置一个对照组,不加入任何化学物质。
5. 细胞存活率检测:使用MTT法检测细胞的存活率。
MTT是一种黄色的化学试剂,它能够被活细胞内的线粒体酶还原为紫色的产物。
通过测量产物的光密度,可以反映细胞的存活率。
实验结果与讨论:经过一定时间的培养和处理后,我们观察到不同浓度的化学物质对A549细胞的影响。
通过MTT法测定细胞存活率,我们得到了以下结果:在化学物质A的处理下,细胞存活率呈现浓度依赖性的下降趋势。
随着化学物质A浓度的增加,细胞存活率逐渐降低。
这表明化学物质A对A549细胞具有明显的毒性作用。
进一步的研究发现,化学物质A可能通过抑制细胞的DNA合成和蛋白质合成来导致细胞死亡。
与化学物质A相比,化学物质B对A549细胞的毒性作用较弱。
在较低浓度下,细胞存活率相对较高,但随着浓度的增加,细胞存活率逐渐降低。
这可能是因为化学物质B对细胞的毒性作用与其浓度成正相关。
进一步的研究发现,化学物质B可能通过干扰细胞的氧化还原平衡和细胞膜的完整性来导致细胞死亡。
化学物质C对A549细胞的毒性作用相对较弱。
在较低浓度下,细胞存活率接近对照组水平,但随着浓度的增加,细胞存活率逐渐降低。
进一步的研究发现,化学物质C可能通过干扰细胞的代谢过程和细胞凋亡通路来导致细胞死亡。

细胞毒性实验简介细胞毒性实验是一种常用的生物学实验方法,用于评估物质对生物体的细胞毒性。
通过测量物质对细胞的影响,可以判断其是否对细胞产生有害作用。
细胞毒性实验常被应用于药物研发、化学品评估以及毒性测试等领域,旨在确保物质的安全性和对生物体的可接受性。
实验步骤1. 细胞培养在进行细胞毒性实验之前,首先需要培养细胞。
选择适当的细胞系,如人类肺癌细胞株A549,将其放入细胞培养皿中,并添加培养基(常用的培养基包括DMEM、RPMI 1640等)。
将细胞培养在恒温恒湿的培养箱中,通常培养温度为37°C,CO2含量为5%。
2. 细胞处理将待测试物质加入培养基中,与细胞一同培养。
通常会设置不同浓度的待测物质组,以便研究其剂量依赖性毒性效应。
同时,还需设置一个阴性对照组(仅含培养基)和阳性对照组(含有已知毒性的物质,如阿霉素)。
3. 细胞存活率检测根据细胞系的不同,可以选择合适的方法检测细胞的存活率。
常用的方法包括MTT法、SRB法和细胞计数法等。
- MTT法MTT法是一种测定细胞代谢活性的方法。
MTT(3-(4,5-二甲基-2-噻吩基)-2,5-二苯基-2H-四唑)是一种黄色溶液,可以被活细胞中的代谢酶还原为紫色的形式。
使用MTT溶液处理细胞后,将细胞溶胀后的产物溶解,通过分光光度计测量溶液的吸光度,间接反映细胞存活率。
- SRB法SRB法是通过测量细胞中蛋白质含量来评估细胞数量的一种方法。
在SRB实验中,细胞在培养皿中固定后,使用SRB染色剂染色。
待染色剂固定后,通过溶解并测量其吸光度,可以间接反映细胞存活率。
- 细胞计数法细胞计数法是直接计数细胞数量来评估细胞存活率的方法。
将细胞用适当的缓冲溶液(如PBS)稀释后,使用血细胞计数器或显微镜进行细胞计数。
通过对细胞数量的统计,可以计算出细胞存活率。
4. 数据分析将实验得到的数据进行统计和分析。
使用适当的统计方法,比如t检验或方差分析,来判断待测物质对细胞的毒性作用是否存在显著差异。

Hotline :400-6111-883 E -上HB210525本产品仅作科研用途!MTT Cell Proliferation Assay Kit MTT 细胞增殖及细胞毒性检测试剂盒Cat NO.40206产品说明书网址: 第1页,共2页MTT Cell Proliferation Assay Kit MTT 细胞增殖及细胞毒性检测试剂盒产品信息MTT Cell Proliferation Assay Kit MTT 细胞增殖及细胞毒性检测试剂盒40206ES76 500 T 40206ES80 1000 T 40206ES905000 T产品描述噻唑兰(Methylthiazolyldiphenyl -tetrazolium bromide , MTT ),也称作溴化噻唑蓝四氮唑,是一种黄色染料,已经普遍替代传统的台盼蓝染色法或者放射性同位素插入法,用来检测细胞的活力,细胞增殖以及细胞毒性分析。
检测原理在于:MTT 是一种可接受氢离子的化合物染料,带正电荷,具有细胞膜渗透性。
活细胞线粒体中的琥珀酸脱氢酶能够将外源进入的MTT 还原成为水不溶性的深蓝色MTT -甲臜结晶,而死细胞不具有此功能。
甲臜结晶是不能穿透细胞膜,因此沉积在处于增殖且未受损伤的细胞内。
甲臜结晶可用DMSO 或者酸化的异丙醇溶解出来,酶标仪下测定570 nm 的吸光度反映甲臜的生成量。
而甲臜的生成量与活细胞数目成正比,用以评估细胞存活状况。
本试剂盒以MTT (高纯度)作为指示剂,在经典操作步骤的基础上,采用独特的甲臜溶解液配方,可以直接溶解甲臜沉淀,无需去除原有的培养液。
从而避免因去除培养液时甲臜被部分去除而引起的操作误差。
具有本底低,灵敏度高,线性范围宽,操作简单等特点。
另外,本试剂盒还提供配套的一次性针头过滤器和注射器,为实验带来更多的便利。
产品组分编号 组分 产品编号/规格40206ES76(500T ) 40206ES80(1000T ) 40206ES90(5000T ) 40206-A MTT 粉末 25 mg 50 mg 250 mg 40206-B MTT 溶剂 5 mL 10 mL 50 mL 40206-C 甲臜溶解液 50 mL 100 mL 100 mL×5 40206-D除菌套装1包1包1包运输和保存方法冰袋运输。
细胞培养法评价生物材料生物相容性研究进展细胞培养法检测材料生物相容性是一种快速、简便、重复性好又价廉的方法,在材料生物相容性评价中起着越来越重要的作用。
由于新材料不断涌现、材料植入体内的部位及使用目的日趋繁杂、材料毒性作用的强弱以及与机体反应的复杂性等因素决定了细胞毒性试验中实验方法及实验细胞的多样性。
根据生物材料本身的理化特性、植入体内的部位及使用目的选择适当的实验方法和实验细胞至关重要。
以往对材料生物相容性的评价往往着眼于细胞的形态与数量的变化,近几年来研究材料对细胞生长、附着、增殖及代谢方面影响的报道日趋增多,并提出了以有活力的细胞数和细胞生长作为材料生物相容性评价标准的观点。
通过结合免疫、化学、放射及影像学等多学科的技术发展,使人们进一步深入了解细胞结构和功能的变化关系,进而阐明材料对细胞的作用机制,是今后细胞培养法评价材料生物相容性的发展方向。
Abstract It is quick convient good-repeating and cheap that examining the biotic materials compatibility through cell-culturing method,and it is more and more important in evaluating the compatibility of biotic material.The new material appeating continously complicating of the part and aim material be planted in the intensity of materials toxic effectthe reactions complication of material and biotic body,all of these decide the variety of experiment method and cells in cell toxicity experiment.It is very important that choices the right experiment method and cells according to the materials character the part and aim the material be planted in .The evaluation of biotic materials compatibility stressed on the changing of cells form and quantity before.Inrecent years,more and more reports appear about material influeances the growth.adhesion proliferation and metabolizing of cell.and presents the point that the evaluation standard of biotic materials compatibility should be set according to the active cells quantity and their bining many subjects technological development,such as immunology, chemistry,radiation and shadowgraphy,thoroughly inquires the changeing relation of cells structure and funtion,furtherly clarifes the materials effect on cell,It is the developing direction in the future that evaluates the biotic materials compatibility in cedd-culturing method.Key words Biotic material Cell-culturing Compatibility Toxicity experiment生物材料的临床应用已有较长的历史,广泛应用于牙科、眼科、整形外科及心血管外科领域。
生物毒性的检测与评估生物毒性是指化学物质或生物物质对于生物体内的某些器官、系统、细胞或诊断级别的影响。
它的出现可能会对生态系统和人类健康造成负面影响。
因此,对于生物毒性的检测与评估是非常重要的。
一、检测方法1. 细胞毒性检测法这种方法使用细胞培养法,将化学物质加入培养基中,观察细胞对于化学物质的反应情况。
根据细胞死亡数量来评估其毒性。
2. 动物毒性检测法这种方法管理动物,注入化学物质,观察其反应情况,并在一段时间后对动物进行解剖。
根据动物死亡数量和脏器损伤情况来评估化学物质的毒性。
3. 试纸检测法这种方法是使用特殊的试纸,将待测的生物物质放入试纸中,观察颜色变化,根据颜色变化的程度来评估其毒性。
二、检测指标1. 水质毒性指标水质毒性指标是评估水体是否受到化学物质污染的一种方法。
其检测指标包括:硬度、总溶解固体、溶解氮含量、pH值、溶解氧含量、化学需氧量、总有机碳和总细菌数等。
2. 土壤毒性指标土壤毒性指标是评估土壤中是否含有毒性物质的一种方法。
其检测指标包括:土壤有机物含量、pH值、电导率、有机磷含量和重金属含量等。
3. 食品毒性指标食品毒性指标是评估食品中是否含有毒性物质的一种方法。
其检测指标包括:食品添加剂、重金属、农药残留以及各种有害化学物质的含量等。
三、评估指标1. 毒性指数毒性指数是评估化学物质对于生态系统或人类健康的影响程度的一种指标。
根据化学物质的浓度、毒性和容积等因素计算出来。
在此基础上,卫生部门或相关机构可以制定针对性的规范和管制措施,确保公众的安全。
2. 生态风险评估生态风险评估是评估化学物质对于生态系统的影响程度的一种方法。
其评估指标包括危害描述、曝露评估、生物处理和效应评估等。
根据评估报告,环境保护部门或相关机构可以采取相应的治理措施,保护野生动物和生态环境。
四、未来发展方向生物毒性检测与评估技术正日趋完善和普及,未来的发展方向主要集中在以下几个方面:1. 合理使用化学物质,研发绿色环保型产品。
mtt法检测细胞毒性原理
MTT法是一种常用的细胞毒性检测方法。
其原理基于细胞代
谢活性与细胞数量之间的关系。
该方法利用一种叫做MTT的
化学物质,它能够被细胞内的还原酶所代谢并转化为紫色的结晶物。
这种发色反应与细胞的代谢活性相关,正常细胞代谢活性高,转化的MTT结晶物也就越多,溶液颜色越深。
而有细
胞毒性的物质会影响细胞的代谢活性,导致MTT转化的结晶
物减少,溶液颜色较浅。
MTT法的操作步骤包括:首先将待测物质添加到包含细胞的
培养基中,培养一定时间使细胞与物质相互作用;然后加入MTT试剂,培养一段时间使其被细胞代谢转化成紫色的结晶物;接下来,将培养基移除,加入溶解剂使MTT结晶物溶解;最后,通过分光光度计测量吸光度来评估细胞的代谢活性,进而判断物质对细胞的毒性。
MTT法具有操作简便、结果可靠的特点,被广泛应用于评估
药物、化学物质和各类材料对细胞毒性的影响。
它可用于筛选有潜在毒性的化合物,评估细胞对新药物的敏感性,并对材料的生物相容性进行评估。
细胞培养板检测标准细胞培养板是细胞培养实验中常用的携带培养基的基质,用于支持和促进细胞的生长和增殖。
为了确保实验结果的准确性和可重复性,细胞培养板的质量控制至关重要。
本文将介绍细胞培养板的检测标准,以确保在细胞培养实验中获得可靠的结果。
一、外观检查细胞培养板的外观检查是初步评估其质量的重要步骤。
正常的细胞培养板应该是透明的,无明显的瑕疵或污染物。
在光线充足的环境下,仔细观察细胞培养板的表面和侧壁,确保无脏污、变色、裂纹或其他影响实验的问题存在。
二、无菌检测细胞培养实验要求无菌条件,因此,细胞培养板的无菌性是必须验证的。
常用的方法是通过培养基接种实验或无菌测试纸评估其无菌状态。
在培养基接种实验中,将细菌或真菌接种于细胞培养板中,然后在适当的培养条件下观察生长情况。
如果培养基无菌,则观察期间不应有任何菌落的出现。
无菌测试纸可以直接放置在细胞培养板内,检测是否会有颜色的发生,用于判断是否存在细菌或真菌的污染。
三、细胞附着性检测细胞附着性是细胞生长的关键步骤,因此,细胞培养板的表面特性对细胞的附着能力至关重要。
常用的检测方法包括浸润角测量、水接触角测量和比色法。
浸润角测量通过观察液体滴在细胞培养板表面的形态以评估其亲水性或疏水性。
水接触角测量可以进一步量化评估,水滴在细胞培养板表面上形成的角度。
比色法可以用于评估附着细胞数量,通过细胞染色和比色分析,确定细胞在细胞培养板上的附着情况。
四、毒性测试细胞培养板材料的毒性是一个必须要考虑的因素。
细胞培养板不应对细胞产生有害影响。
常用的毒性测试方法包括MTT(3-(4,5-二甲基-2-噻唑酰胺基)-2,5-二苯基四唑)试验和细胞增殖试验。
MTT试验通过将MTT溶液加入培养基中,根据细胞的代谢活性生成紫色的产物,然后通过比色分析测定代谢活性水平。
细胞增殖试验则通过比较在培养板中不同时间点的细胞数量来评估细胞的毒性。
五、蛋白吸附检测细胞培养板的表面会与细胞外基质或血清中的蛋白质接触,因此,细胞培养板的蛋白吸附性也是需要评估的一个因素。
细胞毒实验实验报告南方医科大学细胞毒性实验是生物学评估和筛选测试之一,该测试使用体外组织细胞观察医疗器械对细胞生长,繁殖和形态的影响。
细胞毒性实验旨在评估医疗器械和材料的一般毒性。
测试包括在细胞培养基中提取设备,然后将提取液暴露于小鼠成纤维细胞(L929)。
在使用定性或定量方法评估细胞之前,允许细胞在提取液中生长指定的时间。
该测试是在所有与患者接触的医疗设备,原材料以及经过清洁验证或剩余制造的设备上执行的。
虽然可以通过多种不同的方法进行测量,但是通过使用重要染料(福尔马赞染料),蛋白酶生物标志物或通过测量ATP含量来评估细胞活力是确定细胞毒性的最常用方法。
常见的四唑盐包括INT,MTT,MTS和XTT。
通常在371C的补充了血清的哺乳动物细胞培养基(MEM)中提取设备材料。
提取后,将提取物与L929细胞(小鼠成纤维细胞)单层接触。
然后使细胞在提取液中生长指定的时间,然后使用定性或定量方法对细胞进行评估。