混合碱中碳酸钠和碳酸氢钠含量的测定
- 格式:docx
- 大小:39.61 KB
- 文档页数:5


混合碱中碳酸钠和碳酸氢钠含量的测定实验时间:报告人:武伟一、实验目的1.了解强酸弱碱盐在滴定过程中pH的变化。
2.掌握双指示剂法在测定混合碱中碳酸钠和碳酸氢钠以及总碱量的方法二、实验原理在碳酸钠和碳酸氢钠和混合碱中滴入盐酸时,会先发生如下反应:Na2CO3+HCl=NaHC O3+NaCl先使全部的碳酸钠转变成碳酸氢钠,然后再发生反应:NaHC O3+ HCl= Na Cl+ C O2↑+H2O如果在第一个反应发生过程中滴入酚酞溶液,以盐酸滴定到无色,此时溶液中的碳酸钠仅被的滴定成碳酸氢钠,根据用去盐酸的量就可以算出碳酸钠的量。
然后在向溶液中加入甲基橙,用盐酸滴定至溶液由绿色滴定到亮黄色,此时溶液中的碳酸氢钠全部反应,根据盐酸的量可以算出总碱量,结合上一步算出的碳酸钠的量就可以算出该混合碱的组成。
三、实验器材碱灰试样,酚酞指示剂,甲基橙,mol/L的盐酸,滴定管,锥形瓶(3个)四、实验内容i.实验步骤1.准确称量g的试样三份于锥形瓶中,加入50 mL蒸馏水,加入两滴酚酞指示剂,溶液显红色。
2.用盐酸标准液滴定至无色,到达第一终点,记下用去盐酸的体积。
在滴定过程中注意边滴变不断摇晃,以免局部酸浓度过大使碳酸钠直接和盐酸反应生成二氧化碳。
3.向溶液中加入两滴甲基橙,继续用盐酸滴定,直到溶液由黄色到橙色,记下第二次用去盐酸的体积。
4.重复操作三次。
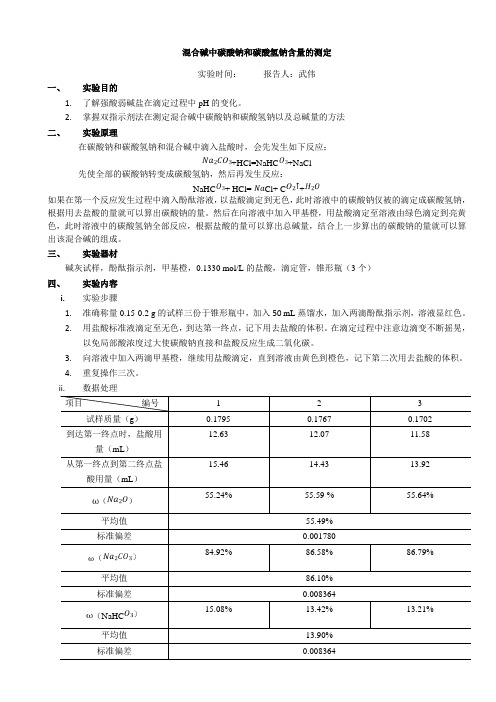
ii.数据处理五、思考题1.本实验用酚酞做指示剂时,所消耗的盐酸较用甲基橙少,为什么因为用酚酞做指示剂时只是盐酸和碳酸钠反应,而用甲基橙做指示剂时,是上一步反应完的生成的碳酸氢根和溶液中本身存在的碳酸氢根的和来反应,反应的比例又相同,所以第二次总会多一点。
2.在总碱量的计算式中,V有几种求法如果只要求测定总碱量,实验应该怎样做V表示用去盐酸的总体积,可以直接读出来;如果只要求测定总碱量,只需要用甲基橙做指示剂,滴定至橙色。
3.在测定一批烧碱或碱灰样品时,若分别出现V1<V2,V1=V2,V1>V2,V1=0,V2=0的情况,说明样品的组成有什么差别4.待测液润洗因为滴定管的移液管要求里面的溶液的浓度一定要准确,所以要润洗,避免内壁的水珠对溶液的稀释;而烧杯或锥形瓶要求里面的总物质的量要准确,所以不可以润洗,避免液体挂在内壁上。

混合碱中碳酸钠和碳酸氢钠含量测定的问题讨论下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!I. 引言混合碱是在实验室常用的一种试剂,其中主要包含碳酸钠和碳酸氢钠。

实验三 混合碱中碳酸钠、碳酸氢钠的含量测定一、实验目的1、掌握盐酸滴定液的配制与标定。
2、巩固用递减称量法称量固体。
3、掌握用酸碱滴定法测定混合碱含量的原理和方法。
二、实验原理浓盐酸因含有杂质而且易挥发,因而不能直接配置成标准溶液,其溶液的准确浓度需要先配制成近似浓度的溶液,然后用其它基准物质进行标定。
常用于标定酸溶液的基准物质有:碳酸钠(Na2CO3)或硼砂(Na2B4O7•10H2O); 用碳酸钠(Na2CO3)标定HCl 溶液反应方程式如下: Na 2CO 3+2HCl+=CO 2+2NaCl+H 2O混合碱系指NaOH 和Na 2CO 3或Na 2CO 3和NaHCO 3等类似的混合物,可采用双指示剂法进行分析,并测定各组分的含量。
三、实验内容一、HCL (0.1 mol/L )标准溶液的配制与标定 1.0.1mol/LHCL 溶液的配制用洁净的10mL 量筒量取浓盐酸 4.5 mL ,倒入事先已加入少量蒸馏水的500mL 洁净的试剂瓶中,用蒸馏水稀释至500mL ,盖上玻璃塞,摇匀,贴好标签。
2.0.1mol/L HCL 溶液的标定准确称取无水Na 2CO 30.12~0.14克于锥形瓶中,加30mL 蒸馏水溶解。
再往锥形瓶中加入甲基红溶液1~2滴,用配制的HCl 溶液滴定至溶液刚刚由黄色变为橙色即为终点,记录所消耗HCl 溶液的体积。
平行测定三份,计算C NaOH 和和标定结果的相对偏差。
二、混合碱中碳酸钠、碳酸氢钠的含量测定精密称取混合碱0.15-0.20 g ,置于250mL 锥形瓶中,加25mL 蒸馏水溶解,加2滴酚酞指示剂,用HCl 标准溶液滴至溶液略带粉色终点,记下用去HCl 溶液的体积V 1;再加入1滴甲基橙指示剂,用HCl 继续滴至溶液由黄色变为橙色,用去的HCl溶液的体积为V2。
重复测定2~3次,其相对偏差应在0.5%以内。
三.实验记录与数据处理1、0.1mol·L- HCL溶液的标定2. 混合碱中碳酸钠碳酸氢钠的含量测定。

溷合碱中碳酸钠和碳酸氢钠含量的测定实验目的:1. 学习并掌握溶液中滴定法的基本原理及操作方法。
2. 了解常见酸碱指示剂的理化性质。
实验原理:1. 滴定法滴定法是一种化学分析方法,它通过在待测溶液中加入已知浓度的标准溶液,通过反应等价点处的指示剂变色,确定两种溶液反应中所用试剂量的大小及其浓度。
浓度法分析时可以对待测溶液中含量极少或与成分相似的物质进行分析,精度较高,误差小。
滴定法实验过程中,滴液速度要保持稳定,掌握好每一滴的落点和滴液速度,这样可以使测量结果更加准确。
在滴定过程中,应先滴几滴来温馨玻璃器皿,以此使玻璃器皿壁面处于湿润状,可以防止粘滞,影响结果。
酸碱指示剂是化学分析中经常使用的一种化学试剂,它在酸性溶液和碱性溶液中以不同颜色变化的方式反应,可以帮助我们确定等价点,从而进行分析。
在本实验中,我们将使用苯酚酞作为指示剂,它在碱性溶液中呈现粉红色,而在酸性溶液中呈现无色或黄色。
苯酚酞作为指示剂在酸碱滴定分析中的使用极为广泛。
因为它有以下特点:① 灵敏度高,指示范围从PH8.3~10.0,最适宜PH值9.8左右。
② 变色明显,色谱清晰,错误小。
③ 常温下相对稳定,保质期较长。
实验步骤:1. 实验前准备:(1)称取约0.72~0.80g的混合碱(精确到0.01g),置于量瓶中,加入约50mL蒸馏水(千分之一误差)。
(2)配制0.1mol/L的盐酸标准溶液,装入滴定管中(移液管)。
(3)准备好苯酚酞指示剂。
(1)将苯酚酞指示剂加入溶液中,搅拌均匀。
(2)用盐酸标准溶液滴定至溶液中出现深粉色,并持续10s左右。
(3)记录滴定所使用的盐酸标准溶液体积,即可求出混合碱中碳酸钠和碳酸氢钠的含量。
实验数据:1. 称取混合碱的质量为0.74g。
2. 第一次滴定使用盐酸标准溶液的体积为23.0mL,第二次滴定使用盐酸标准溶液的体积为23.1mL。
实验结果:平均值(0.74g混合碱):23.0mL+23.1mL÷2 = 23.05mL平均值×摩尔浓度(0.1mol/L)÷质量(0.74g) ×100 %= 69.59%(碳酸钠的含量)通过滴定法测定混合碱中碳酸钠和碳酸氢钠的含量分别为69.59%和30.41%,符合理论分析值。

实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、 实验目的1•了解双指示剂法测定混合碱的原理;2•理解混合碱中各组分的测定方法以及相关计算。
二、 实验原理混合碱试样溶液(含Na 2CO 3、NaHC03)鵬酞指示剂 红色加CI 溶液滴定(V i mL )无色(反应:Na 2CO 3+HC 匸NaHC0 3+NaCI ), (C V I )HCI = n (Na 2CO 3)=n i(NaHC03)按甲酚绿-二甲基黄指示剂(混合指示剂) 绿色眉CI 溶液滴定(V 2mL )亮黄色(反应:NaHCO+HC 匸NaCI+HO+CQ ), (cV 2)Hci =ni(NaHCQ)+n(NaHCO)c(HCI)M-VJ 84.01 m s h 1000又 Na 2O+CO 2=Na 2CO 3n 1(Na 2O)=n(Na 2CO 3)=(cV 1)Hc l Na 2O+2CO 2+H 2O=2NaHCO 3n 2(Na 2O)=n(2NaHCO 3)=1/2 n( NaHCO 3)=1/2c(V 2 — V 1)HCI 所以 n (NaO)=n 1 (Na 2O)+n 2(Na 2O)=1/2c(V 1 + V 2)HCI1C (HCI)(V 1 V 2)Na ?。
% =—m s 勺 000三、实验内容1.混合碱试样溶液(由实验室提供)配制流程:50.00g 试样 溶解》疋量转移》定^1000mL2.试样溶液的测定及数据处理[已知c (HCI )=Na ?CO 3% =c(HCI)V i 106.0m s 1000 NaHCO 3%mol 匕-1]。

混合碱中碳酸钠和碳酸氢钠含量的测定实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1.了解双指示剂法测定混合碱的原理;2.理解混合碱中各组分的测定方法以及相关计算。
二、实验原理混合碱试样溶液(含Na 2CO 3、NaHCO 3) ↓酚酞指示剂 红色↓HCl 溶液滴定(V 1mL )无色(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),(cV 1)HCl =n(Na 2CO 3)=n 1(NaHCO 3)↓溴甲酚绿-二甲基黄指示剂(混合指示剂) 绿色↓HCl 溶液滴定(V 2mL )亮黄色(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)100001.84))((%10000.106)(%123132⨯⨯-=⨯⨯=s s m V V HCl c NaHCO m V HCl c CO Na又 Na 2O+CO 2=Na 2CO 3 n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l Na 2O+2CO 2+H 2O=2NaHCO 3n 2(Na 2O)=n(2NaHCO 3)=1/2n(NaHCO 3)=1/2c(V 2-V 1)HCl 所以 n(NaO)=n 1(Na 2O)+n 2(Na 2O)=1/2c(V 1+V 2)HCl1000))((21%212⨯+=s m V V HCl c O Na三、实验内容1.混合碱试样溶液(由实验室提供)配制流程:mL g 1000试样00.50定容定量转溶解−−→−−−−→−−−→−移 2.试样溶液的测定及数据处理[已知c(HCl)= mol·L -1]。

混合碱中碳酸钠和碳酸氢钠含量的测定实验时间:报告人:武伟一、实验目的1.了解强酸弱碱盐在滴定过程中pH的变化。
2.掌握双指示剂法在测定混合碱中碳酸钠和碳酸氢钠以及总碱量的方法二、实验原理在碳酸钠和碳酸氢钠和混合碱中滴入盐酸时,会先发生如下反应:Na2CO3+HCl=NaHC O3+NaCl先使全部的碳酸钠转变成碳酸氢钠,然后再发生反应:NaHC O3+ HCl= Na Cl+ C O2↑+H2O如果在第一个反应发生过程中滴入酚酞溶液,以盐酸滴定到无色,此时溶液中的碳酸钠仅被的滴定成碳酸氢钠,根据用去盐酸的量就可以算出碳酸钠的量。
然后在向溶液中加入甲基橙,用盐酸滴定至溶液由绿色滴定到亮黄色,此时溶液中的碳酸氢钠全部反应,根据盐酸的量可以算出总碱量,结合上一步算出的碳酸钠的量就可以算出该混合碱的组成。
三、实验器材碱灰试样,酚酞指示剂,甲基橙,0.1330 mol/L的盐酸,滴定管,锥形瓶(3个)四、实验内容i.实验步骤1.准确称量0.15-0.2 g的试样三份于锥形瓶中,加入50 mL蒸馏水,加入两滴酚酞指示剂,溶液显红色。
2.用盐酸标准液滴定至无色,到达第一终点,记下用去盐酸的体积。
在滴定过程中注意边滴变不断摇晃,以免局部酸浓度过大使碳酸钠直接和盐酸反应生成二氧化碳。
3.向溶液中加入两滴甲基橙,继续用盐酸滴定,直到溶液由黄色到橙色,记下第二次用去盐酸的体积。
4.重复操作三次。
ii.数据处理五、思考题1.本实验用酚酞做指示剂时,所消耗的盐酸较用甲基橙少,为什么?因为用酚酞做指示剂时只是盐酸和碳酸钠反应,而用甲基橙做指示剂时,是上一步反应完的生成的碳酸氢根和溶液中本身存在的碳酸氢根的和来反应,反应的比例又相同,所以第二次总会多一点。
2.在总碱量的计算式中,V有几种求法?如果只要求测定总碱量,实验应该怎样做?V表示用去盐酸的总体积,可以直接读出来;如果只要求测定总碱量,只需要用甲基橙做指示剂,滴定至橙色。
混合碱中碳酸钠和碳酸氢钠含量的测定实验时间:报告人:武伟一、实验目的1.了解强酸弱碱盐在滴定过程中pH的变化。
2.掌握双指示剂法在测定混合碱中碳酸钠和碳酸氢钠以及总碱量的方法二、实验原理在碳酸钠和碳酸氢钠和混合碱中滴入盐酸时,会先发生如下反应:+HCl=NaHC+NaCl先使全部的碳酸钠转变成碳酸氢钠,然后再发生反应:NaHC+ HCl=Cl+ C+如果在第一个反应发生过程中滴入酚酞溶液,以盐酸滴定到无色,此时溶液中的碳酸钠仅被的滴定成碳酸氢钠,根据用去盐酸的量就可以算出碳酸钠的量。
然后在向溶液中加入甲基橙,用盐酸滴定至溶液由绿色滴定到亮黄色,此时溶液中的碳酸氢钠全部反应,根据盐酸的量可以算出总碱量,结合上一步算出的碳酸钠的量就可以算出该混合碱的组成。
三、实验器材碱灰试样,酚酞指示剂,甲基橙,0.1330 mol/L的盐酸,滴定管,锥形瓶(3个)四、实验内容i.实验步骤1.准确称量0.15-0.2 g的试样三份于锥形瓶中,加入50 mL蒸馏水,加入两滴酚酞指示剂,溶液显红色。
2.用盐酸标准液滴定至无色,到达第一终点,记下用去盐酸的体积。
在滴定过程中注意边滴变不断摇晃,以免局部酸浓度过大使碳酸钠直接和盐酸反应生成二氧化碳。
3.向溶液中加入两滴甲基橙,继续用盐酸滴定,直到溶液由黄色到橙色,记下第二次用去盐酸的体积。
4.重复操作三次。
ii.数据处理()((NaHC五、思考题1.本实验用酚酞做指示剂时,所消耗的盐酸较用甲基橙少,为什么?因为用酚酞做指示剂时只是盐酸和碳酸钠反应,而用甲基橙做指示剂时,是上一步反应完的生成的碳酸氢根和溶液中本身存在的碳酸氢根的和来反应,反应的比例又相同,所以第二次总会多一点。
2.在总碱量的计算式中,V有几种求法?如果只要求测定总碱量,实验应该怎样做?V表示用去盐酸的总体积,可以直接读出来;如果只要求测定总碱量,只需要用甲基橙做指示剂,滴定至橙色。
3.在测定一批烧碱或碱灰样品时,若分别出现的情况,说明样品的4.滴定管和移液管使用前均需要用操作溶液荡洗,而滴定用的烧杯或锥形瓶为什么不能用待测液润洗?因为滴定管的移液管要求里面的溶液的浓度一定要准确,所以要润洗,避免内壁的水珠对溶液的稀释;而烧杯或锥形瓶要求里面的总物质的量要准确,所以不可以润洗,避免液体挂在内壁上。

实验八混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1、掌握采用双指示剂法测定混合碱中碳酸钠和碳酸氢钠含量的原理和方法。
2、巩固酸碱滴定的有关知识。
二、实验原理(双指示剂法)在混合碱试液中先加入酚酞指示剂,用HCl标准溶液滴定至由红色刚好变为无色,达到第一终点。
此时NaCO3被滴定生成2NaHCO3,用去酸的体积为V1(mL),反应式为:NaOH+HCl= NaCl+H2ONa2CO3+HCl= NaHCO3+NaCl然后加入甲基橙指示剂,继续用HCl标准溶液滴定至由黄色变为橙色,达到第二终点。
所消耗酸的体积为V(mL)。
此时2NaHCO3全部被滴定,产物为H2CO3(CO2+H2O),反应式为:NaHCO3+HCl=NaCl+H2CO3CO2+H2ONa 2CO 3为多元碱,能被强酸准确滴定的条件是:cK b ≥10-8能分步滴定的条件是:K b1 /K b2≥104Na 2CO 3的K b1=2.08×10-4,K b2=2.33×10-8,K b1 /K b2≈104。
所以Na 2CO 3第一步离解产生的OH -可勉强被分步滴定,有一个突跃,理论终点时产物NaHCO 3为两性物质,故第一终点时:8106.5102.4lg KK lg 11721≈×××−=×−−−ΘΘa a pH =第二终点时:9.3102.404.0lg K c lg 71≈××−=⋅−−Θa pH =三、实验步骤(1)准确称取混合碱样品4.5~5.0 g于150 mL烧杯中,加50 mL蒸馏水溶解。
然后定量转移至250 mL容量瓶中,加蒸馏水至刻度,摇匀。
(2)用25 mL移液管移取试液25.00mL置于250mL锥形瓶中,加入1~2滴酚酞指示剂,用HCl标准溶液滴定至红色恰好消失,(mL);然后加入1~2滴甲基橙指示剂,继续记下HCl用量V1用HCl标准溶液滴定至溶液由黄色变为橙色,记录HCl溶液的体(mL)。

混合碱中碳酸钠和碳酸氢钠含量的测定演示教学
混合碱中碳酸钠和碳酸氢钠含量的测定
精品资料
仅供学习与交流,如有侵权请联系网站删除谢谢2 实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的
1.了解双指示剂法测定混合碱的原理;
2.理解混合碱中各组分的测定方法以及相关计算。
二、实验原理
混合碱试样溶液(含Na 2CO 3、NaHCO 3)
↓酚酞指示剂
红色
↓HCl 溶液滴定(V 1mL )
无色(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),
(cV 1)HCl =n(Na 2CO 3)=n 1(NaHCO 3)
↓溴甲酚绿-二甲基黄指示剂(混合指示剂)
绿色
↓HCl 溶液滴定(V 2mL )
亮黄色(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)
100001.84))((%1000
.106)(%123132??-=??=s s m V V HCl c NaHCO m V HCl c CO Na
又 Na 2O+CO 2=Na 2CO 3
n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l
Na 2O+2CO 2+H 2O=2NaHCO 3
n 2(Na 2O)=n(2NaHCO 3)=1/2n(NaHCO 3)=1/2c(V 2-V 1)HCl
所以 n(NaO)=n 1(Na 2O)+n 2(Na 2O)=1/2c(V 1+V 2)HCl。

实验5:混合碱中碳酸钠和碳酸氢钠含量的测定 - 化学学院
一、实验原理
混合碱中碳酸钠和碳酸氢钠含量的测定是一种用来测定混合碱中碳酸钠和碳酸氢钠含量的实验,在该实验中采用的是碱量的化学方法。
碱量的化学方法的基础是氢氧化钾作为碱量试剂计量法衡量混合碱中碳酸钠和碳酸氢钠的抽出V/V %。
混合碱中碳酸钠和碳酸氢钠含量测定中,碱量试剂溶液在标准横流釜中引入50克混合蒙汗钠,放置浓度为
0.1mol/L的碱量试剂,标准横流釜中横流时间为20min,提取液比表示用蒙汗钠溶液以及标准横流釜中提取到的溶液的碱度之比。
二、试剂
1.混合蒙汗钠:根据每100.0克中碳酸钠的质量,将
2.5克的蒙汗钠放入瓶中。
2.碱量试剂:采用0.1mol/L的氢氧化钾溶液,再加入X克的无水硫酸钠,再将碱量溶液稀释至1000ml。
三、实验步骤
1. 将混合蒙汗钠放入500ml的容量瓶中,中碱量母溶液。
2. 用标准横流釜中浓度为 0.1mol/L的氢氧化钾溶液建立测定标准曲线:将同容量瓶中的蒙汗钠溶液十次提取,提取完毕后,用标准横流釜中浓度为 0.1mol/L的碱量溶液引入提取液中,横流时间为20min,放置室温5分钟。
测定横流液的碱度,制作混合蒙汗钠标准曲线,表达式为:
V/V %=K1*A+K2*B
其中:K1为碳酸钠的标准碱量比值,K2为碳酸氢钠的标准碱量比值,A为提取液中碳酸钠的比值,B为提取液中碳酸氢钠的比值。
3.测定混合蒙汗钠中碳酸钠和碳酸氢钠含量:将混合蒙汗钠放入50克容量瓶中,再加入标准横流釜中碱量溶液,横流时间为20min,提取液中碱度为A,根据混合蒙汗钠标准曲线可得出含量:
含量(碳酸钠)=K1*A
四、实验结果。



混合碱中碳酸钠和碳酸氢钠含量的测定实验报告
混合碱中碳酸钠和碳酸氢钠含量的测定实验报告
一、实验仪器
实验仪器:分析天平;pH计;滴定管;滴定烧杯;蒸馏装置;滴定瓶及粉末瓶。
二、实验原理
混合碱中碳酸钠和碳酸氢钠含量的测定用的是根据容量滴定的原理,利用滴定瓶中的k2cr2o7来滴定碳酸钠和碳酸氢钠,碱溶液通过蒸馏装置将其中的极性物质(水)分离出来,继而实现对碳酸钠和碳酸氢钠的测定。
三、实验步骤
1、将混合碱溶液两次蒸发入容量瓶中,确定滴定容量。
2、在滴定管中用碱溶液和k2cr2o7做滴定溶液,并用pH计测定滴定溶液的pH值,确定滴定溶液的投满量。
3、将滴定烧杯放在分析天平上,将混合碱溶液一次性加入,用滴定溶液滴定,观察滴定液余留量,滴定直至滴定液余留量为零,记录滴定液投满量。
4、计算混合碱中碳酸钠和碳酸氢钠的含量,并记录实验数据。
四、实验结果
混合碱中碳酸钠和碳酸氢钠的含量为:
碳酸钠:87.47%
碳酸氢钠:12.53%
五、结论
通过实验测定混合碱中碳酸钠和碳酸氢钠的含量为87.47%和12.53%,实验结果符合所预期。

实验五、混合碱中碳酸钠和碳酸氢钠含量的测定一、实验目的1.了解双指示剂法测定混合碱的原理;2.理解混合碱中各组分的测定方法以及相关计算。
二、实验原理混合碱试样溶液(含Na 2CO 3、NaHCO 3)↓酚酞指示剂 红色↓HCl 溶液滴定(V 1mL )无色(反应:Na 2CO 3+HCl=NaHCO 3+NaCl ),(cV 1)HCl =n(Na 2CO 3)=n 1(NaHCO 3) ↓溴甲酚绿-二甲基黄指示剂(混合指示剂) 绿色↓HCl 溶液滴定(V 2mL )亮黄色(反应:NaHCO 3+HCl=NaCl+H 2O+CO 2),(cV 2)HCl =n 1(NaHCO 3)+n 2(NaHCO 3)100001.84))((%10000.106)(%123132⨯⨯-=⨯⨯=s s m V V HCl c NaHCO m V HCl c CO Na又 Na 2O+CO 2=Na 2CO 3n 1(Na 2O)=n(Na 2CO 3)=(cV 1)HC l Na 2O+2CO 2+H 2O=2NaHCO 3n 2(Na 2O)=n(2NaHCO 3)=1/2n(NaHCO 3)=1/2c(V 2-V 1)HCl 所以 n(NaO)=n 1(Na 2O)+n 2(Na 2O)=1/2c(V 1+V 2)HCl1000))((21%212⨯+=s m V V HCl c O Na三、实验内容1.混合碱试样溶液(由实验室提供)配制流程:mL g 1000试样00.50定容定量转溶解−−→−−−−→−−−→−移2.试样溶液的测定及数据处理[已知c(HCl)= mol·L -1](注:素材和资料部分来自网络,供参考。
请预览后才下载,期待你的好评与关注!)。


混合碱的含量测定实验报告一、实验目的1、掌握双指示剂法测定混合碱中碳酸钠和碳酸氢钠含量的原理和方法。
2、学会正确使用酸式滴定管、移液管等仪器。
3、培养分析问题和解决问题的能力。
二、实验原理混合碱是指碳酸钠与碳酸氢钠或碳酸钠与氢氧化钠的混合物。
常用双指示剂法进行测定,即先以酚酞为指示剂,用盐酸标准溶液滴定至溶液由红色恰好变为无色,此时溶液中的碳酸钠被滴定为碳酸氢钠,氢氧化钠被完全中和,记下消耗盐酸的体积$V_1$。
然后再加入甲基橙指示剂,继续用盐酸标准溶液滴定至溶液由黄色变为橙色,此时碳酸氢钠被完全中和,记下消耗盐酸的体积$V_2$。
根据$V_1$ 和$V_2$ 的大小,可以判断混合碱的组成,并计算各组分的含量。
(1)若$V_1 > V_2$,则混合碱为碳酸钠与氢氧化钠。
碳酸钠的含量计算公式为:\w(Na_2CO_3)&=\frac{c(HCl)\times V_1\times M(Na_2CO_3)}{m} \times 100\%\\\end{align}\氢氧化钠的含量计算公式为:\\begin{align}w(NaOH)&=\frac{c(HCl)\times (V_1 V_2) \times M(NaOH)}{m} \times 100\%\\\end{align}\(2)若$V_1 < V_2$,则混合碱为碳酸钠与碳酸氢钠。
碳酸钠的含量计算公式为:\\begin{align}w(Na_2CO_3)&=\frac{c(HCl)\times V_1\times M(Na_2CO_3)}{m} \times 100\%\\\碳酸氢钠的含量计算公式为:\\begin{align}w(NaHCO_3)&=\frac{c(HCl)\times (V_2 V_1) \timesM(NaHCO_3)}{m} \times 100\%\\\end{align}\其中,$c(HCl)$为盐酸标准溶液的浓度(mol/L),$V_1$、$V_2$ 分别为酚酞和甲基橙指示剂变色时消耗盐酸标准溶液的体积(mL),$M(Na_2CO_3)$为碳酸钠的摩尔质量(g/mol),$M(NaOH)$为氢氧化钠的摩尔质量(g/mol),$M(NaHCO_3)$为碳酸氢钠的摩尔质量(g/mol),$m$ 为混合碱的质量(g)。
混合碱中碳酸钠和碳酸氢钠含量的测定
IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
混合碱中碳酸钠和碳酸氢钠含量的测定
实验时间:报告人:武伟
一、实验目的
1.了解强酸弱碱盐在滴定过程中pH的变化。
2.掌握双指示剂法在测定混合碱中碳酸钠和碳酸氢钠以及总碱量的方法
二、实验原理
在碳酸钠和碳酸氢钠和混合碱中滴入盐酸时,会先发生如下反应:
Na2CO3+HCl=NaHC O3+NaCl
先使全部的碳酸钠转变成碳酸氢钠,然后再发生反应:
NaHC O3+ HCl= Na Cl+ C O2↑+H2O
如果在第一个反应发生过程中滴入酚酞溶液,以盐酸滴定到无色,此时溶液中的碳酸钠仅被的滴定成碳酸氢钠,根据用去盐酸的量就可以算出碳酸钠的量。
然后在向溶液中加入甲基橙,用盐酸滴定至溶液由绿色滴定到亮黄色,此时溶液中的碳酸氢钠全部反应,根据盐酸的量可以算出总碱量,结合上一步算出的碳酸钠的量就可以算出该混合碱的组成。
三、实验器材
碱灰试样,酚酞指示剂,甲基橙, mol/L的盐酸,滴定管,锥形瓶(3个)
四、实验内容
i.实验步骤
1.准确称量 g的试样三份于锥形瓶中,加入50 mL蒸馏水,加入两滴酚酞指
示剂,溶液显红色。
2.用盐酸标准液滴定至无色,到达第一终点,记下用去盐酸的体积。
在滴定
过程中注意边滴变不断摇晃,以免局部酸浓度过大使碳酸钠直接和盐酸反应生成二氧化碳。
3.向溶液中加入两滴甲基橙,继续用盐酸滴定,直到溶液由黄色到橙色,记
下第二次用去盐酸的体积。
4.重复操作三次。
ii.数据处理
五、思考题
1.本实验用酚酞做指示剂时,所消耗的盐酸较用甲基橙少,为什么?
因为用酚酞做指示剂时只是盐酸和碳酸钠反应,而用甲基橙做指示剂时,是上一步反应完的生成的碳酸氢根和溶液中本身存在的碳酸氢根的和来反应,反应的比例又相同,所以第二次总会多一点。
2.在总碱量的计算式中,V有几种求法如果只要求测定总碱量,实验应该怎
样做
3.
V表示用去盐酸的总体积,可以直接读出来;如果只要求测定总碱量,只
需要用甲基橙做指示剂,滴定至橙色。
4.在测定一批烧碱或碱灰样品时,若分别出现V1<V2,V1=V2,V1>V2,V1=
0,V2=0的情况,说明样品的组成有什么差别?
5.
6.滴定管和移液管使用前均需要用操作溶液荡洗,而滴定用的烧杯或锥形瓶
为什么不能用待测液润洗?
因为滴定管的移液管要求里面的溶液的浓度一定要准确,所以要润洗,避免内壁的水珠对溶液的稀释;而烧杯或锥形瓶要求里面的总物质的量要准确,所以不可以润洗,避免液体挂在内壁上。
六、心得体会
我能说我已经没的写了吗每次都写滴定的,我都词穷了,不过,重复的事情,可以做,但你要做到不同的层次。
果然,我这次,又上了一个层次,我想摆脱老师的帮助,根据课本给出的东西,自己判断所有的东西,不是追着老师满实验室跑,哎,老师,这算没有颜色吗你自己决定喽。
老师接下来怎么办啊那个xxxx取多少啊看你自己的报告去。
老师果然是老师,早就开始费尽苦心想让孩子们独立,惭愧今天才悟到,唉。
自己做有点慢,会犯错,不过咱也不求快,咱也不怕错误,我总觉得错误只是偏离了既定的目标的事情,但它同时会通向另一个你不曾领略的神奇的地方,生活不也是这个理儿
吗?自己全程看到了一切,了解到了一切,是别人不能代替的,举个例子,叫老师帮你看,老师说,哦,我觉得到了,你就以为到终点了。
可我自己看的时候,我就知道,由于第一次做不知道,有没有对比,事实上我自己的第一个用纸垫在背后看的话是有点偏红的,很微小,后面几组我就慢慢滴,不断和前面对比,可以做的更好,而这种进步是别人帮你看代替不了的,你自己也不知到那组做的最好了。
咦我不是没的写了么。