化学方程式默写
- 格式:doc
- 大小:68.00 KB
- 文档页数:6

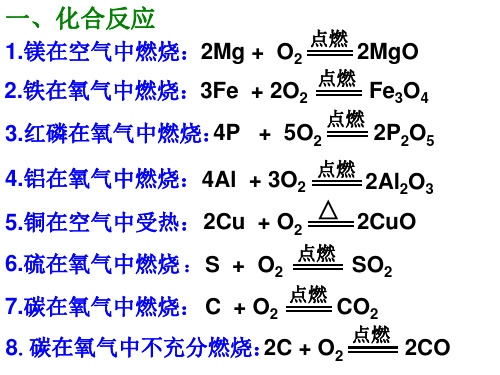
初中化学方程式大全化合反应1、镁在空气中燃烧2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、水蒸气通过灼热碳层:26、焦炭还原氧化铁:其他27.氢氧化钠溶液与硫酸铜溶液反应:28、甲烷在空气中燃烧:29、酒精在空气中燃烧:32、二氧化碳通过澄清石灰水(检验二氧化碳):33、氢氧化钠和二氧化碳反应(除去二氧化碳):34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):35、碳酸钠与浓盐酸反应(泡沫灭火器的原理)一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:二.几个分解反应:13. 水在直流电的作用下分解:14. 加热碱式碳酸铜:15. 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:21. 焦炭还原氧化铁:22. 焦炭还原四氧化三铁:25. 一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸27. 铁和稀硫酸28. 镁和稀硫酸29. 铝和稀硫酸30. 锌和稀盐酸31. 铁和稀盐酸32. 镁和稀盐酸33. 铝和稀盐酸⑵金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:35. 锌和硫酸铜溶液反应:36. 铜和硝酸汞溶液反应:⑶碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:38. 氧化铁和稀硫酸反应:39. 氧化铜和稀盐酸反应:40. 氧化铜和稀硫酸反应:41. 氧化镁和稀硫酸反应:42. 氧化钙和稀盐酸反应:⑷酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质44.苛性钠吸收二氧化硫气体45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:⑸酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53.氢氧化铝药物治疗胃酸过多:54.硫酸和烧碱反应:55.硫酸和氢氧化钾反应:56.硫酸和氢氧化铜反应:57.硫酸和氢氧化铁反应:58.硝酸和烧碱反应:⑹酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液反应:⑺碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:⑻盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:化学方程式反应现象应用剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹银白液、生成红色固体拉瓦锡实验红色金属变为黑色固体银白金属变为白色固体剧烈燃烧、火星四射、生成黑色固体、放热剧烈燃烧、白光、放热、使石灰水变浑浊剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属生成使带火星的木条复燃的气体实验室制备氧气紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验水通电分解为氢气和氧气电解水绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失有大量气泡产生、锌粒逐渐溶解实验室制备氢气有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性冶炼金属钨、利用氢气的还原性冶炼金属钼、利用氢气的还原性剧烈燃烧、黄色火焰离子化合物的形成、苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸蓝色沉淀生成、上部为澄清溶液质量守恒定律实验煤炉中常见反应、空气污染物之一、煤气中毒原因蓝色火焰煤气燃烧黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属冶炼金属冶炼金属碳酸使石蕊变红证明碳酸的酸性石蕊红色褪去澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁白色沉淀逐渐溶解溶洞的形成,石头的风化白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成产生使澄清石灰水变浑浊的气体小苏打蒸馒头工业制备二氧化碳和生石灰固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理固体逐渐溶解、有使澄清石灰水变浑浊的气体黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属冶炼金属原理冶炼金属原理冶炼金属原理醋酸与烧碱的反应甲醇的燃烧蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧银白色金属表面覆盖一层红色物质湿法炼铜、镀铜溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银青白色金属表面覆盖一层红色物质镀铜铁锈溶解、溶液呈黄色铁器除锈白色固体溶解白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解白色固体溶解白色固体溶解蓝色固体溶解白色固体溶解白色固体溶解胃舒平治疗胃酸过多红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2O生成白色沉淀、不溶解于稀硝酸检验Cl—的原理铁锈溶解、溶液呈黄色铁器除锈白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解2NaOH+H2SO4==Na2SO4+2H2O蓝色固体溶解白色固体溶解白色固体溶解红褐色沉淀溶解、溶液呈黄色生成白色沉淀、不溶解于稀硝酸检验SO42—的原理生成白色沉淀、不溶解于稀硝酸检验SO42—的原理生成白色沉淀、不溶解于稀硝酸检验SO42—的原理白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解白色固体溶解蓝色固体溶解白色固体溶解白色固体溶解红褐色沉淀溶解、溶液呈黄色吸收CO、O2、H2中的CO2处理硫酸工厂的尾气(SO2)溶液黄色褪去、有红褐色沉淀生成有白色沉淀生成溶液蓝色褪去、有蓝色沉淀生成白色块状固体变为粉末、生石灰制备石灰浆有白色沉淀生成初中一般不用有白色沉淀生成工业制烧碱、实验室制少量烧碱有白色沉淀生成有白色沉淀生成蓝色晶体变为白色粉末白色粉末变为蓝色检验物质中是否含有水白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子有白色沉淀生成有白色沉淀生成生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子生成使湿润石蕊试纸变蓝色的气体。


化学方程式大全一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:11.甲烷在空气中燃烧:12.酒精在空气中燃烧:二.几个分解反应:13.水在直流电的作用下分解:14.加热碱式碳酸铜:15.加热氯酸钾(有少量的二氧化锰):16.加热高锰酸钾:17.碳酸不稳定而分解:18.高温煅烧石灰石:三.几个氧化还原反应:19.氢气还原氧化铜:20.木炭还原氧化铜:21.焦炭还原氧化铁:22.焦炭还原四氧化三铁:23.一氧化碳还原氧化铜:24.一氧化碳还原氧化铁:25.一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸-------- 盐+氢气(置换反应)26.锌和稀硫酸27.铁和稀硫酸28.镁和稀硫酸29.铝和稀硫酸30.锌和稀盐酸31.铁和稀盐酸32.镁和稀盐酸33.铝和稀盐酸(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34.铁和硫酸铜溶液反应:35.锌和硫酸铜溶液反应:36.铜和硝酸汞溶液反应:(3)碱性氧化物+酸-------- 盐+水37.氧化铁和稀盐酸反应:38.氧化铁和稀硫酸反应:39.氧化铜和稀盐酸反应:40.氧化铜和稀硫酸反应:41.氧化镁和稀硫酸反应:42.氧化钙和稀盐酸反应:(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:44.苛性钠吸收二氧化硫气体:45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:(5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53.氢氧化铝药物治疗胃酸过多:54.硫酸和烧碱反应:55.硫酸和氢氧化钾反应:56.硫酸和氢氧化铜反应:57. 硫酸和氢氧化铁反应:58. 硝酸和烧碱反应:(6)酸+ 盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应:63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液反应:(7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:(8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:。

1.镁在空气中燃烧:_______________________________现象:发出耀眼白光,产生大量的热,生成白色粉末。
2.铁在氧气中燃烧:_______________________________现象:火星四射,产生大量的热,生成黑色固体。
3.铜在空气中受热:_______________________________现象:红色固体变黑。
4.氢气中空气中燃烧:_______________________________现象:发出淡蓝色火焰。
5.红磷在空气中燃烧:_______________________________现象:发出浓厚的白烟。
6.硫粉在空气中燃烧:_______________________________现象:发出明亮的蓝紫色火焰,生成有刺激性气味的气体。
7.碳在氧气中充分燃烧:______________________________现象:发出白光。
8.一氧化碳在氧气中燃烧:____________________________现象:发出蓝色火焰。
9.甲烷在空气中燃烧:_______________________________10.加热高锰酸钾:_______________________________11.高锰酸钾制氧:_______________________________反应类型:固固加热型12.过氧化氢分解反应:_______________________________反应类型:固液常温型气密性检查:橡皮管用止水夹夹住,往漏斗中加水,水柱不变,气密性良好。
13.水在直流电的作用下分解:__________________________注意事项:V正:V负=1:2(正氧负氢)m正:m负=8:1 14.生石灰溶于水:_______________________________现象:大量水汽产生,放出热量。
15.二氧化碳可溶于水:_______________________________现象:滴加紫色石蕊,试剂由紫变红。

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。

1.碳在氧气中完全燃烧:2.双氧水制氧气:3.铁与盐酸反应:4.盐酸除铁锈:5.中和胃酸:第二天1.碳在氧气中不完全燃烧:2.高锰酸钾制氧气:3.氢气还原氧化铜:4.铝与盐酸的反应:5.硫酸除铁锈:第三天1硫在氧气中燃烧火焰颜色(),在空气中燃烧火焰的颜色()化学方程式:2.氯酸钾制氧气:3.碳还原氧化铜:4.铁与硫酸的反应:5.盐酸与氢氧化钠:1.红磷在氧气中燃烧(测空气中氧气的含量):2.电解水:3.木碳还原氧化铁:4.熟石灰与硫酸的反应:5.铝与硫酸的反应:第五天1.氢气的燃烧:2.碳酸不稳定易分解:3.一氧化碳还原氧化铁4.铁与硫酸铜反应:5.氢氧化钠吸收二氧化碳:第六天1.铁丝在纯氧中燃烧:2.工业制二氧化碳:3.一氧化碳还原四氧化三铁:4.铝与硫酸铜反应:5.检验二氧化碳:1.镁条燃烧:2.碳还原二氧化碳(吸热反应):3.铜与硝酸银反应:4.氧化铜与硫酸放映:5.盐酸与硝酸银反应:第八天1.一氧化碳在氧气中燃烧:2.氧化汞受热分解:3.一氧化碳还原氧化铜(CO早到晚退,CuO迟到早退):4.锌与盐酸反应:5.氢氧化钠与二氧化硫反应:第九天1.铝在空气中形成氧化膜:2.实验室制氢气:3.氧化铜与氢氧化钠反应:4.碳酸钠与氢氧化钙反应(工业制氢氧化钠):5.氢氧化钠与三氧化硫反应:1.铜在空气中加热:2.泡沫灭火器原理(碳酸钠与盐酸的反应):3.镁与氯化铝反应:4.氢氧化钠与二氧化硅反应(碱溶液不能用玻璃塞):5.验证二氧化碳:第十一天1.二氧化碳溶于水:2.生石灰制熟石灰:3.氢气与氯气点燃制氯化氢:4.氢氧化钡与硫酸反应:5.甲烷燃烧:第十二天1.熟石灰与硫酸反应:2.配置波尔多液(氢氧化钙与硫酸铜):3.实验室制二氧化碳:4.硝酸银与盐酸反应:5.氢氧化钡与硫酸铜反应:第十三天1.氢氧化钡与硫酸铁反应:2.实验室制氧气(反应装置中塞棉花):3.实验室制二氧化碳:4.氢氧化钠与氯化铁:5.氯化铵与氢氧化钠:第十四天1.酒精燃烧:2.检验二氧化碳:3.盐酸除铁锈:4.一氧化碳还原氧化铁:5.铝与盐酸反应:第十五天1.生石灰制熟石灰:2.工业制二氧化碳:3.氯酸钾制氧气:4.铁与盐酸放:5.硫酸除铁锈:“”“”At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!。

人教版必修一化学方程式默写及答案【人教版必修一化学方程式默写及答案】本篇文章将为大家逐一列举人教版必修一化学中的方程式默写及其答案。
通过默写方程式,有助于加深对化学反应的理解与记忆,并为后续学习提供坚实的基础。
请各位同学准备好纸笔,跟随文章中的提示进行默写。
【单质与化合物】1. 氢气的制取:反应式: Zn + H2SO4 → ZnSO4 + H2↑答案: 锌 + 硫酸→ 硫酸锌 + 氢气↑2. 氧气的制取:反应式: 2KClO3 → 2KCl + 3O2↑答案: 氯酸钾→ 氯化钾 + 氧气↑3. 氮气的制取:反应式: Cu + 2HNO3 → Cu(NO3)2 + NO↑ + H2O答案: 铜 + 硝酸→ 硝酸铜 + 一氧化氮↑ + 水4. 二氧化碳的制取:反应式: CaCO3 → CaO + CO2↑答案: 碳酸钙→ 氧化钙 + 二氧化碳↑5. 硫化氢的制取:反应式: FeS + 2HCl → FeCl2 + H2S↑答案: 硫化铁 + 盐酸→ 氯化铁 + 硫化氢↑【化学方程式及配平】1. 酸碱反应方程式:反应式: H2SO4 + 2N aOH → Na2SO4 + 2H2O答案: 硫酸 + 氢氧化钠→ 硫酸钠 + 水2. 沉淀反应方程式:反应式: AgNO3 + NaCl → AgCl↓ + NaNO3答案: 硝酸银 + 氯化钠→ 氯化银↓ + 硝酸钠3. 酸化反应方程式:反应式: CO2 + H2O → H2CO3答案: 二氧化碳 + 水→ 碳酸酸4. 燃烧反应方程式:反应式: CH4 + 2O2 → CO2 + 2H2O答案: 甲烷 + 氧气→ 二氧化碳 + 水5. 加热反应方程式:反应式: 2HgO → 2Hg + O2↑答案: 氧化汞→ 汞 + 氧气↑【酸和碱】1. 简单酸的电离方程式:反应式: HCl + H2O → H3O+ + Cl-答案: 盐酸 + 水→ 氢氧离子 + 氯离子2. 碱的电离方程式:反应式: NaOH + H2O → Na+ + OH- + H2O答案: 氢氧化钠 + 水→ 钠离子 + 氢氧根离子 + 水3. 碱中金属氧化物:反应式: CaO + H2O → Ca(OH)2答案: 氧化钙 + 水→ 氢氧化钙4. 羧酸与碱的中和反应:反应式: CH3COOH + NaOH → CH3COONa + H2O答案: 乙酸 + 氢氧化钠→ 乙酸钠 + 水5. 化学方法区分酸、碱:反应式: NaCl + HNO3 → NaNO3 + HCl答案: 氯化钠 + 硝酸→ 硝酸钠 + 盐酸【氧化还原反应】1. 氧化反应方程式:反应式: 4NH3 + 5O2 → 4NO + 6H2O答案: 氨 + 氧气→ 一氧化氮 + 水2. 还原反应方程式:反应式: 2KMnO4 + 3H2C2O4 + 5H2SO4 → K2SO4 + 2MnSO4 + 10CO2 + 8H2O答案: 高锰酸钾 + 草酸 + 硫酸→ 硫酸钾 + 二氧化锰 + 二氧化碳+ 水3. 氧化还原反应判别:反应式: Zn + 2HCl → ZnCl2 + H2↑答案: 锌 + 盐酸→ 氯化锌 + 氢气↑4. 化学反应电位:反应式: Zn + CuSO4 → ZnSO4 + Cu答案: 锌 + 硫酸铜→ 硫酸锌 + 铜5. 氧化物和还原物的基本特点:反应式: 2CuO + C → 2Cu + CO2↑答案: 氧化铜 + 碳→ 铜 + 二氧化碳↑以上就是人教版必修一化学中方程式的默写及答案。

化学方程式默写(一)1.Cl2与水反应的离子方程式2.Cl2与NaOH反应的离子方程式3.工业制漂白粉的化学方程式4.实验室制Cl2的离子方程式5.酸性KMnO4与浓盐酸反应的离子方程式6.次氯酸见光分解的化学方程式7.漂白粉在空气中失效的化学方程式8.Cl2与FeCl2反应的离子方程式9.Cl2与KI反应的离子方程式10.Cl2与SO2反应的离子方程式11.KClO3与浓盐酸反应的离子方程式12.足量铁丝在Cl2中燃烧的化学方程式13.SiO2与HF反应的化学方程式14.SiO2与NaOH反应的离子方程式15.SiO2高温下与Na2CO3反应的化学方程式16.Na2SiO3与盐酸反应的离子方程式17.少量CO2与NaOH反应的离子方程式18.过量CO2与NaOH反应的离子方程式19.Na2SiO3溶液中通入足量CO2的离子方程式20.高纯硅的制备流程方程式(原料为SiO2、C、Cl2、H2):、、。
21.小苏打溶液中加入过量的澄清石灰水的离子方程式:。
化学方程式默写(二)1.SO2与CaO反应方程式2.少量SO2与NaOH反应的离子方程式3.少量SO2与澄清石灰水反应的离子方程式4.SO2与H2S反应的化学方程式5.SO2与FeCl3反应的离子方程式6.SO2与新制氯水反应的离子方程式7.SO2与酸性KMnO4反应的离子方程式8.SO2与碘水反应的离子方程式9.工业上用浓氨水处理硫酸工业尾气的化学方程式:、。
10.SO2的催化氧化方程式11.铜与浓硫酸反应的化学方程式12.碳与浓硫酸反应的化学方程式13.铜与双氧水、稀硫酸反应的离子方程式14.少量铁粉在加热条件下与浓硫酸反应的化学方程式:15.NaHSO4与Ba(OH)2反应后溶液呈中性的离子方程式:16.电解精炼铜阳极阴极17.钥匙镀锌阳极阴极化学方程式默写(三)1.N2与O2放电时的化学方程式2.NO与O2反应的化学方程式3.NO2溶于水的离子方程式4.Cu与浓HNO3反应的离子方程式5.Cu与稀HNO3反应的离子方程式6.少量铁粉与稀HNO3反应的离子方程式7.Fe2+与稀HNO3反应的离子方程式8.实验室制NH3的化学方程式9.NH3的工业制法10.NH3·H2O的电离方程式11.氨水受热分解方程式12.工业制硝酸的反应方程式:、、。

1. 镁在空气中燃烧:2. 镁在CO2中点燃:3 铁在氧气中燃烧:4 铜在空气中受热:5 铝在空气中燃烧6 . 氢气在空气中燃烧7 . 红磷在空气中燃烧:8 . 硫粉在空气中燃烧:9 碳在氧气中充分燃烧: . 不充分燃烧:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:13. 水在直流电的作用下分解:14 双氧水分解:15 加热碱式碳酸铜:16 .加热氯酸钾(有少量的二氧化锰):17 .加热高锰酸钾:18 .碳酸不稳定而分解:19 .高温煅烧石灰石:20 碳酸氢钠受热分解:。
21 碳酸氢铵受热分解:。
22 氢氧化铁加热分解:23 .氢气还原氧化铜:24 .木炭还原氧化铜25 .焦炭还原氧化铁:26 .焦炭还原四氧化三铁:27 .一氧化碳还原氧化铜:28 .一氧化碳还原氧化铁:29 .一氧化碳还原四氧化三铁:30 锌和稀硫酸31 .铁和稀硫酸32 .镁和稀硫酸33 .铝和稀硫酸34 .锌和稀盐酸35 .铁和稀盐酸36 .铝和稀盐酸37 .铁和硫酸铜溶液反应:38 .锌和硫酸铜溶液反应:39 .氧化铁和稀盐酸反应:40 .氧化铁和稀硫酸反应:41 氧化亚铁与硫酸:42 铝与硫酸:。
43 氧化铝与硫酸:。
.44 氧化铜和稀盐酸反应:45 .氧化铜和稀硫酸反应:46. 氧化镁和稀硫酸反应:47 .氧化钙和稀盐酸反应:48.苛性钠暴露在空气中变质:49.苛性钠吸收二氧化硫气体:50.苛性钠吸收三氧化硫气体:51.消石灰放在空气中变质:52. 消石灰吸收二氧化硫:53.盐酸和烧碱起反应:54 . .盐酸和氢氧化铜反应:55. 盐酸和氢氧化钙反应:56 . 盐酸和氢氧化铁反应:57 .氢氧化铝药物治疗胃酸过多:58 .硫酸和烧碱反应:59 .硫酸和氢氧化铜反应:61 . 硫酸和氢氧化铁反应:62 . 硝酸和烧碱反应:63.大理石与稀盐酸反应:64.碳酸钠与稀盐酸反应:65.碳酸镁与稀盐酸反应:66.盐酸和硝酸银溶液反应:67 .硫酸和碳酸钠反应:68 .硫酸和氯化钡溶液反应:69.氢氧化钠与硫酸铜:70 .氢氧化钠与氯化铁71 .氢氧化钠与氯化镁:72 . 氢氧化钠与氯化铜:73 . 氢氧化钙与碳酸钠:74.氯化钠溶液和硝酸银溶液:75.硫酸钠和氯化钡:76.二氧化碳溶解于水:77.生石灰溶于水:78.氧化钠溶于水:79.三氧化硫溶于水80 .硫酸铜晶体受热分解:81.无水硫酸铜作干燥剂:。

暑假作业(30)
一.默写化学方程式
1.碳在氧气中燃烧现象
2.硫在氧气中燃烧现象
3.磷在氧气中燃烧现象
4.铁在氧气中燃烧现象
5.鎂在氧气中燃烧现象
6.铝与氧气在常温下反应
7.铜在氧气中加热
8.实验室制氧气①
②
③
二.书写化学式
氯化钠:氯化钾:氯化氢:氯化银:氯化钙:
氯化镁:氯化钡:氯化锌:氯化铝:氯化铜:
氯化铁:氯化亚铁:硝酸钠:硝酸钾硝酸:
硝酸银:硝酸钙:硝酸镁:硝酸钡:硝酸锌
硝酸铝:硝酸铜:硝酸铁硝酸亚铁:硫酸钠
硫酸钾:硫酸:硫酸银:硫酸钙:硫酸镁:
硫酸钡:硫酸锌:硫酸铝:硫酸铜:硫酸铁:
硫酸亚铁碳酸钠碳酸钾:碳酸:碳酸银:
碳酸钙:碳酸镁:碳酸钡:碳酸锌:
碳酸铝:碳酸铜:碳酸铁:碳酸亚铁
氢氧化钠:氢氧化钾:氢氧化银:
氢氧化钙:氢氧化镁氢氧化钡:
氢氧化锌:氢氧化铝:氢氧化铜:氢氧化铁:氢氧化亚铁
氧化钠:氧化钾:氧化银:氧化钙:
氧化镁:氧化钡:氧化锌:氧化铝:
氧化铜:氧化铁:氧化亚铁
三.默写原子团
氢氧根离子碳酸根离子
硫酸根离子硝酸根离子
铵根离子磷酸根离子
氯酸根离子碳酸氢根离子
高锰酸根离子锰酸根离子。


酸的通性:①酸能与反应②酸+ →盐+盐酸和镁条反应:现象:硫酸和铁粉反应:现象:③酸+ →盐+ 水盐酸和氧化铜反应:现象:硫酸和铁锈反应:现象:④酸+ →+盐酸和氢氧化钠反应:硫酸和氢氧化钾反应:⑤酸+ 盐→+盐酸和大理石反应:现象:盐酸和硝酸银反应:现象:硫酸和氯化钡反应:现象:可溶性碱的通性:①可溶性碱能与反应②可溶性碱+ →盐+氢氧化钙和二氧化碳反应:现象:氢氧化钠和二氧化碳反应:氢氧化钠和二氧化硫反应:氢氧化钠和三氧化硫反应:氢氧化钠和二氧化硅反应:③可溶性碱+ →新碱+氢氧化钠和氯化铜反应:现象:氢氧化钠和氯化铁反应:现象:氢氧化钙和碳酸钠反应:现象:④所有碱+ →+氢氧化钙和盐酸反应:氢氧化铜和盐酸反应:现象:氢氧化铁和硫酸反应:现象:盐的性质:①盐+ →+盐酸和大理石反应:现象:盐酸和硝酸银反应:现象:硫酸和氯化钡反应:现象:②盐+ →+氢氧化钠和氯化铜反应:现象:氢氧化钠和氯化铁反应:现象:氢氧化钙和碳酸钠反应:现象:氢氧化钠和硫酸铵反应:现象:③盐+ →+氯化钠和硝酸银反应:现象:硫酸钠和氯化钡反应:现象:金属活动性顺序:(H)金属的性质:①金属+ →镁条在空气中燃烧:现象:铁生锈:现象:铁在氧气中燃烧:现象:铜在空气中加热:现象:②()金属+ →+ 氢气()和硫酸反应:()和硫酸反应:()和硫酸反应:()和硫酸反应:③()金属+ →+ ()金属铁和硫酸铜反应:现象:铜和硝酸银反应:现象:酸的通性:①酸能与 酸碱指示剂 反应②酸 + (活泼)金属 → 盐 + 氢气盐酸和镁条反应:↑+===+222H MgCl Mg HCl现象: 白色固体逐渐消失,产生气泡硫酸和铁粉反应:↑+===+2442H FeSO Fe SO H现象: 黑色粉末逐渐消失,产生气泡,溶液变浅绿色③酸 + 金属氧化物 → 盐 + 水盐酸和氧化铜反应:O H CuCl CuO HCl 222+===+现象: 黑色粉末逐渐消失,溶液变蓝色硫酸和铁锈反应:O H SO Fe O Fe SO H 234232423)(3+====+现象: 红色固体逐渐消失,溶液变黄色④酸 + 碱 → 盐 + 水盐酸和氢氧化钠反应:O H NaCl NaOH HCl 2+===+硫酸和氢氧化钾反应:O H SO K KOH SO H 2424222+===+⑤酸 + 盐 → 新酸 + 新盐盐酸和大理石反应:↑++===+22232CO O H CaCl CaCO HCl现象: 固体逐渐消失,产生气泡盐酸和硝酸银反应:↓+===+AgCl HNO AgNO HCl 33现象: 产生白色沉淀硫酸和氯化钡反应:↓+===+42422BaSO HCl BaCl SO H现象: 产生白色沉淀可溶性碱的通性:①可溶性碱能与 酸碱指示剂 反应②可溶性碱 + 非金属氧化物 → 盐 + 水氢氧化钙和二氧化碳反应:O H CaCO CO OH Ca 2322)(+↓===+现象: 溶液变浑浊/产生白色沉淀氢氧化钠和二氧化碳反应:O H CO Na CO NaOH 23222+===+氢氧化钠和二氧化硫反应:O H SO Na SO NaOH 23222+===+氢氧化钠和三氧化硫反应:O H SO Na SO NaOH 24232+===+氢氧化钠和二氧化硅反应:O H SiO Na SiO NaOH 23222+===+③可溶性碱 + 可溶性盐 → 新碱 + 新盐氢氧化钠和氯化铜反应:↓+===+22)(22OH Cu NaCl CuCl NaOH现象: 产生蓝色絮状沉淀氢氧化钠和氯化铁反应:↓+===+33)(33OH Fe NaCl FeCl NaOH现象: 产生红褐色沉淀氢氧化钙和碳酸钠反应:NaOH CaCO CO Na OH Ca 2)(3322+↓===+现象: 产生白色沉淀④所有碱 + 酸 → 盐 + 水氢氧化钙和盐酸反应:O H CaCl HCl OH Ca 22222)(+===+氢氧化铜和盐酸反应:O H CuCl HCl OH Cu 22222)(+===+现象: 蓝色固体消失,溶液变蓝色氢氧化铁和硫酸反应:O H SO Fe SO H OH Fe 23424236)(3)(2+===+现象: 红褐色固体消失,溶液变黄色盐的性质:①盐 + 酸 → 新盐 + 新酸盐酸和大理石反应:↑++===+22232CO O H CaCl CaCO HCl现象: 固体逐渐消失,产生气泡盐酸和硝酸银反应:↓+===+AgCl HNO AgNO HCl 33现象: 产生白色沉淀硫酸和氯化钡反应:↓+===+42422BaSO HCl BaCl SO H现象: 产生白色沉淀②盐 + 碱 → 新盐 + 新碱氢氧化钠和氯化铜反应:↓+===+22)(22OH Cu NaCl CuCl NaOH现象: 产生蓝色絮状沉淀氢氧化钠和氯化铁反应:↓+===+33)(33OH Fe NaCl FeCl NaOH现象: 产生红褐色沉淀氢氧化钙和碳酸钠反应:NaOH CaCO CO Na OH Ca 2)(3322+↓===+现象: 产生白色沉淀氢氧化钠和硫酸铵反应:↑++===+3242424222)(NH O H SO Na NaOH SO NH 现象: 产生刺激性气味的气体③盐 + 盐 → 新盐 + 新盐氯化钠和硝酸银反应:↓+===+AgCl NaNO AgNO NaCl 33现象: 产生白色沉淀硫酸钠和氯化钡反应:↓+===+42422BaSO NaCl BaCl SO Na现象: 产生白色沉淀金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H ) Cu Hg Ag Pt Au 金属的性质:①金属 + 氧气 → 金属氧化物 镁条在空气中燃烧:MgO O Mg 222点燃+现象: 发出耀眼的白光,生成白色固体铁生锈:322O Fe 23Fe 4===+O现象: 表面出现红褐色固体 铁在氧气中燃烧:432O Fe 2Fe 3点燃O +现象: 剧烈燃烧,放出大量热,火星四射,生成黑色固体 铜在空气中加热:O O Cu 2Cu 22∆+现象: 生成黑色固体②( 活泼 )金属 + 酸 → 盐 + 氢气( 镁 )和硫酸反应:↑+===+2442H H MgSO SO Mg( 铝 )和硫酸反应:↑+===+2342423)(H 32H SO Al SO Al( 锌 )和硫酸反应:↑+===+2442H Zn H ZnSO SO( 铁 )和硫酸反应:↑+===+2442H FeSO SO H Fe③( 较活泼 )金属 + 盐 → 新盐 + (较不活泼)金属铁和硫酸铜反应:Cu Cu 44+===+FeSO SO Fe现象: 红色固体析出,溶液变浅绿色铜和硝酸银反应:Ag NO 2)(Cu AgNO 2Cu 233+===+现象: 白色固体析出,溶液变蓝色。

(书写时对折)1.镁条燃烧2.电解水3.氢气燃烧/爆炸4.铜丝在空气中加热5.白磷或红磷燃烧6.甲烷燃烧(可燃冰燃烧的原理)7.乙炔充分燃烧8.实验室里用过氧化氢制取氧气(二氧化锰作催化剂)9.氧气充足时木炭充分燃烧10.氧气不充足时木炭不充分燃烧11.铁丝在氧气中燃烧,火星四射,生成___色固体12.高温煅烧石灰石(工业制CO2)____________________________________ 13.实验室用石灰石或大理石和稀盐酸制CO2____________________________________14.CO2与水反应(CO2使紫色石蕊试液变红的原因____________________________________ 15.碳酸不稳定分解____________________________________ 16.CO2使澄清的石灰石变浑浊____________________________________ 1.2Mg+O2=== 2MgO2.2H2O ===2 H2 ↑+O2↑3.2H2+O2 === 2H2O4.2Cu+O2===2 CuO5.4P + 5O2=== 2P2O56.CH4+2O2 CO2+2H2O7.2C2H2+5O2 4CO2+2H2O8.2H2O2 === 2H2O+O2↑9.C+O2 CO210.2C +O2 2CO11.3Fe+ 2O2=== Fe3O412.CaCO3CaO+CO2↑13.CaCO3+ 2HCl===CaCl2+H2O+CO2↑14.CO2+H2O=== H2CO315.H2CO3===H2O+ CO2↑16.CO2+Ca(OH)2=== CaCO3 ↓+ H2O 点燃通电△点燃MnO2点燃点燃酸专题1.锌和稀硫酸(实验室制氢气的反应)2. 锌和稀盐酸3.铁和稀硫酸(反应后溶液显色)4.铁和稀盐酸(反应后溶液显色)5.铝和稀硫酸6. 铝和稀盐酸7.镁和稀硫酸8. 镁和稀盐酸9. 氧化铁和稀盐酸(盐酸除铁锈,生成色溶液)10.氧化铁和稀硫酸(反应后溶液显色)11.氧化铜和稀盐酸(反应后溶液显色)12.氧化铜和稀硫酸(反应后溶液显色)13.氢氧化铝和盐酸(用氢氧化铝治疗胃酸过多症)14.氢氧化钙和硝酸(用熟石灰中和土壤中的硝酸)15.氢氧化钠和盐酸16.氢氧化钠和硫酸1.Zn+H2SO4=ZnS04+H2↑2.Zn+2HCl=ZnCl2+H2↑3. 浅绿色Fe+H2S04=FeS04+H2↑4. 浅绿色Fe+2HCl=FeCl2+H2↑5.2Al+3H2SO4=A12(S04)3十3H2↑6.2Al+6HCl=2AlCl3+3H2↑7.Mg+H2SO4=MgS04+H2↑8.Mg+2HCl=MgCl2+H2↑9. 黄色Fe23+6HCl=2FeCl3+3H210. 黄色Fe23+3H2S04= Fe2(S04)3+3H20 11. 蓝绿色CuO+2HCl= CuCl2+2H212. 蓝色CuO+H2SO4=CuSO4+H213.Al(OH)3+3HCl=AlCl3+3H2O14.Ca(OH)2+2HNO3=Ca(NO3)2+2H215.NaOH+HCl=NaCl+H216.2Na0H+H2S04=Na2SO4+2H217.氢氧化镁和盐酸(用盐酸清洗水壶中的水垢中的氢氧化镁)18.氢氧化铜和稀硫酸(蓝色沉淀溶于稀硫酸)19.氢氧化铜和稀盐酸(蓝色沉淀溶于稀盐酸)20.氢氧化铁和稀硫酸(红褐色沉淀溶于稀硫酸)21.氢氧化铁和稀盐酸(红褐色沉淀溶于稀盐酸)22.硝酸银和稀盐酸(检验稀盐酸中Cl-的原理)23.硝酸钡和稀硫酸(检验稀硫酸中SO42-的原理)24.氯化钡和稀硫酸25.碳酸钙和稀盐酸(实验室制C02)26.碳酸钡和稀盐酸27.碳酸钠与稀盐酸28.碳酸钠和稀硫酸写的时候,对折,把答案撕下来(右半栏),写左半栏,把三页左半栏订起来,写完后红笔对答案,家长在第一页签字。

初中化学方程式大全化合反应1、镁在空气中燃烧2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、水蒸气通过灼热碳层:26、焦炭还原氧化铁:其他27.氢氧化钠溶液与硫酸铜溶液反应:28、甲烷在空气中燃烧:29、酒精在空气中燃烧:30、一氧化碳还原氧化铜:31、一氧化碳还原氧化铁:32、二氧化碳通过澄清石灰水(检验二氧化碳):33、氢氧化钠和二氧化碳反应(除去二氧化碳):34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):35、碳酸钠与浓盐酸反应(泡沫灭火器的原理)一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:二.几个分解反应:13. 水在直流电的作用下分解:14. 加热碱式碳酸铜:15. 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:。

高中化学方程式纯默写work Information Technology Company.2020YEAR有机化学基础方程式一、烃1.甲烷烷烃通式:(1)氧化反应甲烷的燃烧:甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:二氯甲烷:三氯甲烷:四氯化碳:2.乙烯乙烯的制取:烯烃通式:(1)氧化反应乙烯的燃烧:乙烯可以使褪色,发生氧化反应。
(2)加成反应与溴水加成:与氢气加成:与氯化氢加成:与水加成:(3)聚合反应乙烯加聚,生成聚乙烯:3.乙炔乙炔的制取:(1)氧化反应乙炔的燃烧:乙炔可以使褪色,发生氧化反应。
(2)加成反应与溴水加成:与氢气加成:与氯化氢加成:(3)聚合反应氯乙烯加聚,得到聚氯乙烯:乙炔加聚,得到聚乙炔:4.苯苯的同系物通式:(1)氧化反应苯的燃烧:苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应①苯与溴反应②硝化反应(3)加成反应5.甲苯(1)氧化反应甲苯的燃烧:甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
6.溴乙烷(1)取代反应溴乙烷的水解:(2)消去反应溴乙烷与NaOH溶液反应:7.乙醇(1)与钠反应乙醇与钠反应:(2)氧化反应乙醇的燃烧:(3)消去反应乙醇在浓硫酸做催化剂的条件下,加热到170℃生成乙烯。
注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚。
8.苯酚苯酚是无色晶体,露置在空气中会因氧化显粉红色。
苯酚具有特殊的气味,熔点43℃,水中溶解度不大,易溶于有机溶剂。
苯酚有毒,是一种重要的化工原料。
(1)苯酚的酸性苯酚钠与CO2反应:(2)取代反应(3)显色反应苯酚能和FeCl3溶液反应,使溶液呈紫色。
9.乙醛乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。

初中化学方程式大全化合反应1、镁在空气中燃烧2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、水蒸气通过灼热碳层:26、焦炭还原氧化铁:其他27.氢氧化钠溶液与硫酸铜溶液反应:28、甲烷在空气中燃烧:29、酒精在空气中燃烧:32、二氧化碳通过澄清石灰水(检验二氧化碳):33、氢氧化钠和二氧化碳反应(除去二氧化碳):34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):35、碳酸钠与浓盐酸反应(泡沫灭火器的原理)一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:二.几个分解反应:13. 水在直流电的作用下分解:14. 加热碱式碳酸铜:15. 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:21. 焦炭还原氧化铁:22. 焦炭还原四氧化三铁:25. 一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸27. 铁和稀硫酸28. 镁和稀硫酸29. 铝和稀硫酸30. 锌和稀盐酸31. 铁和稀盐酸32. 镁和稀盐酸33. 铝和稀盐酸⑵金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:35. 锌和硫酸铜溶液反应:36. 铜和硝酸汞溶液反应:⑶碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:38. 氧化铁和稀硫酸反应:39. 氧化铜和稀盐酸反应:40. 氧化铜和稀硫酸反应:41. 氧化镁和稀硫酸反应:42. 氧化钙和稀盐酸反应:⑷酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质44.苛性钠吸收二氧化硫气体45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:⑸酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53.氢氧化铝药物治疗胃酸过多:54.硫酸和烧碱反应:55.硫酸和氢氧化钾反应:56.硫酸和氢氧化铜反应:57.硫酸和氢氧化铁反应:58.硝酸和烧碱反应:⑹酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液反应:⑺碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:⑻盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:化学方程式反应现象应用剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹银白液、生成红色固体拉瓦锡实验红色金属变为黑色固体银白金属变为白色固体剧烈燃烧、火星四射、生成黑色固体、放热剧烈燃烧、白光、放热、使石灰水变浑浊剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属生成使带火星的木条复燃的气体实验室制备氧气紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验水通电分解为氢气和氧气电解水绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失有大量气泡产生、锌粒逐渐溶解实验室制备氢气有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性冶炼金属钨、利用氢气的还原性冶炼金属钼、利用氢气的还原性剧烈燃烧、黄色火焰离子化合物的形成、苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸蓝色沉淀生成、上部为澄清溶液质量守恒定律实验煤炉中常见反应、空气污染物之一、煤气中毒原因蓝色火焰煤气燃烧黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属冶炼金属冶炼金属碳酸使石蕊变红证明碳酸的酸性石蕊红色褪去澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁白色沉淀逐渐溶解溶洞的形成,石头的风化白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成产生使澄清石灰水变浑浊的气体小苏打蒸馒头工业制备二氧化碳和生石灰固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理固体逐渐溶解、有使澄清石灰水变浑浊的气体黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属冶炼金属原理冶炼金属原理冶炼金属原理醋酸与烧碱的反应甲醇的燃烧蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧银白色金属表面覆盖一层红色物质湿法炼铜、镀铜溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银青白色金属表面覆盖一层红色物质镀铜铁锈溶解、溶液呈黄色铁器除锈白色固体溶解白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解白色固体溶解白色固体溶解蓝色固体溶解白色固体溶解白色固体溶解胃舒平治疗胃酸过多红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2O生成白色沉淀、不溶解于稀硝酸检验Cl—的原理铁锈溶解、溶液呈黄色铁器除锈白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解2NaOH+H2SO4==Na2SO4+2H2O蓝色固体溶解白色固体溶解白色固体溶解红褐色沉淀溶解、溶液呈黄色生成白色沉淀、不溶解于稀硝酸检验SO42—的原理生成白色沉淀、不溶解于稀硝酸检验SO42—的原理生成白色沉淀、不溶解于稀硝酸检验SO42—的原理白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解白色固体溶解蓝色固体溶解白色固体溶解白色固体溶解红褐色沉淀溶解、溶液呈黄色吸收CO、O2、H2中的CO2处理硫酸工厂的尾气(SO2)溶液黄色褪去、有红褐色沉淀生成有白色沉淀生成溶液蓝色褪去、有蓝色沉淀生成白色块状固体变为粉末、生石灰制备石灰浆有白色沉淀生成初中一般不用有白色沉淀生成工业制烧碱、实验室制少量烧碱有白色沉淀生成有白色沉淀生成蓝色晶体变为白色粉末白色粉末变为蓝色检验物质中是否含有水白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子有白色沉淀生成有白色沉淀生成生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子生成使湿润石蕊试纸变蓝色的气体。

钠的化合物的反应方程式的默写一、氧化钠(化学式与物理性质) 1.氧化钠与水反应化学方程式离子方程式2.氧化钠与二氧化碳的反应化学方程式3.氧化钠与稀硫酸的反应化学方程式离子方程式二、过氧化钠(化学式、俗称与物理性质)4.过氧化钠与水反应化学方程式离子方程式5.过氧化钠与二氧化碳的反应化学方程式6.过氧化钠与稀盐酸的反应化学方程式离子方程式三、氢氧化钠(化学式与物理性质)碱的通性:a:b:碱+酸=盐+水化学方程式c:化学方程式d:化学方程式四、碳酸钠(化学式、俗称与物理性质)7.向碳酸钠中逐滴加入稀盐酸化学方程式a:b:离子方程式a:b:8.向盐酸中加入碳酸钠溶液化学方程式离子方程式9.向碳酸钠溶液中通入二氧化碳的反应化学方程式离子方程式10.碳酸钠与氢氧化钙的反应化学方程式离子方程式五、碳酸氢钠(化学式、俗称与物理性质)9.碳酸氢钠与盐酸的反应化学方程式离子方程式10.碳酸氢钠固体受热分解化学方程式11.碳酸氢钠与氢氧化钠的反应化学方程式离子方程式12.碳酸氢钠与少量氢氧化钙的反应化学方程式离子方程式13.碳酸氢钠与过量氢氧化钙的反应化学方程式离子方程式14.氢氧化钠与少量二氧化碳的反应化学方程式离子方程式15.氢氧化钠与过量二氧化碳的反应化学方程式离子方程式16.十水合碳酸钠的风化化学方程式铝及其化合物的化学方程式与离子方程式一、铝1、铝在氧气中燃烧:;2、铝在氯气中燃烧:;3、铝与硫共热:;4、铝与稀硫酸反应:;5、铝与氢氧化钠溶液反应:;6、铝与浓硫酸共热:;7、铝与浓硝酸共热:;8、铝与稀硝酸反应:;9、铝与硝酸银溶液反应:;10、铝与硫酸铜溶液反应:;11、铝与氧化铁高温下反应:;12、铝与四氧化三铁高温共热:;13、铝与氧化铜高温共热:;14、铝与二氧化锰高温共热:;二、氧化铝1、氧化铝与稀硫酸反应:;2、氧化铝与氢氧化钠溶液反应:;3、电解氧化铝的熔融液:;三、氢氧化铝1、氢氧化铝与稀硫酸反应:2、氢氧化铝与氢氧化钠溶液反应:;3、加热氢氧化铝:;四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:;2、硫酸铝的水溶液呈酸性:;3、硫酸铝溶液中加入少量的氢氧化钠溶液:;4、向硫酸铝溶液中加足量的氢氧化钠溶液;5、向硫酸铝溶液中加入少量的氢氧化钡溶液:;6、向硫酸铝溶液中加入足量的氢氧化钡溶液:;7、向明矾溶液中加入少量的氢氧化钡溶液:;8、向明矾溶液中加入足量的氢氧化钡溶液:;9、向硫酸铝溶液中加入氨水:;10、向硫酸铝溶液中加入碳酸钠溶液:;11、向硫酸铝溶液中加入碳酸氢钠溶液:;12、向硫酸铝溶液中加入硫化钠溶液:;13、向硫酸铝溶液中加入硫氢化钠溶液:;14、向硫酸铝溶液中加入硅酸钠溶液:;15、向硫酸铝溶液中加入偏铝酸钠溶液:;五、偏铝酸钠1、偏铝酸钠溶液呈碱性:;2、偏铝酸钠溶液滴入少量盐酸:;3、向偏铝酸钠溶液加入足量盐酸:;4、向偏铝酸钠溶液通入少量二氧化碳气体:;5、向偏铝酸钠溶液通入足量二氧化碳气体:;6、向偏铝酸钠溶液中加入硫酸铝溶液:;7、向偏铝酸钠溶液中加入氯化铵溶液:;8、向偏铝酸钠溶液中加入氯化铁溶液:;铁及其化合物化学方程式及离子方程式1、铁与非金属单质反应:(1) Fe在纯O2中燃烧:化学方程式:;(2) Fe与S的反应:化学方程式:;(3) Fe与Cl2点燃:化学方程式:;(4) Fe与I2的反应:化学方程式:;2、铁与水反应:(1)与水蒸汽反应:化学方程式:;(2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。

化合反应1、碳在氧气中燃烧:C + O点燃CO22、硫在空气中燃烧:S + O点燃SO23、磷在空气中燃烧:4P + 5O点燃2P2O54、铁在氧气中燃烧:3Fe + 2O点燃Fe3O45、镁在空气中燃烧:2Mg + O点燃2MgO6、铝在空气中燃烧:4Al + 3O点燃2Al2O37、钠在氯气中燃烧:2Na + Cl点燃2NaCl8、氢气在空气中燃烧:2H2 + O点燃2H2O9、氢气在氯气中燃烧:H2 + Cl点燃2HCl分解反应10、水通电分解:2H2O通电2H2↑+ O2↑11、过氧化氢制取氧气:2H2O2 MnO2 2H2O + O2↑12、氯酸钾制取氧气:2KClO32KCl + 3O2↑13、高锰酸钾制取氧气:2KMnO4 △K2MnO4+ MnO2 + O2↑14、氧化汞加热:2HgO △ 2Hg + O2↑置换反应15、铁与硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu16、氢气与氧化铜反应:H2 + CuO △ Cu + H2O17、石灰石与稀盐酸反应:CaCO3+ 2HCl === CaCl2 + H2O + CO2↑18、碳酸钠与浓盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑19、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 === Cu(OH)2↓+ Na2SO420、二氧化碳与澄清石灰水反应:CO2 + Ca(OH)2 ==== CaCO3↓+ H2O化合反应1、碳在氧气中燃烧:2、硫在空气中燃烧:3、磷在空气中燃烧:4、铁在氧气中燃烧:5、镁在空气中燃烧:6、铝在空气中燃烧:7、钠在氯气中燃烧:8、氢气在空气中燃烧:9、氢气在氯气中燃烧:分解反应10、水通电分解:11、过氧化氢制取氧气:12、氯酸钾制取氧气:13、高锰酸钾制取氧气:14、氧化汞加热:置换反应15、铁与硫酸铜溶液反应:16、氢气与氧化铜反应:17、石灰石与稀盐酸反应:18、碳酸钠与浓盐酸反应:19、氢氧化钠溶液与硫酸铜溶液反应:20、二氧化碳与澄清石灰水反应:化合反应1、碳在氧气中燃烧:2、硫在空气中燃烧:3、磷在空气中燃烧:4、铁在氧气中燃烧:5、镁在空气中燃烧:6、铝在空气中燃烧:7、钠在氯气中燃烧:8、氢气在空气中燃烧:9、氢气在氯气中燃烧:分解反应10、水通电分解:11、过氧化氢制取氧气:12、氯酸钾制取氧气:13、高锰酸钾制取氧气:14、氧化汞加热:置换反应15、铁与硫酸铜溶液反应:16、氢气与氧化铜反应:17、石灰石与稀盐酸反应:18、碳酸钠与浓盐酸反应:19、氢氧化钠溶液与硫酸铜溶液反应:20、二氧化碳与澄清石灰水反应:。
化学方程式默写
氯
1.电解饱和食盐水制氯气(氯碱工业):
离子方程式:
2.实验室制氯气:
离子方程式:
3.铁与氯气的反应:
4.工业制漂白粉原理:
5.写出漂白粉的有效成分,其漂白原理为:
6.漂白粉久置空气中如何失效,用两个化学方程式表示:
7.从海水中提取溴和从海带中提取碘的主要反应原理(用离子方程式表示)
8.用AgNO3检验溴离子和碘离子(离子方程式)
钠
9.钠与水反应:
离子方程式:
10.电解熔融的氯化钠:
11.钠与O2的反应(两个):
12.过氧化钠分别与水,二氧化碳反应:
13.碳酸钠和碳酸氢钠的相互转化:
14.候德榜制碱原理:
15.澄清石灰水中通入足量的二氧化碳:
镁
16.镁提取中涉及的三个主要方程式(用离子方程式表示)
17.镁在氮气中燃烧:
18.镁在二氧化碳中燃烧:
铝
19.氧化铝的两性(与H+和OH-离子方程式):
20.氢氧化铝的两性(与H+和OH-离子方程式):
21.明矾如何净水:
22.铝与强碱溶液反应(离子方程式):
23.铝热反应(Fe2O3):
24.AlCl3溶液中加入少量NaOH溶液(离子方程式): AlCl3溶液中加入足量NaOH溶液(离子方程式): AlCl3溶液中加入足量氨水(离子方程式): 25.偏铝酸钠溶液中滴加少量HCl(离子方程式): 偏铝酸钠溶液中滴加过量HCl(离子方程式): 偏铝酸钠溶液中通入过量CO2(离子方程式):
26.铁在氯气中燃烧:
27.铁在硫蒸气中燃烧:
28.Fe2O3与HCl(方程式和离子方程式):
29.Fe3O4与HCl(方程式和离子方程式):
30.高炉炼铁主要原理:
31. FeCl2与NaOH溶液(离子方程式)
产物进一步氧化方程式:
32.FeCl2与Cl2反应的方程式:
FeCl2与Cl2反应的离子方程式:
33. FeSO4 + KMnO4+ H2SO4 ==== k2 SO4+ Mn SO4+ Fe2(SO4)3+ H2O
离子方程式:
34. FeSO4+ H2O2+ H2SO4==== Fe2(SO4)3+ H2O
离子方程式:
35. FeCl3+ SO2+ H2O=== FeCl2+ H2SO4+ HCl
离子方程式:
36.Fe3+的检验:滴加KSCN溶液,溶液立即变为血红色。
离子方程式:
37.FeCl3与Fe反应方程式:
离子方程式:
38.FeCl3腐蚀铜制作电路板反应方程式:
离子方程式:
39.铜在氯气中燃烧:
40.铜和氧气加热:
41.铜与硫共热:
42.铜与浓硫酸共热:
43.铜与浓硝酸反应:
离子方程式:
44.铜与稀硝酸反应:
离子方程式:
硅
45.SiO2与CaO高温反应:
46.SiO2与NaOH反应:
47.SiO2与HF反应:
48.工业上制硅三步反应:
49.工业上制玻璃的主要反应
Na2CO3与SiO2高温反应:
CaCO3与SiO2高温反应:
50.CO2通入Na2SiO3溶液中:
硫51.少量SO2通入NaOH溶液中:
离子方程式:
52.过量SO2通入NaOH溶液中:
离子方程式:
53.SO2可以使氯水褪色(SO2还原性):
离子方程式:
54.SO2与H 2O2反应方程式(SO2还原性):
55.H2S与SO2反应(SO2氧化性):
56.工业制取硫酸三步
第一步(沸腾炉):
第二步(接触室):
第三步(吸收塔):
56.Cu与浓H2SO4反应:
57.C与浓H2SO4反应:
58.工业上合成氨的反应原理(人工固氮):
59.“雷雨发庄稼”三步反应(自然固氮)
60.实验室制氨气原理:
61.氨气催化氧化:
62.硝酸见光分解:
63.NH4HCO3受热分解:
64.Cu与浓HNO3反应:
离子方程式:
65.Cu与稀HNO3反应:
离子方程式:
66.C与浓HNO3反应:
有机化学
1.乙烯水化法制乙醇:
2.乙醇催化氧化制乙醛:
3.乙醛催化氧化制乙酸:
4.乙酸乙酯的制备:
5.聚乙烯制备:
6.蔗糖水解方程式:
7.淀粉(纤维素)水解方程式:
8.葡萄糖体内氧化方程式:
9.阿司匹林水解方程式:
10.氨基酸官能团
名称:结构简式:
名称:结构简式:11.油脂水解产物:、。