关于螯合剂的总结(一)2015-9-21
- 格式:docx
- 大小:82.69 KB
- 文档页数:4

常用螯合剂螯合剂是一类能与金属离子形成稳定络合物的化合物。
螯合剂可以通过给予金属离子一个或多个配体上的电子对来形成配位键。
常用的螯合剂有以下几种。
1. 乙二胺四乙酸(EDTA)乙二胺四乙酸(EDTA)是一种多功能螯合剂,广泛用于化学分析和工业生产中。
它能与多种金属离子形成稳定的络合物,并能有效螯合和去除金属离子,起到去污和稳定作用。
EDTA还可用作破坏细胞壁、抑制酶活性等方面的实验试剂。
2. 氰化物(CN-)氰化物(CN-)是一种强碱性的螯合剂,它能与金属离子形成氰化物络合物。
氰化物络合物通常具有较高的稳定性和溶解度,在金属提取和电镀等领域有广泛应用。
然而,氰化物具有强毒性和致命性,需在使用时小心操作,避免接触和吸入。
3. 亚硝酸盐(NO2-)亚硝酸盐(NO2-)也是一种常用的螯合剂,它能与金属离子形成亚硝酸盐络合物。
亚硝酸盐络合物通常具有较高的稳定性和溶解度,广泛用于水处理、金属腐蚀抑制和环境污染治理等领域。
亚硝酸盐还可用作爆炸物和药物的原料。
4. 有机酸有机酸是一类含有羧基的有机化合物,它们可以与金属离子形成稳定的络合物。
常用的有机酸螯合剂包括乙酸、苯甲酸、柠檬酸等。
有机酸络合物在食品、化妆品和医药等领域有广泛应用,可以起到抗氧化、保存、稳定等作用。
5. 胺类化合物胺类化合物是一类含有氮原子的有机化合物,它们可以与金属离子形成稳定的络合物。
常用的胺类螯合剂包括乙二胺、三乙矿、二乙矿等。
胺类螯合剂在化学分析、金属提取和催化反应等领域有广泛应用,可以提高反应的选择性和效率。
螯合剂在化学、生物和环境科学等领域发挥着重要作用。
通过与金属离子形成稳定络合物,螯合剂可以改变金属的性质和行为,扩展其应用范围。
不同的螯合剂适用于不同的金属离子和应用领域,选择合适的螯合剂可以提高实验和生产的效果。
然而,在使用螯合剂时,需要注意其毒性和环境影响,并遵循安全操作规程,以确保实验和生产的安全性和可持续性。



螯合剂制备方法-概述说明以及解释1.引言1.1 概述螯合剂是一种能够与金属离子结合形成配合物的化合物。
由于其特殊的结构和性质,螯合剂在许多领域中被广泛应用,如化学分析、催化剂、药物、环境保护等。
螯合剂的制备方法是研究者们关注的重点之一,因为制备方法的不同将直接影响到螯合剂的性能和应用范围。
本文将对螯合剂制备方法进行系统的总结和分析,以期为相关研究者提供参考和借鉴。
首先,我们将从螯合剂的定义和作用出发,探讨螯合剂在金属离子配位化学中的重要性和应用领域。
接着,我们将对螯合剂制备方法进行分类,从不同的角度出发,对各种制备方法进行详细介绍和分析。
最后,我们将总结各种螯合剂制备方法的优缺点,并展望未来可能出现的新方法和发展方向。
通过本文的阐述和总结,相信读者们能够对螯合剂制备方法有更深入的了解,并在实践中能够选择合适的制备方法来满足不同的需求。
同时,本文也希望能够为相关领域的研究者提供一些启示和思路,促进螯合剂制备方法的进一步发展和创新。
在不断探索和努力中,相信螯合剂制备方法将不断完善和拓展,为更广泛的应用领域提供更多可能性和机遇。
文章结构部分的内容可以从以下几个方面展开:1.2 文章结构在本篇文章中,将首先对螯合剂进行概述,包括其定义和作用。
接着,将介绍螯合剂制备方法的分类,以及分析不同方法的优缺点。
随后,将详细介绍三种常见螯合剂制备方法,包括方法的原理、步骤和适用范围等方面的内容。
最后,将在结论部分对螯合剂的制备方法进行总结,概述各种方法的优缺点,并对未来螯合剂制备方法的发展进行展望。
最终,文章将给出本次研究的结论。
通过上述文章结构的设置,读者能够清晰地了解本篇文章的组织结构和内容安排。
此外,该结构还能帮助读者系统地学习和掌握螯合剂制备方法的相关知识,并对螯合剂的制备方法有更深入的了解。
1.3 目的本文的目的是探讨螯合剂制备方法,总结螯合剂制备方法的优缺点,并展望未来螯合剂制备方法的发展方向。
螯合剂作为广泛应用于化学分析、环境修复、医药制剂等领域的重要化合物,其制备方法的研究具有重要的理论和应用价值。

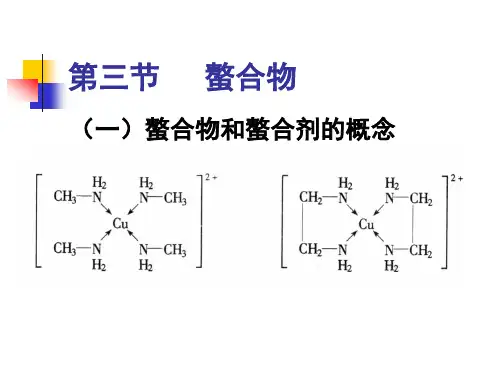
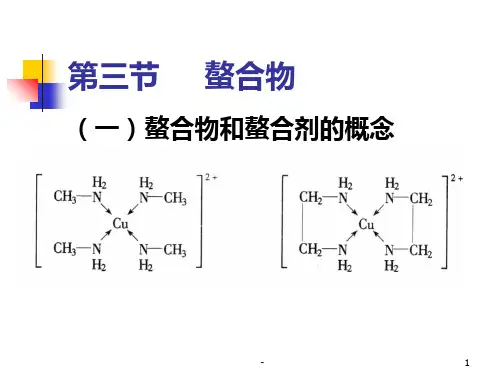
螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(A TMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。

螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA )及其盐等。
如:EDTA的4个酸和2个胺(一NRR )的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP )、氨基三亚甲基膦酸(ATMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。

常用螯合剂1. 什么是螯合剂?螯合剂是一种能够与金属离子形成稳定络合物的化合物。
它们通常含有多个配体基团,这些基团可以通过配位键与金属离子结合。
螯合剂的主要作用是增强金属离子的稳定性和溶解度,并改变其化学性质。
2. 螯合剂的分类根据配体基团的性质和数量,螯合剂可以分为不同的类别:•单齿螯合剂:只有一个配体基团与金属离子形成配位键。
•多齿螯合剂:含有多个配体基团,可以形成多个配位键。
•菁环类螯合剂:由大环结构组成,能够通过π-π堆积与金属离子相互作用。
•线性多齿螯合剂:含有一系列线性排列的配体基团。
•多功能螯合剂:除了与金属离子形成络合物外,还具有其他功能。
3. 常见的螯合剂3.1 EDTA(乙二胺四乙酸)EDTA是一种六齿螯合剂,由乙二胺和四乙酸形成。
它可以与多种金属离子形成稳定的络合物。
EDTA的络合能力非常强,可以与钙、镁、铁等金属离子形成稳定的络合物,从而起到螯合剂的作用。
3.2 DTPA(二氨三丙酸)DTPA是一种五齿螯合剂,由二氨和三丙酸形成。
它与金属离子形成络合物的能力比较强,特别适用于配位数为六的过渡金属离子。
3.3 NTA(N,N-乙二胺四乙酸)NTA是一种四齿螯合剂,由N,N-乙二胺和四乙酸组成。
它可以与多种金属离子形成络合物,并且具有良好的水溶性。
3.4 Phthalocyanine(菲菜纳)Phthalocyanine是一种菁环类螯合剂,由苯并二氮杂菲和金属离子组成。
它具有良好的光电性能和化学稳定性,在催化、电化学和光学领域有广泛应用。
3.5 Crown ether(冠醚)Crown ether是一种多齿螯合剂,由多个环状结构组成。
它可以与金属离子形成稳定的络合物,并且在配位化学和分离技术中有重要应用。
4. 螯合剂的应用螯合剂在许多领域都有广泛的应用,包括:4.1 化学分析螯合剂可以与金属离子形成络合物,从而提高其溶解度和稳定性。
这使得它们在化学分析中起到重要作用,例如配位滴定、离子选择电极等。

螯合剂螯合剂又名络合剂,是一种能和重金属离子发生螯合作用形成稳定的水溶性络合物,而使重金属离子钝化的有机或无机化合物。
这种化合物的分子中含有能与重金属离子发生配位结合的电子给予体,故有软化、去垢、防锈、稳定、增效等一系列特殊作用。
印染工艺中常见的螯合剂有以下几种:(1)磷酸盐类:主要有三聚磷酸钠、多聚磷酸钠、六偏磷酸钠、焦磷酸钠等。
此类螯合剂因有离子交换能力,是最早用于印染工业的水质软化剂,焦磷酸钠可与三价铁离子形成络合离子,故可用于双氧水稳定剂中。
但无机磷酸盐在一些地区已被禁用。
(2)氨基羧酸类:主要有乙二胺四乙酸’(ED—TA),即软水剂B;氮川三乙酸(NTA),即软水剂A。
此外还有二乙撑三胺五乙酸(DTPA)、N一羟乙基乙胺三乙酸(HEDTA)、乙二醇一双一(B一氨基乙醚)一N,N一四乙酸(EGTA)等。
氨基羧酸型螯合剂的配位体是氮原子和带负电荷的羧酸根离子(COO—)。
其配位体数目越多,与金属离子的络合作用越强。
其中DTPA和大多数金属离子络合作用最强,其次是EDTA和HEDTA,NTA最差。
其中DTPA 作为双氧水稳定剂效果最好。
但NTA、EDTA、DTPA等因螯合金属后生物降解性极差,近年来欧洲一些国家已严禁使用。
(3)有机膦酸型类:主要有氨基三亚甲基膦酸(A TMP)、1一羟乙叉一1,1一二膦酸(HEDP)、乙二胺四甲叉膦酸(EDTMP)、二乙烯三胺五甲叉膦酸(DTPMP)、氨基三甲叉膦酸(ATP)等。
此类螯合剂具有使污垢分散、悬浮的能力,在高温下不易水解,对防止产生锅垢效果优良,亦可作锅炉清洗剂。
DTPMP是一种比DTPA效果更好的双氧水稳定剂,DTPA 只是在有硅酸钠存在下,对Ca、Mg盐有较好稳定作用,而DTPMP在不加硅酸钠条件下,也能对双氧水起稳定作用。
这类螯合剂既有较好的螯合、除垢作用,又易于被生物降解,目前使用较多。
(4)羟基羧酸类:主要有葡萄糖酸、聚丙烯酸(PAA)、马来酸(MAO)等。

螯合剂的作用原理1. 螯合剂的定义和分类螯合剂是一类具有多个配位位点的化合物,能够与金属离子形成稳定的配合物。
螯合剂通常具有较高的亲和力,可以选择性地与特定金属离子结合。
根据其配位原子数目,螯合剂可以分为双齿螯合剂、多齿螯合剂和多环螯合剂等。
2. 配位键的形成螯合剂与金属离子之间的结合是通过配位键形成的。
配位键是由一个或多个配体中的一个或多个非共价电子对与金属离子中未被占据的轨道相互作用而形成的。
这种相互作用可以通过共价键、离子键或范德华力来实现。
3. 配位数和络合度一个金属离子与一个或多个配体形成络合物时,金属离子周围所存在的配位位置数目称为其配位数。
具有不同配位数的金属离子对应不同类型的络合物。
而一个金属离子与一个或多个薄弱结构化学键相连时,所形成的络合物称为其络合度。
4. 螯合剂的作用机制螯合剂通过与金属离子形成稳定的络合物,改变了金属离子的化学性质和生物活性。
下面将从以下几个方面详细解释螯合剂的作用机制。
4.1 形成稳定络合物螯合剂与金属离子形成稳定的络合物,可以通过多个配位位点与金属离子形成多个配位键,从而增强配位键的稳定性。
这种稳定性使得金属离子能够在更宽的pH范围内存在,并且不易被其他分子或离子取代。
4.2 改变金属离子的溶解度螯合剂可以与难溶于水的金属离子结合,形成溶解度较高的络合物。
这种络合物具有较好的水溶性,使得原本不易溶解于水中的金属离子能够更容易地被水分散和溶解。
4.3 提高药物活性和选择性螯合剂可以与药物分子结合,形成能够更有效地传递药物到目标组织或细胞的络合物。
螯合剂还可以通过与金属离子结合,改变药物分子的结构和性质,从而提高药物的活性和选择性。
4.4 促进催化反应螯合剂与金属离子形成络合物后,可以改变金属离子的电子结构和配位环境,从而影响催化反应的速率和选择性。
螯合剂可以作为辅助基团参与反应机理中的中间步骤,加速反应速率。
4.5 降低毒性某些金属离子在生物体内具有毒性,而螯合剂能够与这些金属离子形成稳定的络合物,降低其毒性。
螯合剂使用方法1. 螯合剂的概念螯合剂是一类能够与金属离子或原子形成配位键的化合物,通过配位键稳定金属离子,并改变其化学性质和生物活性。
螯合剂的使用方法涉及到选择合适的螯合剂、配位条件以及应用领域。
2. 螯合剂的选择选择适当的螯合剂是确保螯合反应成功的关键。
在选择螯合剂时,需要考虑以下几个方面:2.1 金属离子的性质不同的金属离子具有不同的性质,包括电荷、配位数、尺寸等。
根据金属离子的性质,选择合适的螯合剂进行配位。
2.2 螯合剂的配位方式螯合剂可以通过多个配位点与金属离子配位,形成可以稳定金属离子的配位团。
根据不同的配位方式,选择适当的螯合剂。
2.3 反应条件不同的螯合反应需要不同的反应条件,包括温度、溶剂、pH值等。
选择符合反应条件的螯合剂。
2.4 应用需求根据不同的应用需求,选择特定的螯合剂。
例如,在医药领域中,选择具有良好生物相容性和药物释放性能的螯合剂。
3. 螯合剂的配位条件螯合剂的配位条件是指螯合反应进行的必要条件,其中包括溶剂、温度、pH值等方面。
不同的螯合剂配位条件会有所差异,但一般都要满足以下几个基本条件:3.1 溶剂选择选择适当的溶剂进行螯合反应,使得螯合剂和金属离子能够在溶液中充分混合。
3.2 温度控制根据螯合反应的需要,控制反应的温度。
温度的选择要考虑螯合剂和金属离子的稳定性。
3.3 pH值调节pH值对螯合反应具有重要影响。
通过调节pH值,可以使反应达到最佳条件。
3.4 配位反应时间不同的螯合反应需要不同的反应时间,需要根据具体情况进行调整。
长时间的反应有助于形成稳定的配合物。
4. 螯合剂的应用领域螯合剂在多个领域都有广泛的应用,包括医药、环境保护、材料科学等。
4.1 医药应用螯合剂在医药领域中常用于制备金属螯合物药物。
金属螯合物药物具有特殊的生物活性和药理学性质,可用于治疗肿瘤、炎症等疾病。
4.2 环境保护螯合剂在环境保护中有重要的应用,主要用于金属离子的去除和稳定。
例如,可以利用螯合剂去除水中的重金属离子,减少对环境的污染。
螯合剂种类螯合剂是一种化学物质,可以与金属离子形成稳定的络合物,从而改善金属离子的稳定性、降低金属离子的毒性或增加金属的可溶性。
螯合剂可以广泛应用于医学、农业和工业等领域。
以下是常用的螯合剂种类:1. EDTA(乙二胺四乙酸)EDTA是一种常用的螯合剂,能够络合和稳定多种金属离子,如钙、镁、锰、铁、铜和锌等元素。
EDTA还可以用于垃圾处理和水处理等领域。
2. DTPA(二异丙基三胺五乙酸)DTPA是一种能够络合稀土元素和铁离子的螯合剂,广泛应用于农业和医学领域。
它还可以用于石油开采、污水处理和金属清洗等工业领域。
3. EGTA(四乙二胺四乙酸)EGTA是一种专门用于螯合钙离子的螯合剂,可以被用来研究细胞内的钙离子通路。
EGTA也被应用于医学领域,如心脏手术中的心脏停跳。
4. CDTA(半胱氨酸)CDTA是一种钙螯合剂,能够在中性条件下络合和稳定钙离子。
它可以用于处理含有钙的污水,增强防腐剂的稳定性,以及帮助染料的溶解等领域。
5. NTA(乙二胺四乙酸)NTA是一种可以络合和稳定铁、锰、铜、镍和钴等金属离子的螯合剂。
NTA在医学领域已经被用于治疗重金属中毒。
6. 1,10-菲啰啉1,10-菲啰啉可以络合和稳定铁、钴、镍、铜和锌等金属离子,广泛应用于电池制造、染料制造和金属清洗等工业领域。
7. HEEDTA(羟乙基乙二胺三乙酸)HEEDTA是一种具有高螯合能力的螯合剂,可以络合稀土金属、铁和锰等金属离子。
HEEDTA在化妆品制造中被用作防腐剂。
8. EDDHA(乙二胺二(羟基苯甲酸))EDDHA是一种钙螯合剂,能够提高土壤中铁的可溶性,增加植物根系对铁的吸收率。
EDDHA广泛应用于农业领域,用于防治铁缺乏症和改善植物生长。
9. IDA(亚硝基二乙酸)IDA是一种用于治疗缺铁性贫血的药物,它能够将铁离子转移进入人体细胞,从而增加血红蛋白的合成。
10. DFO(除铁胺)DFO是一种用于治疗铁过载症的药物,能够络合和稳定体内的自由铁离子,改善铁过量引起的神经系统损害。
螯合剂
一、产品性能:
螯合剂主要成分为乙二胺四乙酸钠与稳定剂配合而成的液体高效络合剂。
能与各种金属螯合成盐,在工业上,主要用于水处理剂,以防止水中钙、镁、锰等金属离子带来的各种麻烦问题。
螯合剂进行化学清洁剂使用,可除去氧化铁、垢类等物质。
二、质量指标:主要成分符合GB13171401-1998.
三、应用范围与使用方法:
①螯合剂可用于工业水处理剂。
防止钙、镁、铁等金属离子
的不冷溶性盐类的析出。
②化学清洁。
对金属表面进行清洁,除去钙、镁的垢质及氧
化铁垢等难溶物。
③纸浆工业。
在打浆机中加入螯合剂,完全清除存在于纤维
中的金属离子,增加纸的白度,防止硬度组分结垢。
根据水中钙、镁等阳离子浓度来确定具体用量,工业水处理剂使用时一般为20~40g/吨水。
四、包装与贮存:
本品采用25kg塑料桶包装。
贮存于阴凉通风、防潮、防晒、防冻,远离火源,贮存期半年。
螯合剂
螯合剂是能与多价金属离子结合形成可溶性金属络合物的一类化合物,螯合剂在各领域中都有应用。
在水质处理中作水质软化剂,防止和脱除水垢;用于食品中,消除易引起有害氧化作用的金属离子;用于纺织工业的漂煮、加脂、漂白、染色、整理;用于化妆品作澄清处理;也用于农业,金属精加工,化学反应过程的控制,化学品提纯,稀土元素分离,清除放射性物质污染,发酵反应控制,也用于抗生素和药物的生产和成品,木材制纸浆的过氧化物漂白加工等。
理想的螯合剂应具有如下条件:①在较宽的pH值范围内都能可靠有效的与多价金属离子生成稳定的络合物;②稳定性好,不受普通强酸、强碱或溶剂影响;③与其他助剂相容性好,不挥发,不迁移;
④无毒,安全;⑤价格便宜。
因螯合剂能提高食品的质量和稳定性而被列为重要的食品添加剂。
如与抗氧化剂共用,可防止油脂的氧化;保持维生素稳定,保持乳制品风味,防止食品褪色,使肉类制品中钙、活化凝结失活,用于饮料可防止涌沫和葡萄酒混浊等。
食品用螯合剂总数近30种,常用的有:醋酸钙,氯化钙,柠檬酸及其钙、钾、钠盐及三乙酯二胺四乙酸的二钠及二钠钙盐,葡糖酸的钙、钠盐,磷酸及其一钙、一钾、二钾盐,酸式焦磷酸钠,偏磷酸钠,硫酸钠钙,葡糖酸-δ-内酯,氧化硬脂精等,二醋酸一钠,酒石酸及其钾钠盐、钠盐,硫代酸钠,山梨糖醇等。
螯合剂种类什么是螯合剂?螯合剂是一类能够与金属离子形成稳定配合物的化合物。
它们通过形成共价键或离子键与金属离子结合,从而阻止金属离子发生化学反应或沉淀。
螯合剂可以被广泛应用于许多领域,包括医药、环境保护、工业加工等。
不同种类的螯合剂具有不同的特性,因此在实际应用中需要根据具体情况选择合适的螯合剂。
有机螯合剂有机螯合剂是一类主要由有机化合物构成的螯合剂。
由于有机螯合剂具有良好的溶解性和可选择性,它们在药物设计和水处理领域得到了广泛应用。
α-胎盘素α-胎盘素是一种最常用的有机螯合剂之一。
它具有与许多金属离子结合的能力,包括铁、铝、钙等。
α-胎盘素可以在医药领域用于治疗铁缺乏性贫血,同时也被用作工业废水处理剂。
β-环糊精β-环糊精是另一种常用的有机螯合剂。
它是一种大环多糖,可以与一些金属离子如氢氧化铁结合形成稳定的配合物。
β-环糊精在环境污染治理中起到了重要的作用,可以用来去除废水中的重金属离子。
EDTAEDTA,即乙二胺四乙酸,是一种广泛使用的有机螯合剂。
它可以与多种金属离子形成稳定的配合物,并用于许多不同的应用领域,如医药、食品工业、水处理等。
EDTA在医药领域被广泛用于螯合金离子,从而增强药物的稳定性和生物利用度。
无机螯合剂无机螯合剂主要由无机化合物构成,它们具有较高的化学稳定性和选择性,因此在某些特定的应用中表现出较好的性能。
氨四乙酸氨四乙酸是一种常见的无机螯合剂,也称为乙二胺四乙酸。
它可以与多种金属离子形成稳定的四个配位键,并且具有较好的溶解性。
氨四乙酸广泛应用于工业生产过程中,可以用于除垢、阻垢剂以及金属离子的稳定剂。
硫酸钠硫酸钠是一种无机螯合剂,常用于纸浆和纸张工业中的漂白过程。
它可以与一些金属离子形成络合物,从而降低金属离子对纸张的影响。
硫酸钠在漂白工艺中具有较好的稳定性和选择性。
酒石酸酒石酸是一种天然无机螯合剂,广泛存在于葡萄酒和葡萄酒渣中。
酒石酸可以与一些金属离子结合形成络合物,从而影响葡萄酒的质量和稳定性。
螯合剂的化学性质具有环状结构的配位化合物。
其稳定性高于组成和结构相近的非螯合物。
可以是中性分子(又称内络盐,innercomplexsalt),例如二氧基乙酸合铜;也可以是带电荷的离子,例如二乙二胺合铜离子。
由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键原子各出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原子提供空轨道形成的。
为了区别把共价键用“一”表示,如H.+.H=H:H(H—H),配位键用“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在化学生产过程中有着重要用途。
制浆专用螯合剂TMA-52对金属离子具有极强的捕捉能力和分散效果。
能与钙、镁、铅、锌、铁、铬等多种多价金属离子在相当宽的pH值范围内发生螯合作用,形成较稳定的水溶性络合物。
从而防止金属离子在纸浆漂白过程中引起的反应沉淀结垢、漂白剂无效分解、纸浆返黄等不良后果。
同时具有保护纸浆纤维,增加漂白液分散性的效果。
关于螯合剂的总结(一)螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
原理:螯合剂可以与土壤溶液中的重金属离子结合,从而改变重金属在土壤中的存在形态,使重金属由不溶态转化为可溶态,大大活化土壤中的重金属,为土壤淋洗或植物的吸收创造有利条件。
异位淋洗技术运用采矿与选矿的原理,将污染土壤挖掘、运输到指定地点后,将其与淋洗液按比例混合投加到淋洗反应器中,在一定条件下,经过研磨、搅拌,通过物理与化学方式使污染土壤和淋洗液发生作用,待淋洗液将土壤污染物萃取出后,再将清洁的土壤分离出来,回填、安全利用或作深度处理,淋洗废液经过处理后排放或再次用于淋洗步骤中,污染物质可焚化或填埋。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团,用作螯合剂的这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
螯合金属种类及能力EDTA(乙二胺四乙酸):对大部分重金属(特别是针对Pb、Cd、Cu、和Zn)都具有很强的络合能力,同时能处理多种类型的土壤,EDTA对Pb的活化能力最强。
EDTA 在24h、pH7、0.1mol•L-1条件下对重金属污染土壤的去除率最大,分别为Pb 34.78%、Cd89.14%、Cu 14.96%和Zn 45.14%。
EDTA溶液能在比较广泛的酸度范围内(3~8)对Cu 和Pb进行有效的淋洗。
DTPA(二乙三胺五三乙酸):DTPA与EDTA一样对重金属污染土壤具有强螯合用。
HEDTA(羟乙基替乙二胺三乙酸):它最突出的优点是在碱性溶液中(pH=8-11)中能够与Fe3+形成稳定的鳌合盐,亦能与稀土金属形成稳定的鳌合物EGTA (乙二醇双四乙酸):EDDHA (乙二胺二乙酸):CDTA (环已烷二胺四乙酸):S, S-EDDS(S, S-乙二胺二琥珀酸):生物螯合剂EDDS与过渡金属具有螯合作用,能被生物降解,其生物毒性(包括对植物和土壤微生物的毒性)均低于EDTA,但是其对重金属Pb和Cd的螯合能力不如EDTA。
NTA(二乙基三乙酸):柠檬酸:处理U污染的土壤,Cd(对Cd的提取率较低),PbNa2EDTA(0.2%w/w):处理Pb柠檬酸钠(0.2%w/w):处理Pb,提取Cd的效率大小依次为EDTA>DTPA>NTA>柠檬酸螯合能力大小比较对Pb的活化强弱顺序为EDTA>HEDTA>DTPA>EGTA>EDDHA。
提取Cu、Pb的大小顺序DTPA>EDTA>NTA,提取Zn的大小顺序为EDTA>DTPA>NTA对Cd的提取效率大小:EDTA>DTPA>NTA>柠檬酸;诱导Pb在豌豆(P. sativum L.cv. Sparkle)和玉米(Z. mays L. cv. Fiesta)中的积累的能力的大小:EDTA > HEDTA > DTPA >EGTA > EDDHA;诱导Pb在大白菜(B. capa)茎叶中的能力的大小:EDTA >HEDTA > DTPA;以EDTA和DTPA对Pb的吸收影响效果最大;EDTA对湿地植物积累Cu、Zn、Cd的诱导要高于DTPA。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(ATMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。
如:HEDP是一个五元酸,在水中可电离出5个氢离子,电离后形成5个配位氧原子,可以和Ca2+、Mg2+、Fe2+、Fe3+、Cu2+、Zn2+、Al3+形成稳定的螯合物。
特点:化学稳定性好,不易水解,能耐较高温度,适合双氧水热漂,虽然在制备过程中涉及甲醛,但如经妥善处理可达标。
因为膦酸酯通过亚甲基相连,而C-P的键能为246 kJ/mol,离解能达1 387 kJ/mol,比较牢固,因此很难使单体磷进入水体中造成富营养化。
1.23聚羧酸有聚丙烯酸(PAA)、聚甲基丙烯酸、水解聚马来酸酐(HPMA)、富马酸(反丁烯二酸)—丙烯磺酸共聚体。
它们含有的聚合阴离子都是金属离子的优良螯合剂,因此也被用作阻垢剂。
特点:聚羧酸分子中有大量羧酸存在,羧基氧原子具有形成配位键的能力,具有良好的胶体性能和分散作用,耐碱,但其络合能力较弱,因此须将其进行共聚或改性以改善性能。
1.24含巯基(-SH)的螯合剂利用巯基中S原子与重金属离子有较强结合性能。
如:含二硫代羧基或二硫代氨基的盐、2-羟甲基-4-巯基苯硫酚制成的钠盐、含—CSS-的螫合剂HMCA、四硫代联氧基甲酸TBA)等。
(文献1、24、27、28、29、30)1.2.5席夫碱又称西弗碱,指的是含亚胺或甲亚胺(-RC=N)的一类有机化合物,席夫碱是由胺和活性羰基反应生成,常用于螯合主族和过渡金属元素。
天然高分子材料如淀粉作为载体,与含有氨基的配体反应生成的西弗碱螯合重金属离子后,会形成多配位络合物,固载化了的席夫碱,不仅能使配合物稳定性变强,载体的稳定性也发生了很大的改变。
常用于在工农业生产中净化含重金属离子的废水。
1.3天然改性高分子捕集剂按其来源,可分为淀粉类、纤维素类、植物胶类和聚多糖类。
重金属捕集剂(又叫重金属螯合剂)是指含有配位原子如N、S、O、P 等,可以与重金属离子以配位键相连接,生成稳定螯合物的一类化合物。
2.行业中较有前景的螯合剂2.1土壤重金属污染修复修复重金属污染的土壤时,研究及应用较多的螯合剂主要是羧酸型螯合剂。
研究最多的为乙二胺二琥珀酸(EDDS)。
EDDS能够与过渡金属、放射性核素等形成稳定的螯合体,具有极强的螯合能力,但是EDDS人工合成的成本高,并且有研究表明,EDDS对污泥中Cu、Zn、Cd和Pb具有不同的活化作用,尤其是活化Cd、Pb的能力远低于EDTA。
谷氨酸N,N-二乙酸四钠(GLDA)具有较强金属螯合能力,是新一代生物可降解绿色螯合剂GLDA在螯合能力上与EDTA的效率相当。
在实际应用方面,已在诸如自动洗碗机清洁剂、杀菌剂增效、蔗糖炼制厂除垢中取得一些进展与成果。
GLDA用于修复土壤中重金属已有报道。
GLDA在诱导植物修复重金属污染土壤特别是Cd和Zn污染土壤时具有很大的潜潜力。
2.2污水处理重金属捕集剂对于废水的处理研究较多,用于电镀、采矿、黄铜冶炼等工业废水中重金属离子的去,主要研究有金属捕集剂处理含镍、铬、铜、锌、汞等废水。
研究较多的有DTC 类2.3洗涤行业L-GLDA(谷氨酸N,N- 二乙酸(或谷氨酸二乙酸四钠))为基础的Dissolvine GL绿色替代产品很有前景。
甲基甘氨酸二乙酸,英文名Methylglycine-N,Ndiaceticacid,简称MGDA。
是氨基羧酸型,属于小分子螯合剂,结构类似于NTA,易于生物降解,且无毒。
因此,引起了洗涤行业的关注。
2.3印染工业印染工业使用的螯合剂主要有:无机聚磷酸盐、氨基羧酸型螯合剂、羟基羧酸型螯合剂、有机磷酸盐、聚羧酸型螯合剂。
螯合剂在印染中主要是做阻垢剂。
有机膦酸盐类螯合剂是印染行业很具前景的螯合剂。
此外,根据文献资料,一种新型的氨基多羧酸螯合剂亚氨基二琥珀酸(IDS)逐渐受到印染工业的重视,IDS有很强的螯合过渡金属离子的能力和良好的降解性。
IDS可以用于石油化工、纺织工业、化妆品、医药、土壤中重金属污染物的萃取、纸浆的漂白、水泥和石膏阻滞剂以及洗涤剂。
3.表面活性剂表面活性剂去除土壤中重金属离子的作用机制是通过改变土壤的表面性质或吸附到土壤颗粒表面,再经过离子交换作用或与金属离子发生配合反应,使金属转移到土壤溶液中。
表面活性剂淋洗重金属污染土壤主要是通过降低体系的表面张力而直接与土壤接触,当表面活性剂浓度超过临界胶束浓度时,会在内部形成胶团而达到去除重金属的目的。
研究中用到的表面活性剂:十二烷基硫酸钠(SDS)、鼠李糖脂(RL2)、聚氧乙烯失水山梨醇单油酸酯(TW80)、聚乙二醇辛基酚基醚(TX100)、环糊精。
4.思路:改性淀粉重金属捕集剂(1)天然高分子捕集剂的众多研究方向中,淀粉改性捕集剂的研究开发最引人注目。
淀粉不仅资源广,价格低廉,产物完全可以被生物降解,在自然界形成良性循环,而且与其它高分子改性捕集剂相比,它的水溶性良好,更适合作重金属捕集剂。
采用天然生物高分子材料淀粉作为载体,对其氧化改性后,与有吸附功能的小分子反应生成螯合树脂。
可将含N、O、S的配位基团引入到淀粉上。
改性淀粉重金属捕集剂主要有:淀粉黄原酸酯、淀粉磷酸酯、羧甲基淀粉、丙烯酰胺改性淀粉、氨基淀粉、DTC改性淀粉等。
(2)含有S原子的重金属捕集剂去除废水重金属离子效果最好。
因为含有S原子的官能团通常具有软碱特征,而大多数的有毒的重金属都属于软酸或者交界酸,因此含有S原子的重金属捕集剂与软酸型重金属离子趋向形成更加稳定的配位键,且可以提高去除重金属离子的选择性。
含S原子的重金属捕集剂,俗称有机硫重金属捕集剂,按螯合的有效官能团的种类可以分为DTC类(二硫代氨基甲酸盐类)、黄原酸类、TMT类(三巯三嗪三钠类)和STC 类(三硫代碳酸钠类)。