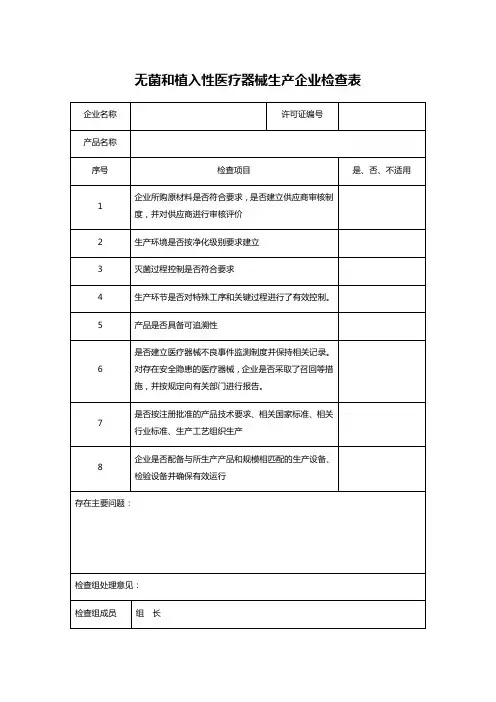
无菌植入类医疗器械检查表
- 格式:doc
- 大小:18.50 KB
- 文档页数:2

医疗器械使用安全检查表1. 检查器械外观
- 是否有明显损坏或破损?
- 是否有锈迹或腐蚀迹象?
- 是否有松动的零件或卡住的按钮/开关?
2. 检查电力和电源
- 是否接通电源?
- 是否有线缆或插头的破损?
- 是否有电源线松动或未正确接地?
3. 检查操作面板和控制
- 是否所有按键和开关都正常工作?
- 是否所有显示屏都正常显示和清晰可读?
- 是否有异常噪音或震动?
- 是否有异常热量散发?
4. 检查安全保护装置
- 是否所有安全保护装置都正常工作?
- 是否有缺失的保护装置或磨损的部件?
5. 检查设备清洁和消毒
- 是否设备表面清洁?
- 是否设备内部清洁?
- 是否设备已经消毒并符合相关卫生要求?
6. 检查设备配件和附件
- 是否设备配件齐全?
- 是否配件和附件有明显损坏或破损?7. 检查设备使用说明书和标签
- 是否有设备使用说明书?
- 是否设备标签清晰可读并与设备相匹配?
8. 检查设备的维修和校准记录
- 是否设备的维修和校准记录完整?
- 是否有过不合格的维修记录?
9. 检查设备相关许可证和认证
- 是否设备相关许可证和认证有效?
- 是否有过期或无效的许可证或认证?
---
此安全检查表旨在确保医疗器械的正常使用和安全性,以保护患者和医护人员的身体健康。
根据实际情况填写并定期进行检查,如有异常情况,请及时通知维修部门或专业人员进行修理或更换。

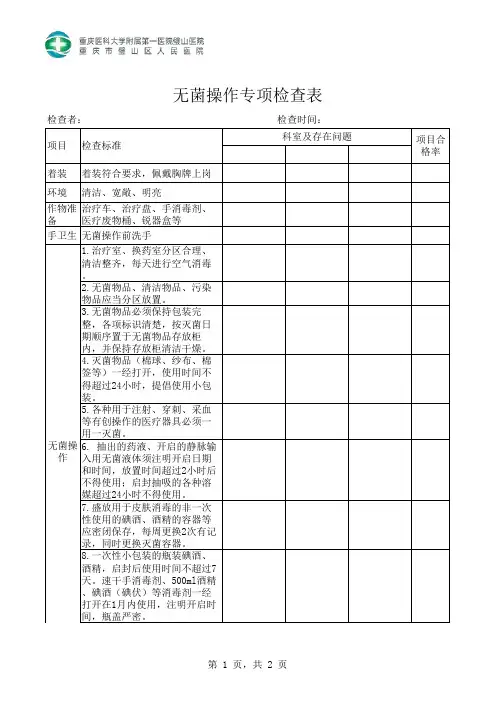

医疗器械安全检查表1. 背景医疗器械是医疗机构中必不可少的工具,而其安全性直接影响患者的生命和健康。
为确保医疗器械的正常运行和使用安全,需要定期进行检查和维护。
本文档提供一份医疗器械安全检查表,旨在帮助医疗机构进行全面的器械安全检查,发现并解决可能存在的安全隐患。
2. 医疗器械安全检查表以下是一份医疗器械安全检查表,供医疗机构使用。
根据实际情况,可以进行适当的修改和补充。
A. 器械基本信息- 器械名称:- 型号:- 出厂编号:- 使用地点:- 上次检查日期:B. 外观检查- 外观是否完整:- 是否有明显损坏或磨损:- 是否有松动的零部件:- 是否有危险的边缘、尖锐或锐利物品:- 是否有生锈现象:C. 电气安全检查- 是否有电气元件暴露在外:- 是否有电气绝缘破损:- 是否有导线松动或接触不良:- 是否有电气设备过载:- 是否有漏电或短路现象:D. 功能检查- 是否能够正常启动和关闭:- 是否有异常噪音或振动:- 是否有异常的气味:- 是否有过热现象:- 是否能够正常工作:E. 清洁和消毒- 是否清洁:- 是否已消毒:- 是否有粘附物:F. 使用指南- 是否有清晰的使用指南:- 是否提供了正确的操作步骤:- 是否提供了安全警示:G. 维护记录- 维护日期:- 维护内容:- 员工签名:3. 使用说明- 根据实际情况,对每一项进行勾选或填写。
- 如有异常情况出现,及时进行维修和报告。
- 检查完成后,及时更新维护记录,并由相关人员签字确认。
4. 总结医疗器械安全检查是医疗机构安全管理的重要环节,通过定期进行全面的安全检查,可以及早发现问题并采取相应措施,保障患者和医务人员的安全。
希望本文档能为医疗机构提供一份简易易用的医疗器械安全检查表,以提高医疗器械的安全性和可靠性。
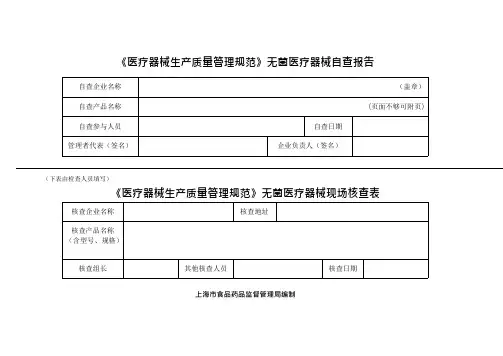
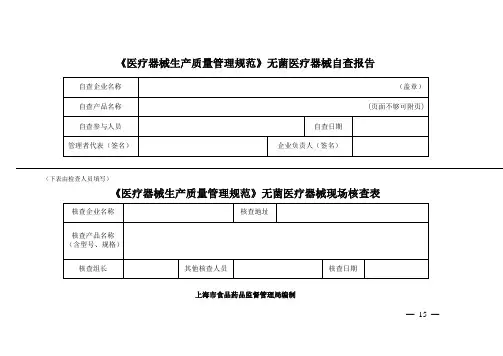
《医疗器械生产质量管理规范》无菌医疗器械自查报告(下表由检查人员填写)《医疗器械生产质量管理规范》无菌医疗器械现场核查表上海市食品药品监督管理局编制— 15—说明:按照《医疗器械生产质量管理规范》及其附录的要求,为了提高企业对质量管理体系自我检查的能力,统一检查标准,制定本自查报告以供参考。
企业在申请质量管理体系核查之前,应按照本报告要求进行全面自查,并按要求逐项填写。
1.企业可以根据申请核查医疗器械的特点、范围、要求,确定相应的检查条款和内容。
对“不适用条款”应当说明“不适用的理由”。
核查组予以确认。
2.对自查结果的填写,要求描写可核查的事实。
对于只填写“是”“符合”的,可以作为资料不全退回补充。
3.企业承诺对自查情况的真实性负责,并愿意承担任何由于失实而引起的法律后果。
自查结果汇总:本次自查关键项目(标识“*”项)条;其中不合格条,是否已经整改:是□否□部分整改□。
本次自查一般项目(未标识“*”项)条;其中不合格条,是否已经整改:是□否□部分整改□。
企业对自查不合格情况已经完成整改,可以附书面整改报告或资料,这些资料可作为认同企业自查报告的附件。
— 16—医疗器械生产质量管理规范— 17—— 18—— 19—— 20—— 21—— 22—— 23—— 24—— 25—— 26—— 27—— 28—— 29—— 30—— 31—— 32—— 33—— 34—— 35—— 36—— 37—— 38—— 39—— 40—— 41—— 42—— 43—— 44—— 45—— 46—— 47—— 48—— 49—— 50—— 51—— 52—— 53—— 54—— 55—。
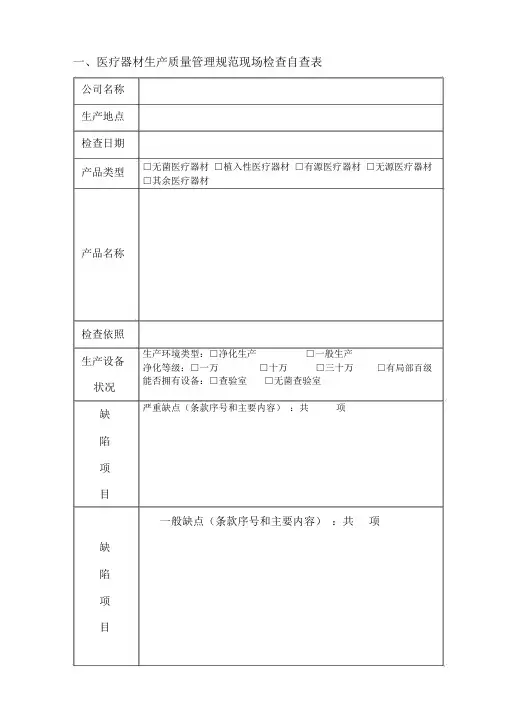
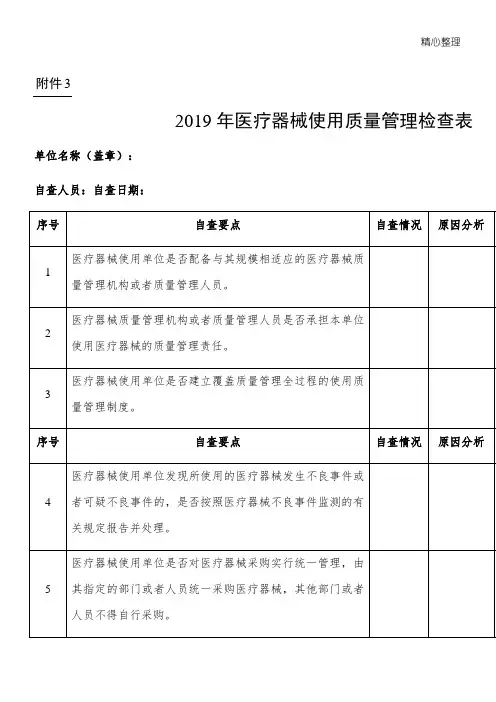
一、医疗器材生产质量管理规范现场检查自查表公司名称生产地点检查日期产品类型产品名称检查依照生产设备状况缺陷项目□无菌医疗器材□植入性医疗器材□有源医疗器材□无源医疗器材□其余医疗器材生产环境类型:□净化生产□一般生产净化等级:□一万□十万□三十万□有局部百级能否拥有设备:□查验室□无菌查验室严重缺点(条款序号和主要内容):共项一般缺点(条款序号和主要内容):共项缺陷项目条款序号和主要内容:不合用检查项目检查项目标准项不合用项缺点数缺点备注目数百分率现场检查要点项目结果统计一般项目总项目检查组对企业质量管理系统的整体评论建议:□经过检查□整顿后复查□未经过检查检查组成员署名日期组员组长察看员备注二、检查项目条款检查内容检查记录评论0401能否成立了与公司目标相适应的质量管理机构。
能否用文件的形式明确规定了质量管理机0402构各职能部门和人员的职责和权限,以及相互交流的关系。
*0403生产管理部门和质量管理部门负责人能否没有相互兼任。
质量管理部门能否拥有独立性,能否能独立*0404履行保持公司质量管理系统正常运转和保证产质量量切合性的职能。
公司负责人能否组织拟订了质量目标,目标0501能否表示了在质量方面所有的企图和方向并形成了文件,联合 2303 检查进行评论。
公司负责人能否组织拟订了质量目标,在产品形成的各个层次长进行了分解,质量目标0502能否可丈量,可评估的。
能否把目标变换成可实现的方法或程序,联合2304检查进行评论。
能否装备了与公司目标和质量目标、质量目0503标相适应,能知足质量管理系统运转和生产管理的需要的人力资源、基础设备和工作环境。
检查公司所装备资源切合要求的记录。
能否拟订了进行管理评审的程序言件,拟订0504了按期进行管理评审的工作计划,并保持了管理评审的记录。
由管理评审所惹起的质量系统的改良获取实行并保持。
有关法律、法例能否规定有专人或部门收0505集,在公司能否获取有效贯彻实行。
一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表1 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 2 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 3 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 4 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 5 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 6 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 7 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 8 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 9 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 10 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-1811 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 12 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 13 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 14 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 15 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 16 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 17 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 18 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 19 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 20 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 21 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 22 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 23 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 24 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 25 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 26 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 27 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 28 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 29 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 31 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 32 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 33 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 34 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 35 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 36 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 37 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 38 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 39 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 40 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 41 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 42 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 43 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 44 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 45 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 46 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 47 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 48 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 49 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 50 / 63一次性使用无菌医疗器械产品(注、输器具)生产实施细则检查表 2014-11-18 51 / 63。