初中酸碱盐溶解度表
- 格式:doc
- 大小:215.00 KB
- 文档页数:3

说明: “一”表示那种物质不存在或遇到水就分解了。
“无”、“白”表示该物质在溶液中的颜色。
注:为什么会出现“无白”这种情况呢?因为该物质微溶,当浓度过高时就会有白色晶体析出。
碳酸铁 /性质:与碳酸铝类似,常温下是很难长时间存在的。
因为碳酸根离子和铁离子的结合很不稳定,它瞬间产生,瞬间就会水解,所以一般情况下很不容易得到这种物质。
但这不排除特定的条件下。
水解方程式:3CO3 2- + 2Fe3+ +3H2O === 2Fe(OH)3 ↓+ 3CO2↑氢氧化银 /白色固体,在水中分解 ,属于碱,常温下AgOH 极不稳定,易分解为褐色微溶于水的氧化银固体阳离子 阴离子OH - NO 3 Cl - SO 4 S SO 3 CO 3 SiO 3 PO 4 H + 溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 不 溶 NH 4 溶、挥无 溶、无 溶、无 溶、无 溶 溶 溶、无 溶 溶 K + 溶、无 溶、无 溶、无 溶、无 溶 溶 溶、无 溶 溶 Na + 溶、无 溶、无 溶、无 溶、无 溶 溶 溶、无 溶 溶 Ba 2+ 溶、无 溶、无 溶、无 不、白 溶 不 不、白 不 不 Ca 2+ 微、无白 溶、无 溶、无 微、无白 微 不 不、白 不 不 Mg 2+ 不、白 溶、无 溶、无 溶、无 溶 微 微、无白 不 不 Al 3+ 不、白 溶、无 溶、无 溶、无- - - 不 不 Mn 2+ 不、白 溶、无 溶、无 溶、无 不 不 不、白 不 不 Zn 2+ 不、白 溶、无 溶、无 溶、无 不 不 不、白 不 不 Cr 3+ 不 溶 溶 溶 - - - 不 不 Fe 2+ 不、白 溶、浅绿 溶、浅绿 溶、浅绿 不 不 不、白 不 不 Fe 3+ 不、红褐 溶、黄 溶、黄 溶、黄 - - - 不 不 Sn 2+ 不 溶 溶 溶 不 - - - 不 Pb 2+ 不 溶 微 不 不 不 不 不 不 Bi 3+ 不 溶 - 溶 不 不 不 - 不 Cu 2+ 不、蓝 溶、蓝 溶、蓝绿 溶、蓝 不 不 不、蓝 不 不 Hg + - 溶 不 微 不 不 不 - 不 Hg 2+ - 溶 溶 溶 不 不 不 - 不 Ag + - 溶、无 不、白 微、无白 不 不 不、白 不 不 + 酸、碱、盐溶解性表(20℃) - 2- 2- 2- 2- 2- 3-。



阳离子--NO Cl-SO S SO CO SiO PO 阴离子OH343343+溶、挥溶、挥溶溶、挥溶、挥溶、挥不溶HNH4溶、挥溶溶溶溶溶溶溶溶+溶溶溶溶溶溶溶溶溶KNa+溶溶溶溶溶溶溶溶溶Ba2+溶溶溶不溶不不不不Ca2+微溶溶微微不不不不2+不溶溶溶溶微微不不MgAl 3+不溶溶溶---不不2+不溶溶溶不不不不不MnZn2+不溶溶溶不不不不不Cr3+不溶溶溶---不不Fe2+不溶溶溶不不不不不Fe3+不溶溶溶---不不Sn2+不溶溶溶不---不Pb2+不溶微不不不不不不Bi 3+不溶-溶不不不-不Cu2+不溶溶溶不不不不不Hg+-溶不微不不不-不Hg2+-溶溶溶不不不-不Ag+-溶不微不不不不不溶解性口诀一钾, 钠,铵,盐, 硝酸盐 ,都能溶解水中间.盐酸盐不溶银, 亚汞 ,硫酸盐不溶钡和铅,微溶有钙银碳酸盐多不溶,溶者只有钾钠铵(除了镁,微溶)钾 , 钠 , 铵,钡碱都溶(钙微溶)溶解性口诀二钾钠铵盐溶水快,① 硫酸盐除掉钡铅钙。
② 氯化物不溶氯化银,硝酸盐溶液都透明。
中未有皆下沉。
④ 注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;酸盐都溶于水;④口诀中没有波及的盐类都不溶于水;③口诀③硝溶解性口诀三钾、钠、铵盐、硝酸盐;说明,以上四句歌谣归纳了氯化物除银、亚汞;硫酸盐除钡和铅;8类相加在水中溶解与不溶的状况。
碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀四钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多半酸溶碱少溶、只有钾钠铵钡溶溶解性口诀五钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其他几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)还有几种微溶物,可独自记着。
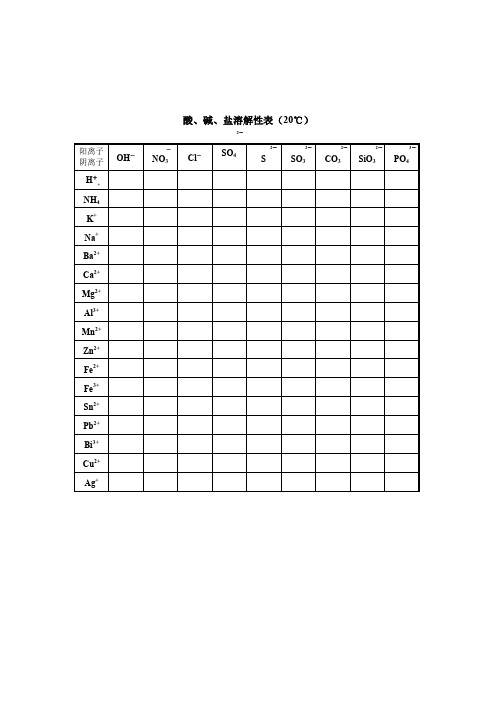
阳离子 阴离子OH -NO 3 Cl -SO 4 S SO 3 CO 3 SiO 3 PO 4 H + NH 4 K + Na + Ba 2+ Ca 2+ Mg 2+ Al 3+ Mn 2+ Zn 2+ Fe 2+ Fe 3+ Sn 2+ Pb 2+ Bi 3+ Cu 2+ Ag ++ 酸、碱、盐溶解性表(20℃)-2-2-2-2-2-3-溶解性口诀一钾,钠,铵,盐,硝酸盐,都能溶解水中间.盐酸盐不溶银,亚汞,硫酸盐不溶钡和铅, 微溶有钙银碳酸盐多不溶,溶者只有钾钠铵(除了镁,微溶)钾,钠,铵,钡碱都溶(钙微溶)溶解性口诀二钾钠铵盐溶水快,①硫酸盐除去钡铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
④注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;③硝酸盐都溶于水;④口诀中没有涉及的盐类都不溶于水;溶解性口诀三钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀四钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀五钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀六钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵溶解性口诀七(仅适用于初中)硝酸盐可溶钾,钠,铵硝酸盐入水无踪影氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾,钠,铵碱溶钡和钾,钠,铵溶解性口诀八(可适用于初中)钾钠硝铵皆可溶(化合物中含钾、钠、硝酸、铵根,都可溶解)盐酸不溶银亚汞(氯化银,氯化亚汞沉淀)硫酸铅钡不溶解(硫酸铅,硫酸钡沉淀)钙银亚汞是微溶(硫酸钙、银、亚汞微溶)可溶之碱有五位钾钠钡铵钙微溶(氢氧化钾、钠、钡、铵可溶,氢氧化钙微溶)氢硫亚硫溶三位(钾钠铵)碳硅磷酸与上同溶解性口诀九(可适用于初中)钾钠铵盐硝酸盐全部溶于水中间盐酸盐除氯化银硫酸盐出硫酸钡其余全溶碳酸盐磷酸盐除钾钠铵盐溶以外其余都不溶溶解性口诀十(可适用于初中)钾盐钠盐铵盐硝酸盐完全溶解不困难(氯化物)盐酸盐不溶只有氯化银硫酸盐不溶只有硫酸钡碳酸盐磷酸盐只溶钾钠铵碱只溶钾钠钡铵溶解性口诀十一(适用于初中)钾钠铵盐硝酸盐,放入水中易溶完.硫酸盐类也易溶,但要除去钙钡银.盐酸盐除银亚贡.碳酸、磷酸盐只有钾钠铵溶溶解性口诀十二(适用于初中)钾钠铵钡四碱溶钾钠铵硝盐全溶盐酸盐,除银盐硫酸盐,除钡盐碳酸盐,唯有钾钠铵可溶或钾、钠、硝酸溶,盐酸除银(亚)汞,再说硫酸盐,不容有钡、铅,其余几类盐,只溶钾、钠、铵,最后说碱类,钾、钠、铵和钡。
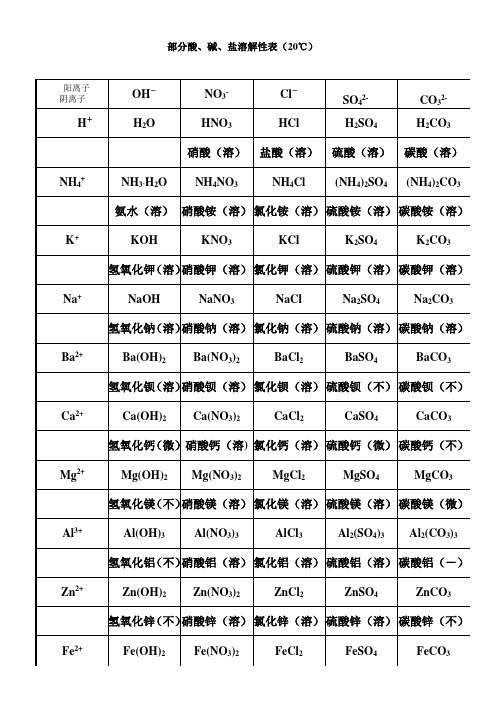
阳离子阴离子OH-NO3-Cl-SO42-CO32-H+H2O HNO3HCl H2SO4H2CO3硝酸(溶)盐酸(溶)硫酸(溶)碳酸(溶)NH4+NH3·H2O NH4NO3NH4Cl (NH4)2SO4(NH4)2CO3氨水(溶)硝酸铵(溶)氯化铵(溶)硫酸铵(溶)碳酸铵(溶)K+KOH KNO3KCl K2SO4K2CO3氢氧化钾(溶)硝酸钾(溶)氯化钾(溶)硫酸钾(溶)碳酸钾(溶)Na+NaOH NaNO3NaCl Na2SO4Na2CO3氢氧化钠(溶)硝酸钠(溶)氯化钠(溶)硫酸钠(溶)碳酸钠(溶)Ba2+Ba(OH)2Ba(NO3)2BaCl2BaSO4BaCO3氢氧化钡(溶)硝酸钡(溶)氯化钡(溶)硫酸钡(不)碳酸钡(不)Ca2+Ca(OH)2Ca(NO3)2CaCl2CaSO4CaCO3氢氧化钙(微)硝酸钙(溶) 氯化钙(溶)硫酸钙(微)碳酸钙(不)Mg2+Mg(OH)2Mg(NO3)2MgCl2MgSO4MgCO3氢氧化镁(不)硝酸镁(溶)氯化镁(溶)硫酸镁(溶)碳酸镁(微)Al3+Al(OH)3Al(NO3)3AlCl3Al2(SO4)3Al2(CO3)3氢氧化铝(不)硝酸铝(溶)氯化铝(溶)硫酸铝(溶)碳酸铝(-)Zn2+Zn(OH)2Zn(NO3)2ZnCl2ZnSO4ZnCO3氢氧化锌(不)硝酸锌(溶)氯化锌(溶)硫酸锌(溶)碳酸锌(不)Fe2+Fe(OH)2Fe(NO3)2FeCl2FeSO4FeCO3部分酸、碱、盐溶解性表(20℃)氢氧化亚铁(不)硝酸亚铁(溶)氯化亚铁(溶)硫酸亚铁(溶)碳酸亚铁(不)Fe3+Fe(OH)3Fe(NO3)3FeCl3Fe2(SO4)3Fe2(CO3)3氢氧化铁(不)硝酸铁(溶)氯化铁(溶)硫酸铁(溶)碳酸铁(-)Cu2+Cu(OH)2Cu(NO3)2CuCl2CuSO4CuCO3氢氧化铜(不)硝酸铜(溶)氯化铜(溶)硫酸铜(溶)碳酸铜(不)Ag+AgOH AgNO3AgCl Ag2SO4Ag2CO3氢氧化银(-)硝酸银(溶)氯化银(不)硫酸银(微)碳酸银(不)通常情况下,大多数酸都易溶于水且部分有挥发性;大多数碱都难溶于水(除钾钠铵钡可溶外);盐中有钾盐、钠盐和硝酸盐都易溶于水,氯化物中只有氯化银不溶,硫酸盐中只有硫酸钡不溶,碳酸盐和磷酸盐多数不溶于水。
酸碱盐的溶解性表
第一条
酸除硅酸全可溶,碱溶钾钠铵钡钙。
钾钠铵盐硝酸盐,全部溶解不困难。
氯化银和硫酸钡,两种沉淀记心间。
碳酸盐除钾钠铵,其余皆不溶于水。
第二条
钾钠铵盐硝酸盐,全都溶于水中间;
溶碱钾钠钡钙铵,碳酸只溶钾钠铵;
硫酸盐中钡不溶,氯化物中银也难;
常见诸酸皆可溶,记住挥酸盐硝碳。
第三条
碱有钾钠铵钡溶,氢氧化钙是微溶。
碳酸铝铁银碱无,钾钠铵硝盐全溶。
硫酸不溶只有钡,硫酸钙银盐微溶。
微溶还有碳酸镁,盐酸只有银不溶。
注:[特殊不溶解:氯化银、硫酸钡不溶于稀硝酸] 第四条
氯盐只有银不溶,碱镁铝锰锌铁铜。
硫酸钡钙银不溶,碳酸钾钠氢氨溶。
氢氧化钙是微溶,钾钠钡铵碱可溶。
红褐铁,蓝絮铜,其它沉淀呈白色。
初中化学酸碱盐溶解性表以及口诀(新的)课题1之---常见酸碱盐的溶解性(导学案)课型:新授课主备:邓爵华审核:化学组一、学习目标:1、强化酸碱盐化学式的读写。
2、加深对酸碱盐间发生复分解反应的条件、实质的理解。
3、初步认识盐的分类方法。
4、重点掌握常见酸碱盐的溶解性及其应用。
二、难点:从酸碱盐的溶解性去理解酸碱盐间发生复分解反应的实质。
三、教学过程:1、知识回顾:指出下列物质中那个是酸?那些是碱?那些是盐?1.H2O2. NaCl3. KNO34. KMnO45.CaCO36. H2SO47. H2O28. NaHCO39.Cu(OH)210. NaNO2 11. Ca(OH)212. N2 13.MnO2 14. H2 15. NH4Cl属于酸的有(填序号,下同):;属于碱的有:;属于盐的有:。
因为酸的构成特点是:H+ + 酸根离子碱的构成特点是:金属离子(或NH4+) + OH-盐的构成特点是:金属离子(或NH4+) + 酸根离子2、根据酸碱盐的构成特点,自学课本114页的常见酸碱盐的溶解性表,①、强化酸碱盐化学式的读写(写出化学式):酸:硫酸碳酸盐酸;碱:氢氧化钠氢氧化钙;盐:氯化钠硫酸铜;碳酸钠硝酸钙。
②、盐的种类较多,为更好的识别、掌握它们,就要给它们分门别类,化繁为简:盐的分类常按所含或的类型来分类;③、归纳酸碱盐的溶解性,并熟记,以便更好应用:酸:酸全溶碱:氢氧铵钠钾钡溶盐:铵钠钾盐硝酸盐(全溶);氯化盐不溶硫酸盐不溶;碳酸盐溶3、学以致用应用一:判断常见的酸碱盐的溶解性考点:某碱或盐加入水中能否形成溶液强化练习1、下列物质加入水中能形成溶液的是()A、Cu(OH)2B、CaCO3C、BaSO4D、(NH4)2CO32、下列各组物质全部能溶于水的是:A 、H2SO4CuSO4NaOH AgNO3B 、CuCl2Na2SO4Mg(OH)2 FeCl2C 、KOH AgCl KNO3Na2CO3D 、Al(OH)3ZnSO4Ca(NO3)2(NH4)2SO4应用二:判断酸碱盐之间的复分解反应可否发生(即是否满足复分解反应的条件)复分解反应发生的条件:生成物中:①有水生成②有气体生成③有沉淀生成三者之一复分解反应发生的条件即体现出复分解反应的实质,即反应物的离子相互结合反应形成:水或气体或沉淀的过程。
酸碱盐的溶解性表说明:此为20℃时的情况。
“溶〞表示那种物质可溶于水,“不〞表示不溶于水,“微〞表示微溶于水,“挥〞表示挥发性,“---〞表示那种物质不存在或遇到水就分解了背诵口诀1.钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶钾钠钡钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【f e(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。
氢氧化铁〔红褐色〕氢氧化铜〔蓝色〕说明【】内为前一物质的特点2.钾钠铵盐全都溶碳酸除镁是微溶其他全都不能溶AgCl、BaSO4酸也不溶磷酸盐,更不溶一、氧气的性质:〔1〕单质与氧气的反响:〔化合反响〕1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧〔研究空气组成的实验〕:4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO〔2〕化合物与氧气的反响:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 +3H2O〔3〕氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑〔实验室制氧气原理1〕15.过氧化氢在二氧化锰作催化剂条件下分解反响:H2O2 MnO22H2O+ O2 ↑〔实验室制氧气原理2〕二、自然界中的水:16.水在直流电的作用下分解〔研究水的组成实验〕:2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃2MgO20.铁和硫酸铜溶液反响:Fe + CuSO4 === FeSO4 + Cu 21.氢气复原氧化铜:H2 + CuO 加热Cu + H2O22. 镁复原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:〔1〕碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭复原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭复原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑〔2〕煤炉中发生的三个反响:〔几个化合反响〕26.煤炉的底层:C + O2 点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2 〔3〕二氧化碳的制法与性质:29.大理石与稀盐酸反响〔实验室制二氧化碳〕:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石〔工业制二氧化碳〕:CaCO3 高温CaO + CO2↑33.石灰水与二氧化碳反响〔鉴别二氧化碳〕:Ca(OH)2 + CO2 === CaCO3 ↓+ H2O〔4〕一氧化碳的性质:34.一氧化碳复原氧化铜:CO+ CuO 加热Cu + CO2 35.一氧化碳的可燃性:2CO + O2 点燃2CO2其它反响:36.碳酸钠与稀盐酸反响〔灭火器的原理〕:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属〔1〕金属与氧气反响:40.镁在空气中燃烧:2Mg + O2 点燃2MgO 41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3 〔2〕金属单质+ 酸-------- 盐+ 氢气〔置换反响〕44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑〔3〕金属单质+ 盐〔溶液〕------- 新金属+ 新盐52. 铁和硫酸铜溶液反响:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反响:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反响:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg〔3〕金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质〔1〕酸+ 金属-------- 盐+ 氢气〔见上〕〔2〕酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反响:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反响:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反响:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反响:CuO + H2SO4 == CuSO4 + H2O 〔3〕酸+ 碱-------- 盐+ 水〔中和反响〕60.盐酸和烧碱起反响:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反响:2HCl + Ca(OH)2 == CaCl2 +2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反响:H2SO4 + 2NaOH == Na2SO4 +2H2O〔4〕酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反响:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反响: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反响:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反响:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质〔1〕碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O〔2〕碱+ 酸-------- 盐+ 水〔中和反响,方程式见上〕〔3〕碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质〔1〕盐〔溶液〕+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反响:Fe + CuSO4 == FeSO4 + Cu 〔2〕盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反响: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反响:NaHCO3 + HCl== NaCl + H2O + CO2↑〔3〕盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH〔4〕盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl钾钠硝铵均可溶,盐酸盐不溶AgCl,硫酸盐不溶BaSO4 ,碳酸盐能溶钾钠铵,钾钠钙钡可溶碱。
初中酸碱盐溶解度表 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
酸碱和盐的溶解性表(0
20C)
口诀
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
再说硫酸盐,不溶有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)
只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住。
[CaSO4 Ca(OH)2 MgCO3 Ag2SO4] 2.酸碱盐的主要溶解性规律
(1)酸:除硅酸(H2SiO3)外,大多数常见酸易溶于水;
(2)碱:KOH、NaOH、Ba(OH)2和氨水易溶,Ca(OH)2微溶,其余碱均不溶于水;
(3)盐:钾盐、钠盐、铵盐、硝酸盐易溶于水,盐酸盐除AgCl外易溶,硫酸盐除BaSO4外易溶.。