部分酸、碱和盐的溶解性表(20℃)
- 格式:doc
- 大小:37.50 KB
- 文档页数:1

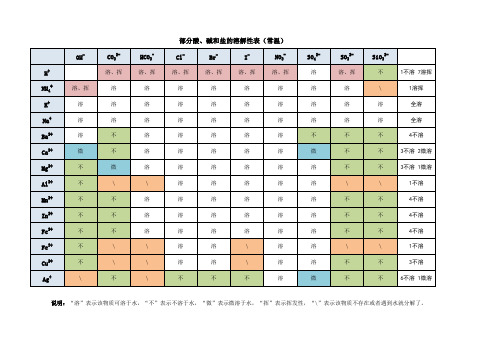



附录一部分酸、碱和盐的溶解性表(室温)教学设计一、教学目标1、通过对表格各离子不同组合,进一步加深对酸、碱、盐的组成理解,强化了酸碱盐化学式的书写。
2、从表中找出酸碱盐的溶解性特点,找出有效的记忆方法或口诀,快速判断出有沉淀生成的复分解反应能否实行。
3、利用表中常见的酸碱盐的溶解性,巩固酸碱盐的鉴别、转化、制取等实验技能,熟悉中考常考的特征离子的检验。
二、教学重难点1、教学重点:酸碱盐的溶解性规律及记忆方法。
2、教学难点:微溶物的处理。
三、课前准备:事先印一张表格,要求学生课前先完成化学式的书写。
附:酸碱盐化学式四、教学流程2、提问:酸碱盐之间发生复分解反应的条件是什么?注意学生往往没说到反应物应是溶液(可溶,酸例外)特别是“盐+碱”、“盐+盐”反应物一定要全溶。
3、引入问题:复分解反应要具备生成物有水、气体、沉淀三个条件之一才能实行,生成水或气体通过方程式很容易判断出来,最难是如何判断是否生成沉淀,所以今天我们来学习酸碱盐的溶解性表。
附练习:3、下列实验能观察到明显现象的()A、硫酸钠溶液滴入氯化铜溶液B、氯化钡溶液滴入氧化铜中C、氢氧化钾溶液滴入硝酸钠溶液中D、硝酸银溶液滴入氯化钠溶液4、只有一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是()A、氯化钡溶液B、石蕊溶液C、碳酸钠溶液D、酚酞溶液5、下列各种物质,相互不能发生反应的是()A、Ca(OH)2溶液和硫酸B、氧化铁和盐酸C、三氧化硫和氢氧化化钠溶液D、盐酸和二氧化碳6、下面是某同学实行碱的化学性质实验时记录的现象,其中与事实不符的是( )A、Ca(OH)2溶液中加入稀盐酸,无明显变化B、NaOH溶液中通入CO2气体,有白色沉淀生成C、Ca(OH)2溶液中加入石蕊溶液,溶液呈蓝色D、NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成7、将下列各组物质放入水中,有化学反应发生,但无沉淀生成,也无气体生成,且溶液为无色的一组是( )A、K2CO3、BaCl2、NaClB、CaSO4、HNO3、NaClC、CaCl2、KOH、Na2CO3D、K2SO4、H2SO4、NaOH8.(2019广安市)酸、碱、盐的溶解性表为我们确定常见物质的溶解性提供了方便,下表是溶解性表中的一部分,结合表格和溶解度知识判断,下列说法不准确的是()常见酸、碱、盐的溶解性表(20℃)A.绘制表格的依据是物质的溶解度B.常见物质一般可分为:溶、微溶和不溶C.Ca(OH)2、CaSO4和CaCO3的溶解度都大于1gD.Ca2+、NO3-、Cl-三种离子在溶液中能大量共存9、完成发生的下列反应的化学方程式。

1 / 2部分酸、碱和盐的溶解性表(室温)注意:1、亚铁离子(Fe 2+)为浅绿色,形成的可溶性盐类物质形成的溶液为浅绿色,即Fe(NO 3)2溶液、FeCl 2溶液、FeSO 4溶液均为浅绿色;铁离子(Fe 3+)为黄色,形成的可溶性盐类物质形成的溶液为黄色,即Fe(NO 3)3溶液、FeCl 3溶液、Fe 2(SO 4)3均为黄色;Cu(NO 3)2溶液、CuCl 2溶液、CuSO 4溶液均为蓝色。
2、Fe(OH)3为红褐色、Cu(OH)2为蓝色不溶于水物质,AgCl 、BaSO 4均为不溶于盐酸和硫酸的白色物质。
读作:氢氧化某读作:硝酸某读作:氯化某读作:硫酸某读作:碳酸某氢氧根硝酸根盐酸根硫酸根碳酸根OH -NO 3-Cl -SO 42-CO 32-H +H 2O 溶、挥HNO 3溶、挥HCl 溶H 2SO 4溶、挥H 2CO 3酸K +溶KOH 溶KNO 3溶KCl 溶K 2SO 4溶K 2CO 3钾盐Na +溶NaOH 溶NaNO 3溶NaCl 溶Na 2SO 4溶Na 2CO 3钠盐NH 4+溶、挥NH 3·H 2O 溶NH 4NO 3溶NH 4Cl 溶(NH 4)2SO 4溶(NH 4)2CO 3铵盐Ba 2+溶Ba(OH)2溶Ba(NO 3)2溶BaCl 2不BaSO 4不BaCO 3钡盐Ca 2+微Ca(OH)2溶Ca(NO 3)2溶CaCl 2微CaSO 4不CaCO 3钙盐Mg 2+不Mg(OH)2溶Mg(NO 3)2溶MgCl 2溶MgSO 4微MgCO 3镁盐Al 3+不Al(OH)3溶Al(NO 3)3溶AlCl 3溶Al 2(SO 4)3---铝盐Mn 2+不Mn(OH)2溶Mn(NO 3)2溶MnCl 2溶MnSO 4不MnCO 3锰盐Zn 2+不Zn(OH)2溶Zn(NO 3)2溶ZnCl 2溶ZnSO 4不ZnCO 3锌盐Fe 2+不Fe(OH)2溶Fe(NO 3)2溶FeCl 2溶FeSO 4不FeCO 3亚铁盐Fe 3+不Fe(OH)3溶Fe(NO 3)3溶FeCl 3溶Fe 2(SO 4)3---铁盐Cu 2+不Cu(OH)2溶Cu(NO 3)2溶CuCl 2溶CuSO 4---铜盐Ag +---溶AgNO 3不AgCl微Ag 2SO 4不Ag 2CO 3银盐盐碱硝酸盐盐酸盐硫酸盐碳酸盐阳离子阴离子3、注意含Fe2+和Fe3+离子的碱和盐的读法。
谨防误读《部分酸、碱和盐的溶解性表》作者:杭作来源:《中学化学》2017年第03期高中化学教材中“两表”伴随始终,其中《部分酸、碱和盐的溶解性表》(下面称《溶解性表》)一些信息易误读,导致理解、运用出错。
本文仅根据《溶解性表》在中学化学应用角度收集常见一些错例,供复习参考。
一、忽视“溶、挥”物质与条件关系《溶解性表》中有四处标明“溶,挥”,在实际应用时易混淆错用。
现分别讨论其区别。
1.HNO3(溶,挥)(1)在稀溶液中,产生为硝酸,溶于水,不能用“↑”;(2)固体或浓溶液(或浓硫酸)反应产生硝酸易挥发,用“↑”表示。
类似有HCl(溶,挥),在水溶液生成氯化氢不用“↑”,氯化钠固体与浓硫酸,加热反应生成氯化氢用“↑”:2NaCl(固)+H2SO4(浓)△Na2SO4+2HCl↑2.NH3·H2O(溶,挥)(1)氨与水以体积比1∶700溶解,在稀溶液、冷溶液中生成氨溶于水,即产物以“NH3·H2O”形式出现。
(2)在浓溶液或加热或固体,加热反应产生的氨,以气体NH3形式,且标注“↑”。
(3)在银氨溶液中反应,因生成氨量少,且溶液为稀溶液,生成氨,以NH3形式,但不标示“↑”。
(4)双水解反应或NH+4水解反应中,水解程度弱,用可逆号表示,且产物以“NH3·H2O”形式。
(5)在铵盐溶液中加入碳化钙,过氧化钠等溶于水放热的固态物质,产生中氨以气体NH3形式,且标明“↑”。
3.H2CO3(溶,挥)二氧化碳溶于水,以H2CO3形式存在;碳酸不稳定,挥发出来就分解,以CO2形式存在。
(1)HCO-3水解或双水解不产生沉淀,则生成的二氧化碳以H2CO3形式。
(2)碳酸盐、碳酸氢盐与足量酸反应,碳酸氢盐受热分解等生成二氧化碳,以“CO2”形式,且标明“↑”。
(3)盐类双水解且产物有难溶物,如氢氧化铝、氢氧化铁、氢氧化镁等,产生二氧化碳,以“CO2”形式,标明“↑”。
(4)如果盐类水解,在煮沸条件下进行,生成二氧化碳以气体形式。