第七章 配位化合物
- 格式:doc
- 大小:1.14 MB
- 文档页数:24

配位化合物的配位数和配位键的性质配位化合物是由一个或多个配体与中心金属离子形成的化合物。
在配位化学领域,配位数和配位键的性质是非常重要且基础的概念。
本文将探讨配位化合物的配位数和配位键的性质,并分析它们在化学中的应用。
一、配位数的概念和分类配位数指在一个配位化合物中,中心金属离子周围结合的配体数量。
根据不同的配体与中心金属离子的结合方式,可以将配位数分为以下几种类型:1. 一配位:指一个配体与一个中心金属离子形成一根配位键的情况。
典型的一配位化合物为氯化物离子(Cl-)与银离子(Ag+)结合形成的AgCl。
2. 二配位:指两个配体与一个中心金属离子形成两根配位键的情况。
例如,氨(NH3)与铜离子(Cu2+)结合形成的[Cu(NH3)2]2+。
3. 多配位:指多个配体与一个中心金属离子形成多个配位键的情况。
例如,氯化物(Cl-)、溴化物(Br-)和碘化物(I-)与铁离子(Fe3+)结合形成的[FeCl3]、[FeBr3]和[FeI3]。
二、配位键的性质配位键是配体与中心金属离子之间的化学键,决定了配位化合物的稳定性和性质。
以下是配位键的一些重要性质:1. 强配位键:强配位键是指能够与中心金属离子形成较强的化学键的配体。
具有强配位键的配体通常是具有较大的电负性和较高的硬度。
常见的强配位键配体包括氨、氰化物(CN-)和水(H2O)等。
2. 弱配位键:弱配位键是指与中心金属离子形成较弱化学键的配体。
具有弱配位键的配体通常是具有较小的电负性和较低的硬度。
典型的弱配位键配体包括一氧化碳(CO)和硫化物(S2-)等。
3. 配位键长度:配位键的长度与配位键强度密切相关。
通常情况下,配位键越短,配位键越强。
配位键长度可以通过X射线晶体学等方法来确定。
4. 配位键的方向性:配位键可以是线性的、平面性的或立体性的。
这取决于配体与中心金属离子之间的共价键角度以及配位平面的几何结构。
三、配位数和配位键的应用配位化合物的配位数和配位键的性质对其在化学和生物学中的应用起着重要作用。

配位化合物第一节配位化合物的基本概念一、配位化合物的定义在CuSO4溶液中加少量氨水,生成浅蓝色Cu(OH)2↓,再加入氨水,沉淀溶解变成深蓝色溶液,加入乙醇,降低溶解度,得到深蓝色晶体,该晶体经元素分析,得知含Cu、SO42-、4NH3、H2O;取深蓝色溶液,加BaCl2,生成白色BaSO4↓,说明存在SO42-,加少量NaOH,无Cu(OH)2↓和NH3产生,说明溶液中不存在Cu2+和NH3分子,从而分析其结构为:[Cu(NH3)4]SO4·H2OCu和NH3之间的加合,既无氧化数的变化,也没有提供单电子配对而形成共价键,不符合经典的化合价理论。
这类化合物就是配合物。
二、配位化合物的组成1893年,维尔纳(A. Werner)提出配位理论。
1、配离子可以是阴或阳离子2、中心离子:简单阳离子,特别是过渡金属离子,也有金属原子。
位于配离子的中心。
3、配体:位于中心离子周围,可以是中性分子,也可以是负离子。
其特点是配位原子含有孤对电子。
能作为配位原子的元素主要有:N、O、C、S及卤素等。
4、配位数:配合物中,配位原子的总数。
决定于中心离子和配位体的性质,其电荷、体积、电子层结构及它们之间相互影响,形成时的条件(T、C)中心离子的电荷:+1 +2 +3 +4特征配位数: 2 4(或6) 6(或4) 6(或8)三、配位化合物的命名服从一般无机化合物的命名原则。
如果化合物的负离子是一个简单离子,叫某"化"某;如果化合物的负离子是一个复杂离子,叫某"酸"某。
络合物内界命名次序为:配位数(一、二、三、四)-配位体名称-"合"(表示配位结合)-中心离子名称-中心离子氧化数(Ⅰ、Ⅱ、Ⅲ、Ⅳ)例:[Co(NH3)6]Cl3[Pt(NH3)4](OH)2K2[PtCl6] H2[PtCl6]氯化六氨合钴(Ⅲ)氢氧化四氨合铂(Ⅱ)六氯合铂(Ⅳ)酸钾六氯合铂(Ⅳ)酸不止一种配体:先列阴离子,后列中性分子,若配体同是阴离子或中性分子,则按配位原子元素符号的英文次序排列。


配位化合物的生成和性质配合物的方程式:Cu2+ + 4 Cl- = [CuCl4]2-Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+Cu(OH)2+4NH3=〔Cu(NH3)4〕2++2OHˉSO42- + Ba2+ = BaSO4↓SO42- + Ba2+ ==BaSO4↓Na2S2O3+2AgNO3==2NaNO3+Ag2S2O3↓Ag2S2O3+Na2S2O3==Na2[Ag(S2O3)2](这是易溶物)(1)2Ag+ + S2O32- == Ag2S2O3(2)Ag2S2O3 +H2O == Ag2S + H2SO4(3)Ag2S2O3 + 3S2O32- == 2[Ag(S2O3)2]3-6H+ + 2S2- + SO3 2- == 3S(沉淀) + 3H2O[Cu(NH3)4]2+ + 2OH- = Cu(OH)2 + 4NH3Fe(3+)+3C2O4(2-)=[Fe(C2O4)3]^3-Fe3+ + 3SCN- =Fe(SCN)3Fe3+ + 6 SCN- = [Fe(SCN)6]^3-,溶液变血红色Ag2S2O3+H2O=Ag2S+H2SO4AgCl+2NH3.H2O=Ag(NH3)2OH+Cl-+H2OAg+ + 2NH3·H2O = [Ag(NH3)2]+ + 2H2O1.配位化合物与复盐的区别:配合物是中心离子(原子)跟几个配体结合得到,配体不一定是酸根离子。
而复盐必须是有不同金属阳离子和同一种酸根离子才能叫复盐复盐:由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐。
配合物:配位化合物的简称,也叫络合物,是由一定数量的配位体(有孤电子或电子对的负离子或分子)通过配位键(由成键一方单独提供电子而形成的共价键)结合于中心离子(或中心原子)的周围而形成的一个复杂离子(或分子),并与原来各组分的性质不同.配合物在晶体和溶液中能稳定的存在,有些稳定的配合离子在溶液中很少离解.配合物都具有一定的空间构型,有特定的理、化性质。

配位化合物的化学反应引言:配位化合物是指由中心金属离子和配位体组成的化合物。
在化学反应中,配位化合物的中心金属离子与配位体之间会发生一系列的化学反应,这些反应对于理解配位化合物的性质和应用具有重要的意义。
本文将从配位化合物的合成、分解和置换反应等角度来探讨配位化合物的化学反应。
一、配位化合物的合成反应1. 配位加合反应配位加合反应是指将中心金属离子与配位体通过配位键结合形成配位化合物的反应。
例如,二价的铜离子与氨配位体反应,生成配位化合物氨合铜离子:Cu2+ + 4NH3 → [Cu(NH3)4]2+2. 配位置换反应配位置换反应是指在已有配位化合物中,通过替换某个配位体来生成新的配位化合物的反应。
常见的配位置换反应有配位体的替换和配位数的变化两种情况。
(1)配位体的替换反应配位体的替换反应发生在一个配位体离开或被另一个配位体所替代的过程中。
例如,氯铂酸与亚硫酸钠反应,生成含有亚硫酸配位体的二价铂离子:[PtCl6]2- + 4Na2SO3 + 4H2O → [Pt(SO3)4]2- + 8NaCl + 8NaOH(2)配位数的变化反应在配位化合物中,有些中心金属离子的配位数是可变的。
这种配位数的变化反应可以通过添加或去除配位体来实现。
例如,六价铬离子和三个水分子反应,生成四价的配位化合物二氧化铬:[Cr(H2O)6]3+ + 3H2O → [Cr(H2O)3(OH)3] + 3H3O+二、配位化合物的分解反应配位化合物的分解反应是指在适当条件下,配位化合物能够分解成中心金属离子和配位体的反应。
例如,氯化钾与六水合铜(II)硫酸盐反应,可以使该配位化合物分解成两个离子:[Cu(H2O)6]SO4 + 2KCl → CuSO4 + 6H2O + 2KCl三、配位化合物的置换反应配位化合物的置换反应是指在适当条件下,配位化合物中的一个配位体被另一个配位体所替代的反应。
这种反应可以通过改变条件,例如温度、溶剂、酸碱性等来实现。

配位化合物的制备与性质配位化合物是由一个或多个配体与一个中心金属离子形成的化合物。
配位化合物在化学和生物学中都有广泛的应用。
本文将探讨配位化合物的制备方法以及它们的性质。
一、配位化合物的制备方法1. 水合物合成法水合物合成法是最常见的制备配位化合物的方法之一。
它是通过将金属离子与水合剂反应形成水合物。
水合剂通常是水,但也可以是其他溶剂,例如乙醇。
水合物的配体数目可以通过实验条件来控制,使得配位数发生变化。
例如,将CuSO4溶解在水中,可以得到蓝色的CuSO4·5H2O水合物。
2. 配体置换法配体置换法是一种常用的制备特定配位化合物的方法。
通过在溶液中加入所需的配体,与原有配体进行竞争配位,实现配体的置换。
这种方法可用于制备具有特定性质的配位化合物。
例如,通过将氯化铜(CuCl2)溶解在水中,然后加入亚硝酸钠(NaNO2),可以得到亚硝酸铜(Cu(NO2)2)。
3. 配位聚合法配位聚合法是一种将多个配体与中心金属离子形成配位化合物的方法。
这种方法可以通过将金属离子与多个配体同时反应,使它们在空间上连接起来,形成一个配位聚合物。
例如,将铜离子与乙二胺(en)和氰化钠(NaCN)同时反应,可以制备出[Cu(en)2(CN)2]复合物。
二、配位化合物的性质1. 配位数配位数是指配合物中与中心金属离子配位的配体数目。
配位数通常在2至6之间。
配位数的增加会增加配位化合物的稳定性和化学性质的多样性。
2. 颜色许多配位化合物具有鲜艳的颜色,这是由于配体与金属离子之间的电荷转移或电子转移的结果。
不同的配体和金属离子对颜色的影响是不同的。
3. 稳定性配位化合物通常比金属离子更稳定。
这是因为配体能够通过与中心金属离子形成配位键来降低金属离子的电荷密度,从而减少金属离子与其周围环境的相互作用。
4. 配位键性质配位键是配位化合物中配体与金属离子之间的化学键。
配位键的性质直接影响配位化合物的稳定性和反应性。
配位键可以是共价键或离子键。

第七章配位化合物(一)选择题1.历史上记录的第一种人工合成的配位化合物是( )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( )A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( )A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是( )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是45.下列说法中错误的是()A.一般说来内轨型配合物较外轨型配合物稳定B.IIB元素形成为四的配离子几乎都是四面体形-和CO作为配体时力图形成内轨型配合物D.金属原子不能作配合物的形成体6.在下列说法正确的是()A 配合物的内界与外界之间主要以共价键结合B 内界中有配键,也可能形成共价键C 由多齿配体形成的配合物,可称为螯合物D 在螯合物中没有离子键7.NH4[Cr(NCS)4(NH3)2]的正确名称是()A 顺一二(三苯基膦).二氯合铂(ⅱ)B 反一二(三苯基膦).二氯合铂(ⅱ)C 反一二氯.二(三苯基膦)合铂(ⅱ)D顺一二氯.二(三苯基膦)合铂(ⅱ)8.NH4[Cr(NCS)4(NH3)2]的正确名称是()A 四(硫氰酸根).二氨全铬(ⅲ)酸铵B 四(异硫氰酸根).二氨全铬(ⅲ)酸铵C 四(异硫氰酸根).二氨全铬酸(1-)铵 D.四(硫氰酸).二氨全铬(ⅲ)酸铵9.下列说法中错误的是()A.对于Ni2+来说,当配位数为6时,无论是强声或弱声配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质10.下列说法中错误的是()A.配位平衡指溶液中配合物离解为内界和外界的离解平衡B.本位平衡是指溶液中配离子或配位分子或多或少离解为形成体和配体的离解平衡C.配离子在溶液中的行为象弱电解质D.对配位平衡来说,K稳.K不稳=111.解释在FeCl3溶液中滴加KCNS试剂,溶液变红的原因是()A FeCl3溶液被稀释放B 生成了[Fe(CNS)6]3-C 没有反应D 生成了Fe(CNS)3沉淀12.下列试剂能溶解Zn(OH)2,AgBr,Cr(OH)3和Fe(OH)3四种沉淀的是()A 氨水B 氰化钾溶液C 硝酸D 盐酸13.下列配体的本位能力的强弱次序为()->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为()A 3B 4C 5D 615.内轨型配离子[Cu(CN)4]2-的磁距等于2.0B.M.判断其空间构型和中心离子的杂化轨道分别为()A 四面体形和SP3B 正方形和dsp2 C.八面体形和SP3d2 D 八面体形和d2sp316.下列配离子都具有相同的强场配体(CN-)其中属于外轨型配合物的是()A [Zn(CN)4]2- B.[Cu(CN)4]2- C.[Ni(CN)4]2- D.[Co(CN)6]3-17.以CN-和CO作配体时较之以F-和H2O作配体时形成的配合物多为内轨型,其原因是()A.在CN-和CO中的C较之F和O更易提供电子对B.C比O和F的原子半径大,极化率大,易变形,所提供的电子对易进入中心体的内层空轨道C.C的原子量较之F和O小-和CO的式量较之F和O的原子量大18.配位酸或配位碱比相应的普通酸或普通碱的酸性或碱性强,其原因是()A 配位酸碱较稳定B 配位酸、碱较不稳定C H+或OH-为配位酸或碱的外界D 配位后极性增强19.[Co(NO2)6]3-显黄色(吸收紫光),而[Co(NH3)6]3-显橙色(吸收蓝光),根据它们颜色(或所吸收光的波长)判断出Co3+在这两种配离子中分裂能(△)的大小为()A 相等B 不能判断 C. △[Co(NO2)6]3->△[Co(NH3)6]3+ D. △[Co(NO2)6]3-<△[Co(NH3)6]3+20.已知电子的成对能(P)与d轨道的分裂能(△)的相对大小会影响八面体构型的配离子成为高自旋或低自旋的配离子。

保密工作学习培训计划一、培训目标通过本次培训,全体员工将深入了解保密工作的重要性,掌握保密工作的基本知识和技能,增强对保密工作的责任感和使命感,确保公司信息安全和业务稳定运行。
二、培训内容1. 保密工作的意义和作用2. 保密工作的相关法律法规和政策文件3. 保密工作的基本知识和技能4. 保密工作的日常操作和管理5. 保密工作的应急处置和风险防范三、培训方式1. 理论教学2. 案例讨论3. 视频教学4. 角色扮演5. 现场考察四、培训时间本次培训计划为期2个月,每周安排2次培训,每次培训时长为2小时。
五、培训人员全体公司员工参与培训,领导班子成员和保密管理人员全程参与培训并组织实施。
六、培训流程第一阶段(第1-2周):1. 保密工作的意义和作用2. 保密工作的法律法规和政策文件3. 保密工作的基本知识和技能第二阶段(第3-4周):1. 保密工作的日常操作和管理2. 保密工作的应急处置和风险防范第三阶段(第5-6周):1. 案例讨论和角色扮演2. 现场考察和实际操作第四阶段(第7-8周):1. 考试和评测2. 结业证书颁发和培训总结七、培训考核1. 考试成绩占总成绩的50%2. 实际操作成绩占总成绩的20%3. 现场表现成绩占总成绩的20%4. 出勤成绩占总成绩的10%八、培训评估1. 培训后进行满意度调查,收集员工对培训的意见和建议2. 进行培训效果评估,确保培训达到预期目标九、培训材料1. 保密工作相关法律法规和政策文件2. 保密工作基本知识和技能教材3. 培训案例和实例材料4. 培训视频和PPT材料十、培训经费1. 培训场地费用2. 培训师资费用3. 培训材料费用4. 培训证书费用十一、培训后续1. 定期组织保密工作培训和答疑2. 发挥保密管理人员的作用,加强对保密工作的管理和监督3. 加强对员工的保密意识培养和宣传教育十二、培训总结本次培训的目标是通过对保密工作相关知识和技能的学习和掌握,增强员工对保密工作的责任感和使命感,提高保密工作的管理水平和保密风险防范能力,确保公司信息安全和业务稳定运行。

配位化合物和配位化学在化学领域中,配位化合物是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配位化合物在化学研究和工业应用中占据着重要地位,其结构和性质的研究对于理解化学反应机理和设计新型功能材料具有重要意义。
本文将介绍配位化合物的基本概念、结构特点和应用。
一、配位化合物的定义和特点配位化合物的定义是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配体是指能够用一个或多个供体原子通过配位键与金属形成配位络合物的分子或离子。
配位键是通过配位化学中的配位原理形成的。
典型的配位键包括金属与配体中供体原子之间的共价键、离子键和金属与配体之间的范德华力等。
配位化合物的结构特点是中心金属离子或原子周围被配体所包围,形成一个或多个配位位点。
在配位化合物中,中心金属离子或原子通过配位键与配体相连接,形成一个稳定的配位络合物。
配位络合物的结构可以通过X射线晶体学、核磁共振等技术手段进行表征。
二、配位化合物的分类根据配位化合物的结构和性质特点,可以将其分为以下几类:1. 单核配位化合物:指只含有一个中心金属离子或原子和一个配体形成的配位化合物。
例如,[Co(NH3)6]3+是一个单核配位化合物,其中Co3+是中心金属离子,六个氨分子是配体。
2. 多核配位化合物:指含有两个或更多中心金属离子或原子与一个或多个配体形成的配位化合物。
例如,[Fe2O(NH2)4(H2O)2]2+是一个多核配位化合物,其中包含两个铁离子和六个氨基甲酸分子作为配体。
3. 配位聚合物:指由大量配体通过配位键连接形成的高分子化合物。
例如,聚合氯化铁是一种配位聚合物,其中氯化铁离子通过氯化物配体进行连接。
4. 双核配位化合物:指由两个中心金属离子或原子和一个或多个配体形成的配位化合物。
例如,[Cu2(H2O)2(OAc)4]是一个双核配位化合物,其中包含两个铜离子和四个乙酸根离子作为配体。
三、配位化合物的应用配位化合物在生物学、材料科学、环境保护等领域中具有广泛的应用价值。

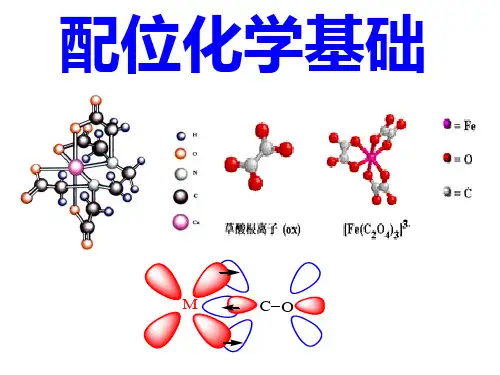
配位化合物目录[隐藏]定义组成命名方法价键分类稳定性配位化合物(coordination compound)[编辑本段]定义简称配合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
[编辑本段]组成配合物由中心原子、配位体和外界组成,例如硫酸四氨合铜(Ⅱ)分子式为〔Cu(NH3)4〕SO4,其中Cu2+是中心原子,NH3是配位体,SO4 2-是外界。
中心原子可以是带电的离子,如〔Cu(NH3)4〕SO4中的Cu2+,也可以是中性的原子,如四羰基镍〔Ni(CO)4〕中的Ni。
周期表中所有的金属元素都可作为中心原子,但以过渡金属最易形成配合物。
配位体可以是中性分子,如〔Cu (NH3)4〕SO4中的NH3,也可以是带电的离子,如亚铁氰化钾K4〔Fe(CN)6〕中的CN-。
与中心原子相结合的配位体的总个数称为配位数,例如K4〔Fe(CN)6〕中Fe2+的配位数是6 。
中心原子和配位体共同组成配位本体(又称内界),在配合物的分子式中,配位本体被括在方括弧内,如〔Cu(NH3)4〕SO4中,〔Cu(NH3)4〕2+就是配位本体。
它可以是中性分子,如〔Ni(CO)4〕;可以是阳离子,如[Cu(NH3)4〕2+ ;也可以是阴离子,如〔Fe(CN)6〕4-。
带电荷的配位本体称为配离子。
[编辑本段]命名方法①命名配离子时,配位体的名称放在前,中心原子名称放在后。
②配位体和中心原子的名称之间用“合”字相连[1]。
③中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态。
④配位数用中文数字在配位体名称之前。
⑤如果配合物中有多种配位体,则它们的排列次序为:阴离子配位体在前,中性分子配位体在后;无机配位体在前,有机配位体在后。
不同配位体的名称之间还要用中圆点分开。
根据以上规则,〔Cu(NH3)4〕SO4称硫酸四氨合铜(Ⅱ),〔Pt(NH3)2Cl2〕称二氯·二氨合铂(Ⅱ),K〔PtCl3(C2H4)〕称三氯·(乙烯)合铂(Ⅱ)酸钾。
配位化合物的结构配位化合物,是指由一个或多个中心金属离子与周围的配体形成的化合物。
在配位化学中,了解和研究配位化合物的结构对于理解它们的性质和反应机理至关重要。
本文将从配位化合物的组成、键的类型以及结构的分析等方面进行探讨。
一、配位化合物的组成配位化合物的组成主要包括中心金属离子和配体两个部分。
中心金属离子是指在配位过程中能够接受电子对的离子,常见的有过渡金属离子如铁离子(Fe3+)、铜离子(Cu2+)等。
配体是指能够给出电子对的分子或离子,通过与中心金属离子形成配位键。
常见的配体有水(H2O)、氨(NH3)、氯化物(Cl-)等。
二、配位键的类型配位化合物中的配位键主要分为离子键、共价键和配位键三种类型。
离子键是指中心金属离子与配体之间通过电荷吸引力形成的键。
这种键的特点是电离度较高,形成的化合物晶体结构稳定,常见于硫氰酸盐(SCN-)和铁离子(Fe3+)之间的配位键形成离子键。
共价键是指中心金属离子与配体之间通过共用电子对形成的键。
这种键的特点是电性介于离子键和配位键之间,形成的化合物多为分子结构。
例如,乙二胺(C2H8N2)和铜离子(Cu2+)之间的配位键形成共价键。
配位键是一种特殊的键,是通过配体中的一个或多个原子的孤对电子与中心金属离子形成的键。
配位键的特点是配体中的原子与中心金属离子之间形成较强的键,常见于水合配合物中。
三、配位化合物的结构分析配位化合物的结构可以通过各种实验手段进行分析,例如X射线衍射、红外光谱和核磁共振等技术。
X射线衍射是一种常用的分析方法,通过测量样品对X射线的散射模式来确定配位化合物的晶体结构。
这种技术可以提供有关晶体中原子位置和键角的信息。
红外光谱可以用于表征配位化合物中化学键的类型和它们的振动方式。
不同的配位键对应不同的振动频率,通过红外光谱可以确定配位化合物中存在的配位键类型。
核磁共振是通过测量核磁共振信号来确定配位化合物中的原子位置和电子环境。
这种技术可以提供有关中心金属离子周围的配体以及它们之间的相互作用的信息。
. 精品 第七章 配位化合物 一、单项选择题 1. 下列物质中不能作为配体的是 ( B ) A. NH3 B. NH4+ C. OH- D. NO2-
2. 下列离子或化合物中,具有顺磁性的是 ( B ) A. Ni(CN)24 B. CoCl24 C. Co(NH3)36 D. Fe(CO)5
3.在配合物[Co(NH3)4(H2O)]2(SO4)3中,中心离子的配位数为 ( B )
A. 4 B. 5 C. 9 D. 12 4. 配离子[Co(NH3)6]2+的空间构型为 ( A ) A. 八面体 B. 四方锥形 C. 四面体 D. 三角双锥 5. EDTA 是四元弱酸,当其水溶液pH 12时,EDTA的主要存在形式为 ( C ) A. H4Y; B. H3Y; C. Y4-; D. HY3- 6.下列关于价键理论对配合物的说法正确的是 ( C ) A. 任何中心离子与任何配体都可形成外轨型化合物; B. 任何中心离子与任何配体都可形成内轨型化合物; C. 中心离子用于形成配位键的原子轨道是经过杂化的等价轨道; D. 以sp3d2和d2sp3杂化轨道成键的配合物具有不同的空间构型。 7.下列物质中能被氨水溶解的是 ( B ) A. Al(OH)3 B. AgCl C. Fe(OH)3 D. AgI 8. 下面哪一个不属于EDTA与金属离子形成螯合物的特点 ( B ) A. 具有环状结构 B . 稳定性差 C. 配位比一般为1:1 D. 易溶于水 9. 下列说法欠妥的是: ( C ) A. 配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。 B. 螯合物以六员环、五员环较稳定。 C. 配位数就是配位体的个数。 D. 二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。 10. AgCl在11molL
氨水中比在纯水中的溶解度大,其原因是 ( B )
A. 盐效应 B. 配位效应 C. 酸效应 D. 同离子效应 11. 离子以dsp2杂化轨道成键而形成的配合物,其空间构型是 ( A ) A. 平面正方形 B. 四面体形 C. 直线形 D. 八面体形 12. 22Cu(en)的稳定性比234Cu(NH)大得多,主要原因是前者 ( B ) A. 配体比后者大; B. 具有螯合效应; C. 配位数比后者小; D. en的分子量比NH3大。 13. Al3+与EDTA形成 ( A ) A. 鳌合物 B. 聚合物 C. 非计量化合物 D. 夹心化合物 14.下列说法中错误的是 ( D ) A. 配体的配位原子必须具有孤电子对。 B. 配离子的配位键愈稳定,其稳定常数愈大。. 精品 C. 配合物的颜色最好用晶体场或配位场理论解释。 D. 配合物的颜色最好用价键理论来解释。 15. 下列几种物质中最稳定的是 ( A ) A. [Co(en)3]Cl3 B. [Co(NH3)6] (NO3)3
C. [Co(NH3)6]Cl2 D. Co(NO3)3
16. 下列配离子在强酸中能稳定存在的是 ( D )
A. [Fe(C2O4)]3- B. [AlF6]3- C. [Mn(NH3)6]2+ D. [AgCl2]- 17.下列叙述中正确的是 ( D ) A. 配合物中的配位键必定是由金属离子接受电子对形成的 B. 配合物都有内界和外界 C. 配位键的强度低于离子键或共价键 D. 配合物中,中心原子(离子)与配位原子间以配位键结合 18. 下列水溶液中的反应,其标准平衡常数可作为[FeF6]3-的稳定常数的是( A ) A. [Fe(H2O)6]3+ + 6F- = [FeF6]3- + 6H2O B. [FeF6]3- = Fe3+ + 6F-
C. [FeF6]3- + 6H2O = [Fe(H2O)6]3+ + 6F-
D. [FeF6]3- + H2O = [FeF5(H2O)]2- + F-
19. 下列物质中的中心离子磁矩最小的是 ( B ) A. [Fe(CN)6]3- B. [Co(CN)6]3- C. [Cu(NH3)4]2+ D. [FeF6]3-
20. 配合物K2[Zn(OH)4]的名称是: ( C ) A. 氢氧化锌钾 B. 四氢氧化锌(II)钾 C. 四羟基合锌(II)酸钾 D. 四羟基合锌(II)钾 21. 下列配离子都具有相同的强场配体CN-,其中属于外轨型配合物的是( A ) A . [Zn(CN)4]2- B. [Fe(CN)6]3- C. [Ni(CN)4]2- D. [Co(CN)6]3-
22. 下列说法中错误的是 ( D )
A. 一般说来内轨型配合物较外轨型配合物稳定 B. 在[Cu(en)2]2+中,Cu2+的配位数是4 C. CN-和CO作为配体时力图形成内轨型配合物 D. 金属原子不能作配合物的形成体 23. NH4[Cr(NCS)4(NH3)2]的正确名称是 ( B ) A. 四(硫氰酸根)·二氨合铬(Ⅲ)酸铵 B. 四(异硫氰酸根)·二氨合铬(Ⅲ)酸铵 C. 四(异硫氰酸根)·二氨合铬酸铵 D. 四(硫氰酸)·二氨合铬(Ⅲ)酸铵 24. 内轨型配离子[Fe(CN)6]3-的磁距等于2.0 B.M.,判断其空间构型和中心离子的杂化轨道分别为 ( D ) A. 四面体形和sp3 B. 正方形和dsp2 C. 八面体形和sp3d2 D. 八面体形和d2sp3
25. 下列配离子中最稳定的离子是: ( D ) A. [AgCl2] B. [Ag(NH3)2]+ C. [Ag(S2O3)2]3 D. [Ag(CN)2] 26. 以下表达式中,正确的是: ( C )
A. /MY(MY)MYfcKccΘ B. /f
MY
MYKΘ
C. fMY(MY)MYK D. f
MY(MY)MYK. 精品 27. 利用生成配合物而使难溶电解质溶解时,最有利于沉淀的溶解的条件是 ( B ) A. lgKMY愈大,Ksp愈小 B. lgKMY愈大,Ksp愈大 C. lgKMY愈小,Ksp愈大 D. lgKMY >>Ksp 28. 在[Co(en)2Cl2]+离子中,钴的氧化数和配位数分别为: ( C ) A. 0和4 B. +2和4 C. +3和6 D. +2和6 29. 某金属离子生成的两种配合物的磁矩分别为μ=4.90 BM和μ=0.00 BM,则该金属可能是: ( B ) A. Cr3+ B. Fe2+ C. Mn2+ D. Zn2+
30. 配合物K3[Fe(CN)5CO]的中心离子杂化类型是: ( C ) A. sp3d2 B. dsp3 C. d2sp3 D. sp3d 31. EDTA与金属离子形成的配合物的配位比一般为 ( A ) A. 1﹕1 B. 1﹕2 C. 2﹕1 D. 1﹕3 32. 在0.20 1molL [Ag(NH3)2]Cl溶液中,加入等体积的水稀释(忽略离子强度影响),则下
列各物质的浓度为原来浓度的21的是 ( D ) A. c([Ag(NH3)2]Cl) B. 解离达平衡时c(Ag+) C. 解离达平衡时c(NH3·H2O) D. c(Cl-) 33. 向 [Cu(NH3)4]2+水溶液中通入氨气,则 ( D ) A. K稳([Cu(NH3)4]2+)增大 B. [Cu2+]增大 C. K稳([Cu(NH3)4]2+)减小 D. [Cu2+]减小 34. 对于配合物中心体的配位数,说法不正确的是 ( A ) A. 直接与中心体键合的配位体的数目 B. 直接与中心体键合的配位原子的数目 C. 中心体接受配位体的孤对电子的对数 D. 中心体与配位体所形成的配价键数 35. [Ca(EDTA)]2-配离子中,Ca2+的配位数是 ( D ) A. 1 B. 2 C. 4 D. 6 36. 在[Co(en)(C2O4)2]配离子中,中心离子的配位数为 ( D ) A. 3 B. 4 C. 5 D. 6 37. 在[Ru(NH3)4Br2]+中,Ru的氧化数和配位数分别是 ( C ) A. +2和4 B. +2和6 C. +3和6 D. +3和4 38. Fe的原子序数为26,化合物K3[FeF6]的磁矩为5.9 B.M.,而 K3[Fe(CN)6]的磁矩为2.4 B.M.,这种差别的原因是 ( C ) A. 铁在这两种配合物中有不同的氧化数 B. CN-比F-引起的晶体场分裂能更小 C. F比C或N具有更大的电负性 D. K3[FeF6]不是配位化合物 39. 对配位反应的条件稳定常数K'MY而言,下列说法正确的是: ( C )
A. K'MY是常数,不受任何条件限制;
B. K'MY的大小完全是由KMY决定的; C. K'MY的大小表示有副反应发生时主反应进行的程度;. 精品 D. K'MY的大小只受溶液酸度的影响 40. 影响EDTA滴定反应平衡常数的因素有: ( A ) A. 温度; B. 催化剂; C. 反应物浓度; D. 反应速率
41. 已知lgKAlY=16.1,pH=10时lgY(H)=0.5,AlY的条件稳定常数lgKAlY'是: ( B ) A. 16.6; B. 15.6; C. 15.1; D. 8.5 42.Fe3+具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P所要满足的条件是 ( C )
A. △和P越大越好 B. △> P C. △< P D. △= P 43. 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋和低自旋的电子构型是 ( C ) A. d2 B. d3 C. d4 D. d8
44. 下列说法中正确的是( D) A. 配位原子的孤电子对越多,其配位能力就越强 B. 电负性大的元素充当配位原子,其配位能力也强 C. CH3-C-OH配体是双齿配体 D. 在[Cu(en)2]2+中,Cu2+的配位数是4 45. 解释在FeCl3溶液中滴加KCNS试剂,溶液变红的原因是( B) A. FeCl3溶液被稀释放 B. 生成了[Fe(CNS)6]3- C. 没有反应 D. 生成了Fe(CNS)3沉淀 46. 以CN-和CO作配体时较之以F-和H2O作配体时形成的配合物多为内轨型,其原因是( A) A. 在CN-和CO中的C较之F和O更易提供电子对 B. C比O和F的原子半径大,极化率大,易变形,所提供的电子对易进入中心体的内层空轨道 C. C的原子量较之F和O小 D. CN-和CO的式量较之F和O的原子量大 47. 已知AgI 的Ksp=K1,[Ag(CN)2]-的K稳=K2,则下列反应的平衡常数K为( A) AgI(s)+2CN- [Ag(CN)2]-+I-