包涵体纯化
- 格式:docx
- 大小:27.18 KB
- 文档页数:10

包涵体:包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。
包涵体的组成与特性:一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、外膜蛋白ompC、ompF 和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等,大小为0.5-1um,难溶与水,只溶于变性剂如尿素、盐酸胍等。
包涵体的形成:主要因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,或环境不适,无法形成正确的次级键等原因形成的。
1、表达量过高,研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。
原因可能是合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确的配对,过多的蛋白间的非特异性结合,蛋白质无法达到足够的溶解度等。
2、重组蛋白的氨基酸组成:一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关。
3、重组蛋白所处的环境:发酵温度高或胞内pH接近蛋白的等电点时容易形成包涵体。
4、重组蛋白是大肠杆菌的异源蛋白,由于缺乏真核生物中翻译后修饰所需酶类,致使中间体大量积累,容易形成包涵体沉淀。
因此有人采用共表达分子伴侣的方法以增加可溶蛋白的比例。
包涵体表达的有利因素:1、可溶性蛋白在细胞内容易受到蛋白酶的攻击,包涵体表达可以避免蛋白酶对外源蛋白的降解。
2、降低了胞内外源蛋白的浓度,有利于表达量的提高。
3、包涵体中杂蛋白含量较低,且只需要简单的低速离心就可以与可溶性蛋白分离,有利于分离纯化。
4、对机械搅拌和超声破碎不敏感,易于破壁,并与细胞膜碎片分离。
破菌:1、机械破碎2、超声破碎3、化学方法破碎分离:1、离心:5000-20000g15min离心,可使大多数包涵体沉淀,与可溶性蛋白分离。
2、过滤或萃取方法:洗涤:由于脂体及部分破碎的细胞膜及膜蛋白与包涵体粘连在一起,在溶解包涵体之前要先洗涤包涵体,通常用低浓度的变性剂如2M尿素在50mM TrispH7.0-8.5左右,1mMEDTA中洗涤。

包涵体的纯化和复性总结(二)关于包涵体的纯化是一个令人头疼的问题,包涵体的复性已经成为生物制药的瓶颈,关于包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化,内容比较庞杂一、菌体的裂解1、怎样裂解细菌?细胞的破碎方法1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
此法适用于动物内脏组织、植物肉质种子等。
2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG 频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。
对超声波及热敏感的蛋白和核酸应慎用。
4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。
无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。


<包涵体的纯化和复性总结二、包涵体的洗涤1、包涵体的洗涤问题通常的洗涤方法一般是洗不干净的,我以前是这么做的,先把包涵体用6M盐酸胍溶解充分,过滤除去未溶解的物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以一直稀释到合适的浓度,你可以找到一个合适去除杂质的办法,其实这就是梯度沉淀的方法,我觉得比通常的直接洗脱效果好。
包涵体一般难溶解,所以你要注意未溶解的部分,你可以跑电泳对比,因为有时候难溶解的就是你的目标蛋白,所以每次处理都要把上清和沉淀跑电泳对比,免得把目标蛋白弄丢了。
此外刚处理完的包涵体好溶解。
冷冻后难溶解,溶解也需要长点时间,也需要大量的溶剂。
如果说是不少不溶解的不是你要的,那就不用管了。
2、如何得到比较纯的包涵体对于包涵体的纯化,包涵体的前处理是很重要的。
包涵体中主要含有重组蛋白,但也含有一些细菌成分,如一些外膜蛋白、质粒DNA和其它杂质。
洗涤常用1%以下的中性去垢剂,如Tween、Triton、Lubel和NP40等加EDTA和还原剂2-巯基苏糖醇(DTT)、β-巯基乙醇等反复多次进行,因去垢剂洗涤能力随溶液离子强度升高而加强,在洗涤包涵体时可加50 mM NaCL。
这样提取的包涵体纯度至少可达50%以上,而且可保持元结构。
也可用低浓度的盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去包涵体表面吸附的大部分不溶性杂蛋白。
洗涤液pH以与工程菌生理条件相近为宜,使用的还原剂为0.1-5mM。
EDTA为0.1-0.3 mM。
去垢剂如Triton X-100、脱氧胆酸盐和低浓度的变性剂如尿素充分洗涤去除杂质,这一步很重要,因为大肠杆菌外膜蛋白Omp T(37 KDa)在4-8mol/L尿素中具有蛋白水解酶活性,在包涵体的溶解和复性过程中可导致重组蛋白质的降解。
对于尿素和盐酸胍的选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。

包涵体产物的纯化工艺
纯化涉及从原料中分离和去除杂质以获得纯净化合物的工艺。
对于包含有机或无机物的体产物,其纯化工艺可以根据具体情况进行调整,但以下是一般常用的几种纯化工艺:
1. 结晶:通过温度控制和溶剂选择,使目标化合物从溶液中结晶出来,然后进行过滤、洗涤和干燥等步骤,以获得纯净的产物。
2. 蒸馏:利用成分之间的沸点差异来分离和纯化混合物。
通过加热混合物,使成分按照沸点的高低逐渐蒸发和冷凝,从而分离目标化合物。
3. 萃取:利用不同物质在不同溶剂中的溶解度差异,将目标化合物从混合物中分离提取出来。
常见的萃取方法包括溶剂萃取、液液萃取和固相萃取等。
4. 色谱:利用样品成分在移动相和固定相之间的差异,通过一系列分离和纯化步骤来分离和纯化产物。
常见的色谱方法包括薄层色谱、柱层析、高效液相色谱和气相色谱等。
5. 活性炭吸附:通过将目标化合物吸附在活性炭上,去除混合物中的杂质物质,从而纯化产物。
这种方法常用于水处理、空气净化和溶剂回收等领域。
6. 晶体化学:通过对化合物晶体结构的解析和再合成,消除晶体中的杂质,实
现产物纯化。
以上是一些常见的纯化工艺,具体选择哪种工艺取决于产物性质、目标纯度要求、经济性和实际应用等因素。

一、实验目的1. 掌握包涵体纯化的基本原理和操作步骤。
2. 学习利用离子交换层析法对包涵体进行纯化。
3. 评估包涵体纯化效果,并探讨优化纯化条件的方法。
二、实验原理包涵体是细菌表达外源蛋白时形成的一种不溶性蛋白质聚集体。
由于包涵体中的蛋白质缺乏生物活性,因此需要通过一系列操作将其溶解、复性,并最终纯化得到具有生物活性的蛋白质。
本实验采用离子交换层析法对包涵体进行纯化,通过改变缓冲液中的离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合,从而实现蛋白质的分离和纯化。
三、实验材料1. 包涵体样品2. 离子交换层析柱3. 标准蛋白样品4. 标准缓冲液5. 蛋白质浓度测定试剂盒6. 超声波破碎仪7. 离心机8. 荧光分光光度计9. 数据处理软件四、实验步骤1. 包涵体样品的处理将包涵体样品用超声波破碎仪处理,使包涵体溶解。
然后将溶液离心,取上清液作为后续实验的样品。
2. 样品预处理将样品用缓冲液稀释,调整离子强度和pH值,使包涵体中的蛋白质与层析柱上的亲和基团结合。
3. 离子交换层析将预处理后的样品上柱,用缓冲液进行洗脱,收集洗脱液。
4. 蛋白质纯化效果评估采用蛋白质浓度测定试剂盒对洗脱液进行蛋白质浓度测定,比较不同洗脱液中的蛋白质浓度,评估纯化效果。
5. 数据处理与分析利用数据处理软件对实验数据进行统计分析,探讨优化纯化条件的方法。
五、实验结果1. 包涵体样品经过超声波破碎后,溶液变得清澈,说明包涵体已成功溶解。
2. 通过离子交换层析法,成功将包涵体中的蛋白质与层析柱上的亲和基团结合,实现了蛋白质的分离和纯化。
3. 通过蛋白质浓度测定,发现洗脱液中的蛋白质浓度明显高于未处理的样品,说明纯化效果良好。
4. 通过数据分析,发现改变缓冲液中的离子强度和pH值对包涵体纯化效果有显著影响。
在一定范围内,增加离子强度和降低pH值有利于提高蛋白质的纯化效果。
六、实验结论1. 本实验成功实现了包涵体的纯化,并获得了具有生物活性的蛋白质。

包涵体洗涤纯化-CAL-FENGHAI.-(YICAI)-Company One11包涵体洗涤试剂1.1裂解液50mmol/L Tris·Cl(pH7.2),10mmol/L EDTA,300mmol/L NaCl.。
1.2Buffer I20mmol/L Tris-HCl,5mmol/L EDTA,100mM NaCl。
1.32M/4M/8M 尿素溶液分别称取2mol/4mol/8mol的尿素,用Buffer I定容至1L即可。
2工程菌的大量表达从平板上挑生长饱满的单克隆菌落接种于25ml LB(含抗生素),37℃振荡培养过夜。
将培养菌液按1:1000扩种,至装有500ml LB(含抗生素)的1000ml三角培养瓶中,培养的瓶数根据需要而定。
37℃振荡培养,至OD600nm1.0左右。
使菌液冷却,加IPTG至终浓度为0.2mmol/L,25℃,诱导6hr。
收集菌体,4℃,10,000g离心4min。
以培养液体积的1/50量的裂解液悬浮。
冰浴,用超声破碎仪或高压均质机破碎菌体。
超声条件为:输出功率70%,作用2sec、间歇4sec为一个脉冲,共作用时间累计30min/100ml裂解液。
同时保留上清和沉淀部分,分别制样进行SDS-PAGE分析。
3包涵体的洗涤纯化包涵体沉淀以裂解液等体积的2% Triton X100(Buffer I溶解)重悬,37℃,振荡30min。
4℃,8,000g,离心10min,沉淀以等体积的Buffer I重悬,超声波处理5min/100ml悬浮液。
4℃,8,000g,离心10min,沉淀以等体积的2% Triton X100(Buffer I 溶解)重悬,37℃,振荡30min。
4℃,8,000g,离心10min,沉淀以等体积的Buffer I重悬,37℃,振荡30min。
4℃,8,000g,离心10min,沉淀以等体积的2mol/L尿素溶解,室温搅拌30min。
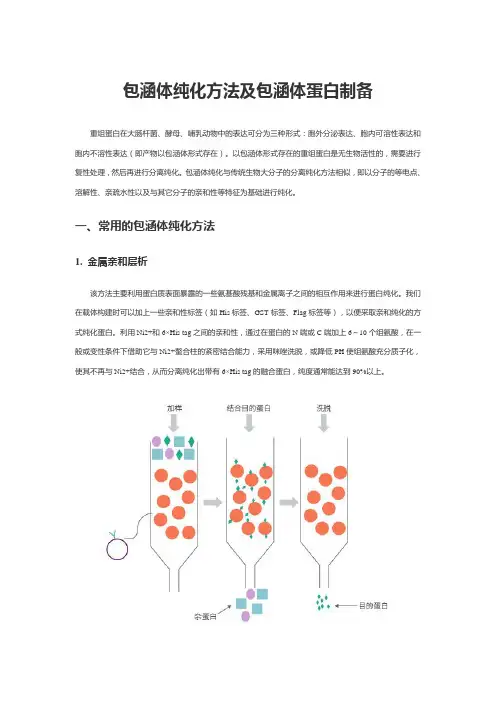
包涵体纯化方法及包涵体蛋白制备重组蛋白在大肠杆菌、酵母、哺乳动物中的表达可分为三种形式:胞外分泌表达、胞内可溶性表达和胞内不溶性表达(即产物以包涵体形式存在)。
以包涵体形式存在的重组蛋白是无生物活性的,需要进行复性处理,然后再进行分离纯化。
包涵体纯化与传统生物大分子的分离纯化方法相似,即以分子的等电点、溶解性、亲疏水性以及与其它分子的亲和性等特征为基础进行纯化。
一、常用的包涵体纯化方法1. 金属亲和层析该方法主要利用蛋白质表面暴露的一些氨基酸残基和金属离子之间的相互作用来进行蛋白纯化。
我们在载体构建时可以加上一些亲和性标签(如His标签、GST标签、Flag标签等),以便采取亲和纯化的方式纯化蛋白。
利用Ni2+和6×His tag之间的亲和性,通过在蛋白的N端或C端加上6~10个组氨酸,在一般或变性条件下借助它与Ni2+螯合柱的紧密结合能力,采用咪唑洗脱,或降低PH使组氨酸充分质子化,使其不再与Ni2+结合,从而分离纯化出带有6×His tag的融合蛋白,纯度通常能达到90%以上。
2.离子交换层析离子交换层析是根据在一定pH条件下,蛋白质所带电荷不同而进行的分离的方法。
常用的离子交换剂有羧甲基纤维素(阳离子交换剂,弱酸型)和二乙基氨基乙基纤维素(阴离子交换剂,弱碱型)。
阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,需要通过提高洗脱液中的盐浓度等措施将其洗脱下来。
根据蛋白质结合能力不同,洗脱的速度会存在差异,通常结合较弱的蛋白质先被洗脱。
反之,阳离子交换基质会结合带有正电荷的蛋白质,可以通过提高洗脱液的PH或增加洗脱液中的盐浓度将蛋白洗脱下来。
3.凝胶过滤层析凝胶过滤层析通常又称为分子筛方法,主要是根据蛋白质的大小和形状达到分离和纯化的目的。
一般是大分子先流出来,小分子后流出来。
此方法的优点在于层析所用的凝胶属于惰性载体,不带电荷并且吸附力弱,可较广的温度范围内进行。

包涵体的纯化关于包涵体的纯化是一个令人头疼的问题,包涵体的复性已经成为生物制药的瓶颈,关于包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化,内容比较庞杂一、菌体的裂解1、怎样裂解细菌?细胞的破碎方法1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
此法适用于动物内脏组织、植物肉质种子等。
2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。
对超声波及热敏感的蛋白和核酸应慎用。
4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。
无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。

基因工程包涵体的纯化方法基因工程可真是个神奇的领域,像是现代科技的魔法师,把DNA这个小家伙们玩弄得团团转。
在这片神秘的土地上,包涵体就像是隐藏的宝藏,得先把它们找出来,再通过纯化的方法把这些小宝贝洗净,才能让它们为我们所用。
今天,我们就来聊聊基因工程包涵体的纯化方法,让这趟旅程轻松愉快。
1. 什么是包涵体?首先,包涵体可不是某种古怪的生物,它们其实是细胞在生产某些蛋白质时,形成的一种颗粒。
就像是做饭时,锅里油烟聚集的那些小油滴,虽然它们看起来不太好,但里面可藏着好东西。
你要知道,包涵体里面有大量的目标蛋白质,但通常它们会和其他杂质混在一起,像是大海捞针,得费点功夫才能捞出来。
1.1 包涵体的形成当细胞用上基因工程的技术,强行让某种蛋白质“上班”时,有时候它们就会不太乖,聚集成包涵体。
这就像你在做作业时,有的题目就特别难,结果一堆答案写错了,最后只好把它们堆到一边。
虽然包涵体一开始可能看起来像个废物,但其实它们是生产特定蛋白质的一种“副产品”。
1.2 包涵体的用途那包涵体有什么用呢?别小看了它们,它们可是制药、疫苗开发的重要角色。
有的包涵体能转化为活跃的蛋白质,成为我们需要的药物,甚至可以用于研究新治疗方法,简直就是科研界的“黑马”。
所以,找到它们、纯化它们,那可是相当重要的任务。
2. 包涵体的纯化步骤接下来,我们就要聊聊如何把这些包涵体给纯化出来,步骤其实不复杂,但得有点耐心。
2.1 细胞裂解首先,得把细胞给撬开,就像剥开一个鸡蛋,才能见到里面的蛋黄。
这里我们通常会用一些裂解缓冲液,像是加盐的水,帮助细胞膜变得松软。
然后,咱们可以用超声波处理、化学试剂或者冷冻融化的方式把细胞打散,让包涵体慢慢浮出来。
2.2 离心分离一旦细胞裂解,包涵体就会在液体中游荡。
这时候,就要用离心机来大显身手了。
离心机就像是一位厨师,用强大的“旋转功力”把细胞残骸和包涵体分开。
你可以想象,把一大锅汤放进离心机,旋转后,沉淀物就会在底下,清汤会在上面。

包涵体蛋白纯化步骤生物日记部落,这次将会擦掉黑板上曾经书写的知识笔记,转角进入“包涵体蛋白”。
包涵体蛋白纯化的步骤主要包括裂解、洗涤、溶解、复性、纯化。
在实验前线着手于瓶瓶罐罐的大家,实验所纠结的问题或许总会缠绕身前身后,闯入梦中。
在情理之中时,又是怎么看待“处理实验问题”的态度?两天一个周期的实验结束,没有结果,暂且随之不作为,接着重复做一次。
小伙伴们,这是一种正确的态度么?“如果你的工具只有一柄铁锤,你就可能认为所有的问题都是铁钉”。
回想,变通,将路延伸在嘴巴上请教,预测时间进程,交叉重复,这是在过去灰色的记忆里想起的一位老师给我讲的一种态度。
将态度按照个人的素养去演绎变幻,就会有多条路,意外到问题本身。
——看的见的问题是态度本身包涵体蛋白纯化步骤包涵体洗涤包涵体溶解包涵体复性包涵体纯化1、包涵体裂解细胞内重组蛋白的提取要依照蛋白的来源和性质选择合适的方法,蛋白一般来源于细菌、植物、哺乳动物细胞等。
细胞裂解常用的方法有:酶解法、研磨、匀浆、超声破碎法、冻融等。
(1) 细胞酶解:在稀释菌液中加入0.2-0.4 mg/ml 溶菌酶、1 mM MgCl 2、20 μg/mlDNase 、1mM PMSF ,混均匀,冰上或者室温放置30 min 。
根据目的蛋白对温度的敏感性选择合适的温度。
向着太阳是向日葵不变的态度(2)机械裂解:加入1% Triton X-100,充分混匀,冰上放置15 min,在冰上用超声波破碎细胞10 min,至细胞变澄清,或在-20℃下冰冻,室温溶解,反复冻融5次以上;4 ℃,5000 r/min离心15 min,弃上清,用0.45 μm或0.22 μm的滤膜过滤除去细胞碎片;在细胞裂解时应该注意:a 尽量选择比较温和的处理方法,避免太剧烈地操作导致目的蛋白变性,或者蛋白酶释放。
b 为了保持蛋白质的稳定性,在蛋白的提取时应迅速,低温,添加蛋白酶抑制剂,例如,加入DFP(二异丙基氟磷酸)抑制或者减慢自容,加入碘乙酸抑制巯基作用的蛋白水解酶活性,加入PMSF(苯甲磺酰基氟化物)抑制蛋白水解酶的活性,另外,选择合适的缓冲溶液稳定蛋白溶液的PH值及离子强度,添加DNA酶降低核酸的粘稠度。
包涵体蛋白纯化步骤引言:包涵体蛋白纯化是生物技术和生物制药领域中重要的工艺步骤之一。
通过纯化包涵体蛋白,可以获得高纯度的目标蛋白,为后续的研究和应用提供了基础。
本文将介绍包涵体蛋白纯化的一般步骤,包括细胞破碎、包涵体回收、包涵体溶解、亲和层析和蛋白质再折叠等。
一、细胞破碎:细胞破碎是包涵体蛋白纯化的第一步。
通常使用机械方法(如超声波破碎或高压均质)或化学方法(如洗涤剂破碎)来破碎细胞,释放包涵体蛋白。
需要注意的是,破碎条件应该使得包涵体蛋白能够充分溶解而不会发生蛋白质降解。
二、包涵体回收:包涵体蛋白通常以包涵体的形式存在于细胞裂解液中。
包涵体回收是将包涵体从其他细胞成分中分离出来的过程。
一种常用的方法是通过离心将细胞碎片和其他细胞成分与包涵体分离。
此外,还可以使用过滤、沉淀或超滤等技术来实现包涵体的回收。
三、包涵体溶解:包涵体蛋白在还原条件下通常以不溶性的形式存在。
为了使包涵体蛋白能够溶解,通常需要添加变性剂(如尿素或胍氯酸)和还原剂(如二硫醇)。
通过调节溶解条件,可以使得包涵体蛋白迅速溶解为可溶性蛋白。
四、亲和层析:亲和层析是包涵体蛋白纯化的关键步骤之一。
通过将目标蛋白与亲和层析介质上的亲和配体结合,可以实现目标蛋白的富集和纯化。
亲和配体可以是金属离子、抗体或亲和标签等。
在亲和层析过程中,需要注意选择合适的亲和配体和适宜的洗脱条件,以实现对目标蛋白的高效纯化。
五、蛋白质再折叠:由于包涵体蛋白在还原条件下溶解,其折叠状态通常不完整。
为了使得目标蛋白具有正确的结构和功能,需要对其进行再折叠。
常用的再折叠方法包括逐渐降低变性剂浓度、添加折叠辅助剂和调节pH 值等。
通过适当的再折叠条件,可以使得目标蛋白恢复到天然的折叠状态。
结论:包涵体蛋白纯化是一项复杂的工艺步骤,需要经过细胞破碎、包涵体回收、包涵体溶解、亲和层析和蛋白质再折叠等步骤。
通过这些步骤的有序进行,可以得到高纯度和高活性的包涵体蛋白。
随着生物技术和生物制药的不断发展,对包涵体蛋白纯化技术的要求也越来越高,希望通过不断的研究和创新,能够进一步提高包涵体蛋白纯化的效率和纯度,为生物医药领域的研究和应用提供更好的支持。
包涵体的纯化和复性总结二、包涵体的洗涤1、包涵体的洗涤问题通常的洗涤方法一般是洗不干净的,我以前是这么做的,先把包涵体用6M盐酸胍溶解充分,过滤除去未溶解的物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以一直稀释到合适的浓度,你可以找到一个合适去除杂质的办法,其实这就是梯度沉淀的方法,我觉得比通常的直接洗脱效果好。
包涵体一般难溶解,所以你要注意未溶解的部分,你可以跑电泳对比,因为有时候难溶解的就是你的目标蛋白,所以每次处理都要把上清和沉淀跑电泳对比,免得把目标蛋白弄丢了。
此外刚处理完的包涵体好溶解。
冷冻后难溶解,溶解也需要长点时间,也需要大量的溶剂。
如果说是不少不溶解的不是你要的,那就不用管了。
2、如何得到比较纯的包涵体对于包涵体的纯化,包涵体的前处理是很重要的。
包涵体中主要含有重组蛋白,但也含有一些细菌成分,如一些外膜蛋白、质粒DNA和其它杂质。
洗涤常用1%以下的中性去垢剂,如Tween、Triton、Lubel和NP40等加EDTA 和还原剂2-巯基苏糖醇(DTT)、β-巯基乙醇等反复多次进行,因去垢剂洗涤能力随溶液离子强度升高而加强,在洗涤包涵体时可加50 mM NaCL。
这样提取的包涵体纯度至少可达50%以上,而且可保持元结构。
也可用低浓度的盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去包涵体表面吸附的大部分不溶性杂蛋白。
洗涤液pH以与工程菌生理条件相近为宜,使用的还原剂为0.1-5mM。
EDTA为0.1-0.3 mM。
去垢剂如Triton X-100、脱氧胆酸盐和低浓度的变性剂如尿素充分洗涤去除杂质,这一步很重要,因为大肠杆菌外膜蛋白Omp T(37 KDa)在4-8mol/L尿素中具有蛋白水解酶活性,在包涵体的溶解和复性过程中可导致重组蛋白质的降解。
对于尿素和盐酸胍的选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
包涵体蛋白3种纯化方法的比较目的比较3种纯化方法对表达的肠道病毒71型(EV71)VP1区包涵体蛋白的纯化效果。
方法分别用差速离心法、固定化金属离子亲和层析(IMAC)及不同浓度饱和硫酸氨沉淀法3种包涵体蛋白纯化法对原核表达EV71 VP1包涵体蛋白进行纯化,蛋白垂直(SDS-PAGE)电泳检测蛋白纯化效果。
结果差速离心法可以进行大批量表达蛋白纯化,纯化效果较好,但存在蛋白损失较多,且纯化蛋白不能反复冻融的问题。
IMAC柱纯化获得的蛋白纯度较高,且蛋白性状稳定,但仍存在纯化蛋白量较少的问题。
饱和硫酸氨沉淀纯化法无法获得纯度较高的包涵体蛋白。
结论差速离心法可用于大批量蛋白纯化,纯化蛋白应避免反复冻融,可小量分装冻存后备用。
IMAC柱纯化可获得纯度较高且性状相对稳定的纯化蛋白,其在相应抗体检测方法学的建立及疫苗制备方面均有广泛用途。
饱和硫酸氨法只适用于表达蛋白的初步浓缩纯化。
[Abstract] Objective To compare the expressed inclusion body protein of EV71 VP1 with three purification methods. Methods The expressed EV71 VP1 inclusion body protein was purified by differential centrifugation,IMAC column purification and ammonium sulfate precipitation. SDS-PAGE experiments determinate the purity effects. Results Expressed inclusion body purification in large quantities could been undertaken by differential centrifugation and the purification effect was better but with a lot of protein loss and the purified protein could not be repeatedly frozen and thawed. The purification effect of IMAC was good and stable,but less purified protein was purified. High purity of inclusion body protein wasn’t obtained by ammonium sulfate precipitation. Conclusion Differential centrifugation is applicable in large quantities of protein purification,but avoid repeatedly freezing and thawing. The protein purification of IMAC can be used to establish corresponding antibody detection methods. The ammonium sulfate precipitation is only applicable for the preliminary purification of the expressed proteins.[Key words] Inclusion body protein;Protein purification;SDS-PAGE electrophoresis包涵体是外源基因在细胞中表达量过高形成的一种膜包裹的高密度、不溶性蛋白颗粒。
1. 融合蛋白上清液及包涵体溶解液的制备1) 按照摸索出的最佳表达条件集菌400mL,6000rpm离心10min,收集菌体;2) 用40ml的缓冲液重悬菌体进行洗涤,重离心弃上清;3) 加40ml冰浴的缓冲液,重悬菌体沉淀4) 冰上超声破碎菌体,超声2s,间隔10s,功率800W,超声40次;5) 18000rpm离心30min,取上清备用;6) 向离心后沉淀中加入40ml的包涵体洗涤液,重悬沉淀,冰浴超声洗涤一次:超声2s,间隔10s,功率1200W,超声40次;7) 12000rpm离心10min,弃上清,留沉淀;8) 包涵体沉淀的溶解:向洗涤后的包涵体沉淀中加入20ml的包涵体溶解液,用5mL枪头吹散沉淀,室温下放置1个小时使其充分溶解,18000rpm离心30min,取上清即得包涵体溶解液;9) 将包涵体溶解液装入透析袋中(透析范围:8000-14000),置于含4mol/L尿素的透析液中,4℃透析2h,然后转入含2mol/L尿素的透析液中,4℃透析12h,最后转入含0mol/L尿素的透析液中,4℃透析24h,充分脱尿素。
2. 利用凝血酶切割融合蛋白得到目的蛋白按照10bp凝血酶/mg融合蛋白的比例加入凝血酶,25℃水浴切割12h。
3. 利用GST亲和层析纯化融合蛋白菌体破碎后上清或者透析后包涵体溶解液1) 30ml的1×PBS预平衡Glutathione-Sepharose 2ml柱(含1ml Glutathione-Sepharose亲和介质),液体的流速0.4ml/min;2) 上样:菌体破碎后上清或者透析后包涵体溶解液过Glutathione-Sepharose 2ml柱,反复过两次;3) 洗涤杂蛋白:用10ml的1×PBS洗涤杂蛋白;4) 洗脱:向柱子中加入洗脱液(10mM reduced Glutathione)进行洗脱,利用记录仪记录洗脱峰;5) 收集洗脱液,利用Bradford法检测蛋白浓度;6) 用30ml的1×PBS洗涤Glutathione-Sepharose 2ml柱;7) 用10ml的含有20%乙醇的1×PBS洗涤Glutathione-Sepharose 2ml柱,4℃保存。
包涵体(inclusion body)的纯化包涵体是外源基因在原核细胞中表达时,尤其在大肠杆菌中高效表达时,形成的由膜包裹的高密度、不溶性蛋白质颗粒,在显微镜下观察时为高折射区,与胞质中其他成分有明显区别。
包涵体形成是比较复杂的,与胞质内蛋白质生成速率有关,新生成的多肽浓度较高,无充足的时间进行折叠,从而形成非结晶、无定形的蛋白质的聚集体;此外,包涵体的形成还被认为与宿主菌的培养条件,如培养基成分、温度、pH值、离子强度等因素有关。
细胞中的生物学活性蛋白质常以可融性或分子复合物的形式存在,功能性的蛋白质总是折叠成特定的三维结构型。
包涵体内的蛋白是非折叠状态的聚集体,不具有生物学活性,因此要获得具有生物学活性的蛋白质必须将包涵体溶解,释放出其中的蛋白质,并进行蛋白质的复性。
包涵体的主要成分就是表达产物,其可占据集体蛋白的40%~95%,此外,还含有宿主菌的外膜蛋白、R NA聚合酶、RNA、DNA、脂类及糖类物质,所以分离包涵体后,还要采用适当的方法(如色谱法)进行重组蛋白质的纯化。
(一)试剂配制1、缓冲液A:50mM Tris-HCl(pH8.0),2mM EDTA,100mM NaCl。
2、缓冲液B:50mM Tris-HCl(pH8.0),1mM EDTA,100 mM NaCl,1% NP-40。
3、缓冲液Ⅰ:50mM Tris-HCl (pH8.0),2mM EDTA,100 mM NaCl,0.5%Triton X-100(V/V),4M脲素。
4、缓冲液Ⅱ:50M Tris-HCl(pH8.0),2mM EDTA,100 mM NaCl,3% Triton X-100 。
5、缓冲液Ⅲ:50mM Tris-HCl(pH8.0),2mM EDTA,100 mM NaCl,0. 5%Triton X-100,2M 盐酸胍。
6、缓冲液C:8M脲素,10mMβ-巯基乙醇,100 mM Tris-HCl(pH8.0),2mM EDTA及脱氧胆酸钠。
包涵体重组蛋白不同纯化方法的比较1. 本文概述本文旨在比较三种不同的纯化方法对表达的肠道病毒71型(EV71)VP1区包涵体蛋白的纯化效果。
研究中使用了差速离心法、固定化金属离子亲和层析(IMAC)以及不同浓度饱和硫酸铵沉淀法这三种包涵体蛋白纯化方法,并对原核表达的EV71 VP1包涵体蛋白进行了纯化。
通过蛋白垂直(SDSPAGE)电泳检测了蛋白的纯化效果。
研究结果显示,差速离心法适用于大批量蛋白纯化,纯化效果较好,但存在蛋白损失较多且纯化蛋白不能反复冻融的问题。
IMAC柱纯化可获得纯度较高且性状相对稳定的纯化蛋白,但在纯化蛋白量方面存在较少的问题。
而饱和硫酸铵沉淀纯化法则无法获得纯度较高的包涵体蛋白。
本文得出的结论是,差速离心法适用于大批量蛋白纯化,但应避免纯化蛋白的反复冻融,可采用小量分装冻存的方式备用。
IMAC 柱纯化适用于获得高纯度且性状稳定的纯化蛋白,在抗体检测方法学的建立及疫苗制备方面有广泛的应用。
饱和硫酸铵法仅适用于表达蛋白的初步浓缩纯化。
2. 包涵体重组蛋白的形成机制包涵体是外源基因在细胞中表达量过高时形成的一种膜包裹的高密度、不溶性蛋白颗粒。
这种蛋白通常不具有生物学活性,其分子的空间结构表现为非折叠态的聚集体,但复性后可以恢复其生物学活性。
包涵体形成的主要原因包括:蛋白表达量高,合成速度快:当蛋白表达量过高或合成速度过快时,蛋白质可能没有足够的时间进行正确的二硫键配对,导致蛋白质溶解度差,从而形成包涵体。
氨基酸组成:蛋白质中涉及二硫键配对的半胱氨酸含量越多,越容易形成包涵体。
脯氨酸的含量也与包涵体的形成呈正相关。
重组蛋白产生环境:发酵温度高或胞内pH接近蛋白的等电点时,蛋白质的正确折叠和组装受到影响,容易形成包涵体。
蛋白异源性:在大肠杆菌等原核生物中表达真核生物的蛋白质时,由于缺乏真核生物中翻译后修饰所需的酶类,可能导致中间体大量积累,从而形成包涵体沉淀。
包涵体的形成虽然会导致重组蛋白的不溶性,但也存在一些优势,如避免内源和外源蛋白酶的降解、降低细胞质中外源蛋白的含量、减少杂蛋白等,这些特性使得包涵体更有利于重组蛋白的纯化。
包涵体纯化与复性:色谱柱纯化包涵体包涵体纯化的方法与肝素有亲合力的包涵体的纯化包涵体纯化复性的一篇文章HIS包涵体的NI纯化包涵体的纯化和复性总结(精华呦)洗涤纯化的原理GST融合蛋白包涵体的纯化Amersham关于包涵体蛋白复性、纯化的报告包涵体提出、纯化、复性"必胜技"Pet28a/Bl21plys 表达体系包涵体的纯化GST融合蛋白的包涵体能过柱子纯化吗?含量低的目的蛋白的纯化包涵体的进一步处理包涵体直接纯化效果好还是复性以后纯化效果好?包涵体如何复性关于包涵体蛋白的复性,浓缩,纯化关于包涵体的提取方法制备多克隆抗体的蛋白是否需要除去尿素从包涵体中提纯蛋白有关包涵体的溶解问题包涵体的洗涤请教:菌体超声破壁时,所用的频率及时间是怎样的?另外应该菌体完全破壁时,菌液应该是怎样的?(也就是说超声的程度)xxz990913 wrote:请教:菌体超声破壁时,所用的频率及时间是怎样的?另外应该菌体完全破壁时,菌液应该是怎样的?(也就是说超声的程度)超声时所用的频率以及时间是跟你的表达菌的种类以及你目的蛋白的性质密切相关的。
比如说你的表达菌的承受能力比较强的话,你就可以适当加大超声频率以及超声时间,另外,比如说你的目的蛋白是以包涵体形式存在的话那么你就要注意你的超声力度了,因为很有可能对目的蛋白有很大的影响。
一般实验室的超声仪探头的最大承受频率大概也就是400W,所以可以选用300w,超声10s,停止10s,或是选用400w,超声5s,停止5s。
超声如果效果较好的话,整个样品应该是比较清亮的,但是并不是十分清亮,当然这跟你在湿菌体中加入pbs的量是有关系的,加多了,就清亮些,加少了,就浑浊些。
还有就是超声效果如果好的话,样品不会出现像原来的那种教粘稠的情况,因为长链核酸全部被打断了。
当然为了减小超声的负担,可以在超声前加入溶菌酶,反复冻融等步骤。
这也要根据宿主菌而确定。
20021108战友辛苦了很需要有你这样的热心战友!请教:蛋白质复性的具体步骤,我的目的蛋白溶解在20mM tris-hcl ,ph 7.2 0.5M Nacl, 复性缓冲液需要Tris缓冲液还是Pbs缓冲液?我用的是Pbs缓冲液,老是出现沉淀谢谢xxz990913 wrote:请教:蛋白质复性的具体步骤,我的目的蛋白溶解在20mM tris-hcl ,ph 7.2 0.5M Nacl, 复性缓冲液需要Tris缓冲液还是Pbs缓冲液?我用的是Pbs缓冲液,老是出现沉淀谢谢复性问题是表达蛋白过程中的一个很棘手的问题,因为氨基酸组成的不同,造成蛋白不同的性质,同时也使复性变得困难。
包涵体蛋白复性方法大概有如下几种:稀释复性、透析复性、超滤复性、柱上复性、高蛋白质浓度下的复性,此外,吸附法、反胶束法和双水相萃取法等都可用蛋白质的复性。
鉴于战友的情况,我个人认为应该使用Tris缓冲液较好,因为目前普遍认为大多数蛋白复兴使用Tris缓冲液效果较好(这可是有文献可查的哦)。
至于出现沉淀这一点是不用说的,再成功的复性也会出现沉淀,而且我觉得复性也可以看作是一个纯化的过程,我们期望看到沉淀,因为沉淀的不仅仅是我们的目的蛋白,还有一些杂蛋白,即使按比例沉淀,我们的目的蛋白还是越来越纯了,不是吗?而且这一点我认为战友没有必要担心,如果目的蛋白浓度过小的话,你可以在复性结束后浓缩一下以提高浓度。
当然如果目的蛋白全部沉淀的话,就说明这种缓冲液不适合你的目的蛋白,就要改变复性方案了。
影响复性效率的因素就有很多了,比如蛋白质的复性浓度、pH和温度等等等等。
这样的贴为什么不加分啊!!我强烈支持加分斑竹!!20021108衣带渐宽终不悔这是个好战友,希望以后能多请教!!biosepq wrote:20021108战友辛苦了很需要有你这样的热心战友!谢谢龙版的鼓励!vicardin wrote:这样的贴为什么不加分啊!!我强烈支持加分斑竹!!20021108衣带渐宽终不悔这是个好战友,希望以后能多请教!!谢谢战友您的鼓励!请教不敢当,互相学习吧。
加不加分没什么太大的关系,开设这个帖的主要目的是和大家共同探讨纯化和复性的经验、技巧等等。
斑竹也不是每时每刻都在线的,也许是还没阅帖吧,呵呵。
谢谢你们请问Tris缓冲液如何配制?急需谢谢你们请问Tris缓冲液如何配制?急需谢谢你们请问Tris缓冲液如何配制?急需xxz990913 wrote:谢谢你们请问Tris缓冲液如何配制?急需Tris缓冲液:50mM Tris0.5mM EDTA50mM Nacl5%或10%甘油如果有条件加入1%的甘氨酸或精氨酸和谷胱甘肽会更好些。
也可以在其中加入氧化还原系统,如双型谷胱甘肽、DTT等。
PH理论上是要根据你蛋白的等电点来确定的,应该是比等电点稍高一些。
但是PH7.9、8.0我都试过,效果没区别。
我曾经使用过PH 9.5成功复性目的蛋白天边的一片云wrote:我曾经使用过PH 9.5成功复性目的蛋白如上所述,缓冲液的PH是根据你的目的蛋白的等电点而确定的,呵呵.复性是一个十分复杂的过程,解决得方法也是多种多样。
首先是选择合适的表达载体和表达菌株,尽量少产生包含体。
可以先进行预实验确定表达条件,我建议采用正交分析法来进行。
一般的我采用4因素3水平的正交实验,因素主要考虑培养温度、诱导物加入量、加入诱导物时的菌浓度和诱导时间。
每个因素考虑小、中、大三个水平。
我曾经使用这种方法,很好的选择了一个蛋白的表达条件,使其大部分以可溶形式表达。
再谈包含体的复性,在采用通常的方法不行的条件下,可以考虑加入一些化学试剂,一般报道的有PEG、丁酸和多糖。
chinna wrote:复性是一个十分复杂的过程,解决得方法也是多种多样。
首先是选择合适的表达载体和表达菌株,尽量少产生包含体。
可以先进行预实验确定表达条件,我建议采用正交分析法来进行。
一般的我采用4因素3水平的正交实验,因素主要考虑培养温度、诱导物加入量、加入诱导物时的菌浓度和诱导时间。
每个因素考虑小、中、大三个水平。
我曾经使用这种方法,很好的选择了一个蛋白的表达条件,使其大部分以可溶形式表达。
再谈包含体的复性,在采用通常的方法不行的条件下,可以考虑加入一些化学试剂,一般报道的有PEG、丁酸和多糖。
这位战友说的是正确的.但是如果表达载体和表达菌一旦确定以后,想在根据温度、IPTG等来控制包涵体的形成我想并不是很现实,因为每次你加入的母液的浓度总是不一样的,即使是做成了,这种实验的可重复性也是比较差的。
因为不稳定性因素太多了,呵呵。
谢谢你们用Trition -100可以洗涤任何包涵体吗?会不会有什么影响?谢谢!xzyzb wrote:用Trition -100可以洗涤任何包涵体吗?会不会有什么影响?谢谢!曲拉通是一种表面活化剂,润湿及洗涤剂。
在洗涤包涵体的时候是把它当作洗涤剂来用的,也就是主要是把它当作一种去垢剂,用它来洗涤一些杂质或是分子量很大的一些杂蛋白。
不能说可以洗涤任何包涵体,因为“任何”包括的太多了。
但是我想绝大多数的包涵体还是可以用曲拉通来洗涤的,我也曾经试过用PBS来当作曲拉通来洗涤,效果也还可以,所以说曲拉通的洗涤只是一个可有可无的过程,对于整个包涵体蛋白的纯化来说不是很主要的一个过程。
看了些资料,发到自己的帖子上面,呵呵。
菌体/细胞裂解法:一、反复冻融法:1、将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2、至少3次以上冻溶。
3、IFCC推荐法:收集细胞悬液,4℃低温离心(3000rpm,5min),弃上清,加入一定量PBS(200ul),轻轻吹打混匀,-200C 冷冻30 min,370C 解冻,如此反复3次,可形成细胞裂解液。
步骤如下:1)收集细胞悬液2)40C 低温离心(3000rpm,5min)3)弃上清,加入一定量PBS(200ul),轻轻吹打混匀,-200C 冷冻30 min,370C 解冻,如此反复3次,可形成细胞裂解液。
4、用液氮冻融三四次就可以了,细胞冻住后,取出放37度水浴,溶解后震荡,再冻二、超声波处理法1、要设定好超声时间和间隙时间,一般超声时间不超过5秒,间隙时间最好大于超声时间,这些都有利于保护酶的活性。
我的实验超声时间5秒、间隙时间10秒、工作次数20次。
注意事项:1)、一个细胞超声仪可以配备不同尺寸的探头,根据你实验中收集细胞的容器大小选择合适规格的探头。
2)、另外冰浴非常重要,空化效应会局部产热,从而使细胞内酶失活,所以我通常将收集细胞的离心管置于冰盒中。
3)、要设定好超声时间和间隙时间,一般超声时间不超过5秒,间隙时间最好大于超声时间,这些都有利于保护酶的活性。
我的实验超声时间5秒、间隙时间10秒、工作次数20次,镜下观察细胞破碎效果很好,供参考。
不同细胞实验条件得具体摸索。
4)、最后好好看仪器说明书,探头到液面下的距离及与容器底部的距离都有要求。
2、每个样本超声时间5秒,每个间隔5秒,粉碎5次。
3、100ml菌液离心,用8ml缓冲液悬浮,加8mg溶菌酶,冰浴30min,然后超声处理。
750W 40%功率。
5秒超声,9秒间隔。
超声至少90min。
超声完毕后,菌液应该是澄清的,略显油状。
4、综合冻融和超声的方法:1500g离心,弃除上清。
冰上,用小体积PBS重悬细胞。
将重悬液集中,1500g离心浓缩,弃除上清。
液氮骤冷。
用约5倍体积的PBS缓冲液重悬细胞,并搅拌。
可选择:4℃下超声破碎细胞。
加入终浓度为0.25M的KCl,15mM的DTT。
4℃下111500g×60min离心裂解液。
取出上清。
过柱子。
三、渗透法:冰冷的20 mmol/L Tris-Cl(pH8.0),2.5 mmol/L EDTA处理,冰浴放置10min。
《精编分子生物学实验指南》四、裂解液处理法:1、细胞裂解液:50 mmol/L Tris-Cl pH 6.8,100 mmol/L DTT,2% SDS,0.1%溴酚蓝,10%甘油。
SDS是阴离子型表面活性剂、极易促溶、强变性作用。
2、在loading buffer加SDS,100度5分钟,是变性方法。
SDS与蛋白等量结合,可以通过条带位移判断蛋白大小,考染不会影响结果。
3、如果是做小量菌液,跑PAGE胶看其表达情况的话,可以直接加蛋白loading buffer 煮沸5分钟即可,需注意的是上样前要离心12000rpm至少5分钟,然后上样时,枪头别吸最底下的。
4、20毫升细胞裂解液配方:40 μL 0.5M EDTA (PH8.0),4 ml 10% SDS,1 ml 1M Tris-cl(PH6.8),14.96 ml 蒸馏水。
可以适当加入几种蛋白酶的抑制剂,如PMSF,leupeptin等。