羧酸的命名和结构
- 格式:doc
- 大小:423.00 KB
- 文档页数:2

高一化学必修三羧酸知识点羧酸是有机化合物中十分重要的一类物质,它在生物学、医药学、化工等领域都扮演着重要角色。
羧酸可用于制药、生物催化、有机合成等领域,因此,对于高中化学学生来说,了解羧酸的性质、结构和反应十分重要。
一、羧酸的基本结构羧酸分子由一个羧基(-COOH)和一个碳链组成。
羧基是由一个碳原子与一个氧原子和一个氢原子连接而成的。
羧酸的碳链可以是直链、支链或环状结构,其中直链和支链结构的羧酸是最常见的。
二、羧酸的命名和表示方法羧酸的命名通常以其碳链的命名为基础,然后在末端加上“酸”字。
例如,乙酸就是由两个碳原子组成的羧酸分子。
除了常见的化学式表示外,羧酸还可以用分子式、结构式和简图表示。
三、羧酸的性质1. 酸性:羧酸具有较强的酸性。
它们可以与碱反应生成相应的盐和水。
例如,乙酸与氢氧化钠反应生成乙酸钠和水。
2. 气味:羧酸在溶液中具有特殊的气味,例如,乙酸的气味呛鼻且具有辛辣的性质。
3. 溶解性:羧酸在水中具有一定的溶解性。
溶解度与羧酸的碳链长度有关,碳链越短,溶解度越高。
4. 沸点和熔点:羧酸的沸点和熔点与其分子大小、分子间相互作用力有关。
一般来说,分子量较大的羧酸沸点和熔点较高。
四、羧酸的常见反应1. 氧化反应:羧酸可以在适当条件下发生氧化反应,生成相应的醛、酮或羧酸。
例如,乙酸可以被氧气氧化生成乙醛。
2. 脱羧反应:羧酸可以在加热条件下发生脱羧反应,生成相应的酸酐和水。
例如,乙酸可以加热生成醋酸酐和水。
3. 还原反应:羧酸可以通过还原剂还原为相应的醛、酮或烃。
还原反应的条件取决于具体的羧酸和还原剂。
例如,乙酸可以被还原为乙醛。
五、羧酸的应用领域1. 制药:许多药物都是羧酸衍生物,包括乙酸钠、阿司匹林等。
羧酸可以增加药物的水溶性和生物利用度。
2. 化学工业:羧酸可用于合成香料、润滑剂、染料和橡胶等化工产品。
3. 生物学:在生物学中,羧酸是脂肪酸和氨基酸的重要成分,参与体内能量代谢和脂质合成等生物过程。
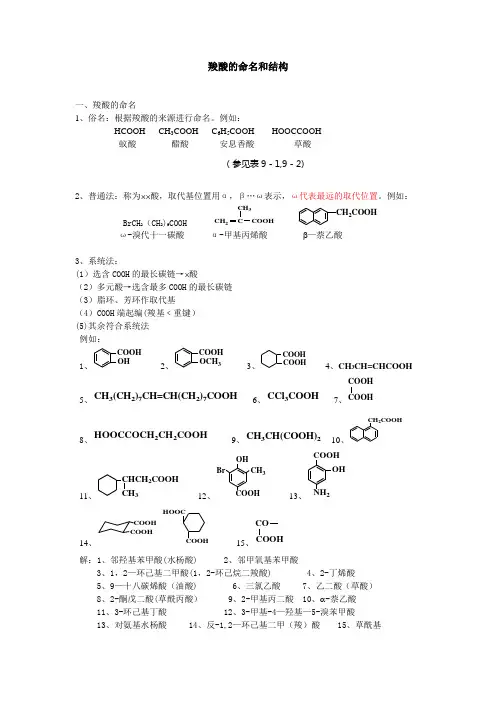
羧酸的命名和结构一、羧酸的命名1、俗名:根据羧酸的来源进行命名。
例如:HCOOH CH 3COOH C 6H 5COOH HOOCCOOH 蚁酸 醋酸 安息香酸 草酸(参见表9-1,9-2)2、普通法:称为⨯⨯酸,取代基位置用α,β…ω表示,ω代表最远的取代位置。
例如:BrCH 2(CH 2)9COOH COOH CH 2CH 3CCH 2COOHω-溴代十一碳酸 α-甲基丙烯酸 β—萘乙酸3、系统法:(1)选含COOH 的最长碳链→⨯酸(2)多元酸→选含最多COOH 的最长碳链 (3)脂环、芳环作取代基(4)COOH 端起编(羧基﹤重键) (5)其余符合系统法 例如: 1、OHCOOH 2、COOH OCH 33、COOHCOOH 4、CH 3CH=CHCOOH 5、CH 3(CH 2)7CH=CH(CH 2)7COOH 6、CCl 3COOH 7、COOH COOH8、HOOCCOCH 2CH 2COOH 9、CH 3CH(COOH)2 10、CH 2COOH11、CHCH 2COOHCH 312、BrCH 3COOH OH13、COOHNH 2OH14、COOHCOOHCOOH HOOC15、COOH CO解:1、邻羟基苯甲酸(水杨酸) 2、邻甲氧基苯甲酸3、1,2—环己基二甲酸(1,2-环己烷二羧酸)4、2-丁烯酸5、9—十八碳烯酸(油酸)6、三氯乙酸7、乙二酸(草酸)8、2-酮戊二酸(草酰丙酸)9、2-甲基丙二酸 10、α-萘乙酸 11、3-环己基丁酸 12、3-甲基-4—羟基—5-溴苯甲酸13、对氨基水杨酸 14、反-1,2—环己基二甲(羧)酸 15、草酰基二、结构特点CH-+H1、羧酸中存在羟基与羰基的共轭,使羧酸的性质与醇、醛酮显著不同;2、p—π共轭使氢氧键极性↑,H+易离去,且羧基负离子也因p—π共轭而稳定性↑,因此羧酸具有明显的酸性;3、p—π共轭使羰基碳上δ+↓,因此羰基的亲核加成活性 ,而更易发生羟基取代的反应,生成相应的羧酸衍生物。


羧酸的化学知识点总结一、羧酸的结构和命名1. 结构:羧酸分子的基本结构是一个含有羧基的碳原子。
羧基通常连接在碳原子上,并且与氢原子取代原子或它们的共轭基。
2. 命名:羧酸通过在化学名词前面加上“酸”字作为后缀来命名。
例如甲酸、乙酸、苹果酸、柠檬酸等。
二、羧酸的物理性质1. 溶解性:大多数羧酸在水中溶解度较高,因为羧基上的氧原子能够与水形成氢键。
2. 气味:许多羧酸具有特殊的气味,如乙酸的发酵味、醋酸的芳香味等。
3. 沸点和熔点:羧酸的沸点和熔点因其分子结构而异,但大多数羧酸的沸点和熔点都较高。
三、羧酸的化学性质1. 酸性:羧酸中的羧基是一个弱酸基,可以脱去氢离子形成阴离子,导致其呈现酸性。
羧酸越理想,pKa值越小,酸性越弱。
2. 反应性:羧酸能够与醇、胺等进行酯化、酰胺化等反应,形成酯、酰胺等不同种类的化合物。
3. 氧化还原反应:羧酸可以与氢气发生还原反应,生成醇和二氧化碳;也可以与醇发生酯化反应,生成酯。
四、羧酸的生物活性1. 蛋白质合成:氨基酸中的羧酸与胺基在蛋白质合成过程中发生缩合反应,形成多肽链。
2. 新陈代谢:某些羧酸在生物体内是重要的代谢产物,如醋酸作为能量物质参与有氧呼吸过程。
3. 药物作用:某些羧酸具有抗菌、抗炎、抗氧化等生物活性,被广泛应用于医药领域。
五、羧酸的应用1. 化妆品:果酸可促进皮肤代谢,被广泛用于美容产品中。
2. 食品饮料:柠檬酸、乙酸等常作为食品酸味剂使用。
3. 农业:乙酸、丙酸等可作为农药原料,用于制备杀虫剂、杀菌剂等。
总结:羧酸作为一类具有羧基的有机酸,在自然界和人造环境中广泛存在,并且具有重要的生物活性和化学性质。
它们不仅被广泛应用于医药、农业、食品和工业领域,还对理解生命的起源和进化具有重要意义。
随着对羧酸的深入研究,相信其在各个领域中的应用将会更加广泛。

羧酸的名词解释羧酸是一类有机化合物,其化学结构中含有羧基(-COOH)。
羧基由一个碳原子与一个氧原子以双键相连,并与一个氢原子以单键相连。
这个羧基使得羧酸具有许多特殊的化学性质和用途。
1. 羧酸的结构和命名羧基与一个碳原子及其它原子或基团相连形成的化合物被称为羧酸。
羧酸分子中的羧基可以与不同的基团(如烷基、芳基等)相连,从而得到不同的羧酸。
常见的羧酸包括甲酸、乙酸、苯甲酸等。
羧基与烷基相连形成羧酸的命名通常遵循“羧基前缀+烷基名+酸”这样的命名规则,例如,甲酸(HCOOH)是由甲基(-CH3)与羧基(-COOH)相连而成的羧酸。
2. 羧酸的性质羧酸的羧基是一个极性官能团,因此导致羧酸具有一些特殊的化学性质。
首先,羧酸具有明显的酸性。
羧酸的羧基可以给出氢离子,形成H+离子,因此是酸性物质。
例如,乙酸(CH3COOH)在水中可以与水反应,给出H+离子和乙酸根离子(CH3COO-),呈现酸性溶液。
其次,羧酸可与含有氢的化合物进行酯化反应,形成酯。
这是因为羧基中的羧碳向氧原子提供了部分正电荷,使得羧酸对亲核试剂更具亲和力。
酯广泛应用于食品、制药和化妆品等领域。
除此之外,羧酸还可发生其他一些重要的化学反应,如与胺反应形成酰胺、与醇反应生成酯等。
3. 羧酸的用途羧酸广泛应用于生活和工业生产中。
首先,羧酸常用作精细化工产品的原料。
例如,乙酸被广泛用于制作醋酸纤维和塑料,甲酸用于制作染料和鞣制皮革等。
其次,羧酸也被应用于医药领域。
羧酸衍生物具有良好的生物相容性和生物活性,因此用作药物载体、肿瘤治疗药物等具有巨大的潜力。
此外,羧酸还在食品和化妆品工业中得到广泛应用。
例如,羧酸可用作食品防腐剂,保持食品的新鲜和延长保质期;在化妆品中,羧酸可以作为护肤剂和抗氧化剂。
综上所述,羧酸是一类重要的有机化合物,具有多种特殊的化学性质和广泛的应用。
羧酸的命名以及其与其他化合物的反应和用途,使得羧酸成为化学研究和工业生产中不可或缺的一部分。

化学羧酸的知识点总结一、结构和命名1. 结构化学羧酸的结构由一个羧基和一个碳骨架组成。
其中羧基是一个碳氧双键和一个碳氢化合物基团连接而成的官能团,通常表示为-COOH。
在有机化合物中,羧基是一种常见的官能团,可以存在于碳链的末端或中间位置。
2. 命名对于简单的化学羧酸,其命名通常遵循通用命名法。
以甲酸(HCOOH)为例,其名称为methanoic acid。
由于羧酸是一种官能团,可以存在于许多有机分子中,因此在有机化合物命名中,羧酸官能团通常被标记为"-oic acid"。
二、性质1. 物理性质化学羧酸通常呈液体或固体状态,具有酸味和刺激性气味。
它们可以溶解于水和许多有机溶剂中,形成透明的溶液。
在固体状态下,化学羧酸通常呈白色或无色晶体。
2. 化学性质化学羧酸是一类弱酸,其羧基可以脱去质子而形成羧酸根离子。
这使得化学羧酸可以发生酸碱中和反应,并参与许多重要的有机合成反应。
此外,化学羧酸还可以与许多金属离子形成盐,这些盐通常被称为羧酸盐。
三、合成化学羧酸可以通过多种途径进行合成,其中最常见的方式包括氧化、羧化和羧酸衍生物的水解等方法。
1. 氧化许多有机化合物可以通过氧化反应而形成化学羧酸。
最常见的氧化剂是酸性高锰酸钾溶液(KMnO4)。
在此条件下,许多有机物质,如醇、醛、醛酸和酮等,可以氧化生成相应的羧酸。
2. 羧化许多有机化合物可以通过羧化反应而合成羧酸。
羧化反应通常以卤代烃和氢氧化物为原料,通过加成反应而生成羧酸。
例如,乙酸可以通过氯乙酸和氢氧化钠反应而合成。
3. 羧酸衍生物的水解许多羧酸衍生物,如酰氯和酯,可以通过水解反应而生成相应的羧酸。
例如,酰氯可以与水反应生成羧酸和盐酸。
四、反应化学羧酸具有多种重要的化学反应,包括酸碱中和、酯化、酯水解、酰胺合成和酸酐生成等。
1. 酸碱中和化学羧酸可以与碱反应生成相应的盐和水。
这是化学羧酸常见的反应之一,也是酸碱中和反应的一种特例。

第12章 羧酸§12.1 羧酸的分类、结构与命名12.1.1 结构和分类 1、定义分子中含有C OH O基团(羧基)的有机化合物称为羧酸。
2、羧酸的结构通式:R-COOH (-R=烷基或芳基) 3、羧酸(RCOOH)的分类方法☐ 按照羧基连的烃基构造: ☐ 按照分子中羧基的数目:脂肪族羧酸(饱和及不饱和) 一元羧酸 脂环族羧酸 二元羧酸 芳香族羧酸 多元羧酸其中链状的一元羧酸(包括饱和的及不饱和的)通称为脂肪酸12.1.2 命名 1、系统命名法A 、饱和脂肪酸的命名1)选择含有羧基的最长碳链为主链,并按主链碳数称“某酸”; 2)从羧基碳原子开始编号,用阿拉伯数字标明取代基的位置; 3)并将取代基的位次、数目、名称写于酸名前。
如:C H 3 C H 2 C H 2 CO O H丁酸 C H 3 C H C H 3 C H C H 3C H 2 C O O H 3 , 4 - 二甲基戊酸 β , γ - 二甲基戊酸12 3 4 5 α β γB 、不饱和脂肪酸的命名1)选择包括羧基碳原子和各C=C 键的碳原子都在内的最长碳链为主链,根据主链上碳原子的数目称“某酸”或“某烯(炔)酸”;2)从羧基碳原子开始编号;3)在“某烯(炔)酸”前并注明取代基情况及双键的位置。
如:CH 3CCHCH CH 3CH 3COOHC CCOOHHOOCH H2, 4–二甲基–3–戊烯酸 (E ) –丁烯二酸 3-苯基丙烯酸C 、脂环族羧酸的命名1)羧基直接连在脂环上时,可在脂环烃的名称后加上“羧酸或二羧酸”等词尾; 2)不论羧基直接连在脂环上还是在脂环侧链上,均可把脂环作为取代基来命名。
如:D 、芳香族羧酸的命名1)以芳甲酸为母体;2)若芳环上连有取代基,则从羧基所连的碳原子开始编号,并使取代基的位次最小。
如:E 、二元酸的命名选包括两个羧基碳原子在内的最长碳链作为主链,按主链的碳原子数称为“某二酸”。

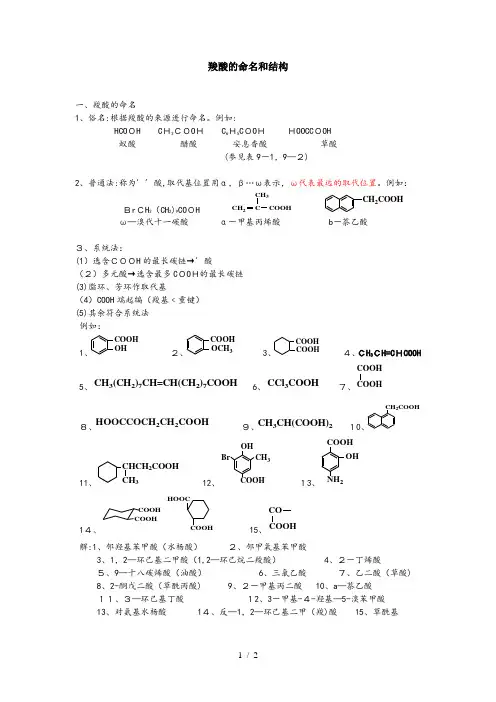
羧酸的命名和结构一、羧酸的命名1、俗名:根据羧酸的来源进行命名。
例如:HCO OH C H3COO H C 6H5C OO H HOOCC OOH 蚁酸 醋酸 安息香酸 草酸(参见表9-1,9—2)2、普通法:称为´´酸,取代基位置用α,β…ω表示,ω代表最远的取代位置。
例如:Br CH 2(CH 2)9CO OH COOH CH 2CH 3CCH 2COOHω—溴代十一碳酸 α-甲基丙烯酸 b -萘乙酸3、系统法:(1)选含COOH 的最长碳链→´酸(2)多元酸→选含最多C OO H的最长碳链 (3)脂环、芳环作取代基(4)COOH 端起编(羧基﹤重键) (5)其余符合系统法 例如: 1、OHCOOH 2、COOH OCH 33、COOHCOOH 4、CH 3CH=C HCOOH5、CH 3(CH 2)7CH=CH(CH 2)7COOH6、CCl 3COOH 7、COOH8、HOOCCOCH 2CH 2COOH 9、CH 3CH(COOH)2 10、CH 2COOH11、CHCH 2COOHCH 312、BrCH 3OH13、COOH2OH14、COOHCOOHCOOH HOOC15、CO解:1、邻羟基苯甲酸(水杨酸) 2、邻甲氧基苯甲酸3、1,2—环己基二甲酸(1,2—环己烷二羧酸)4、2-丁烯酸5、9—十八碳烯酸(油酸) 6、三氯乙酸 7、乙二酸(草酸) 8、2-酮戊二酸(草酰丙酸) 9、2-甲基丙二酸 10、a —萘乙酸 11、3—环己基丁酸 12、3-甲基-4-羟基—5-溴苯甲酸13、对氨基水杨酸 14、反—1,2—环己基二甲(羧)酸 15、草酰基二、结构特点CH-+H1、羧酸中存在羟基与羰基的共轭,使羧酸的性质与醇、醛酮显著不同;2、p-π共轭使氢氧键极性↑,H+易离去,且羧基负离子也因p—π共轭而稳定性↑,因此羧酸具有明显的酸性;3、p—π共轭使羰基碳上δ+↓,因此羰基的亲核加成活性¯,而更易发生羟基取代的反应,生成相应的羧酸衍生物。

羧酸的结构和分类1.羧酸的概念羧酸是由烃基和羧基相连构成的有机化合物。
最简单的羧酸是甲酸,其结构简式为HCOOH。
饱和一元羧酸的通式为C n H2n O2(n≥1)或C n H2n+1COOH(n≥0)。
2.羧酸的分类(1)按照与羧基相连的烃基的结构分类(2)按照分子中羧基的数目分类3.羧酸的系统命名法(1)选主链:选择含有羧基的最长碳链作为主链,按主链碳原子数称为某酸。
(2)编号位:在选取的主链中,从羧基碳原子开始给主链上的碳原子编号。
(3)定名称:在“某酸”名称之前加上取代基的位次号和名称。
例如:典例详析例1(2019安徽合肥检测)下列物质中,属于饱和一元脂肪酸的是A.乙二酸B.苯甲酸C.硬脂酸D.石炭酸解析◆乙二酸分子中含有两个羧基,为二元脂肪酸,故A错误;苯甲酸中含苯环,不属于饱和一元脂肪酸,故B错误;硬脂酸(C17H35COOH)由烷基和一个羧基直接相连而成,属于饱和一元脂肪酸,故C正确;石炭酸为苯酚,属于酚类,不属于羧酸,故D错误。
答案◆C例2(2020湖南师大附中)现有5种基团:—CH3、—OH、—CHO、—COOH、—C6H5,对由其中2个基团构成且显酸性的有关物质的叙述正确的是A.共有4种,其中一种物质不属于羧酸B.共有5种,其中一种为二元酸C.共有6种,其中只有一种不是有机物D.共有6种,它们在一定条件下均能与乙醇发生酯化反应解析◆羧酸和酚具有酸性,5种基团两两组合后具有酸性的有:CH3—COOH、C6H5—OH、OHC—COOH、C6H5—COOH、HO—CHO(HCOOH)、HO—COOH(H2CO3),共6种,其中H2CO3为无机物,且属于二元酸,其他5种属于有机物,其中C6H5—OH不能与乙醇发生酯化反应。
答案◆C。
羧酸的命名和结构
一、羧酸的命名
1、俗名:根据羧酸的来源进行命名。
例如:
HCOOH CH 3COOH C 6H 5COOH HOOCCOOH 蚁酸 醋酸 安息香酸 草酸
(参见表9-1,9-2)
2、普通法:称为⨯⨯酸,取代基位置用α,β…ω表示,ω代表最远的取代位置。
例如:
BrCH 2(CH 2)9COOH COOH CH 2
CH 3
C
CH 2COOH
ω-溴代十一碳酸 α-甲基丙烯酸 β-萘乙酸
3、系统法:
(1)选含COOH 的最长碳链→⨯酸
(2)多元酸→选含最多COOH 的最长碳链 (3)脂环、芳环作取代基
(4)COOH 端起编(羧基﹤重键) (5)其余符合系统法 例如: 1、
OH
COOH 2、
COOH OCH 3
3、
COOH
COOH 4、CH 3
CH=CHCOOH 5、CH 3(CH 2)7CH=CH(CH 2)7COOH 6、CCl 3COOH 7、COOH
8、HOOCCOCH 2CH 2COOH 9、CH 3CH(COOH)2 10、
CH 2COOH
11、
CHCH 2COOH
CH 3
12、
Br
CH 3
OH
13、COOH
2
OH
14、
COOH
COOH
COOH HOOC
15、CO
解:1、邻羟基苯甲酸(水杨酸) 2、邻甲氧基苯甲酸
3、1,2-环己基二甲酸(1,2-环己烷二羧酸)
4、2-丁烯酸
5、9-十八碳烯酸(油酸)
6、三氯乙酸
7、乙二酸(草酸)
8、2-酮戊二酸(草酰丙酸)
9、2-甲基丙二酸 10、α-萘乙酸 11、3-环己基丁酸 12、3-甲基-4-羟基-5-溴苯甲酸
13、对氨基水杨酸 14、反-1,2-环己基二甲(羧)酸 15、草酰基
二、结构特点
C
H
-+
H
1、羧酸中存在羟基与羰基的共轭,使羧酸的性质与醇、醛酮显著不同;
2、p-π共轭使氢氧键极性↑,H+易离去,且羧基负离子也因p-π共轭而稳定性↑,因此羧酸
具有明显的酸性;
3、p-π共轭使羰基碳上δ+↓,因此羰基的亲核加成活性 ,而更易发生羟基取代的反应,
生成相应的羧酸衍生物。
与羰基进行亲核加成反应活性相对较弱的试剂如HCN、NaHSO3等不能与之发生反应。
4、p-π共轭使α-H的酸性↓,不如醛酮中的α-H活性强,其卤代需要磷的催化,因此即使
有3个α-H的羧酸也不能发生卤仿反应(引伸:酯也同理);
5、羧基氧化度较高,可还原,也可继续被氧化成CO2,即脱羧;
6、二元羧酸受热可发生分解反应,两个羧基间距不同,分解产物不同。