2023年高考化学一轮复习:物质结构与性质 元素周期律-原子坐标专题训练(含答案)
- 格式:docx
- 大小:708.97 KB
- 文档页数:9

专题能力训练10 物质结构 元素周期律(必修)
(时间:45分钟 满分:100分)
一、选择题(共7小题,每小题6分,共42分。每小题只有1个选项符合题意)
1.(2015浙江温州模拟)钅必是最反磁性(又称抗磁性)的金属,亦是除汞以外有最低热导率的金属。下列关于Bi和Bi的说法错误的是( )
A.Bi和Bi的质量数、中子数不同,但质子数、核外电子数、核电荷数均相同
BBi和Bi的所有性质均不相同
CBi和Bi是不同的核素,且互为同位素
DBi和Bi的核外电子排布、原子结构示意图均相同
2.(2015北京东城模拟)下列物质递变规律不能用元素周期律解释的是( )
A.非金属性:C>Si
B.碱性:NaOH>Mg(OH)2
C.酸性:H2SO3>H2CO3
D.还原性:HI>HBr
3.短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径:r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是( )
A.元素Z、W的简单离子的电子层结构不同
B.元素Y的简单气态氢化物的热稳定性比Z的强
C.仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
D.化合物X2Z2与W2Z2所含化学键类型完全相同
4.(2015湖北孝感模拟)元素周期律和周期表揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系。下列有关性质的大小关系符合元素周期律的是( )
A.酸性:HNO3>H3BO3>H2CO3
B.稳定性:HF>PH3>H2O
C.碱性:Be(OH)2>Mg(OH)2>Ca(OH)2
D.金属性:K>Mg>Al
5.(2015北京理综)下列有关性质的比较,不能用元素周期律解释的是( )
A.酸性:H2SO4>H3PO4
B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2
D.热稳定性:Na2CO3>NaHCO3

第 1 页 共 16 页 2023课标版化学高考第一轮专题练习
第十一章 物质结构与性质
第1节 原子结构与元素的性质
考点 原子结构与元素的性质
1.(1)[2021广东广州阶段训练,2分]基态Ti原子的未成对电子数是 ,基态Ti原子4s轨道上的1个电子激发到4p轨道上形成激发态,写出该激发态的价层电子排布式: 。
(2)[2021河南鹤壁联考,2分]下列状态的铝中,电离最外层的一个电子所需能量最小的是 (填标号)。
A.[Ne]○↑ 3s
B.[Ne]○↑↓ 3s
C.[Ne]
D.[Ne]○↑○↑○↑○ 3s3px3py3pz
(3)[2分]基态镍原子的价层电子中能量最高的电子所占能级的原子轨道有 个伸展方向。
(4)[4分]钪(Sc)为21号元素,其基态原子M能层电子数为 ;基态镝(Dy)原子的核外电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 。
(5)[2021河北邯郸三模,4分]基态氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,电子重排后氧原子的价电子排布图为 ,电子重排后的氧原子能量有所升高,原因是不符合 (填“泡利原理”或“洪特规则”)。
(6)[2分]Cd与Zn同族且相邻,若基态Cd将次外层的1个d电子激发进入最外层的p能级,则该激发态原子的外围电子排布式为 。
(7)[2021山西太原二模,2分]对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是 (填标号)。
A.Ni:3d10
B.As:4s24p𝑥14p𝑦14p𝑧1
C.As:4s↑↓ 4p↑↓↑
D.Ni:3d↑↓↑↑↓↑↑↓ 4s↑↓ 第 2 页 共 16 页 2.[4分]P能形成众多单质与化合物,P在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为 。

课时规范练13 原子结构 元素周期表
基础巩固
1.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
A.He·· B.
C.1s2 D.
2.(2020江苏化学,2)反应8NH3+3Cl26NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是( )
A.中子数为9的氮原子:79N
B.N2分子的电子式:N︙︙N
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
3.(2020山东临沂4月一模)下列状态的铝中,电离最外层的一个电子所需能量最小的是( )
A.[Ne] B.
C. D.
4.(2020湖北汉口检测)下列关于现行元素周期表的说法正确的是( )
A.元素周期表目前共有8个周期
B.元素周期表中共有18个族,其中有主族、副族、0族和第Ⅷ族
C.元素周期表中第一、二、三周期为短周期
D.元素周期表中第ⅠA族全部是金属元素
5.X、Y、Z和R代表4种元素。如果aXm+、bYn+、cZn-、dRm-4种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是( )
A.a-c=m-n
B.a-b=n-m
C.c-d=m+n
D.b-d=n+m
6.(2020江西南昌期末)1869年俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表有7个横行、18个纵列,即有7个周期、18个族
B.可在过渡元素中寻找半导体材料 C.俄罗斯专家首次合成了 116178X原子,116号元素位于元素周期表中第七周期第ⅥA族
D.第ⅥA族的元素全部是非金属元素
7.某基态原子的价层电子排布式为2s22p3,按要求解答下列问题。
①原子结构示意图为 ,原子的电子式: 。
②价层电子轨道表示式(电子排布图)为 。

试卷第1页,共20页2023届高考化学第一轮专题复习真题试卷模拟
——物质的结构与性质
1.(2023·山东聊城·统考二模)金属及其化合物在化工、医药、材料等领域有着广泛的应用。
请回答下列问题:
(1)与Fe最外层电子数相同且同周期的过渡元素有___________种。
(2)次磷酸的正盐KH
2PO
2中P的___________杂化轨道与O的___________轨道形成
键。
(3)Zn、Fe、Cu等过渡金属的原子或离子易通过配位键形成配合物或配离子。
①和中所有原子均共面,其中氮原子较易形成配位键的是___________。
②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容
易提供孤电子对。则对于配合物Fe(SCN)
3,配体SCN-中提供孤电子对的原子是
___________(填元素符号)。
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物
质中,属于顺磁性物质的是___________。
A.[Cu(NH
3)
2]C1B.[Cu(NH
3)
4]SO
4
C.[Zn(NH
3)
4]SO
4D.[Cr(H
2O)
5Cl]Cl
2
(4)硫化锌(ZnS)晶体属于六方晶系,Zn原子位于4个S原子形成的正四面体空隙中。晶胞参
数如图所示α=120°,β=γ=90°。
①该晶体中,锌的配位数为___________。
②已知空间利用率100%晶胞中含有原子的体积
晶胞的体积,设锌和硫的原子半径分别r
1cm和试卷第2页,共20页
r
2cm,则该晶体的空间利用率为(列出计算式即可)___________。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。
若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为___________。
2.(2023·西藏拉萨·统考一模)Na、Cl、Cu是中学化学中常见的成盐元素,它们之间能形
成多种化合物。回答下列问题:

试卷第1页,共7页 2023届高考化学一轮专题复习-----物质结构与性质专题训练
1.24ZnCN在水溶液中与HCHO发生如下反应:22222444HCHOZnCN4H4HOZnHO4HOCHCN。下列说法正确的是
A.HCHO的分子构型是是三角锥形
B.基态2Zn的电子排布式为82Ar3d4s
C.224ZnHO中与2Zn形成配位键的原子是H
D.1mol2HOCHCN中所含σ键的数目是6mol
2.下列各项叙述中,正确的是
A.SO2分子的空间构型与它的VSEPR模型一致
B.价电子排布为5s25p1的元素位于第五周期第I A族,是s区元素
C.在同一电子层上运动的电子,其自旋方向可以相同
D.s-s σ键与s-p σ键的电子云形状的对称性不相同
3.3Fe由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的323FeNO9HO晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
已知:3+26FeHO为浅紫色,36FeSCN为红色,3-6FeF为无色。
下列说法错误的是
A.323FeNO9HO晶体溶于水后溶液不是浅紫色而是黄色,是因为3Fe水解生成3FeOH所致
B.SCN与3Fe形成配位键时,S原子提供孤电子对
C.溶液Ⅱ加NaF后溶液由红色变为无色,说明SCN与3Fe配位键强度不及F与3Fe配位键强度
D.焰色试验中可用无锈铁丝替代铂丝,说明铁灼烧时无焰色且不会产生发射光谱
4.下列化学用语正确的是
A.硝基苯的结构简式
B.丙烷分子的比例模型为 试卷第2页,共7页 C.四氯化碳分子的电子式为
D.2-乙基-1,3-丁二烯分子的键线式为
5.下列图示与对应的叙述相符的是(夹持装置已略去)
A.10.50molL氢氧化钠溶液的配制 B.将氯化钠溶液蒸干得到氯化钠固体 C.验证碳酸钠与碳酸氢钠的稳定性 D.测浓24HSO的pH
单元检测十四 物质结构与性质
一、选择题(本题包括15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列各项叙述正确的是( )
A.N、P、As的电负性随原子序数的增大而增大
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:
2.下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的15的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
3.下列关于元素第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的电离能I1<I2<I3<…
4.对于短周期元素形成的各分子,下表所述的对应关系错误的是( )
选项 A B C D
分子式 CH4 NH3 CO2 SCl2
VSEPR模型名称 正四面体形 四面体形 直线形 四面体形
分子的空间结构名称 正四面体形 平面三角形 直线形 V形
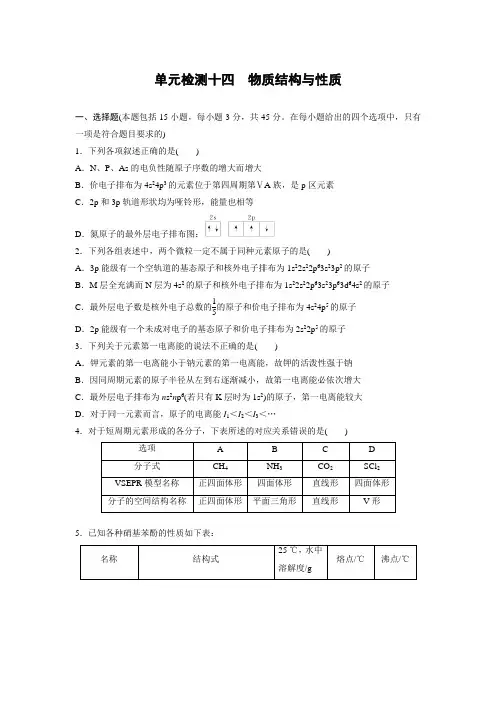
5.已知各种硝基苯酚的性质如下表:
名称 结构式 25 ℃,水中溶解度/g 熔点/℃ 沸点/℃ 邻硝基苯酚
0.2 45 100
间硝基苯酚
1.4 96 194
对硝基苯酚
1.7 114 295
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另两种硝基苯酚

2023届高考化学一轮专题 强化练习题——物质结构与性质
1.(2022·河北邢台·模拟预测)一种无机纳米晶体材料,仅由铯、铅、溴三种元素构成,在太阳能电池方向有巨大应用前景。回答下列问题:
(1)基态Br原子核外电子占据能量最高的能级的电子云轮廓图形状为_______。Pb属于_______区元素。
(2)NaCs、位于同主族,NaCs、元素的第一电离能分别为-11I(Na)=496kJmol、-11I(Cs)=375.7kJmol。11I(Cs)
(3)FBrPb、、三种元素的电负性如下表。2PbF具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是_______。
电负性
F Br Pb
4.0 2.8 1.9
(4)该晶体材料的立方结构如图所示,其化学式为_______。若其晶胞参数为anm,阿伏加德罗常数的值为AN,则该晶体密度=_______3gcm。
(5)该晶体材料电池并未实现商业化,原因在于自身的不稳定性。
①该晶体材料在潮湿环境中易从固体变成溶液(发生相变),导致器件效率降低,其原因是_______。
②某大学采用2CdBr对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,_______(离子)脱离晶格,用2CdBr钝化后的晶体比原晶体材料更稳定,其原因是_______。
(已知:应力与应变相伴而生,从原子尺度上来理解,应力为单位晶格上的作用力,应变即为晶格的拉伸或收缩,对应于拉伸应变和压缩应变。对应出现的驰豫是指一个宏观平衡系统由于受到外界的作用变为非平衡状态,再从非平衡状态过渡到新的平衡态的过程。)
2.(2022·河北衡水·二模)近日,以色列魏茨曼科学研究所提出了一种新颖的模块化催化剂框架,将过渡金属Fe(III)、Ni(II)和Cu(II)放在三缺位多金属氧酸盐骨架的最近邻位置,通过精确调节金属组成来指导催化活性和选择性。研究人员通过简单的合成发现,三铜取代的化合物[SiCu3W9]在CO2还原为CO过程中具有最佳活性,FeNi2取代的化合物(SiFeNi2W9)在CO氧化为CO2过程中具有最佳活性。回答下列问题:
试卷第1页,共14页 2023届高考化学一轮训练—物质结构与性质
1.(2022·重庆·高三单元测试)第ⅤA族元素及其化合物在生产,生活中用途广泛。
(1)苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点、沸点分别高于甲苯的熔点、沸点,原因是_______。
(2)两种氧化物的熔点如下表所示,解释表中氧化物之间熔点差异的原因:_______。
氧化物 2SO 46PO
熔点/Ⅴ 75.5 23.8
(3)乙二胺(2222HNCHCHNH)是一种有机化合物,乙二胺能与2Mg、2Cu等金属离子形成稳定环状离子,其原因是_______,其中与乙二胺形成的化合物稳定性相对较高的是_______(填“2Mg”或“2Cu”)。
(4)贵金属磷化物2RhP可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______,晶体的密度为_______3gcm(列出计算式)。
2.(2022·重庆·高三单元测试)铁被誉为“第一金属”,铁及其化合物在生活中被广泛应用。
(1)基态2Fe的简化电子排布式为_______。
(2)实验室可用KSCN、苯酚()来检验3Fe。N、O、S三种元素的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306Ⅴ,沸点为315Ⅴ。3FeCl的晶体类型是_______。4FeSO常作补铁剂,24SO的立体构型是_______。
(4)羰基铁[5FeCO]可用作催化剂、汽油抗爆剂等。1mol 5FeCO分子中含_______mol键。
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为3ρg/cm,AN代表阿伏加德罗常数的值。试卷第2页,共14页 在该晶胞中,与2Fe紧邻且等距离的2Fe数目为_______;2Fe与2O最短核间距为_______pm(列出表达式即可)。

高考化学复习原子结构与元素周期表专项综合练附详细答案
一、原子结构与元素周期表练习题(含详细答案解析)
1.同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列)。该周期部分元素氟化物的熔点见下表。
氟化物 AF BF2 DF4
熔点/K 1266 1534 183
(1)A原子核外共有_______种不同运动状态的电子、_______种不同能级的电子;
(2)元素C的最高价氧化物对应水化物的电离方程式为__________;
(3)解释上表中氟化物熔点差异的原因:_______;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是_______(填化学式)。A、B、C三种原子形成的简单离子的半径由大到小的顺序为______(填离子符号)。
【答案】11 4 AlO2-+H++H2OAl(OH)3Al3++3OH- NaF与 MgF2为离子晶体,离子之间以离子键结合,离子键是强烈的作用力,所以熔点高;Mg2+的半径比Na+的半径小,离子电荷比Na+多,故MgF2的熔点比NaF高;SiF4为分子晶体,分子之间以微弱的分子间作用力结合,故SiF4的熔点低 HCl Na+>Mg2+>Al3+
【解析】
【分析】
图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,H、I的沸点低于0℃,根据气体的沸点都低于0℃,可推断H、I为气体,气体元素单质为非气体,故为第三周期元素,则A为Na,B为Mg,C为Al,D为Si,E为P、G为S,H为Cl,I为Ar。
(1)原子中没有运动状态相同的电子,由几个电子就具有几种运动状态;
根据核外电子排布式判断占有的能级;
(2)氢氧化铝为两性氢氧化物,有酸式电离与碱式电离;
(3)根据晶体类型不同,以及同种晶体类型影响微粒之间作用力的因素解答;
(4)同周期自左而右非金属性增强,非金属性越强氢化物越稳定;

最新高考化学复习资料单元综合测试五
时间:90分钟 满分:100分
一、选择题(本题共20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.下列化学符号表示同一种元素的是( )
①3517X ②3717X ③ ④
A.只有①③ B.只有②③
C.只有①②③ D.全部
[答案]C
[解析]元素是具有相同质子数的同一类原子的总称,所以元素的种类是由质子数决定的;①②③中三种微粒的质子数都是17,所以是同种元素。④中微粒的质子数为18,所以和①②③中微粒表示的不是同种元素。
2.(2012·天津,3)下列叙述正确的是( )
A.乙酸与丙二酸互为同系物
B.不同元素的原子构成的分子只含极性共价键
C.235 92U和238 92U是中子数不同质子数相同的同种核素
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
[答案]D
[解析]本题考查同系物、极性共价键、原子结构、元素周期律等知识。乙酸与丙二酸分子中含有的羧基数目不同,二者不是同系物,A项错误;H2O2分子中含有非极性共价键,B项错误;235U和238U属于不同的核素,互为同位素,C项错误;短周期的第ⅣA和第ⅦA元素构成的分子有SiF4、CF4、CCl4和SiCl4,均满足最外层8电子结构,D项正确。
3.下列化学用语正确的组合是( )
①氚:31H ②S2-:
③Na2O2:Na+[··O····O····]2-Na+
④CaCl2:2··Cl·····+×Ca×―→Ca2+[··Cl······]-2
⑤NH3: ⑥N2:··N⋮⋮N:··
A.①②⑤⑥ B.①③④⑥
C.①⑤⑥ D.②⑤⑥
[答案]C
[解析]S2-的结构图应为,Na2O2的电子式为Na+[··O······O······]2-Na+;CaCl2的形成应为2··Cl·····+×Ca×―→[··Cl·····×]Ca2+[·×Cl······]-。

答案第24页,共33页 2023届高考化学一轮强化练习——元素或物质推断题
1.(2022·四川成都·高三期末)短周期主族元素A、B、C、D、E、F的原子序数依次增大,其中A、D同主族,A原子的最外层电子数是K层电子数的2倍;C是短周期元素中原子半径最大的主族元素,2B和C元素形成的阳离子电子层结构相同,E的氧化物是形成酸雨的主要物质。用相关化学用语回答下列问题:
(1)D元素的名称是_______,E的最高价氧化物对应的水化物的化学式为_______,F离子的结构示意图为_______。
(2)B的一种同位素原子的中子数比质子数多2,则该核素的原子符号为_______,36g由该同位素形成的2B分子中含有的中子数为_______。
(3)A、B两种元素可形成化合物2AB,则2AB的结构式为_______,B、C两种元素可形成化合物22CB,则22CB的电子式为_______。
(4)A的最简单气态氢化物的空间结构为_______,它与F的单质在光照条件下反应生成两种气体的化学方程式为_______。
2.(2022·陕西·西安中学高三期末)下表为元素周期表的一部分,请参照①-①在表中的位置,用相应的化学用语填空。
①
① ① ① ①
① ① ① ① ①
(1)用序号标出的10种元素中,非金属性最强元素的离子结构示意图为___________,①在元素周期表中的位置是___________。
(2)①、①、①的离子半径由大到小的顺序为___________(用离子符号表示)
(3)由表中①、①元素可以组成一种淡黄色物质,请画出该物质电子式___________。
(4)元素①、①、①的最高价含氧酸的酸性由强到弱的顺序是___________(用化学式表示)。
(5)①的单质与①的最高价氧化物对应水化物的水溶液反应的化学方程式为___________。
3.(2022·上海交大附中高三开学考试)有R、W、X、Y、M五种原子序数依次增大的元素。R2是密度最小的气体。W与X可形成两种稳定的化合物WX和WX2。人类使用的化石燃料在燃烧过程中将大量WX2排入大气,导致地球表面平均温度升高。Y的原子序数是X的2答案第25页,共33页 倍。
试卷第1页,共18页 2023届高考化学一轮练习题:物质结构与性质
1.(2022·安徽·高三开学考试)砷化镓(GaAs)半导体材料与传统的硅材料相比,同样条件下,它能更快地传导电流。且它不仅可以用来制作发光二极管、光探测器,还能用来制备半导体激光器,广泛应用于光通信等领域。回答下列问题:
(1)Ga基态原子核外电子排布式为___________第四周期主族元素中,第一电离能介于Ga、As之间的元素是___________(填元素符号)。
(2)砷与卤素可形成AsXs、AsX3型两类化合物,其中三卤化砷的熔点和沸点数据如下表所示。
砷的卤化物 AsF3 AsCl3 AsBr3 AsI3
熔点/℃ -6 -18 31.1 140.9
沸点/℃ 57.8 130.2 221 424
℃三卤化砷晶体类型是___________其熔点变化规律及原因是:___________
℃已知AsCl5的空间构型是三角双锥,则它是___________(填“极性”、“非极性”)分子。
(3)在GaH3、NH3、AsH3中,GaH3是平面三角形分子而AsH3是三角锥形分子,判断的依据是_______三种氢化物中,易与H+形成配位键的是________。
(4)砷化镓的立方晶胞结构如下图所示,晶胞参数为anm,砷化镓晶体的密度为ρg/cm3。则Ga的配位数是___________,阿伏加德罗常数NA=___________/mol(用含a、ρ的式子表示)
2.(2022·重庆市第七中学校高三阶段练习)物质结构的多样性使人类使用的材料精彩纷呈,请回答下列问题。
(1)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用。锆是与钛同族的第五周期元素,则锆原子的价电子排布式为____。
(2)同主族元素所形成的物质具有性质相似的特点,H2O的熔沸点均比H2S高,其原因是____。
第1页/总39页【高考化学】广东省2023届高考备考第一轮复习
物质结构与性质提升训练
1.(2022秋·广东汕尾·高三统考期末)金属氮化物具有高熔点、高硬度、高化学稳定性以及良
好的导热、导电性,目前已经广泛应用于磁学、电子工业、耐高温结构陶瓷等领域。回答下列
问题:
(1)下列不同状态的氮原子其能量最高的是____(填字母)。
A
.B
.
C
.D
.
(2)第一电离能I
1(N)____I
1(P)(填“>”“<”或“=”),其原因是____。
(3)A和B两种金属的含氮化合物的结构如图所示:
①基态Ni原子的核外电子排布式为[Ar]____。
②物质A中碳原子的杂化方式为____。
③物质A的熔点高于物质B的,主要原因是____。
④物质B中含有的化学键类型有____(填字母,可多选)。
a.金属键
b.σ键
c.π键
d.配位键
(4)氮化铝晶胞如图所示。氮原子的配位数为____,每个铝原子周围紧邻____个铝原子;已知
立方氮化铝晶体密度为ρg•cm-3
,晶胞中最近的两个铝原子之间的距离为____pm(列出计算式即
可,阿伏加德罗常数为6.02×1023mol-1)。试卷第2页,共20
页2.(2022秋·广东广州·高三统考期末)硅、锗(Ge)及其化合物广泛应用于光电材料领域,钙钛
矿()型化合物是一类可用于生产太阳能电池的功能材料。回答下列问题:
3CaTiO
(1)太阳能电池板主要材料为单晶硅。基态原子价层电子排布式为_______,单晶硅的晶体类Si
型为_______。
(2)硅和卤素单质反应可以得到硅的卤化物(),的熔点和沸点如下表:
4SiX
4SiX
4SiX
4SiF
4SiCl
4SiBr
4SiI
熔点/℃-90.2-70.45.2120.5
沸点/℃-85.857.8154.2287.7
沸点依次升高的原因是_______。
(3)钙钛矿的晶胞如图所示,其组成元素的电负性大小顺序是_______。与间的
3CaTiO
2
Ca2
O
作用力为_______,该晶体中每个钛离子周围与它最近且相等距离的钛离子有_______个。
答案第21页,共32页 2023届高考化学一轮专题练习题:元素或物质推断题
1.(2022·四川·盐亭中学一模)元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列,得到如图所示的“蜗牛元素周期表”,图中每个圆圈代表一种元素,其中①代表氢元素。请回答下列问题:
(1)①在元素周期表中的位置为_______。
(2)①①①的离子半径由大到小的顺序为_______。
(3)①①①的最高价氧化物对应水化物的酸性由强到弱的顺序是_______(填化学式)。
(4)用电子式表示由①和①组成的化合物的形成过程:_______。
(5)实验室制取①的简单氢化物的化学方程式为_______。
(6)可以验证①、①两元素金属性强弱的实验是_______(填字母)。
A.比较①、①两种元素的单质的硬度及熔点
B.将除去氧化物薄膜的①、①的单质分别和热水作用,并滴入酚酞溶液
C.将除去氧化物薄膜的①、①的单质分别和2mL1 mol∙L−1的盐酸反应
D.比较①、①两种元素的最高价氧化物对应水化物的溶解性
2.(2022·浙江绍兴·模拟预测)化合物X由三种元素组成,为探究其组成,设计实验流程及实验结果如下:
已知:气体1在标况下的密度为1.429g/L。
请回答下列问题: 答案第22页,共32页 (1)化合物X的化学式为_______,固体3的成分是_______,(用化学式表示)
(2)某黄绿色的气体化合物...Y和22HO共同加入某强碱溶液可生成上述盐X,请写出相应的离子反应方程式_______。
(3)另一小组采用以下方案探究固体1的成分:
①写出步骤①中发生反应的离子反应方程式_______
①实验结果发现白色沉淀4的质量大于43.05g,造成这个实验结果的原因是_______
3.(2022·浙江嘉欣·模拟预测)化合物A由4种元素组成,实验如下:
已知:除说明外,加入试剂均为足量;生成1molF时消耗3/4mol的32HPO
课时规范练40 原子结构与性质
一、选择题:本题包括12小题,每小题只有1个选项符合题意。
1.(2021山东泰安高三二模)下列有关化学用语表达正确的是( )
A.CS2的填充模型:
B.铍原子最外层原子轨道的电子云图:
C.Na2S的电子式:Na··S··Na
D.氧原子核外电子的电子排布图:
2.具有下列电子层结构的原子,其第一电离能由大到小排列正确的是( )
①3p轨道上只有一对成对电子的原子
②价层电子排布为3s23p6的原子
③其3p轨道为半充满的原子
④正三价阳离子的电子排布式与氖的相同
A.①②③④ B.③①②④
C.②③①④ D.②④①③
3.已知某元素+3价离子的电子排布式为
1s22s22p63s23p63d5,该元素在周期表中的位置是( )
A.第三周期第Ⅷ族,p区
B.第三周期第ⅤB族,ds区
C.第四周期第Ⅷ族,d区
D.第四周期第Ⅴ族,f区
4.第四周期元素中基态原子核外有3个未成对电子的共有 ( )
A.2种 B.3种
C.4种 D.5种
5.X、Y、Z为主族元素,X原子的最外层电子排布为ns1;Y原子的M电子层有2个未成对电子;Z原子的最外层p轨道上只有一对成对电子,且Z原子的核外电子比Y原子少8个电子,由这三种元素组成的化合物的分子式不可能的是( )
A.XYZ4 B.X2YZ4
C.X2YZ3 D.X2Y2Z3
6.元素周期表长周期共有18个纵列,从左到右排为18列,即碱金属是第1列,稀有气体是第18列。按这种规定,下列说法正确的是( )
A.第9列元素中没有非金属 B.第15列元素的原子最外层的电子排布是ns2np5
C.最外层电子排布为ns2的元素一定在第2列
D.第11、12列为d区的元素
7.(2021四川成都模拟)某微粒的核外电子排布式为1s22s22p6。下列说法正确的是( )
A.可以确定该微粒为Ne
B.对应元素一定位于元素周期表中第13列
高考化学综合题专练∶原子结构与元素周期表含详细答案
一、原子结构与元素周期表练习题(含详细答案解析)
1.著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。稀土元素包括钪、钇和镧系元素。请回答下列问题:
(1)写出基态二价钪离子(Sc2+)的核外电子排布式____,其中电子占据的轨道数为 ____。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3∙nH2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为____;1 mol H2C2O4分子中含σ键和π键的数目之比为 ___。
②H2O的VSEPR模型为 ___;写出与H2O互为等电子体的一种阴离子的化学式_______。
③HCI和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl∙2H2O,HCl∙2H2O中含有H5O2+,结构为,在该离子中,存在的作用力有___________
a.配位键 b.极性键 c.非极性键 d.离子键 e.金属键 f氢键 g.范德华力 h.π键 i.σ键
(3)表中列出了核电荷数为21~25的元素的最高正化合价:
元素名称 钪 钛 钒 铬 锰
元素符号 Sc Ti V Cr Mn
核电荷数 21 22 23 24 25
最高正价 +3 +4 +5 +6 +7
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为_____g∙cm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。
【答案】1s22s22p63s23p63d1 10 sp2杂化 7:2 四面体形 NH2- abfi 五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和
(10)原子坐标——2023届高考化学一轮复习物质结构与性质
元素周期律创新
1.我国科学家合成了太阳能电池材料333CHNHPbI,其晶体结构如图所示,属于立方晶系,晶胞质量为gm,其中大黑球代表33CHNH,原子坐标参数A为(0,0,0),B为(111,,222)。下列说法错误的是( )
A.B代表2Pb
B.每个晶胞含有I的数目为6
C.C的原子坐标参数为(11,,022)
D.333CHNHPbI的摩尔质量为123gmol6.0210m
2.钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点的为(12,0,12),下列说法中错误的是( )
A.配合物中基态2Co的价层电子排布式为73d
B.距离2Co最近且等距的2O的数目为8
C.C点的原子坐标参数为(12,12,12)
D.该物质的化学式为2TiCoO
3.2CuO晶体结构与CsC1相似,只是用4CuO占据CsC1晶体(图Ⅰ)中的C1的位置,而Cs所占位置由O原子占据,如图Ⅱ所示,下列说法正确的是( )
A.2CuO晶胞中4CuO四面体的O坐标为(,,222aaa),则①的Cu坐标可能为(33,,444aaa)
B.2CuO晶胞中有2个2CuO
C.CsCl的晶胞参数为a cm,设AN为阿伏加德罗常数的值,相对分子质量为M,则密度为33A2Mg/cmaN
D.Cu2O晶胞中Cu的配位数是4
4.近日,科学家研究利用2CaF晶体释放出的2Ca和-F脱除硅烷,拓展了金属氟化物材料的生物医学功能。下列说法错误的是( )
A.F、Si和Ca,原子半径依次增大
B.2SiO与2OF的晶体类型及氧原子的杂化方式均相同
C.图中A处原子分数坐标为(0,0,0),则B处原子分数坐标为(14,14,34)
D.脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,脱硅能力222BaFCaFMgF<<
5.24KHPO晶体具有优异的非线性光学性能。我国科学工作者制备的超大24KHPO晶体已应用于大功率固体激光器。分别用o、●表示24HPO和+K,24KHPO 晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是24HPO,+K在晶胞xz面、yz 面上的位置:
①若晶胞底边的边长均为apm、高为c pm,阿伏加德罗常数的值为AN,下列说法错误的是( ) A. 34HPO是中强酸,则34HPO的结构为 B. 34HPO分子中键角:∠H-O-P<∠ O-P-O
C. 24KHPO晶体的密度为02A3413610Nacg/cm3
D. 24KHPO晶胞在x轴方向的投影图为
6.铁氮化合物xyFeN在磁记录材料领域有着广泛的应用前景.某xyFeN,的晶胞如图1所示,Cu可以完全替代该晶体中m位置Fe或n位置Fe,形成Cu替代型产物.xyFeN转化为两种Cu替代型产物的能量变化如图2所示.下列说法错误的是( )
A.与铜同周期且基态原子最外层未成对电子数与基态铜原子相同的元素有3种
B.xyFeN晶胞中Fe与Fe之间的最短距离为2cm2a
C.当m位置的Fe位于体心时,n位置的Fe位于棱心
D.两种产物中,更稳定的Cu替代型产物的化学式为3FeCuN
7.我国科研团队将Li掺杂到1NiMgOnn结构单元中,得到一种高性能的p型太阳能电池材料。掺杂后的晶胞属于立方晶系,边长为nma,其结构如图所示。已知位于A点的原子坐标参数为(0,1,1),下列说法正确的是( )
A.晶胞中Mg原子与Ni原子数之比为1:2
B.Li的坐标参数为(1,1,0.5)C.晶体中每个O原子周围都有3个等距且最近的Ni原子
D.A点的原子与Li间的距离是6nm2a 8.把氯化汞(2HgCl)加入到溶有氨气的氯化铵溶液中,可以得到某种含汞化合物,其晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,在晶胞中a的分数坐标为(0,0,0),晶胞的体积为3cmV。下列说法正确的是( )
A.基态N原子的轨道表达式是
B.该化合物的化学式是342HgNHCl
C.汞原子b的分数坐标为311,,422
D.该晶体的密度是3A611.2g/cmVN
9.一种四方结构的超导化合物的晶胞如图甲所示。晶胞中Sm和As原子的投影位置如图乙所示。
图中F和2O共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为_______;通过测定密度和晶胞参数,可以计算该物质的x值,完成它们关系表达式:=____3gcm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图甲中原子1的坐标为(111,,222),则原子2和3的坐标分别为_______、_______。
10.回答下列问题:
(1)铬的一种氧化物的晶胞结构如图1所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如ACr在123456OOOOOO、、、、、构成的八面体空隙中)。
①该氧化物的化学式为__。②该晶胞有___%八面体空隙未填充阳离子。
③已知氧离子半径为acm,晶胞的高为bcm,AN代表阿伏加德罗常数的值,该晶体的密度为__3gcm。(用含a、b和NA的代数式表示) (2)①血红蛋白在血液中输送氧气,其结构如图2,2Fe的配位数为__,当空气中CO浓度较大时,人体会缺氧窒息,甚至死亡,其原理是__。
②晶体αX只含钠、镁、铅三种元素,其晶胞如图3,钠原子填满Pb原子的四面体空隙,X的化学式为___。若Pb原子与Na原子的最近距离为anm,则该晶胞的密度为__3gcm(用含a和AN的式子表示)。
(3)铁氮化合物是磁性材料领域研究中的热点课题之一。晶体中铁的堆积方式为面心立方,氮原子位于体心,沿z轴投影如图4所示,已知阿伏加德罗常数的值为AN,Fe(Ⅰ)、Fe(Ⅱ)原子最近距离为apm。
①结构中原子坐标参数A为(0,0,0),氮原子为(12,12,12),则B坐标参数为__。
②计算该晶体密度为__3gcm。
答案以及解析
1.答案:BD 解析:由晶体结构图可知,题图表示2个晶胞,其中33CHNH位于晶胞的顶点,个数为1818,B位于晶胞内部,个数为1,C位于晶胞面上,个数为1632,由化学式333CHNHPbI可知B代表2Pb,C代表I。由分析可知,B代表2Pb,A项正确;图示晶体结构中含有2个晶胞,则每个晶胞含有I的数目为3,B项错误;由原子坐标参数A为(0,0,0),B为(111,,222)可知,C的原子坐标参数为(11,,022),C项正确;由上述分析可知,每个晶胞中含有1个333CHNHPbI,设其摩尔质量为M,则2311g6.0210molMm,解得2316.0210gmolMm,D项错误。
2.答案:BD
解析:钴元素的原子序数为27,基态钴原子的价层电子排布式为723d4s,则配合物中基态2Co的价层电子排布式为73d,故A正确;由晶胞结构可知,距离2Co最近且等距的2O的数目为6,故B错误;C点位于体心,由A点的原子坐标参数为(0,0,0),B点的为(12,0,12)可知,C点的原子坐标参数为(12,12,12),故C正确;由晶胞结构可知,一个晶胞中位于顶点的4Ti的个数为1818,位于体心的2Co的个数为1,位于面心的2O的个数为1632,则该物质的化学式为3TiCoO,故D错误。
3.答案:AB
解析:根据图中所给坐标系,和已知O坐标为(,,)222aaa,则①的Cu坐标为33(,,)444aaa, A项正确;根据均摊法可以算出2CuO晶胞中有2个O,4个Cu,即2个2CuO,B项正
确;CsCl晶胞中有1个CsCl的密度为33AMg/cmaN,C项错误;Cu2O晶胞为Cu的配位数是2,D项错误。
4.答案:BD
5.答案:A
6.答案:A
解析:A. Cu元素为29号元素,原子核外有29个电子,核外电子排布式为: 226261011s2s2p3s3p3d4s,
Cu是第四周期的元素,原子的最外层有1个为成对的电子,与铜同周期的所有元素的基态原子中,未成对电子数与铜原子相同的元素有K、Cr共2种, 故A错误; B.晶胞边长为a cm,xyFeN晶胞中Fe与Fe之间的最短距离为22aa2acm222,给B正确;C.由图1将顶点置于体心,即当m位置的Fe位于体心时,n位置的Fe位于棱心,故C正确;D.由图可知,Cu替代m位置Fe型能量更稳定,所以Cu位于晶胞面心位置,原子数目为1818;
Fe位于顶点位置、原子数目为1632; N位于体心,原子数为1;即更稳定的Cu替代型产物的化学式为3FeCuN,故D正确;故选A选项。
7.答案:D
解析:晶胞中Mg原子个数为11912828,Ni原子个数为111973828,故Mg原子与Ni原子数之比为9:19,A选项错误。位于A点的原子坐标参数为(0,1,1),则Li的坐标参数为(1,0.5,0.5),A点的原子与Li间的距离是2226(0.5)(0.5)nmnm2aaaa,B项错误,D项正确。由图可知并非所有的O原子周围都有3个等距且最近的Ni原子,如坐标参数为(0.5,1,1)的O原子周围不止3个等距且最近的Ni原子,C项错误。
8.答案:D
解析:基态N原子的轨道表达式中2p轨道电子自旋方向相同,因此正确的轨道表达式是,A错误;由晶胞结构可知,每个晶胞中有8个Hg原子在晶胞顶点上,2个Hg原子在面上,根据均摊法可知每个晶胞中Hg原子的个数为1182282;8个3NH分子在棱上,4个3NH分子在面上,根据均摊法可知每个晶胞中3NH分子的数目为1184442;4个Cl原子在面上,2个Cl原子在晶胞内,根据均摊法可知每个晶胞中Cl原子的数目为14242,所以该含汞化合物的化学式为322HgNHCl,B错误;汞原子a的分数坐标为(0,0,0),结合坐标系,由图可知汞原子b的分数坐标为11,0,22,C错误;由B项分析可知,1个晶胞的质量是AA435.52200.6417611.2ggNN,晶胞的体积为3cmV,则该晶体的密度为3A611.2g/cmVN,D正确。
9.答案:1SmFeAsOFxx;230A2[28116(1)19]10xxacN;(11,,022);(10,0,2)解析:由题图甲可知,晶胞内Fe处于体心和棱心,Fe原子一共有14124个,结合题图乙得知,As原子承Sm原子位