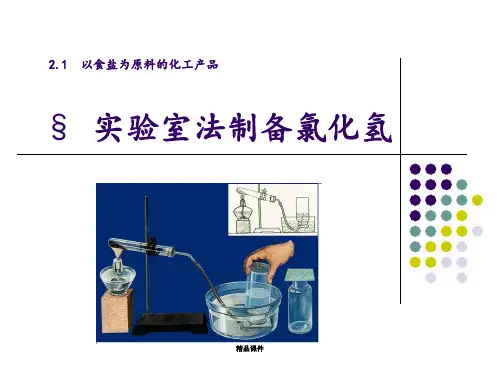
氯化氢的实验室制法【实用参考】
- 格式:ppt
- 大小:708.50 KB
- 文档页数:21


hcl的实验室制法化学方程式HCl是一种强酸,化学式为HCl,分子量为36.46 g/mol。
它是无色、刺激性的气体,密度比空气大,具有强烈的刺激性气味。
HCl可以与水反应生成盐酸溶液,有着广泛的应用领域,如化学实验室、工业生产和日常生活中。
盐酸的制备方法有多种,下面将介绍几种常用的实验室制法。
1. HCl气体的制备方法实验室常用制备HCl气体的方法是通过酸与氧化剂的反应来获得。
化学方程式为:H2SO4 + 2NaCl → Na2SO4 + 2HCl操作步骤如下:1)在500 mL锥形瓶中加入10 mL浓硫酸(H2SO4)。
2)慢慢地加入10 mL浓盐酸(HCl)。
3)立即观察到白色气雾的生成。
这是因为HCl气体与空气中的水蒸气结合形成了可见的微小水滴。
2.硼砂法制备HCl气体硼砂法是另一种常用的制备HCl气体的实验室方法。
化学方程式为:NaCl + H2SO4 + NaH2BO3 → NaHSO4 + Na3BO3 + HCl↑操作步骤如下:1)在集气瓶中加入适量的NaCl溶液和少量的硼砂(NaH2BO3)。
2)慢慢地加入浓硫酸(H2SO4)。
3)收集挥发的HCl气体。
3.醋酸法制备HCl气体醋酸法也是一种制备HCl气体的方法。
化学方程式为:NaCl + CH3COOH → CH3COONa + HCl↑操作步骤如下:1)在集气瓶中加入适量的NaCl溶液。
2)慢慢地加入浓醋酸(CH3COOH)。
3)产生HCl气体并收集。
4.氯化亚铁法制备HCl气体氯化亚铁法是制备HCl气体的另一种常用方法。
化学方程式为:4FeCl2 + 4HClO → 4FeCl3 + 2HCl + 2H2O操作步骤如下:1)在反应瓶中加入适量的氯化亚铁(FeCl2)和氯酸(HClO)。
2)随着反应进行,氯化亚铁被氧化为氯化铁(FeCl3)并产生HCl气体。
3)通过配备好的适当装置收集HCl气体。
总结:以上是几种常用的实验室制备HCl气体的方法及其化学方程式。

实验室制氯化氢方程式
在化学实验室中,制备氯化氢(氢氯酸)是一项常见的实验。
氯化氢是一种无色气体,具有刺激性气味,可以被用于许多化学实验和工业应用中。
下面我们将介绍一种在实验室中制备氯化氢的方法,并给出相应的化学方程式。
在实验室中,氯化氢气体通常是通过盐酸和一种含有氯离子的化合物反应制备的。
其中,最常见的方法是通过盐酸和氯化钠(食盐)的反应来制备氯化氢气体。
反应的化学方程式如下所示:
2HCl(aq) + NaCl(s) → 2NaCl(aq) + H2(g)。
在这个方程式中,盐酸(HCl)和氯化钠(NaCl)在水中反应生成氯化氢气体和氯化钠溶液。
氯化氢气体会从反应瓶中释放出来,可以通过适当的方法收集和保存。
制备氯化氢气体的实验过程需要十分小心,因为氯化氢气体具有剧烈的刺激性气味,对人体有害。
实验室工作人员需要佩戴适当的防护装备,并在通风良好的环境下进行操作。
总之,制备氯化氢气体是化学实验室中的一项常见实验。
通过
盐酸和氯化钠的反应,我们可以获得氯化氢气体,并且可以通过相
应的实验操作来收集和保存这种气体。
然而,在进行这项实验时,
必须严格遵守实验室安全规定,以确保实验操作的安全性和可靠性。


实验室制取氯化氢
离
子
方
程
式
二〇一四年八月十六日星期六
●实验室制取氯化氢:
●将浓硫酸与氯化钠固体混合加热,
●因为氯化钠为固体,
●而浓硫酸中水很少,
●不足以支持硫酸和氯化钠的电离,
●故都不能拆成离子形态。
不加热或稍加热:
NaCl+H2SO4(浓)=NaHSO4+HCl ↑加强热:
2NaCl+H2SO4(浓)=强热=Na2SO4+2HCl ↑
●实验室制HBr、碘化氢:
●由于浓硫酸有强氧化性,
●会将生成的HBr、HI氧化,
●故不能用浓硫酸,
●应换成浓磷酸,
●同样也是固体与浓磷酸的反应,
●也不能拆成离子形态。
●离子方程式与化学方程式相同:
●
NaBr+H3PO4(浓)=NaH2PO4+HBr ↑●实验室制硝酸,
●用硝酸钠固体与浓硫酸反应,
●同样不能拆成离子形式:
NaNO3+H2SO4(浓)=NaHSO4+HNO3 ↑。

氯化氢的实验室制取
教学目标
1.知识与技能
了解氯化氢的物理化学性质
掌握氯化氢的实验是制法
2.过程与方法
通过观察演示实验,提高学生的观察能力,准确应用化学语言纪录实验现象从喷泉实验的演示到尾气吸收装置,学生学会知识的迁移
3.情感态度价值观
通过实验活动,提高学生的实验设计能力以及创新精神.
教学重点
氯化氢的实验室制法
教学难点
实验室制取氯化氢气体的实验设计
板书
氧气的实验室制取 化学方程式:
二氧化碳的实验室制取 化学方程式:
氯化氢气体的物理性质 无色气体 熔、沸点较低
密度略大于空气 是空气的1.26倍 有刺激性气味 溶解性? 极易溶于水
溶解比例 1:500
运用 氯化氢的尾气吸收
3O 2
2KCl + 2KClO CaCO 3+2HCl CaCl 2+H 2O+CO 2。
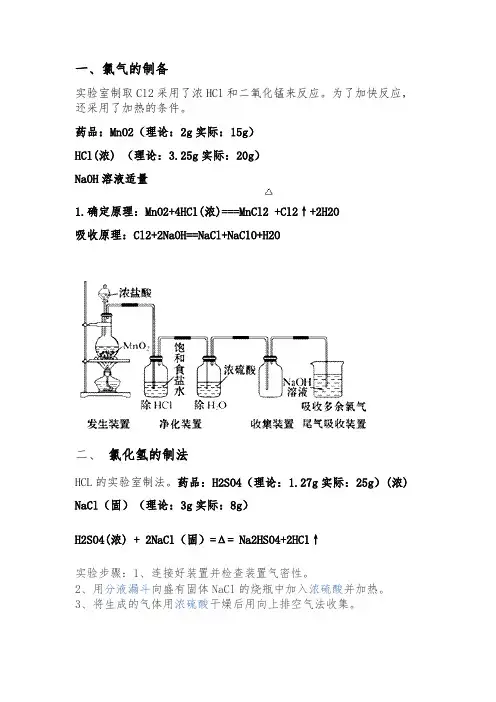
一、氯气的制备实验室制取Cl2采用了浓HCl和二氧化锰来反应。
为了加快反应,还采用了加热的条件。
药品:MnO2(理论:2g实际:15g)HCl(浓) (理论:3.25g实际:20g)NaOH溶液适量1.确定原理:MnO2+4HCl(浓)===MnCl2 +Cl2↑+2H2O吸收原理:Cl2+2NaOH==NaCl+NaClO+H2O二、氯化氢的制法HCL的实验室制法。
药品:H2SO4(理论:1.27g实际:25g)(浓)NaCl(固)(理论:3g实际:8g)H2SO4(浓) + 2NaCl(固)=Δ= Na2HSO4+2HCl↑实验步骤:1、连接好装置并检查装置气密性。
2、用分液漏斗向盛有固体NaCl的烧瓶中加入浓硫酸并加热。
3、将生成的气体用浓硫酸干燥后用向上排空气法收集。
4、尾气用稀碱溶液处理。
5、收集完毕,先折导管,再熄灭酒精灯。
氢氧化钠三、一氧化碳的制备药品:甲酸(理论:2g实际:15g),浓硫酸(理论:2g实际:15g)甲酸脱水:甲酸和浓硫酸混合加热到80℃以上脱水HCOOH=(△,浓H2SO4)=H2O+CO↑条件:加浓硫酸,并加热。
(用此方法生成的气体通过浓NaOH(aq)除去CO2(g)) 1.在250mL蒸馏烧瓶里加入密度为1.84g/cm3的浓硫酸50mL,在分液漏斗里盛放密度为1.2g/cm3的甲酸10mL,装置如图所示。
检查装置的气密性。
2.给浓硫酸加热到80--90℃,移去酒精灯。
3.向烧瓶内逐滴加入甲酸,即有一氧化碳产生o4.当空气排尽后,用排水法收集一氧化碳,并用橡皮塞塞紧集气瓶口。
(第一瓶一氧化碳气体里混有空气,点燃时会发生爆鸣,应注意安全。
)酒精灯。
四、二氧化硫的制备药品:Na2SO3 (理论:3g实际:10g) H2SO4(理论:1.27g实际:15g)①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O③装置——分液漏斗,圆底烧瓶④检验——先通入品红试液,褪色,后加热又恢复原红色;⑤除杂质——通入浓H2SO4(除水蒸气)⑥收集——向上排气法⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O实验开始时,将浓H2SO4逐滴加入烧瓶里,立即有二氧化硫气体发生,不需加热。

制取氯化氢的方法及方程式氯化氢(化学式为HCl)是一种无色、刺激性气体,常用于实验室中的化学反应和工业生产中。
制取氯化氢的方法主要有以下几种:1. 氢氧化钠与盐酸反应法:氢氧化钠(NaOH)与盐酸(HCl)反应可制取氯化氢。
反应方程式如下:NaOH + HCl → NaCl + H2O在实验室中,先将氢氧化钠固体溶解在水中,得到氢氧化钠溶液。
然后将溶液倒入集气瓶中,加入适量的盐酸,并用橡皮塞密封。
随着反应进行,氯化氢气体会生成并被集气瓶收集。
2. 硫酸与盐酸反应法:硫酸(H2SO4)与盐酸反应也可以制取氯化氢。
反应方程式如下:H2SO4 + 2HCl → 2H2O + SO2 + Cl2这种方法产生的氯化氢同时伴随着二氧化硫和氯气的生成。
实验室中可以将硫酸和盐酸混合后,通过加热使反应进行,然后通过冷却和收集气体的方式获取氯化氢。
3. 硫酸与氯化钠反应法:硫酸与氯化钠反应也可以制取氯化氢。
反应方程式如下:NaCl + H2SO4 → NaHSO4 + HCl这种方法中,硫酸与氯化钠反应生成氯化氢气体。
实验室中可以将氯化钠固体与硫酸混合,然后通过冷却和收集气体的方式获取氯化氢。
4. 氢氯酸与硫酸反应法:氢氯酸(HClO4)与硫酸(H2SO4)反应也可以制取氯化氢。
反应方程式如下:HClO4 + H2SO4 → HCl + H2S2O7这种方法中,氢氯酸与硫酸反应生成氯化氢气体。
实验室中可以将氢氯酸和硫酸混合,然后通过冷却和收集气体的方式获取氯化氢。
以上是制取氯化氢的几种常见方法,这些方法都是通过化学反应产生氯化氢气体。
根据实际需要和条件的不同,可以选择适合的方法进行制取。
在操作过程中需要注意安全,避免接触到氯化氢气体对人体造成伤害。


氯化氢的实验室制法氯化氢的实验室制法之一【原理】高沸点酸可与低沸点酸的盐反应,生成低沸点酸。
浓H2SO4是难挥发的高沸点酸,盐酸是易挥发的低沸点酸,实验室就是用浓H2SO4与NaCl晶体共热来制取氯化氢气。
氯化氢溶于水即得盐酸。
NaCl+H2SO4(浓)NaHSO4+HCl↑2NaCl+H2SO4(浓)Na2SO4+2HCl↑氯化氢极易溶于水,不能用排水法收集。
因氯化氢的密度比空气大,所以可以用瓶口向上的排空气集气法收集。
【用品】食盐、浓H2SO4、蒸馏水、铁架台、烧瓶、石棉网、分液漏斗、烧杯、集气瓶、酒精灯、漏斗、棉花【操作】1.按装置图连接好,检验气密性后,在烧瓶中加入约15g干燥的食盐。
2.从分液漏斗往烧瓶里逐渐加入浓H2SO4,使酸液浸没食盐,便会有氯化氢生成。
3.加微热,用集气瓶收集。
4.用蘸有浓氨水的玻璃棒放在集气瓶口试验,如有大量白烟生成,证明已集满。
(或将湿润的蓝石蕊试纸放在集气瓶口试验,如试纸变红,则证明集气瓶里已集满了氯化氢气。
)【备注】1.这个实验开始时反应较剧烈,不需加热,不然会使反应过快,产生的氯化氢逸散到空气中去。
当反应缓慢时再用微火均匀加热,温度不能过高,以免烧瓶里产生的泡沫随气体一同逸出。
2.发生装置和收集氯化氢气的集气瓶均应干燥。
3.集气瓶口要放疏松的棉花团或盖上纸片,以减少氯化氢向空气的扩散。
4.氯化氢气是有刺激性气味的气体,对多余的氯化氢可按图装置中倒扣的漏斗用水吸收。
氯化氢的实验室制法之二【原理】食盐跟浓硫酸起反应,不加热或稍微加热,就生成硫酸氢钠和氯化氢。
NaCl+H SO()=NaHSO+HCl浓↑244硫酸氢钠在500~600℃的条件下,继续起反应而生成硫酸钠和氯化氢。
总的化学方程式可以表示如下:2NaCl+H2SO4(浓)Na2SO4+2HCl↑【用品】食盐、浓硫酸、分液漏斗、烧瓶、集气瓶、烧杯、铁架台、酒精灯、漏斗、石棉网【操作】把少量食盐放在烧瓶里如图。
实验室制取氯化氢化学方程式嘿,朋友们!今天咱们来聊聊实验室制取氯化氢这事儿,可有趣啦!咱们先说一个制取氯化氢的经典方法。
就像两个小伙伴联手搞事情一样,氯化钠(NaCl)和浓硫酸(H₂SO₄)凑到了一块儿。
想象一下,氯化钠就像个老实巴交的小盐粒,浓硫酸呢,那可是个厉害的“酸老大”。
当它们相遇的时候,就会发生这样的反应:2NaCl + H₂SO₄(浓)==加热== Na₂SO₄ + 2HCl↑。
这就好比小盐粒被酸老大“教训”了一下,然后就乖乖地放出了氯化氢这个小调皮。
再看另一种情况哈。
如果把这个反应想象成一场魔法秀,氯化钠是带着咸味的魔法小颗粒,浓硫酸是充满魔力的强酸液体。
在加热这个魔法火焰的催化下,氯化氢就像从魔法锅里冒出来的神秘小烟雾一样,按照化学方程式的脚本开始登场啦。
还有哦,你可以把氯化钠当作是被浓硫酸盯上的小猎物。
浓硫酸就像个贪婪的大怪兽,一口咬住氯化钠,然后经过加热这个激烈的战斗过程,就把氯化氢这个小跟班给挤了出来,就像2NaCl + H₂SO₄(浓)==加热== Na₂SO₄ + 2HCl↑这个方程式所展示的那样有秩序。
咱们再从一个超级搞笑的角度来看。
氯化钠是一群小小的盐兵,浓硫酸是强大的酸将军。
酸将军一声令下:“小盐兵们,在加热的战场上,给我变出氯化氢来!”然后呢,小盐兵们就只能按照化学的法则,变成了硫酸钠(Na₂SO₄),还释放出了氯化氢,像方程式里写的那么精确。
要是把这个反应比喻成一场美食制作呢?氯化钠是食材,浓硫酸是特殊的调料。
加热就像是炉灶的火。
在这个奇特的“厨房”里,食材和调料一混合,就做出了氯化氢这道“化学菜”,而反应方程式就是这道菜的烹饪秘籍:2NaCl + H₂SO₄(浓)==加热== Na₂SO₄ + 2HCl↑。
从微观的世界看呀,氯化钠的小离子们和浓硫酸的氢离子、硫酸根离子就像不同帮派的小生物。
在加热的大环境下,它们互相交换伙伴,就像在开一场离子派对,然后氯化氢这个新的小团体就从派对里诞生了,这都是方程式所描述的神奇过程。
实验室制备氯化氢方程式嘿,宝子们!今天咱们来唠唠实验室制备氯化氢这事儿,那可就像一场奇妙的化学魔法秀呢!首先呢,最常见的一种方法是用氯化钠固体和浓硫酸反应来制备氯化氢。
这就像是一场氯化钠士兵和浓硫酸大魔王的战斗,方程式是$2NaCl + H_{2}SO_{4}(浓)\stackrel{\triangle}{=\!=\!=}Na_{2}SO_{4}+2HCl\uparro w$。
你看啊,氯化钠固体小颗粒就像一群规规矩矩的小兵,浓硫酸呢,那可是个厉害的角色,就像一个拥有强大力量的大魔王。
加热的时候,就像是吹响了战斗的号角,然后氯化氢这个小气体就像胜利的旗帜被高高举起,从反应体系里冒了出来。
还有一种办法呢,有点像“借兵打仗”。
用浓盐酸滴入浓硫酸里。
这浓盐酸就像一个装满武器的小仓库,浓硫酸像一个超级抽风机。
方程式可以近似看成$HCl(浓)+H_{2}SO_{4}(浓)\stackrel{}{=\!=\!=}HCl\uparrow +H_{2}SO_{4}\cdot H_{2}O$。
浓盐酸里的氯化氢被浓硫酸这么一“抽”,就像被龙卷风卷起来一样,迅速地脱离出来,变成氯化氢气体跑掉啦,感觉氯化氢就像一个调皮的小娃娃,被浓硫酸这个大力士给揪了出来。
咱再说说如果把氯化镁和浓硫酸放一起反应制备氯化氢。
氯化镁就像一个有点内敛的小助手,浓硫酸还是那个霸气的主角。
反应方程式$MgCl_{2}+H_{2}SO_{4}(浓)\stackrel{\triangle}{=\!=\!=}MgSO_{4}+2H Cl\uparrow$。
在加热这个魔法咒语下,氯化镁把自己的氯离子贡献出来,和硫酸根交换,氯化氢就像变魔术一样从反应容器里冒出来了,就像从魔法盒子里突然蹦出个小精灵。
要是用氯化铵和浓硫酸呢,氯化铵就像一群带着特殊装备(铵根和氯离子)的小队伍。
方程式$2NH_{4}Cl +H_{2}SO_{4}(浓)\stackrel{\triangle}{=\!=\!=}(NH_{4})_{2}SO_{4}+2HCl\u parrow$。