乙烯的物化性质
- 格式:doc
- 大小:16.00 KB
- 文档页数:2

乙烯性质知识点总结归纳1. 物理性质乙烯是一种无色、有刺激性气味的气体。
在常温和常压下,乙烯是一种无色无臭的气体。
它的沸点为-103.7摄氏度,密度为0.91克/升。
由于乙烯是一种不稳定的气体,通常以液态的形式存储和运输,以减少安全风险。
2. 化学性质乙烯是一种高度活泼的化合物,它具有许多特殊的化学性质。
首先,乙烯对氧气具有很高的亲和力,容易发生氧化反应,导致氧化性质比较强。
其次,乙烯还可以和卤素发生加成反应,例如和氯气发生加成反应得到1,2-二氯乙烷。
此外,乙烯可以和水发生加成反应,生成乙醇。
最后,乙烯还可以和许多有机物发生加成反应,生成不同种类的有机化合物。
3. 燃烧性质乙烯是一种易燃的气体,在空气中可以燃烧产生火焰。
乙烯的燃烧反应为:C2H4 + 3O2 → 2CO2 + 2H2O在氧气充足的条件下,乙烯燃烧会产生大量的热能和光能,释放出明亮的火焰。
这使得乙烯成为一种重要的燃料和燃烧剂,在工业生产和日常生活中都有广泛的应用。
4. 溶解性质乙烯在水中的溶解度相对较低,但可以在一定程度上溶解。
乙烯还可以溶解在一些有机溶剂中,例如乙醇、丙酮等。
此外,乙烯还可以在液态氨中溶解,形成乙烯-氨复合物。
这些溶解性质对于乙烯的分离和提纯具有一定的意义。
5. 催化性质乙烯具有很强的催化性质,它可以用作许多重要的工业催化剂。
例如,乙烯可以作为裂化反应的催化剂,将较重的烃类化合物裂解成较轻的烃类化合物。
此外,乙烯还可以用作合成乙烯醇、聚乙烯等重要化学产品的催化剂。
6. 光敏性质乙烯在紫外线的作用下会产生自聚合分解反应,生成聚乙烯。
这种光敏性质使得乙烯成为一种重要的聚合物原料,在塑料工业、合成橡胶工业中有着广泛的应用。
7. 生物活性乙烯在植物生长中起着重要的生理作用。
乙烯可以促进植物的果实成熟和脱落,调节植物的生长和发育过程。
此外,乙烯还可以作为一种植物激素,参与植物的生长和代谢过程。
因此,乙烯在农业生产中有着重要的应用价值。

聚乙烯的合成(1)乙烯的物化性能乙烯常温下为无色易燃气体,纯乙烯在350℃以下稳定,其特性参数见表1.2—3。
表1.2—3 乙烯的特性参数乙烯的分子式为CH2=CH2,分子对称无极性,偶极短近乎为零,乙烯分子中两个碳原子间的共用电子对在不同条件下会分别发生均裂或异裂,进而按不同机理进行聚合,用于聚合的乙烯,纯度要求很高,含量(质量分数)必须在99.9%以上。
(2)乙烯的聚合按乙烯聚合方法的特点,合成PE的技术路线有三种,即高压、中压和低压法。
工业上三种方法并存,每种方法都有各自的特性,每种PE的结构、密度和性能都有一定的差异。
2)高压聚合法乙烯临界温度很低,高度压缩也难以液化,只有在微量氧存在的条件下,压力超过100MPa,且温度在200℃左右时生成游离基才能引发聚合反应。
这种条件下所制得的产品即为高压法LDPE。
高压聚合反应的特点之一。
是在温度200℃时,微量氧与乙烯作用生成过氧化物,然后再分解为游离基引发乙烯聚合,并不是氧分子本身起引发剂作用。
该法属游离基型聚合,也遵循一般游离基型聚合规律,并经历链引发、链增长等阶段。
聚合反应的第二个特点,是聚合温度高于一般游离基聚合反应。
高温下增长链游离基的活性大,易于发生链转移。
加之反应体系内并没有链转移剂,仅有单体和PE大分子,因而活性增长链游离基与单体和大分子中的氢原子作用而生成新游离基,同时发生支链化反应。
其支链反应的结果既有长支链,也有分子内链转移而形成的短文链,还可能产生甲基短支链。
由于以上反应,高压法PE的分子结构是具有较多支链的线型大分子,密度仅为0.92g/cm3左右。
工业生产的LDPE数均相对分子质量约在2.5万—5.0万范围内,重均相对分子质量则达10万以上,而且在其主链中每1000个碳原子便有20-30个支链。
当前高压法PE的生产技术发展趋势是,生产规模和反应器的大型化,将有利于降低生产成本。
进一步提高聚合压力,有改善PE的透明性和耐老化性的可能。


从乙烯的结构式可以看出,乙烯分子里含有C=C双键,链烃分子里含有碳碳双键的不饱和烃叫做烯烃。
乙烯是分子组成最简单的烯烃。
乙烯分子的空间构型为了更简单形象地描述乙烯分子的结构,我们常用分子模型来表示(如下图)。
在下图中,I 的球棍模型里,两个碳原子间用两根可以弯曲的弹性短棍来连接,用它们来表示双键。
在下图中,II 是乙烯分子的比例模型。
乙烯分子的模型实验表明,乙烯分子里的C=C双键的键长是 1.33×10-10m,乙烯分子里的两个碳原子和四个氢原子都处在同一平面上。
它们彼此之间的键角约为120°。
乙烯双键的键能是615kJ/mol,实验测得乙烷C-C单键的键长是1.54×10-10m,键能是348kJ/mol。
这表明C=C双键的键能并不是C-C单键键能的两倍,而是比两倍略少。
因此,只需要较少的能量,就能使双键里的一个键断裂。
这从下面介绍的乙烯的化学性质是可以得到证实。
制取乙烯的原理工业上所用的乙烯,主要是从石油炼制工厂和石油化工厂所生产的气体里分离出来的。
实验室里是把酒精和浓硫酸混合加热,使酒精分解制得。
浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液——液加热型乙烯能使酸性KMnO4溶液很快褪色,这是乙烯被高锰酸钾氧化的结果,而甲烷等烷烃却没有这种性质。
乙烯的化学性质——加成反应把乙烯通入盛溴水的试管里,可以观察到溴水的红棕色很快消失。
乙烯能跟溴水里的溴起反应,生成无色的1,2-二溴乙烷(CH2Br-CH2Br)液体。
这个反应的实质是乙烯分子里的双键里的一个键易于断裂,两个溴原子分别加在两个价键不饱和的碳原子上,生成了二溴乙烷。
这种有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成别的物质的反应叫做加成反应。
乙烯还能跟氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应。
乙烯的化学性质——氧化反应点燃纯净的乙烯,它能在空气里燃烧,有明亮的火焰,同时发出黑烟。
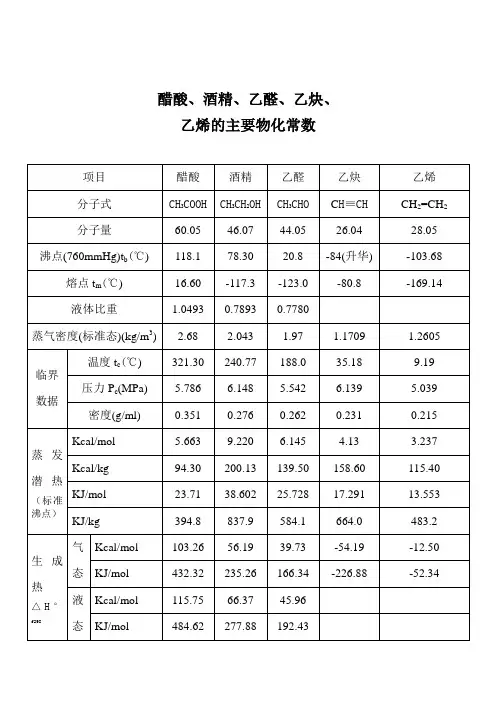

废气的物化性质1、苯乙烯极微溶于水(40℃时为0.05),溶于乙醇、丙酮、苯,分子量M=104.15,比重d=0.90604(20℃时),t沸=145.2℃,ΔH蒸=43.94(25℃时)。
蒸发潜热:84.69 cal/g(145度) 2、对二甲苯无色晶体或溶液,不溶于水,易溶于乙醇、乙醚,与丙酮、苯无限互溶,分子量M=106.17,比重d=0.86114(20℃时),t沸=138.35℃,ΔH蒸=359.30。
3、苯无色液体,在水中的溶解度很小,能与乙醇、乙醚、二硫化碳等有机溶剂混溶。
分子量M=78.11,比重d=0.8765(20℃时),t沸=80.1℃。
4、甲苯微溶于水(16℃时为0.057),与乙醇无限互溶,分子量M=92.14,比重d=0.86694(20℃时),t沸=110.626℃,ΔH蒸=37.99(26℃时)。
5、间二甲苯不溶于水,易溶于乙醇,与丙酮、苯无限互溶,分子量M=106.17,比重d=0.8642(20℃时),d=0.86835(15℃时),t沸=139.1℃,ΔH蒸=363.60。
6、临二甲苯不溶于水,易溶于乙醇,与丙酮、苯无限互溶,分子量M=106.17,比重d=0.8802(20℃时),t沸=144.41℃,ΔH蒸=367.30。
7、环氧丙烷溶于水、乙醇、乙醚,分子量M=58.08,比重d=0.859(20℃时),t沸=154℃,39.9℃时能与1%的水共沸。
8、丙酮与水、乙醇、乙醚、苯、三氯甲烷无限互溶,分子量M=58.08,比重d=0.7899(25℃时),d=0.7928(20℃时),t沸=56.24℃,ΔH蒸=29.67(56.20℃时)。
9、醋酸酐无色液体,遇乙醇分解,溶于水、苯,分子量M=102.09,比重d=1.082(20℃时),t 沸=140.0℃。
10、醋酸乙烯无色液体,溶于水,与乙醇、乙醚无限互溶,分子量M=86.09,比重d=1.013(20℃时),t沸=164.0℃。

乙烯的原理
乙烯,也被称为乙烯或乙烯基,是一种含有两个碳原子的烯烃化合物。
它的化学式为C2H4,结构上有一个碳碳双键。
乙烯
是一种无色、可燃的气体,在常温下可以压缩成液体。
乙烯的产生主要通过裂解石油和天然气中的烃类化合物得到。
在这个过程中,高温和催化剂的作用下,长链烃分子被断裂成较短的烃分子。
乙烯是其中最简单的烯烃。
乙烯是一种重要的工业化学原料,广泛应用于各个领域。
其中最重要的是制造聚乙烯(PE)。
聚乙烯是一种塑料,可用于
制造包装薄膜、容器、管道等各种日常用品。
此外,乙烯也用于制造乙烯醇、乙烯氧化物、醋酸乙烯等多种化学品。
乙烯的化学性质主要与其碳碳双键相关。
由于双键中的π电子较为松散,因此乙烯容易发生反应。
它可以参与加成反应,例如与氢气反应生成乙烷。
此外,乙烯还可以进行聚合反应,通过将乙烯的分子连接起来,制得聚乙烯。
总之,乙烯是一种重要的化学品,广泛应用于塑料制造、化学工业等领域。
它的产生主要通过石油和天然气的裂解得到。
乙烯的化学性质主要来自于其碳碳双键,使其具有丰富的反应性。

乙烯性质知识点总结在本文中,我将详细介绍乙烯的性质,包括物理性质、化学性质、制备方法以及其在工业和化工中的应用。
第一部分:乙烯的物理性质1.密度和相对分子质量乙烯的相对分子质量约为28.05 g/mol,密度约为0.88 g/cm3。
在标准大气压下,乙烯的沸点为-103.7°C,冰点为-169.4°C。
它是一种易挥发的气体,在室温下无色无味。
2.燃烧性质乙烯是一种易燃气体,与空气混合形成爆炸性混合物。
当乙烯与氧气混合燃烧时,会产生高温和大量的热量,它的燃烧方程式为:C2H4 + 3O2 → 2CO2 + 2H2O3.溶解性乙烯可溶于非极性溶剂,如乙醚、苯和石油醚等。
在水中的溶解度较低,但可以通过气相吸收法大量溶解于水中。
第二部分:乙烯的化学性质1.加成反应乙烯是一种具有高度反应性的烯烃,它可以与许多化合物发生加成反应,生成新的化合物。
例如,乙烯与卤素发生加成反应生成卤代乙烷,与酸发生加成反应生成乙醇。
2.聚合反应乙烯是一种重要的合成树脂和合成橡胶的原料,它可以通过聚合反应生成聚乙烯。
聚乙烯是一种常见的塑料,具有良好的机械性能和化学稳定性。
3.氧化反应乙烯可以通过氧化反应生成乙烯醇和乙醛。
例如,乙烯在氧气的存在下可以氧化生成乙烯醇,化学方程式为:C2H4 + O2 → C2H4O4.加氢反应乙烯可以通过加氢反应生成乙烷。
在催化剂的作用下,乙烯与氢气反应生成乙烷,化学方程式为:C2H4 + H2 → C2H6第三部分:乙烯的制备方法1.烃基卤化物的脱氢乙烯可以通过烃基卤化物的脱氢制备。
例如,当溴乙烷经过催化剂的作用加热时,可以发生脱氢反应生成乙烯。
2.乙醇的干燥脱水乙烯还可以通过乙醇的干燥脱水制备。
当乙醇在高温下经过干燥剂的作用,会发生脱水反应生成乙烯。
3.集气法乙烯可以通过使用集气法制备。
例如,可以通过乙烷的裂解或气相吸收法从天然气中提取乙烯。
第四部分:乙烯的应用1.化工原料乙烯是一种重要的化工原料,广泛用于合成各种有机化合物,如醇类、酮类、醛类等。

乙烯化学性质及用途乙烯,也称作乙烯基(C2H4),是一种无色、可燃的气体。
乙烯是一种重要的有机化合物,具有很多重要的化学性质和广泛的应用。
下面我将详细介绍乙烯的化学性质及其在各个领域的用途。
乙烯是一种非极性分子,具有较低的沸点和熔点。
它在常温下是无色气体,但可以通过压缩或冷却使其液化。
乙烯的燃烧性质非常活泼,可以燃烧产生水和二氧化碳,并放出大量的能量。
这使得乙烯成为一种重要的燃料。
此外,乙烯还可以参与多种化学反应,如加成反应、自由基反应和聚合反应等。
乙烯的重要化学性质之一是加成反应。
乙烯可以与氢气进行加成反应,生成乙烷。
这种反应常用于工业乙烯的合成。
此外,乙烯还可以与卤素气体发生加成反应,生成卤代烃。
这种反应可用于生产溴代乙烷等化合物。
乙烯还可以与醇、酸等官能团进行加成反应,生成醚、酯等化合物。
乙烯的自由基反应性质也非常重要。
乙烯可以通过自由基反应与氧发生反应,生成环氧乙烷。
这是一种重要的中间体,可用于合成多种有机化合物。
乙烯还可以与自由基引发剂反应,如过氧化氢、过氧化二苯甲酮等,生成自由基,在乙烯聚合反应中起到引发剂的作用。
乙烯最重要的用途之一是作为一种重要的化工原料。
乙烯可以通过蒸馏分离、催化裂化等方法从石油炼油过程中分离出来。
然后,乙烯可以通过加成反应、自由基反应等进行化学转化,生成各种有机化合物。
例如,乙烯可以制备乙醇、醋酸乙烯酯、氯乙烯等。
这些有机化合物广泛用于制药、涂料、塑料、橡胶等行业。
乙烯的另一个重要应用领域是塑料工业。
乙烯可以通过聚合反应制备聚乙烯,这是一种广泛用于包装、容器、管道等领域的塑料。
聚乙烯具有良好的柔韧性、耐腐蚀性和耐热性。
此外,乙烯还可以与其他单体进行共聚反应,生成各种特殊功能的塑料,如聚丙烯腈、聚氯乙烯、聚苯乙烯等。
此外,乙烯还广泛应用于橡胶工业。
乙烯可以与一些单体进行聚合反应,生成各种合成橡胶。
其中,乙烯与丙烯共聚可以制备氯丁橡胶,乙烯与乙烯基苯共聚可以制备聚乙烯基苯橡胶。

PVC——高分子聚合物百科名片PVC其实是一种乙烯基的聚合物质,其材料是一种非结晶性材料。
PVC材料在实际使用中经常加入稳定剂、润滑剂、辅助加工剂、色料、抗冲击剂及其它添加剂。
具有不易燃性、高强度、耐气侯变化性以及优良的几何稳定性。
PVC对氧化剂、还原剂和强酸都有很强的抵抗力。
然而它能够被浓氧化酸如浓硫酸、浓硝酸所腐蚀并且也不适用与芳香烃、氯化烃接触的场合。
另外游戏中术语person vs computer,缩写为PVC,以及PVC人形经常被简称为PVC 等PVC 永久虚电路PVC (Permanent Virtual Circuit)编辑本段PVC简介聚氯乙烯(Poly Vinyl Chloride,PVC)分子结构[1][1][1][1][1][1][1][1]pvc薄膜Polyvinylchloride,主要成份为聚氯乙烯,色泽鲜艳、耐腐蚀、牢固耐用,由于在制造过程中增加了增塑剂、抗老化剂等一些有毒辅助材料来增强其耐热性,韧性,延展性等,故其产品一般不存放食品和药品。
它是当今世界上深受喜爱、颇为流行并且也被广泛应用的一种合成材料。
它的全球使用量在各种合成材料中高居第二。
据统计,仅仅1995年一年,PVC在欧洲的生产量就有五百万吨左右,而其消费量则为五百三十万吨。
在德国,PVC的生产量和消费量平均为一百四十万吨。
PVC正以4%的增长速度在全世界范围内得到生产和应用。
近年来PVC 在东南亚的增长速度尤为显著,这要归功于东南亚各国都有进行基础设施建设的迫切需求。
在可以生产三维表面膜的材料中,PVC是最适合的材料。
PVC(聚氯乙烯),其单体的结构简式为CH2=CHCl.PVC材料用途极广,具有加工性能良好,制造成本低,耐腐蚀,绝缘等良好特点,主要用于制作:普瑞文pvc卡片;pvc贴牌;pvc铁丝;pvc窗帘;pvc涂塑电焊网;pvc发泡板、pvc吊顶、pvc水管、pvc踢脚线等以及穿线管、电缆绝缘、塑料门窗、塑料袋等方面。

乙烯化学性质
乙烯(Ethylene)是一种挥发性的有机无机化合物,其分子式为C2H4,是一种重要的有机化工原料,应用范围极广。
它是一种无色无味的气体,常用于合成某些化学物质,比如聚乙烯、乙烯乙烯烯丙烯、乙烷、乙醇、丁二醇、乙酸等,在工业上有着重要作用。
乙烯分子结构由两个碳原子和四个氢原子组成,形成了一个很简单的烃结构,它是一种立体分子,具有旋光性。
它的结构非常稳定,具有极高的化学稳定性,由于碳原子上的共价键很强,不易被其它物质所改变,因此乙烯的形式在自然界中存在很长的时间。
乙烯的分子量为28.05克/克升,其熔点为-169度,沸点为10.4度。
它在常温下是气态存在,沸点低使得它更容易被压缩、装载、调配。
乙烯易挥发,所以几乎不溶于水,它也不易被水所分解,但是它可能会与油脂等有机物质发生反应,形成混合物。
乙烯的氧化反应性非常强,它可以与氧气发生反应,产生乙烯氧化产物,比如乙酰乙醛和乙醛。
乙烯也能与硝酸发生反应,生成硝酸乙烯。
乙烯还是某些特殊物质的原料,比如乙烯氢磺酸,乙烯氯磺酸,乙烯亚甲基磺酸,乙烯基氯化钠等。
乙烯还可以被用于合成一些聚合物,比如聚乙烯薄膜、乙烯乙烯基丙烯腈橡胶等,广泛应用于塑料、油漆、涂料、橡胶制品等工业。
以上是关于乙烯的化学性质的介绍,大家可以根据它的化学性质,来处理一些有机物质,从而获得更多的应用领域。
乙烯正由于其多样
的性质而受到越来越多的重视,它的未来发展和应用都非常广阔,给我们带来了莫大的希望。
甲醇1、物理性质2、化学性质甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等乙烯1、物理性质2、化学性质乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯1、物理性质2、化学性质丙烯除了在烯键上起反应外,还可在甲基上起反应,决定了丙烯能够发生许多化学反应。
丙烯在不同种催化剂的催化下发生各类聚合反应,如生成聚丙烯等聚合物,还可与硫酸、氯和水等发生加成反应,也能在催化剂存在下与氨和空气中的氧起氨氧化反应,生成丙烯腈,它是合成塑料、橡胶、纤维等高聚物的原料,等等。
丙烯主要的下游产物是聚丙烯,另外丙烯可制丙烯腈、异丙醇、苯酚和丙酮、丁醇和辛醇、丙烯酸及其脂类以及制环氧丙烷和丙二醇、环氧氯丙烷和合成甘油等。
聚乙烯1、物理性质可作为电视、雷达等的高频绝缘材料。
2、化学性能聚乙烯有优异的化学稳定性,室温下耐盐酸、氢氟酸、磷酸、甲酸、胺类、氢氧化钠、氢氧化钾等各种化学物质,硝酸和硫酸对聚乙烯有较强的破坏作用。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解,碳黑对聚乙烯有优异的光屏蔽作用。
受辐射后可发生交联、断链、形成不饱和基团等反映。
聚丙烯1、物理性质中文名称聚丙烯英文名称polypropylene ,简称PPCAS号9003-07-0俗称百折胶分子式[C3H6]n 结构简式溶解性不溶于常见的酸、碱有机溶剂外观和性状无毒、无臭、无味的乳白色高结晶的聚合物2、化学性能聚丙烯的化学稳定性很好,除能被浓硫酸、浓硝酸侵蚀外,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使PP软化和溶胀,同时它的化学稳定性随结晶度的增加还有所提高,所以聚丙烯适合制作各种化工管道和配件,防腐蚀效果良好。
乙烯的性质和用途乙烯是一种无色、无味的气体,化学式为C2H4,相对分子质量为28.05、以下是关于乙烯的性质和用途的详细介绍:乙烯的物理性质:1.熔点和沸点:乙烯的熔点为-169.4°C,沸点为-103.9°C。
2. 密度:乙烯的密度为0.879 g/cm33.溶解性:乙烯在水中几乎不溶,但可以溶于有机溶剂如醚、醇、酮等。
4.稳定性:乙烯具有较高的化学稳定性,不易燃烧,但在高温和高压条件下会发生自发性聚合反应。
乙烯的化学性质:1.氧化反应:乙烯可以与氧气发生燃烧反应,生成二氧化碳和水。
2.加成反应:乙烯是一种典型的亲电试剂,在反应中与其他化合物发生加成反应,如和卤代烷反应生成烷烃,和水反应生成乙醇等。
3.聚合反应:乙烯是一种重要的单体,可以发生聚合反应生成聚乙烯,这是一种常用的塑料材料。
乙烯的用途:1.聚乙烯的制备:乙烯是聚乙烯的主要原料。
通过高温、高压催化剂的作用,乙烯通过聚合反应可以制备聚乙烯。
聚乙烯是一种重要的塑料材料,具有良好的化学稳定性、电绝缘性能和低温耐性,广泛用于包装、建筑、电子、汽车等行业。
2.乙烯的制醇:乙烯可以通过加水反应生成乙醇。
乙醇是一种重要的有机溶剂,广泛用于化工、制药、冶金等领域。
3.乙烯的制醛:乙烯通过氧化反应可以生成乙醛。
乙醛是一种常用的有机合成原料,广泛用于制造树脂、染料、药品等。
4.乙烯的制酯:乙烯可以与酸酐反应生成相应的酯。
乙烯酯是一种重要的溶剂和涂料原料,在化工、油漆、印刷等领域中有广泛的应用。
5.乙烯的制橡胶:乙烯可以通过聚合反应制备乙烯橡胶。
乙烯橡胶具有高强度、耐磨性好等特点,广泛用于轮胎、密封件、管道等领域。
6.乙烯的催化裂化:乙烯可以通过催化裂化反应在高温下分解成其他有机化合物,如乙苯、丙烯等。
这些有机化合物是许多化工产品的重要原料。
7.乙烯的用于水果成熟:乙烯可以作为植物生长激素,促进水果的成熟和脱落。
总结:乙烯是一种重要的化工原料,具有广泛的用途。
乙烯的理化性质及危险特性
概述
乙烯(又称乙烯烃、乙烯基)是一种无色、无臭的气体,分子
式为C2H4。
它是有机化合物的一种,常见于石油、天然气等化石
燃料的裂解产物中。
乙烯具有一些重要的理化性质和危险特性,本
文将对其进行介绍。
理化性质
1. 熔点和沸点:
- 乙烯的熔点为-169.4℃,沸点为-103.7℃。
由于其较低的沸点,乙烯常以气体形式存在。
2. 密度:
- 乙烯的密度为0.909 g/cm³(20℃,液态),0. g/cm³(0℃,
气态)。
3. 溶解性:
- 在常温下,乙烯几乎不溶于水,但可溶于多数有机溶剂,如
醇类、醚类和脂类等。
4. 燃烧性:
- 乙烯是易燃物质,在空气中与氧气反应会产生火焰,燃烧产物主要为二氧化碳和水。
5. 化学反应:
- 乙烯可以通过加成反应与许多物质发生反应,如与卤素、硫酸、硝酸等。
危险特性
1. 火灾和爆炸:
- 乙烯是易燃气体,与火源接触可能引发爆炸。
在空气中的浓度达到3.4%到36%时,乙烯能够形成可燃气体混合物。
2. 毒性:
- 乙烯对人体有一定的毒性,长时间暴露于高浓度乙烯气体中会引起嗜睡、头痛、头晕等中毒症状。
3. 环境影响:
- 乙烯会对环境造成一定影响,其燃烧生成的二氧化碳是温室
气体之一,对全球气候变化产生影响。
结论
乙烯是一种重要的化学物质,具有独特的理化性质和危险特性。
在使用和处理乙烯时,应注意其易燃性和对人体健康的影响,同时
也要重视其对环境的潜在影响。
乙烯知识点总结会考乙烯的物理性质1. 乙烯是无色、无臭、易燃的气体。
2. 乙烯的密度比空气小,可以通过液化制备为液体或固体形式。
3. 乙烯可以溶解于大多数有机溶剂,如丙酮、乙醇、苯等。
4. 乙烯的制冷温度为-169℃。
乙烯的化学性质1. 乙烯具有较强的还原性,可以与氧气发生燃烧反应,生成二氧化碳和水。
2. 乙烯可以与卤素发生加成反应,生成相应的卤代烃。
3. 乙烯可以与H2、HCl、HBr、HI等发生加成反应。
4. 乙烯还可以与水分子发生加成反应,生成乙醇。
乙烯的制备方法1. 从石油和天然气中分离。
乙烯可以通过裂解石油和天然气获得,这是目前工业上生产乙烯的主要方法之一。
2. 从醇中脱水得到。
乙烯可以通过乙醇的脱水反应得到。
3. 从乙炔加氢得到。
乙炔可以通过加氢反应制备乙烯。
乙烯的应用1. 作为化工原料。
乙烯可以用于制备聚乙烯、聚乙烯醇、醋酸乙烯酯、聚乙二醇等重要的化工原料。
2. 作为燃料。
乙烯可以作为燃料使用,如与氧气发生燃烧反应,释放出大量的能量。
3. 作为医药原料。
乙烯可以用于制备一些药物,如合成维生素A、消毒剂等。
4. 作为日用品原料。
乙烯可以用于制备一些日用品,如洗涤剂、香料等。
乙烯的环境影响1. 乙烯气体具有强烈的刺激性气味,对人体有一定的危害。
2. 乙烯的燃烧会产生二氧化碳和水,会增加大气中的二氧化碳含量,加剧全球暖化现象。
乙烯的安全性提示1. 乙烯是易燃气体,存放和使用时要注意防止火源。
2. 乙烯具有一定的刺激性气味,接触高浓度乙烯气体时应及时转移至通风处。
乙烯是一种重要的有机化学品,具有广泛的应用价值。
了解乙烯的物理性质、化学性质、制备方法、应用领域以及对环境和安全的影响,可以更好地理解和使用乙烯,并且在实际生产和生活中更加合理地使用和管理乙烯资源。
各类溶剂的物化性质表溶剂分子量M沸程101.3kpa\℃凝固点℃密度g/ml折光指数n D20粘度(20℃)mpa*s蒸气压20℃ kpa闪点℃脂肪烃石油醚82.2 42-62 -150 0.653 1.370 0.46(25℃)31.0 <0200# 132 144-165 <-20 0.743 1.415 0.7 4.0 -2戊烷72.2 35-38 -130 0.632 1.358 0.45(25℃)65 <20己烷86.2 65-70 -95 0.664 1.372 0.46(25℃)20.0 -22庚烷100.2 94-99 -91 0.684 1.387 0.62(25℃)8.5 -4脂环烃环己烷84.2 80.5-81.5 6.5 0.778 1.426 0.94 10.4 -17 甲基环己烷98.2 101-103 -126 0.769 1.423 0.68 5.1 -4 乙基环己烷112.2 132 -11.3 0.79 19 四氢化萘132.2 200-209 -31 0.969 1.539 2.2 0.024 74 芳香烃苯78.1 79.8-80.8 5.5 0.879 1.501 0.65 10.1 -11 甲苯92.1 110-111 -95 0.873 1.499 0.61 2.9 6 二甲苯106.2 137-142 -25 0.874 1.489 0.65 0.9 25 异丙苯120.2 169.3 -96 0.862 1.492 0.73 0.5 46 氯化烃二氯甲烷84.9 40.2 -96 1.326 1.424 0.44 47.5三氯甲烷119.4 61.2 -64 1.488 1.445 0.58 21.0氯乙烷64.5 12.5 -138 0.924 1.379 0.96 133.0 -43 2-氯丙烷78.6 36.2 -117 0.859 1.378 0.29 -36 1,2-二氯乙烷99.0 83-84 -36 1.254 1.444 0.74 8.2 13 1,1,1-三氯乙烷133.4 74 -32 1.332 1.738 1.1 13.51,2-二氯丙烷113.0 97.0 -100 1.155 1.442 0.85 5.6 12 三氯乙烯131.4 86.7 -86 1.446 1.477 0.58 7.3全氯乙烯165.9 121 -23 1.629 1.506 0.88 1.9醇类甲醇32.0 64.6 -98 0.791 1.329 0.61 12.8 10乙醇46.1 78.-114 0.789 1.361 1.19 5.9 13丙醇60.1 97.2 -127 0.804 1.386 2.26 1.923溶剂分子量M 101.3kpa\℃℃g/ml n D20(20℃)mpa*s20℃ kpa闪点℃异丙醇60.1 82.4 -88 0.786 1.377 2.20 4.2 13 丁醇74.1 117.7 -80 0.810 1.399 3.00 0.67 35 异丁醇74.1 107.7 -108 0.802 1.396 3.76 1.2 28 2-乙基丁醇102.2 149.5 -15 0.833 1.421 5.6 0.16 58 环己醇100.2 160.8 20 0.949 1.456 62.5 0.06 67 甲基环己醇114.2 160-195 -38 0.925 1.465 62.5 0.06 67 苯甲醇108.1 205.2 -15 1.043 1.539 0.61 0.002 96甲基苯甲醇122.2 -200-205 21.5 1.008 0.959-1.52511.2 0.003 90双丙酮醇116.2 168 -56 0.946 1.424 3.6 0.10 67 酮类丙酮58.1 56.2 -95 0.791 1.359 0.33 24.1 -19 甲乙酮72.1 79.6 -86 0.805 1.379 0.40 0.1 -14 甲基丁基酮100.2 127.2 -57 0.808 1.403 0.63 1.3 23 二乙酮86.1 100-102 -41 0.814 1.391 0.47 1.3 4 环己酮98.1 153-156 -26 0.946 1.451 2.2 0.35 43 异佛尔酮138.2 210-216 -8 0.920 1.477 2.6 0.04 85 酯类甲酸异丁酯74.1 97.5 -96 0.875 1.386 0.67 4.4醋酸甲酯88.1 55-57 -98 0.932 1.362 0.37 22.6 -13 醋酸乙酯102.1 76-77 -84 0.900 1.372 0.45 10.3 -5 醋酸丁酯116.2 124-128 -77.9 0.880 1.394 0.74 1.11 23 醋酸异丁酯116.2 114-118 -99 0.871 1.390 0.69 1.8 19 碳酸乙烯酯88.1 246.7 36.4 1.332 1.415 1.68 0.001 145 碳酸丙烯酯102.1 243.4 -54 1.205 1.422 2.76 0.004 130 丁内酯86.1 204 -42 1.124 4.436 2.0 0.09 98 醋酸丙酯102.1 101-102 -92 0.888 1.385 0.59 3.1 10 醋酸戊酯130.2 146-149 -100 0.876 1.403 0.92 0.6 40 醇醚类乙二醇单甲醚76.1 124.5 -85 0.966 1.402 1.98 0.83 38 乙二醇单乙醚90.1 134-137 <-80 0.930 1.408 2.08 0.5 43乙二醇单丙醚104.2149.5-153.5-90 0.911 1.414 2.42 0.13 49二乙二醇甲醚120.2 194.2 -85 1.021 1.424 4.0 0.03 90 二乙二醇乙醚162.2 224-234 -68 0.956 1.431 5.85 0.01 105 醚类溶剂分子量M 101.3kpa\℃℃g/ml n D20(20℃)mpa*s20℃ kpa闪点℃二乙醚74.1 34.5 -116 0.714 1.353 0.24 58.8 -40 二丁醚130.2 142.2 -95 0.769 1.399 0.7 0.65 25 甲基叔丁基醚88.2 55.3 -109 0.740 1.369 0.36 27.1 -28 四氢呋喃72.1 66 -108 0.888 1.407 0.61 17.3 -21.5 其它类二甲亚砜78.1 189.0 18.5 1.100 1.478 1.99 0.06 95 硝基甲烷61.0 101.2 -29 1.139 1.381 0.65 3.7 33 硝基乙烷75.1 114.0 -90 1.052 1.391 0.68 2.08 29。
乙烯性能描述
常温常压下,乙烯是一种无色气体,但通常以带压低温液体的形式进行储存、运输。
健康危害:具有较强的麻醉作用。
急性中毒:吸入高浓度乙烯可立即引起意识丧失,无明显的兴奋期,但吸入新鲜空气后,可很快苏醒。
对眼及呼吸道粘膜有轻微刺激性。
与液态的乙烯接触,会由于其迅速蒸发而导致身体组织冻伤。
慢性影响:长期接触,可引起头昏、全身不适、乏力、思维不集中;个别人有胃肠道功能紊乱。
环境危害:对环境有危害,对水体、土壤和大气可造成污染。
燃爆危险:易燃,与空气混合能形成爆炸性混合物;遇明火、高热或与氧化剂接触,有引起燃烧爆炸的危险;与氟、氯等接触会发生剧烈的化学反应。
有害燃烧产物:一氧化碳、二氧化碳。
职业接触限值:中国MAC(mg/m3):未制定标准;TLVTN:ACGIH 窒息性气体。
液态乙烯及气体特性和安全数据
物理特性
分子式:C2H4
分子量:28.05
CAS No.:74-85-1
类别:不饱和碗烃(脂肪类的)外观:无色液体,气体呈云雾状
比空气重
气味:微甜,略具烃类特有的臭味凝固点:-169.2℃(大气压下)沸点:-103.7℃(大气压下)闪点1 : 约-136.1℃
燃烧温度2:450℃
燃烧限值:在空气中体积比为2.7—36%
比重:0.569(-104℃)
相对蒸气密度:0.977(0℃/1.013bar)蒸气压力:0.999bara (-104℃)
40.05bara (0℃)
溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚安全数据
TLV3:在空气中为1000ppm(v/v) 液态下影响:对眼部和皮肤造成冻伤和组织损伤
气态下影响:窒息、眩晕和恶心,高浓度会导致麻醉,无法感觉到疼痛、冷热
注:
1可燃性液体的蒸气在液体表面与空气混合,能即刻被点燃所需的最低温度
2在空气中能够维持自我燃烧的物质被点燃所需要的最低温度
3对身体产生影响的最低限值。