氯化钙水溶液的性质
- 格式:pdf
- 大小:8.03 KB
- 文档页数:2

氯化钙安全技术手册(MSDS)氯化钙安全技术手册(MSDS)1. 概述氯化钙(CaCl2),化学式为CaCl2·2H2O,俗称无水氯化钙和二水氯化钙,是一种常用的无机盐。
本手册提供了关于氯化钙的安全技术信息,包括物理化学性质、危险性、预防措施等。
2. 物理化学性质- 分子式:CaCl2(无水)/ CaCl2·2H2O(二水)- 分子量:111.0 (无水) / 147.0 (二水)- 外观:白色或灰白色颗粒或粉末- 溶解性:易溶于水- 熔点:772°C(无水)- 沸点:1900°C(无水)3. 危险性3.1 健康危害- 吸入:长期吸入氯化钙粉尘可能引起呼吸道刺激,严重时可导致肺炎。
- 摄入:误服可能导致消化道刺激,严重时可引起肾功能损害。
- 皮肤接触:可能导致皮肤刺激或炎症。
- 眼睛接触:可能导致眼睛刺激或炎症。
3.2 火灾和爆炸危害- 氯化钙本身不燃烧,但与水接触时会生成热量,可能导致溶液温度升高。
- 在潮湿环境中,氯化钙可能促进某些物质的腐蚀性反应,从而产生火灾或爆炸风险。
3.3 环境危害- 氯化钙对环境相对稳定,但在水体中可能导致水体硬化。
- 长期大量排放可能导致土壤和水体污染。
4. 安全措施4.1 个人防护- 操作时应佩戴防护眼镜、口罩、手套和防护服。
- 避免粉尘扬散,必要时使用防尘口罩。
- 避免与皮肤和眼睛直接接触。
4.2 储存- 储存于干燥、通风的地方,避免潮湿。
- 包装密封,防止粉尘泄漏。
- 远离火源、热源、腐蚀性物质和还原剂。
4.3 泄漏处理- 泄漏时立即采取紧急措施,避免吸入、接触。
- 使用砂浆、蛭石等非可燃物质覆盖泄漏区域,防止扩散。
- 请专业人员处理泄漏事故。
5. 急救措施5.1 皮肤接触- 立即脱去污染衣物,用大量清水冲洗至少15分钟。
- 如有必要,寻求医疗救治。
5.2 眼睛接触- 立即用大量清水冲洗至少15分钟,必要时就医。
5.3 吸入- 立即转移到新鲜空气处,保持呼吸道的通畅。

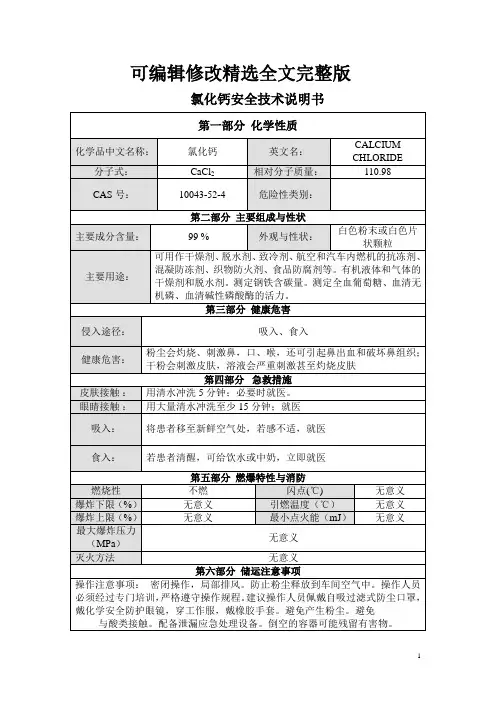
氯化钙安全技术说明书第一部分:化学品名称中文名称:氯化钙英文名称: calciun chloride分子式: CaCl2分子量: 110.99第二部分:成分/组成信息第三部分:危险性概述侵入途径:粉尘吸入,食入,经皮肤吸收。
健康危害:粉尘会灼烧、刺激鼻腔、口、喉,还可引起鼻出血和破坏鼻组织;干粉会刺激皮肤,溶液会严重刺激甚至灼伤皮肤。
燃爆危险:不燃第四部分:急救措施皮肤接触:脱去污染的衣着,用大量流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医吸入:脱离现场至空气新鲜处。
如呼吸困难,给输氧。
就医。
食入:饮足量温水,催吐。
严重时就医。
第五部分:消防措施危险特性:本品不燃。
灭火剂:选用适合周围火源的灭火器。
灭火方法:消防人员须佩戴防毒面具、穿全身消防服。
灭火剂:芽状水、泡沫、化碳、砂土。
灭火注意事项:没有配备化学防护衣和供氧设备请不要待在危险区。
防止化学品进入地表水和地下水。
第六部分:泄漏应急处理个人防护:避免产生和吸入粉尘。
当粉尘浓度过高时,应急处理人员须穿戴安全防护用具进入现场。
保证密封屋内的新鲜空气供应。
环境保护措施:化学品未经处理严禁向环境排放。
清洁吸收措施:采用安全的方法将泄洞物收集回收或运至废物处理场所处理,采用液体吸收残留物,根据化学品性质进一步处理。
清理污染区,洗液排入废水处理池。
应急处理:隔离泄漏污染区,限制出入。
避免扬尘,小心扫起,置于袋中转移至安全场所或运至废物处理场所处置。
第七部分:操作处置与储存操作注意事项:密闭操作,加强通风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员凤戴自吸过滤式防尘口罩,避免产生粉尘。
搬运时要轻装轻卸,防止包装及容器损坏。
储存注意事项:储存于阴凉、通风的库房。
包装容器必须密封,防止受潮。
与潮解性物品分开堆放。
第八部分:接触控制/个体防护工程控制:生产过程密闭,加强通风。
呼吸系统防护:空气中粉尘浓度超标时,必须佩戴自吸过滤式防尘口罩。

氯化钙常见特性氯化钙为无机化合物,一种由氯元素和钙元素构成的盐,为典型的离子型卤化物。
性状为白色、硬质碎块或颗粒。
微苦,无味。
氯化钙对氨具有突出的吸附能力和低的脱附温度,在合成氨吸附分离方面具有很大的应用前景。
但由于氯化钙不易形成稳定的多孔材料,与气氨的接触面积小,并且在吸附、解吸过程中容易膨胀、结块,因此使之难以在这方面付诸实际应用。
将氯化钙担载于高比表面载体上,可以大大提高氯化钙与气氨的接触面积。
已有相关研究表明,将氯化钙担载于分子筛上而制备的复合吸附剂比单一吸附剂有更好的吸附性能和稳定性。
氯化钙,一种由氯元素和钙元素构成的盐,化学式为CaCl2。
它是典型的离子型卤化物,室温下为白色固体。
它常见应用包括制冷设备所用的盐水、道路融冰剂和干燥剂。
因为它在空气中易吸收水分发生潮解,所以无水氯化钙必须在容器中密封储藏。
氯化钙及其水合物和溶液在食品制造、建筑材料、医学和生物学等多个方面均有重要的应用价值。
物理性质无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
微毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热(氯化钙的溶解焓为-176.2cal/g),其水溶液呈微酸性。
溶于醇、丙酮、醋酸。
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
低温下溶液结晶而析出的为六水物,逐渐加热至30℃时则溶解在自身的结晶水中,继续加热逐渐失水,至200℃时变为二水物,再加热至260℃则变为白色多孔状的无水氯化钙。
化学性质5%水溶液pH值4.5~9.2。
1.7%水溶液同血清等渗。
该品以碳酸钙和盐酸为原料制得,为镁中毒时的解毒剂。
[3] 钙离子可与氟化物形成不溶性氟化钙,用于氟中毒解救。
主要应用工业用途1、用作多用途的干燥剂,如用于氮气、氧气、氢气、氯化氢、二氧化硫等气体的干燥。
生产醇、酯、醚和丙烯酸树脂时用作脱水剂。

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载氯化钙中文MSDS地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容氯化钙化学品安全技术说明书MSDS 第一部分:化学品名称化学品中文名称:氯化钙化学品英文名称:calciun chloride分子式:CaCl2 分子量: 110.99第二部分:成分/组成信息有害物成分纯品含量100% CAS No.10043-52-4 第三部分:危险性概述侵入途径:粉尘吸入,食入,经皮肤吸收健康危害:粉尘会灼烧、刺激鼻腔、口、喉,还可引起鼻出血和破坏鼻组织;干粉会刺激皮肤,溶液会严重刺激甚至灼伤皮肤环境危害:燃爆危险:不燃第四部分:急救措施皮肤接触:脱去污染的衣着,用大量流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
吸入:脱离现场至空气新鲜处。
如呼吸困难,给输氧。
就医。
食入:饮足量温水,催吐。
严重时就医。
第五部分:消防措施危险特性:本品不燃。
有害燃烧产物:灭火剂:选用适合周围火源的灭火器。
灭火方法:消防人员须佩戴防毒面具、穿全身消防服。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
灭火注意事项:没有配备化学防护衣和供氧设备请不要待在危险区。
防止化学品进入地表水和地下水。
第六部分:泄漏应急处理个人防护:避免产生和吸入粉尘。
当粉尘浓度过高时,应急处理人员须穿戴安全防护用具进入现场。
保证密封屋内的新鲜空气供应。
环境保护措施:化学品未经处理严禁向环境排放。
清洁/吸收措施:采用安全的方法将泄漏物收集回收或运至废物处理场所处理,采用液体吸收残留物,根据化学品性质进一步处理。
清理污染区,洗液排入废水处理池。
应急处理:隔离泄漏污染区,限制出入。
避免扬尘,小心扫起,置于袋中转移至安全场所或运至废物处理场所处置。

氯化钙氯化钙的性质:名称:氯化钙(此处指无水氯化钙)俗称:干燥氯化钙英文名称:Calcium chloride分子式:CaCl2;分子量:110.98;CAS NO.:10043-52-4 性状:白色多孔块状、粒状或蜂窝状固体。
味微苦,无臭。
水溶液为无色。
熔点:782℃;沸点:大于1600℃相对密度:2.15;稳定性:稳定溶解情况:溶于水(放出大量热)、乙醇、丙酮、醋酸、甲酸、肼、吡啶和乙酰胺,不溶于醚。
氯化钙用途:氯化钙用于:(1)氯化钙在制冷工业用于制冷,冷却溶液及工艺中气体和液体干燥介质,用于空调系统。
(2)化学工业原无机化工原料及硫酸根脱除剂,褐藻酸钠剂的凝固剂。
(3)污水处理。
(4)造纸工业添加剂及废纸张脱墨。
(5)橡胶行业乳胶凝结剂。
(6)建筑行业早强剂,提高混凝土强度,生产涂料的凝固剂。
(7)用于防潮用干燥剂。
(8)防除尘埃、煤尘、矿尘。
(9)用于颜料及印染。
(10)用于防治小麦、苹果、白菜等腐烂及食品防腐剂。
(11)石油钻探,钻井工作液,完井液,石油化工脱水液。
(12)黑色冶金工业作氯化剂和添加剂。
(13)道路、高速公路、停车场、机场、高尔夫球场冬季除雪。
还可以用作医药钙片。
氯化钙的生产方法:1、纯碱废液制备氯化钙;2、电石渣制备氯化钙;3、盐酸石灰乳制备氯化钙。
氯化钙生产工艺流程:一、中和反应:在搪玻璃、带搅拌装置的夹套反应器中加入浓度约为4~8mol/L的副产品盐酸,在搅拌条件下慢慢加入石灰乳。
反应器内反应放出大量的热量,可向夹套内通入冷却水冷却。
加料速度视反应情况而定,前期因酸浓度高,反应较剧烈,应适当加慢些,后期随着酸浓度逐渐降低,反应速度逐渐放慢,可加快些。
中和到后期时,注意随时检测溶液的PH 值,当中和到8.5-9时,停止投加石灰乳和搅拌,把中和液静止澄清。
二、过滤把经过中和的料浆用泵打入板框压滤机过滤,滤至澄清,得到棕红色澄清液。
滤渣可作建材或废弃。
三、脱色向滤液中加入粉状活性炭(约为料液量的3%~5%),稍许搅拌,使活性炭分散均匀。

氯化钙溶液的沸点研究氯化钙溶液的沸点研究1. 引言氯化钙是一种常见的无机化合物,广泛应用于各个领域。
了解氯化钙溶液的沸点对于理解其特性和应用具有重要意义。
本文将深入探讨氯化钙溶液的沸点,并提供相关观点和理解。
2. 氯化钙的性质2.1 结构和化学性质氯化钙的化学式为CaCl2,是由一个钙离子和两个氯离子组成的离子结构。
由于其极性较强,具有良好的溶解性和离解能力。
2.2 溶解度氯化钙在水中的溶解度随温度的增加而增加。
这意味着在不同温度下制备的氯化钙溶液含量会有所不同。
2.3 氯化钙的沸点氯化钙溶液的沸点取决于溶液的浓度和压力。
随着浓度的增加,沸点会提高。
压力的变化也会对沸点产生影响。
3. 氯化钙溶液的沸点与浓度关系3.1 浓度对沸点的影响根据拉乌尔定律,溶液的沸点取决于其溶质在溶液中的摩尔分数。
氯化钙溶液的沸点随着浓度的增加而升高。
这是因为溶质的存在会降低溶剂的逸蒸作用。
3.2 沸点与溶质的背离程度氯化钙溶液的沸点与理想溶液的沸点有所偏离。
这是由于溶质和溶剂之间的非理想相互作用所致。
这种背离程度随着浓度的增加而增大。
4. 氯化钙溶液沸点的影响因素4.1 压力压力的改变会引起氯化钙溶液的沸点产生变化。
较低的压力将导致沸点降低,而较高的压力将使沸点升高。
这是因为压力会影响溶剂的蒸发速率。
4.2 溶液的附加成分在某些情况下,氯化钙溶液中的其他溶质可能会对沸点产生影响。
这些溶质的存在会改变溶剂和溶质之间的相互作用,从而影响溶液的沸点。
4.3 温度温度是影响氯化钙溶液沸点的最重要因素。
随着温度的升高,溶剂分子的动能增加,蒸发速率加快,致使沸点升高。
5. 总结与回顾本文对氯化钙溶液的沸点进行了深入研究,并指出了影响其沸点的因素。
我们了解到,氯化钙溶液的沸点与溶液的浓度、压力和温度密切相关。
高浓度、高压力和高温度都会使氯化钙溶液的沸点升高。
溶液中的其他附加成分也可能会影响沸点的变化。
6. 观点和理解鉴于氯化钙溶液的沸点受多个因素的影响,我们可以利用这些特性来调控氯化钙溶液的沸点,以满足不同应用领域的需求。

氯化钙水溶液放久了冰点变高的原因-概述说明以及解释1.引言1.1 概述概述:氯化钙水溶液是一种常见的化学溶液,其冰点随着放置时间的延长而逐渐升高。
这一现象引发了人们的兴趣,并且在许多领域中具有重要的实际应用价值。
因此,了解氯化钙水溶液放久了冰点变高的原因是非常有意义的。
本文旨在探讨氯化钙水溶液放久了冰点变高的原因,并对相关的理论和实验结果进行分析和解释。
下面将首先介绍一些基本的背景知识,然后逐步展开对该现象的解释。
首先,我们需要了解冰点的含义。
冰点是指在给定的压力下,物质从液态转变为固态的温度。
在理想情况下,纯净水的冰点为0摄氏度。
然而,当加入其他物质时,例如氯化钙,水的性质会发生变化,从而导致冰点的升高。
那么,为什么氯化钙水溶液放久了冰点会变高呢?这主要是由于溶质的影响。
溶质是指溶解在溶剂中的物质,它会改变溶剂的性质。
在氯化钙水溶液中,氯化钙是溶质,而水是溶剂。
氯化钙是一种离子化合物,当溶解在水中时会分离成钙离子(Ca2+)和氯离子(Cl-)。
这些离子会与水分子发生相互作用,改变水分子的排列和运动方式,从而影响到水的冰点。
通过研究和实验证明,氯化钙溶液的冰点通常会随着氯化钙的浓度增加而升高。
这是因为氯化钙的离子会占据水分子之间的空隙,阻碍水分子形成规则的晶格结构,使冰点升高。
另外,放久了的氯化钙水溶液冰点变高可能还与其溶液浓度的变化有关。
由于水分子的蒸发,溶液中的氯化钙浓度可能会逐渐增加,从而导致冰点的升高。
综上所述,氯化钙水溶液放久了冰点变高的原因主要是由于溶质的影响。
氯化钙离子的存在阻碍了水分子的结晶,使冰点升高。
此外,溶液中的氯化钙浓度的变化也可能对冰点的升高起到一定的影响。
在接下来的文章中,我们将详细探讨这些影响因素,并进一步解释氯化钙水溶液冰点升高的机理。
1.2文章结构文章结构部分的内容可以包括以下内容:1.2 文章结构:本文将按照以下结构进行论述:- 第一部分:引言- 在这一部分,将对文章的研究背景和目的进行概述,介绍氯化钙水溶液的相关基本知识。

氯化钙储存操作注意事项
氯化钙是白色或灰白色的,有粉末状,颗粒状,片状和球状,氯化钙的吸湿性极强,在空气中极其容易吸收空气中的水分发生潮解,易溶于水,同时放出大量的热,水溶液呈碱性。
这是氯化钙的性质。
根据氯化钙的这些性质我们就可以知道平时在氯化钙的储存和使用搬运时应该注意什么:
1.氯化钙应该储存于阴凉干燥通风的环境中,以免会潮湿使氯化钙发生性质改
变;
2.氯化钙不能混储,特别是潮解性的物品会使氯化钙吸收水分发生变质;
3.盛放氯化钙的袋子或容器应该密封;
4.粉状的氯化钙在储存时应该避免扬起粉尘;
5.氯化钙储存仓库的照明,通风等设施应该采用防爆型,并且配备相应的消防
器材;
6.氯化钙不能与其他化合物一起存放,以免会发生化学反应;
7.在移动氯化钙时应该注意轻装轻卸,防止损坏包装。
邦泽作为一个专业生产氯化钙的生产厂家,对氯化钙有所了解,因此告知氯化钙储存时跟操作时应该注意的地方,希望可以对您有帮助,我们也欢迎您随是订购产品。

写在应用里面:氯化钙为典型的离子型卤化物。
性状为白色、硬质碎块或颗粒。
微苦,无臭。
氯化钙对氨具有突出的吸附能力和低的脱附温度,在合成氨吸附分离方面具有很大的应用前景。
但由于氯化钙不易形成稳定的多孔材料,与气氨的接触面积小,并且在吸附、解吸过程中容易膨胀、结块,因此使之难以在这方面付诸实际应用。
将氯化钙担载于高比表面载体上,可以大大提高氯化钙与气氨的接触面积。
已有相关研究表明,将氯化钙担载于分子筛上而制备的复合吸附剂比单一吸附剂有更好的吸附性能和稳定性。
它常见应用包括制冷设备所用的盐水、道路融冰剂和干燥剂。
因为它在空气中易吸收水分发生潮解,所以无水氯化钙必须在容器中密封储藏。
氯化钙及其水合物和溶液在食品制造、建筑材料、医学和生物学等多个方面均有重要的应用价值。
物理性质:熔点:782°C,密度:1.086 g/mL at 20°C,沸点:1600°C,闪点:>1600°C,水溶性:740 g/L (20°C)。
氯化钙是无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
无毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热(氯化钙的溶解焓为-176.2cal/g),其水溶液呈微碱性。
溶于醇、丙酮、醋酸。
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
低温下溶液结晶而析出的为六水物,逐渐加热至30℃时则溶解在自身的结晶水中,继续加热逐渐失水,至200℃时变为二水物,再加热至260℃则变为白色多孔状的无水氯化钙。
[2]制备:1、二水氯化钙(脱水法)法:将食用二水氯化钙于200~300℃下进行干燥脱水,制得食用无水氯化钙成品。
其化学反应方程式:CaCl2·2H2O[260℃]→CaCl2+2H2O对于中性氯化钙溶液,可采用喷雾干燥塔,在300℃热气流下进行喷雾干燥脱水,制得无水氯化钙粉末状成品。

氯化钙公司网址:氯化钙一、氯化钙,化学式CaCl2·2H20白色晶体或块状物。
熔点782℃,沸点1600℃,密度2.15克/厘米3(25℃)。
氯化钙在水中的溶解度很大,0℃时100克水能溶解59.5克。
氯化钙,100℃时溶解159克。
能形成含1、2、4、6个结晶水的水合物,无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
无毒、无臭、味微苦。
相对密度2.15(25℃) 。
熔点782℃。
沸点1600℃以上。
二、氯化钙性状:白色颗粒,片状,粉末或熔融块状。
有强吸湿性。
易溶于水(使溶液凝固点降低)和乙醇。
相对密度(d154)2.152。
熔点772℃。
沸点>1600℃。
低毒,半数致死量(大鼠,经口)1g/kg。
三、氯化钙用途:可用作干燥剂、脱水剂、致冷剂、航空和汽车内燃机的抗冻剂、混凝防冻剂、织物防火剂、食品防腐剂等。
有机液体和气体的干燥剂和脱水剂。
测定钢铁含碳量。
测定全血葡萄糖、血清无机磷、血清碱性磷酸酶的活力。
四、物理性质:无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
无毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热,其水溶液呈微酸性。
溶于醇、丙酮、醋酸。
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
低温下溶液结晶而析出的为六水物,逐渐加热至30℃时则溶解在自身的结晶水中,继续加热逐渐失水,至200℃时变为二水物,再加热至260℃则变为白色多孔状的无水氯化钙。
五、氯化钙作用与用途:无水氯化钙是工业和实验室常用干燥剂,如用于氮气、氧气、氢气、氯化氢、二氧化硫等气体的干燥,但不能用来干燥乙醇和氨(会与氯化钙反应生成CaCl2·4C2H5OH和CaCl2·8NH3)。
生产醇、酯、醚和丙烯酸树脂时用作脱水剂。
六、氯化钙工业用途:无机工业用作制造金属钙、氯化钡、各种钙盐(如磷酸钙等)的原料。
氯化钙常见特性氯化钙为无机化合物,一种由氯元素和钙元素构成的盐,为典型的离子型卤化物。
性状为白色、硬质碎块或颗粒。
微苦,无味。
氯化钙对氨具有突出的吸附能力和低的脱附温度,在合成氨吸附分离方面具有很大的应用前景。
但由于氯化钙不易形成稳定的多孔材料,与气氨的接触面积小,并且在吸附、解吸过程中容易膨胀、结块,因此使之难以在这方面付诸实际应用。
将氯化钙担载于高比表面载体上,可以大大提高氯化钙与气氨的接触面积。
已有相关研究表明,将氯化钙担载于分子筛上而制备的复合吸附剂比单一吸附剂有更好的吸附性能和稳定性。
氯化钙,一种由氯元素和钙元素构成的盐,化学式为CaCl2。
它是典型的离子型卤化物,室温下为白色固体。
它常见应用包括制冷设备所用的盐水、道路融冰剂和干燥剂。
因为它在空气中易吸收水分发生潮解,所以无水氯化钙必须在容器中密封储藏。
氯化钙及其水合物和溶液在食品制造、建筑材料、医学和生物学等多个方面均有重要的应用价值。
物理性质无色立方结晶体,白色或灰白色,有粒状、蜂窝块状、圆球状、不规则颗粒状、粉末状。
微毒、无臭、味微苦。
吸湿性极强,暴露于空气中极易潮解。
易溶于水,同时放出大量的热(氯化钙的溶解焓为-176.2cal/g),其水溶液呈微酸性。
溶于醇、丙酮、醋酸。
与氨或乙醇作用,分别生成CaCl2·8NH3和CaCl2·4C2H5OH络合物。
低温下溶液结晶而析出的为六水物,逐渐加热至30℃时则溶解在自身的结晶水中,继续加热逐渐失水,至200℃时变为二水物,再加热至260℃则变为白色多孔状的无水氯化钙。
化学性质5%水溶液pH值4.5~9.2。
1.7%水溶液同血清等渗。
该品以碳酸钙和盐酸为原料制得,为镁中毒时的解毒剂。
[3] 钙离子可与氟化物形成不溶性氟化钙,用于氟中毒解救。
主要应用工业用途1、用作多用途的干燥剂,如用于氮气、氧气、氢气、氯化氢、二氧化硫等气体的干燥。
生产醇、酯、醚和丙烯酸树脂时用作脱水剂。
氯化钙热力学物性参数1氯化钙理化性质及其应用氯化钙的相对密度为2.15g/cm3,熔点782℃、沸点1600℃以上。
具有极强的吸湿性,暴露于空气中极易潮解。
易溶于水,同时放出大量的热。
文献[1]详细介绍了氯化钙的应用和生产工艺:氯化钙的应用按级别分为:工业级氯化钙[2]和食品级氯化钙[3]。
1.1工业级氯化钙工业级氯化钙具有遇水发热且凝点低的特点,可用于融雪和除冰[4-6]。
并有吸水性强的功能,还可用作干燥剂,如用于氮气、氧气、氢气等气体的干燥。
还是港口消雾[7]和路面集尘[8]、织物防火的最佳材料[9]。
氯化钙水溶液是冷冻机用和制冰用的重要制冷介质[10]。
另外氯化钙还可当作脱水剂、防冻剂、絮凝剂及生产色淀颜料的沉淀剂等。
1.2食品级氯化钙应用在食品生产中,氯化钙可用于食品加工的稳定剂、稠化剂、吸潮剂、口感改良剂等。
在医药领域,氯化钙还可用于药物合成的原料。
1.3氯化钙用于热泵氯化钙主要是用于化学热泵(Chemical Heat Pump 简称CHP),它是利用不同条件下的一对耦合的可逆化学反应所产生的吸收放热现象来实现热量的传递的,它是一种将热能转化为化学能,从而将蓄热机和热泵机合二为一的新型节能技术[11]。
文献[11]研究了化学热泵为CaCl 2/CH 3OH 体系,它利用了如下化学反应:23232()2()CaCl CH OH g CaCl CH OH s −−→+∙←−−该反应是一个气固两相的可逆络合反应,反应的正方向是放热反应。
以CaCl 2/CH 3OH 体系设计的化学热泵的工作原理图如下:下面是氯化钙的部分热力学性质图表:1溶解度[12](温度0~100℃)2粘度[12](温度-50℃~20℃,质量分数0~30%)表一表二3沸点[12](质量浓度10~95%,压力20~400kpa)4饱和蒸汽压[13]5比热容[12](-24~20℃)6导热系数[12](质量分数0~40%)References:[1]. 李宁等, 氯化钙生产和应用综述. 盐业与化工, 2009(6): 第42-43+46页.[2].欧育湘, 国外阻燃剂发展动态及对发展我国阻燃剂工业之浅见. 精细与专用化学品, 2003(2): 第3-6页.[3]. 李响等, 几种高分子聚合型阻燃剂概述. 阻燃材料与技术, 2003(6): 第5-8页.[4]. 欧育湘, 世界阻燃剂市场及阻燃剂工业发展特点. 阻燃材料与技术, 2005(5): 第1-6页.[5]. 阻燃剂的介绍及其在阻燃塑料中的应用.[6]. 李永华与曾幸荣, 苯乙烯系阻燃塑料合金的研究进展. 工程塑料应用, 2002(11): 第60-63页.[7]. 辛敏琦与刘春艳, 磷、溴阻燃剂在PC/ABS合金中的应用. 塑料助剂, 2006(2): 第32-34页.[8]. 欧育湘, 韩廷解与孟征, RoHS指令与阻燃塑料的发展. 塑料, 2007(1): 第17-21页.[9]. 贾玉强, 张静与李广臣, 人工消雾原理和方法. 现代农业科技, 2006(9): 第214-215页.[10]. 固体吸附制冷吸附剂的研究进展.[11]. 李瑞波, 新型化学热泵的实验研究. 承德民族师专学报, 1996(2).[12]. 刘光启等, 化工物性算图手册. 2002.[13]. 张立志, 除湿技术. 2005: 化学工业出版社.运动与健康题目:体育锻炼对运动系统的影响指导老师:欧阳靜仁班级:热能092班姓名:林灿雄学号:200910814223摘要:这篇文章通过对人体运动系统组成的介绍,以及体育锻炼对运动系统的作用和影响的一点点描述,给平时不重视锻炼的人说明了体育锻炼的好处,希望能够有更多的人重视体育锻炼。
氯化钙溶液的理化性质及危险特性(表-)
---
氯化钙溶液是一种常见的化学品,具有一系列特定的理化性质和危险特性。
本文将详细介绍氯化钙溶液的理化性质和相关的危险特性。
理化性质
1. 外观:氯化钙溶液呈无色透明液体。
2. 密度:氯化钙溶液的密度随浓度的变化而不同。
3. 熔点和沸点:氯化钙溶液的熔点约为-55℃,沸点约为1670℃。
4. 溶解性:氯化钙溶液可以在水中完全溶解,溶解度随温度的增加而增加。
5. pH值:氯化钙溶液呈强酸性,pH值通常在1-3之间。
6. 导电性:氯化钙溶液具有良好的导电性。
危险特性
1. 腐蚀性:氯化钙溶液具有较强的腐蚀性,接触皮肤和眼睛会引起灼伤。
2. 有害性:氯化钙溶液对人体有一定的毒性,长期接触可能导致健康问题。
3. 燃烧性:氯化钙溶液不易燃烧,但在与可燃物质接触时,可能引起燃烧或爆炸。
4. 环境影响:氯化钙溶液对水生生物和环境有一定的影响,应避免直接排放到水体中。
5. 储存安全:氯化钙溶液应储存在密封的中,避免与其他化学品混存,切勿与有机物、酸类等物质接触。
综上所述,氯化钙溶液有其独特的理化性质和危险特性。
在使用和储存过程中,应当严格遵守相关的安全操作规程,以保障人身安全和环境的健康。
氯化钙溶液和碳酸钠溶液化学方程式碳酸钠溶液:Na2CO3(aq) + H2O(l) → 2Na+(aq) + CO32-(aq)
1.氯化钙溶液的化学性质及反应:
在化学反应中,氯化钙溶液可以与一些阴离子产生置换反应,如与硫酸产生氯化钙和硫酸钙:
CaCl2(aq) + H2SO4(aq) → CaSO4(s) + 2HCl(aq)
CaCl2(aq) + Na2CO3(aq) → CaCO3(s) + 2NaCl(aq)
2.碳酸钠溶液的化学性质及反应:
碳酸钠溶液是一种无色、无味的溶液,呈碱性。
在水中,碳酸钠会离解成两个钠离子(2Na+)和一个碳酸根离子(CO32-)。
碳酸钠溶液易溶于水。
在化学反应中,碳酸钠溶液可以与酸反应,产生二氧化碳气体:
Na2CO3(aq) + 2HCl(aq) → CO2(g) + H2O(l) + 2NaCl(aq)
碳酸钠溶液还可以与一些金属离子产生沉淀反应,生成金属碳酸盐。
例如,与钙离子反应产生碳酸钙沉淀:
Ca2+(aq) + CO32-(aq) → CaCO3(s)
综上所述,氯化钙溶液和碳酸钠溶液可以发生多种化学反应。
氯化钙溶液可以与硫酸反应生成硫酸钙,与碳酸钠反应生成碳酸钙沉淀。
碳酸钠溶液可以与酸反应产生二氧化碳气体,与钙离子反应生成碳酸钙沉淀。
这些反应在实际应用中具有重要的意义,例如在水处理中,可以利用氯化钙溶液与碳酸钠溶液的反应,去除水中的硬度离子和产生二氧化碳气体。
氯化钙分解温度引言在化学领域中,氯化钙(CaCl2)是一种常见的无机化合物。
它具有许多实际应用,例如在消防中用作灭火剂、在农业中用作除草剂、在食品加工中用作钙源等。
然而,氯化钙的分解温度对于其应用和稳定性具有重要意义。
本文将对氯化钙的分解温度进行全面、详细、完整且深入地探讨。
氯化钙的化学性质氯化钙是一种离子化合物,由一个钙离子(Ca2+)与两个氯离子(Cl-)组成。
它具有较高的溶解度,并能在水中迅速溶解。
当氯化钙溶液蒸发时,水分子逐渐蒸发,氯化钙溶质浓度逐渐增大,直至达到饱和度。
在这个过程中,氯化钙溶液中的钙离子和氯离子会不断结晶形成氯化钙固体。
氯化钙的分解过程氯化钙的分解过程是指在加热条件下,氯化钙固体逐渐分解为钙氧化物(CaO)和氯气(Cl2)。
这一反应可以用以下化学方程式表示:2CaCl2 -> 2CaO + Cl2氯化钙的分解温度是指当氯化钙固体加热到一定温度时,开始发生分解反应的温度。
分解温度取决于氯化钙的晶体结构、纯度、外部条件等因素。
影响氯化钙分解温度的因素纯度纯度是影响氯化钙分解温度的重要因素之一。
高纯度的氯化钙不仅可以提高分解温度,还能减少杂质对分解反应的影响。
晶体结构氯化钙的晶体结构对其分解温度也有一定影响。
晶体结构较稳定的氯化钙通常具有较高的分解温度,因为在分解过程中需要克服晶体结构的稳定能。
外部条件外部条件,如气压和加热速率等,也会影响氯化钙的分解温度。
较高的气压和较快的加热速率会提高氯化钙的分解温度。
氯化钙分解温度的测试方法为了准确确定氯化钙的分解温度,科学家们开发了许多测试方法。
以下是其中一种常用的方法:1.选取一定量的氯化钙固体作为样品。
2.将样品放置在专用的实验装置中,如高温炉。
3.通过加热样品,逐渐升高温度。
4.在升温过程中,观察样品的变化。
当样品开始分解时,可以通过观察颜色、取样等方法初步判断分解温度。
5.针对样品分解温度的不同,可以使用不同的测试方法进行精确测量,如差热分析仪(DSC)。