线粒体的染色方法(红色荧光)
- 格式:pdf
- 大小:263.01 KB
- 文档页数:4
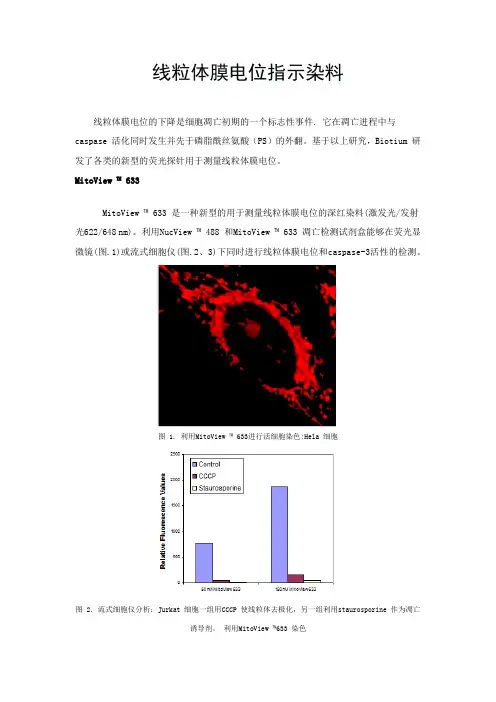
线粒体膜电位指示染料线粒体膜电位的下降是细胞凋亡初期的一个标志性事件. 它在凋亡进程中与caspase 活化同时发生并先于磷脂酰丝氨酸(PS)的外翻。
基于以上研究,Biotium 研发了各类的新型的荧光探针用于测量线粒体膜电位。
MitoView ™ 633MitoView ™ 633 是一种新型的用于测量线粒体膜电位的深红染料(激发光/发射光622/648 nm)。
利用NucView ™ 488 和MitoView ™ 633 凋亡检测试剂盒能够在荧光显微镜(图.1)或流式细胞仪(图.2、3)下同时进行线粒体膜电位和caspase-3活性的检测。
图 1. 利用MitoView ™ 633进行活细胞染色:Hela 细胞图 2. 流式细胞仪分析:Jurkat 细胞一组用CCCP 使线粒体去极化,另一组利用staurosporine 作为凋亡诱导剂。
利用MitoView ™633 染色图3. 流式细胞仪分析:对照(A)与经staurosporine 处置(B)的Jurkat 细胞(JC-1 染色). FL1 (x- 轴) 为绿色荧光; FL2 (y-轴) 为红色荧光。
(A 图) 较高的红绿荧光比例说明线粒体膜电位未下降. (B 图)较低的红绿荧光比例说明:由于staurosporine诱导了凋亡的发生,细胞的线粒体膜电位大幅下降。
JC-1 线粒体膜电位检测试剂盒JC-1通常被用于检测细胞中线粒体膜电位的转变。
在健康细胞中,JC-1以聚合体(J-aggregates),的形式存在在线粒体基质中,能够产生红色的荧光(激发光/发射光585/590nm)。
相反,在正在凋亡或坏死的细胞中,JC-1不能聚集在基质中,以单体的形式存在,从而发出绿色的荧光( 激发光/ 发射光510/527nm),如此能够利用流式细胞仪和荧光显微镜、荧光计数仪通过测量荧光颜色的转变来检测线粒体膜电位的转变。
经常使用红绿荧光的相对照例来衡量线粒体去极化的比例。

组织线粒体膜电位检测方法检测细胞内线粒体膜电位的方法可以帮助研究者了解线粒体功能和细胞代谢状态。
以下是几种常用的检测线粒体膜电位的方法:1. Rhodamine 123 染色法: Rhodamine 123 是一种荧光染料,它能够进入活性线粒体并与线粒体膜电位呈反比关系。
这种染料会在正常的线粒体内累积并发出荧光信号,可以通过荧光显微镜或流式细胞仪来观察和测量。
线粒体膜电位高时,Rhodamine 123 的荧光信号较强;而电位低时,荧光信号则减弱。
2. JC-1染色法: JC-1 是一种双荧光探针,可根据线粒体膜电位的变化而显示不同的荧光颜色。
在正常的线粒体膜电位较高时,JC-1 形成聚集体,产生红色荧光。
而当线粒体膜电位低时,JC-1 解聚,产生绿色荧光。
通过观察红色与绿色荧光的比例变化,可以间接反映线粒体膜电位的高低。
3. TMRM染色法: Tetramethylrhodamine methyl ester (TMRM) 是一种荧光染料,其进入细胞内后与活跃的线粒体结合并发出荧光信号。
其荧光强度与线粒体膜电位的高低成正比关系。
通过荧光显微镜或流式细胞仪来观察和测量 TMRM 的荧光信号,以评估线粒体膜电位的变化。
4. 光学显微测量法: 这种方法通常利用荧光探针或荧光指示剂结合光学显微技术,直接在细胞或组织水平上测量线粒体膜电位的变化。
可以使用适当的荧光显微镜系统和图像分析软件来观察和分析线粒体膜电位的变化。
需要指出的是,这些方法每一种都有其优缺点。
选择适合的方法应根据研究需求、实验条件和所研究的细胞类型来决定。
同时,使用这些荧光探针测量线粒体膜电位时,需要注意其特异性、灵敏度和操作的准确性,以确保获得可靠和准确的结果。


线粒体膜电位检测(JC-1)大量的研究表明线粒体与细胞凋亡密切相关,其中线粒体跨膜电位(△ψ的破坏,被认为是细胞凋亡级联反应过程中最早发生的事件之一,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。
JC-1(5,5’,6,6’-tetrachloro-1,1’,3,3’-tetraethylbenzimidazolcarbocyanine iodide)是一种阳离子脂质荧光染料,可作为检测线粒体跨膜电位指示剂。
JC-1有单体和多聚体两种存在状态,在低浓度时以单体的形式存在,高浓度时以多聚体形式存在,两者的发射光谱不同,但均可在流式细胞仪绿色(FL-1)通道检测出绿色荧光,JC-1可透过正常细胞膜以单体状态聚集胞内,正常健康线粒体的膜电位(△ψ)具有极性,JC-1依赖于△ψ的极性被迅速摄入线粒体内,并因浓度增高而在线粒体内形成多聚体,多聚体发射光为红色荧光;可被流式细胞仪的红色(FL-2)通道检测到,而细胞发生凋亡时,线粒体跨膜电位被去极化,JC-1从线粒体内释放,红光强度减弱,以单体的形式存在于胞质内发绿色荧光。
根椐这一特征检测线粒体膜电位的变化。
所需仪器或者试剂流式细胞仪或荧光显微镜、高速离心机、CO2培养箱、微量移液器1.5m L Microtube、载玻片、盖玻片(荧光显微镜观察需用)、PBS、灭菌去离子水使用注意事项1.微量试剂取用前请离心集液。
2. JC-1避光保存及使用。
3.细胞培养的数量不宜超过1×106,否则细胞会产生自然凋亡影响检测。
4.对PH变化过于敏感的细胞建议用胎牛血清取代Buffer孵育染色及洗涤,或延长观测时间5.流式细胞仪检测线粒体膜电位变化受到多种因素的影响,因诱导剂、细胞株类型,作用时间的不同而荧光强度比例都有不同,因此没有通用标准的补偿设门指南,因此每个试验需设阴性及阳性对照组进行荧光补偿及设门。

jc-1线粒体膜电位染色实验原理
线粒体膜电位染色实验是一种测定线粒体膜电位的方法。
线粒体膜电位是指线粒体内外膜之间的电位差,是维持线粒体功能的重要参数之一。
线粒体膜电位的高低与线粒体的能量代谢、ATP合成、离子通道的开闭等过程密切相关。
因此,测定线粒体膜电位对于研究线粒体的生物学功能具有重要意义。
线粒体膜电位染色实验是利用荧光染料JC-1来测定线粒体膜电位的方法。
JC-1是一种双荧光染料,它在低电位下形成绿色荧光单体形式,而在高电位下形成红色荧光聚集体形式。
因此,在线粒体膜电位高时,JC-1会形成红色聚集体,而在线粒体膜电位低时,JC-1会形成绿色单体形式。
通过测定JC-1的荧光强度比值,可以反映线粒体膜电位的高低。
具体实验步骤如下:
1.将细胞或组织块离心,去除上清液,用PBS洗涤一遍,离心。
2.将细胞或组织块加入含有1μM的JC-1的PBS缓冲液中,室温下孵育30分钟。
3.离心洗涤一遍,去除上清液。
4.将细胞或组织块加入含有PBS缓冲液的离心管中,用流式细胞仪或荧光显微镜观察JC-1的荧光强度比值。
通过对JC-1的荧光强度比值的测定,可以反映线粒体膜电位的高低。
若JC-1的荧光强度比值越大,说明线粒体膜电位越高;若JC-1的荧光强度比值越小,说明线粒体膜电位越低。

冰冻切片氧化应激活性氧超氧阴离子MitoSOX红色荧光测定试剂盒产品说明书(中文版)主要用途冰冻切片氧化应激活性氧超氧阴离子MitoSOX红色荧光测定试剂是一种旨在通过透膜荧光染色剂MitoSOX,在线粒体氧化损伤条件下,产生红色荧光,来检测冰冻组织细胞线粒体内超氧阴离子活性氧族的存在状况的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
适宜于冰冻动物组织细胞线粒体内的超氧阴离子分析。
可以被用于细胞凋亡、信号传递、衰老、代谢和营养学等的研究。
产品严格无菌,即到即用,操作简易,定性检测,性能稳定。
技术背景超氧自由基阴离子(superoxide radical;O2-)、过氧化氢(hydrogen peroxide;H2O2)、羟自由基或氢氧基(hydroxyl radical;OH-)、过氧化基(peroxyl radical;ROO-)、氢过氧自由基(hydroperoxyl;HOO)、烷氧自由基(alcoxyl radical)、氮氧基(nitric Oxide;NO-)、过氧亚硝基阴离子(peroxynitrite anion;ONOO-)次氯酸(hypochlorous acid;HOCl)、半醌自由基(semiquinone radical)、单线态氧气(singlet oxygen)等细胞内活性氧族(Reactive Oxygen Species;ROS)的产生和增多,将导致细胞衰老或凋亡。
其中线粒体氧化磷酸化副产物之一是超氧阴离子,为线粒体内最主要的活性氧族,与心血管疾病,包括高血压、冠状动脉硬化、糖尿病相关的血管疾病、神经退行性疾病(巴金森氏症、阿茨罕默症、肌萎缩硬化症)相关。
MitoSOX 是一种完全自由通过细胞膜,并选择性在活体细胞线粒体内长期滞留而不外漏的染色剂。
一旦被超氧自由基阴离子氧化,便产生荧光。
据此证明细胞线粒体内超氧阴离子活性氧族的存在。
产品内容清理液(Reagent A)20毫升染色液(Reagent B)40微升稀释液(Reagent C)20毫升产品说明书1份保存方式保存染色液(Reagent B)在-20℃冰箱里,严格避免光照;其余的保存在4℃冰箱里;有效保证6月用户自备1.5毫升离心管:用于工作液配制的容器培养箱或恒温水槽:用于染色孵育(共聚焦)荧光显微镜:用于观察荧光组织细胞实验步骤实验开始前,将-20℃冰箱里的试剂盒中的染色液(Reagent B)置入冰槽里融化,稀释液(Reagent C)置于室温预热。

MitoTracker®Red CMXRos线粒体红色荧光探针使用说明货号:M9940规格:50μg保存:-20℃避光干燥保存。
产品说明:MitoTracker®Red CMXRos是一种细胞渗透型的X-rosamine衍生物,包含标记线粒体的弱巯基反应性的氯甲基官能团。
本品是一种氧化型的红色荧光染料(Ex=579nm,Em=599nm),只需简单孵育细胞,即可被动运输穿过细胞膜并直接聚集在活性线粒体上。
一旦线粒体被染色后,还能根据后续实验的需求进行固定(醛类固定剂如甲醛)和透化(醛类去污剂如Triton X-100),探针依然维持在细胞内。
本品适合双标实验,因其红色荧光与其他的绿色荧光探针具有良好的分辨率。
虽然传统的线粒体荧光探针如TMR和罗丹明123,也能很容易的聚集在功能线粒体上,但是一旦线粒体膜电位丧失即会被洗掉,从而在一些需要细胞进行醛类固定或者包含线粒体能量状态影响因子的实验中,使其应用大受限制。
产品性质:CAS号(CAS NO.):167095-09-2分子式(Formula):C32H32Cl2N2O分子量(Molecular weight):531.52外观(Appearance):紫色固体激发波长(Ex):579nm发射波长(Em):599nm结构式(Structure):使用方法1.储存液的配制本品是以粉末形式提供,使用前需将本品回温至室温。
之后使用细胞培养级别的无水DMSO 将其充分溶解至终浓度1mM。
本品M.Wt.=531.52g/mol,换算下来,50μg粉末只需加入94μL DMSO即可得到1mM储存液。
可根据单次的使用量将储存液分装后放到-20℃避光,避免反复冻融。
2.工作液的配制根据不同的实验目的使用不同的探针浓度,以下的起始操作条件仅作参考,可根据细胞类型和其他的相关因素如细胞或组织的透化等进行适当调整。
用适当的缓冲液或者细胞培养基稀释1mM储存液至工作液浓度。

线粒体膜电位检测方法线粒体是细胞内的重要器官,它主要参与细胞的能量代谢和调节细胞凋亡等重要生命活动。
线粒体膜电位是线粒体内膜两侧离子浓度梯度所形成的电化学梯度,是线粒体功能的重要指标之一。
线粒体膜电位的检测对于研究细胞能量代谢、药物毒性、细胞凋亡等具有重要意义。
本文将介绍几种常用的线粒体膜电位检测方法。
首先,荧光染料法是一种常用的线粒体膜电位检测方法。
通过使用荧光染料如JC-1、TMRE等,可以直接观察线粒体膜电位的变化。
这些染料在高膜电位条件下会形成聚集体,发出红色荧光;而在低膜电位条件下则会解聚,发出绿色荧光。
通过检测红绿荧光比值的变化,可以间接反映线粒体膜电位的变化情况。
其次,电化学法也是一种常用的线粒体膜电位检测方法。
通过使用玻碳电极或玻碳纤维电极等电化学探头,可以直接测量线粒体内膜的电位变化。
这种方法具有高灵敏度、高时效性的特点,可以实时监测线粒体膜电位的变化。
另外,膜通透性法也是一种常用的线粒体膜电位检测方法。
通过使用荧光探针如TMRM、Rhodamine 123等,可以直接观察线粒体膜通透性的变化。
当线粒体膜电位降低时,荧光探针会从线粒体内泄漏出来,导致荧光信号的减弱。
通过检测荧光信号的变化,可以间接反映线粒体膜电位的变化情况。
最后,生物传感器法也是一种新兴的线粒体膜电位检测方法。
通过使用基于生物传感器的技术,可以实现对线粒体膜电位的高灵敏、高特异性检测。
这种方法具有快速、准确的特点,可以广泛应用于线粒体功能的研究领域。
综上所述,线粒体膜电位检测方法包括荧光染料法、电化学法、膜通透性法和生物传感器法等多种方法。
这些方法各有特点,可以根据实验需要选择合适的方法进行线粒体膜电位的检测。
线粒体膜电位的准确检测对于研究细胞生物学和药物研发具有重要意义,相信随着技术的不断进步,线粒体膜电位检测方法会更加完善,为相关领域的研究提供更多有力的支持。

线粒体活体染色原理线粒体是一个重要的细胞器,它主要负责细胞的能量代谢和呼吸作用。
为了更好地研究线粒体的结构和功能,科学家们研发了一种叫做线粒体活体染色的技术。
线粒体活体染色是一种基于荧光的显微镜技术,可以用于研究线粒体在细胞内的位置、数量、形态和功能等方面。
它利用荧光分子特异性地结合到线粒体的表面或内部,使其发出荧光信号,并可以通过显微镜观察到。
线粒体活体染色的原理和方法有很多,下面详细介绍几种常见的:1. MitoTracker活体染色法MitoTracker是一种荧光染料,它会在细胞内结合到活性线粒体的膜上,发出可见荧光信号。
利用MitoTracker染色,可以标记线粒体的数量、形态、分布和运动等特征,还可以用于研究线粒体的功能状态和代谢活动。
2. JC-1活体染色法JC-1是一种荧光染料,它可以通过荧光共振能量转移的机制来标记线粒体的膜电势。
当线粒体的膜电势较高时,JC-1会形成线粒体聚集物,发出红色荧光信号。
而当膜电势降低时,JC-1会分散在细胞质中,发出绿色荧光信号。
利用JC-1染色,可以通过红/绿荧光比值来评估线粒体的膜电势变化,进而研究线粒体的活性和代谢功能。
3. TMRE活体染色法TMRE是一种可选择性地结合到线粒体膜上的荧光染料,它可以发出红色荧光信号。
利用TMRE染色,可以标记活性的线粒体,并且通过红色荧光密度来反映线粒体的数量和质量。
总之,线粒体活体染色技术是一种极为有用的工具,可以帮助科学家们更好地了解线粒体在细胞生物学中的作用和机制。
随着技术的不断改进和发展,相信这种技术将会被广泛应用于各种疾病的诊断和治疗中。
线粒体膜电位检测试剂盒(JC-1法)简介:JC-1是一种检测线粒体膜电位(mitochondrial membrane potential) 的理想荧光探针。
在线粒体膜电位较高时,JC-1聚集在线粒体的基质(matrix)中,形成聚合物,产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光。
这样就可以通过荧光颜色的转变来检测线粒体膜电位的变化,常用红绿荧光的相对比例来衡量线粒体去极化的比例。
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。
通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,这种转变也可作为细胞凋亡早期的一个检测指标。
JC-1单体的最大激发波长为,最大发射波长为。
JC-1聚合物(J-aggregates)的最大激发波长为,最大发射波长为。
实际观察时,使用常规的观察红色荧光和绿色荧光的装置即可。
Leagene 线粒体膜电位检测试剂盒(JC-1法)(Mitochondrial membrane potential assay kit with JC-1)是一种以JC-1为荧光探针,快速灵敏地检测细胞、组织或纯化的线粒体膜电位变化的试剂盒,可以用于早期的细胞凋亡检测,CCCP 作为诱导线粒体膜电位下降的阳性对照。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:操作步骤(仅供参考):1、 配制JC-1染色工作液:取适量JC-1 Stain (200×),按照每50μl JC-1 Stain (200×)加入8ml ddH 2O 的比例稀释JC-1,剧烈Vortex 充分溶解并混匀JC-1。
然后再加入2ml JC-1 Buffer(5×),混匀后即为JC-1染色工作液。
6孔板每孔所需JC-1染色工作液的量为,其它培养器皿的JC-1染色工作液的用量以此类推; 对于细胞悬液每0.5~1.0×106细胞需JC-1染色工作液。

细胞增殖、凋亡-检测方法汇总1.直接计数法面单粗暴、傻瓜式的检查方法!利用计数板或计数仪得出细该数目•然后对数目逬行比较。
方法需要对不同时间原的细胞分别固定•而后在光疑下计数,可绘制出细胞生长曲线。
而具不足之处在于无法区分壇蓿细胞与非增殖抵胞,下适合样品奴星參和评估特定亚群的情况。
2「H・TdR渗入法OH腺龜碇核百(TdR )是DNA持有的滅基「也是DNA合成的必需物氐用同位素中标记TdR即3H-TdR作为DNA合成的前体渗入DNA合成代谢过程,通过液体闪烁计数器可迴走细胞的放射性强虐,间接放映出细胞增殖情况。
该方法优点在于敏感性高”客观性强,盍每性好.但是爲要一走设备集件,也存在放时性核素污染问题。
3、Brdu/EdU检测法Brdu&EdU均是胸腺嚅睫的衍生物r均可代替胸腺嚅噪在DNA合成期掺入细胞中。
不同的是J Brdu检测法可利用B「du专性抗体和具他細胞标记物对细'进行双重染色,可判断増殖细胞的种类及増殖速度,不仅适用于体外实验也能用于活体实验。
这个方法最大的缺点需要变性DNA才能与抗体结合,破坏了DNA双链结构r导致染色弥散、准确性降低等问题。
EdU检测法则基于EdU与Apollo荧光染料的特异性反应检测DNA复制活性r适用于细胞増殖、细胞标记示踪筈方IEI的研究,尤其适合进行siRNA、miRNA、小分子化合物及其他药物的筛选实验。
EdU检测染料只有BrdU抗体大小的1/500,®田胞内很容易就扩散,无需DNA变性。
rdU与EdU检测优缺点综合比较BrdU EdU 检测分子大很小检测方式免疫反应化学反应影响其他标记是否DNA变性需要不需要实验时间过夜 2.5小时检测灵敏度一般灵敏4、WITT检测法&CCK8检测法MTT检测法反映细胞的能臺代谢「是检测细胞増殖活力的一种简便准确方法°其原理是在活纟田胞生长和增殖过程中,线粒体内的脱氢酶可将黄色的MTT分解为蓝紫色的水不溶性的甲瓒(Formazan ),并沉积在细胞中(死细胞无此功能。
MitoTracker®Red CMXRos线粒体红色荧光探针货号:M9940规格:50μg保存:-20℃避光干燥保存。
产品说明:MitoTracker®Red CMXRos是一种细胞渗透型的X-rosamine衍生物,包含标记线粒体的弱巯基反应性的氯甲基官能团。
本品是一种氧化型的红色荧光染料(Ex=579nm,Em=599nm),只需简单孵育细胞,即可被动运输穿过细胞膜并直接聚集在活性线粒体上。
一旦线粒体被染色后,还能根据后续实验的需求进行固定(醛类固定剂如甲醛)和透化(醛类去污剂如Triton X-100),探针依然维持在细胞内。
本品适合双标实验,因其红色荧光与其他的绿色荧光探针具有良好的分辨率。
虽然传统的线粒体荧光探针如TMR和罗丹明123,也能很容易的聚集在功能线粒体上,但是一旦线粒体膜电位丧失即会被洗掉,从而在一些需要细胞进行醛类固定或者包含线粒体能量状态影响因子的实验中,使其应用大受限制。
产品性质:CAS号(CAS NO.):167095-09-2分子式(Formula):C32H32Cl2N2O分子量(Molecular weight):531.52外观(Appearance):紫色固体激发波长(Ex):579nm发射波长(Em):599nm结构式(Structure):使用方法1.储存液的配制本品是以粉末形式提供,使用前需将本品回温至室温。
之后使用细胞培养级别的无水DMSO将其充分溶解至终浓度1mM。
本品M.Wt.=531.52g/mol,换算下来,50μg粉末只需加入94μL DMSO即可得到1mM 储存液。
可根据单次的使用量将储存液分装后放到-20℃避光,避免反复冻融。
2.工作液的配制根据不同的实验目的使用不同的探针浓度,以下的起始操作条件仅作参考,可根据细胞类型和其他的相关因素如细胞或组织的透化等进行适当调整。
用适当的缓冲液或者细胞培养基稀释1mM储存液至工作液浓度。
Hoechst染色:hoechst可以穿过活细胞膜与细胞核结合(主要为凋亡活细胞)在紫外光下将核染为蓝色. Hoechst染细胞核会影响共聚焦显微镜对该样本其他荧光的观察效果.hoechst 有hoechest33342和hoechst33258两种hoechsts33258,hoechst33342二者区别不大,但是hoechst33342对细胞的毒性作用更小一些,所以一般来说hoechsts33258用于细胞固定后再染色,而hoechst33342则可以对活细胞直接进行染色!染色步骤PI (Propidium Iodide碘化丙啶)染色:是一种可对DNA染色的细胞核染色试剂,常用于细胞凋亡检测.碘化丙啶(Propidium Iodide, PI)是一种核酸染料(红色),它不能透过完整的细胞膜,但凋亡中晚期的细胞和坏死细胞由于细胞膜通透性的增加,PI 能够透过细胞膜而使细胞核染红.用PI单一染色观测培养细胞,只能表示细胞的坏死情况,而不是凋亡(当然晚期凋亡PI亦可着色)。
但是如果您只是想知道细胞的死亡情况,而不是仔细区分坏死或凋亡,那么PI单一染色也可以。
但是如果您一定要认定细胞的凋亡,那么PI单一染色显然不够!annexin-v染色细胞凋亡早期,细胞膜标志发生改变.其中,磷脂酰丝氨酸(Annexin-V,PS)外翻,Annexin-V 在Ca+存在的条件下与其高亲和力特异性结合.这样,Annexin-v 染色阳性,表示细胞处于早期凋亡状态.Annexin-V结合不同的荧光抗体,就可以利用流式细胞仪、荧光显微镜以及共聚焦激光扫描显微镜检测细胞凋亡的发生。
Annexin V用FITC标记发绿色荧光;如果用PE标记就发红色荧光。
JC-1染色JC-1是一种阳离子染料,可以在线粒体内聚集,低浓度时主要以单体(monomer)存在,发射光以绿光(~525nm)为主;而在高浓度时则可以形成多聚体(aggregation),发射光以红光(-590nm)为主。
mitotracker red染色原理Mitotracker Red是一种常用的荧光染料,用于研究线粒体在细胞中的分布和活动。
它可通过与线粒体内的膜电位相关的染料积聚而发出红色荧光。
Mitotracker Red染色原理基于线粒体的电化学特性和荧光成像技术。
线粒体是细胞中的重要细胞器,参与细胞的能量代谢和调节细胞生理功能。
线粒体内膜由质子泵驱动,形成电化学梯度,这个梯度通过ATP合成酶产生ATP。
Mitotracker Red染料的工作原理是利用线粒体内质子梯度的存在。
Mitotracker Red是一种阳离子染料,它可以穿过细胞膜进入细胞。
在细胞内,Mitotracker Red被内质网和线粒体吸收。
内质网对Mitotracker Red的吸收较低,而线粒体对其具有较高的亲和力。
当Mitotracker Red进入线粒体后,它会受到线粒体内膜的质子梯度的影响。
内膜的质子梯度会使Mitotracker Red在线粒体内积聚。
Mitotracker Red的积聚与线粒体内膜电位成正相关,积聚量与内膜电位的变化程度成正比。
由于Mitotracker Red是一种荧光染料,积聚后的Mitotracker Red会发出红色荧光。
通过荧光显微镜观察细胞中Mitotracker Red的荧光强度和分布,可以获得线粒体的定量信息。
荧光显微镜可以通过滤光片选择性地观察红色荧光,而抑制细胞内其他荧光的干扰。
通过图像分析软件,可以对Mitotracker Red的荧光强度和分布进行定量分析。
Mitotracker Red染色的优点是可以对活细胞进行实时观察,可以动态地监测线粒体的状态和活动。
此外,Mitotracker Red的荧光信号强度与线粒体内膜电位的变化成正比,可以反映线粒体功能和代谢的变化。
因此,Mitotracker Red在研究线粒体功能障碍、细胞凋亡、细胞老化等方面具有重要的应用价值。
然而,需要注意的是,Mitotracker Red染料的使用也存在一些限制。
亚细胞定位叶绿体红色激发荧光解释说明1. 引言1.1 概述本文旨在探讨亚细胞定位中使用叶绿体红色激发荧光技术的应用和解释说明。
叶绿体作为植物和一些原生生物细胞中的重要亚细胞结构,扮演着光合作用等关键功能角色。
随着科学技术的不断发展,人们逐渐意识到了对于叶绿体在细胞内精确定位的重要性。
1.2 文章结构本文将按照以下结构展开对亚细胞定位叶绿体红色激发荧光的描述和解释说明。
首先,我们将在第2部分介绍叶绿体的结构与功能,以增加读者对该亚细胞结构的基本了解。
其次,在第3部分,我们将详细阐述红色激发荧光技术以及其在亚细胞定位中的应用。
这将涵盖该技术的原理、实验方法和步骤,并通过结果分析来解释其有效性。
最后,在第4部分,我们将总结回顾此项研究内容,并探讨其意义和未来可能的展望。
1.3 目的本文旨在向读者介绍亚细胞定位叶绿体红色激发荧光技术,并对其进行解释说明。
通过对叶绿体的结构与功能、红色激发荧光技术及其应用的深入探讨,我们希望能够提供有关该技术的详尽信息,以进一步推动相关领域的研究和发展。
同时,我们也将强调该技术在生物学和医学等领域中的重要性和前景,鼓励更多科学家和研究人员参与到这一领域的探索中来。
2. 亚细胞定位叶绿体红色激发荧光2.1 叶绿体结构与功能叶绿体是植物和其他一些生物的细胞器,主要位于植物细胞的质体中。
它们是光合作用的关键位置,负责将阳光能转化为化学能,并生产出氧气和有机物质。
叶绿体内含有叶绿素等色素分子,在受到适当波长的光激发后,会产生荧光信号。
2.2 红色激发荧光技术概述红色激发荧光技术是一种用于可视化叶绿体的方法。
传统上,通过蓝色或紫外线波长来激发叶绿体产生荧光信号。
然而,在大多数活细胞条件下,这些波长处于较高能级且难以穿透细胞组织。
为了解决这个问题,科学家们开发出了红色激发荧光技术,该技术使用较长波长的红色或近红外线光来激发叶绿体产生荧光信号。
2.3 红色激发荧光在亚细胞定位中的应用红色激发荧光技术在亚细胞定位中具有重要应用价值。
MitoTracker对在体小鼠小脑和体外培养颗粒细胞线粒体的染色方法王小青;王淑曼;王来;鄢明超;邓锦波【期刊名称】《解剖学杂志》【年(卷),期】2016(039)002【摘要】目的:采用线粒体红色荧光探针MitoTracker标记小脑颗粒细胞线粒体,并与标记体外培养神经元线粒体进行比较,探讨MitoTracker标记在体脑细胞线粒体的实验方法.方法:在脑立体定位仪下,微量注射MitoTracker线粒体红色荧光探针到小鼠小脑皮质,继续饲养3d后,常规取脑、固定、切片,利用共聚焦显微镜观察线粒体标记情况.结果:共聚焦显微镜下,可观察到在体标记的神经细胞内颗粒样线粒体呈团块状分布,排列较体外培养神经元标记的杆状线粒体紧密.结论:MitoTracker线粒体红色荧光探针可用于标记在体小脑细胞的线粒体.【总页数】3页(P226-228)【作者】王小青;王淑曼;王来;鄢明超;邓锦波【作者单位】河南大学生命科学学院神经生物学研究所,开封475004;河南大学生命科学学院神经生物学研究所,开封475004;河南大学生命科学学院神经生物学研究所,开封475004;河南大学生命科学学院神经生物学研究所,开封475004;河南大学生命科学学院神经生物学研究所,开封475004【正文语种】中文【相关文献】1.Bmp8a和Bmp8b基因在体外培养小鼠卵巢颗粒细胞中的表达 [J], 王建起;Selvaraj J.NIMAL;曹文广2.人卵丘颗粒细胞和壁层颗粒细胞体外培养方法比较 [J], 何文;吕杰;李涛;文艳飞;韩婵林;蔡柳洪3.乙醇对感觉刺激诱发小鼠小脑颗粒细胞反应的影响机制 [J], 金娟;咸峰元;吴光;崔松彪4.丙泊酚对小鼠小脑皮层颗粒细胞层感觉信息传递的影响 [J], 金文哲;邴艳华;邱德来;初春平;金哲虎5.雌二醇对小鼠小脑颗粒细胞轴突生长、体外增殖和迁移的影响 [J], 艾晓杰;李伟因版权原因,仅展示原文概要,查看原文内容请购买。