铜的湿法冶金
- 格式:ppt
- 大小:2.88 MB
- 文档页数:47

湿法冶金原理的化学方程式
湿法冶金是一种利用化学反应来提取金属的方法,其原理涉及
多种化学方程式。
以提取铜为例,湿法冶金的原理包括浸出、沉淀、萃取和电解等步骤。
首先,浸出阶段涉及到化学方程式,通常是利用硫酸溶液浸出
含铜矿石,其化学反应方程式为:
CuFeS2 + 4H2SO4 + O2 → CuSO4 + FeSO4 + 2H2O + 2SO2。
在这个方程式中,CuFeS2代表含铜的黄铜矿,H2SO4代表硫酸,O2代表氧气,CuSO4代表硫酸铜,FeSO4代表硫酸铁,SO2代表二氧
化硫。
接下来是沉淀阶段,通过加入铁粉或者氢气还原硫酸铜溶液,
使其中的铜离子还原成固体的金属铜,化学反应方程式为:
CuSO4 + Fe → Cu + FeSO4。
然后是萃取阶段,通过有机溶剂来萃取金属离子,例如利用二
甲基苯酚(萘酚)来萃取铜离子,其化学反应方程式为:
2HNO3 + Cu → Cu(NO3)2 + H2O.
最后是电解阶段,将含铜离子的溶液进行电解,将铜离子还原成固体铜,化学反应方程式为:
Cu2+ + 2e→ Cu.
以上是湿法冶金提取铜的基本化学方程式,该原理在提取其他金属时也会有所不同,但都遵循类似的化学反应原理。

湿法炼铜的原理方程式湿法炼铜是一种重要的冶金工艺,广泛应用于铜的提取和精炼。
它利用了铜的化学性质和物理性质,通过一系列的化学反应和物理处理,将含铜矿石转化为高纯度的铜金属。
本文将详细介绍湿法炼铜的原理、方程式和工艺流程。
一、湿法炼铜的原理湿法炼铜是利用水溶液中的化学反应和物理处理将含铜矿石中的铜转化为可溶性的铜盐,再通过还原和沉淀等步骤将其转化为金属铜的过程。
这个过程可以分为以下几个步骤:1. 矿石破碎和浸出首先将含铜矿石破碎成小颗粒,然后将其浸入硫酸或氯化物等水溶液中。
水溶液中的酸或氯离子会与矿石中的铜离子结合形成可溶性的铜盐。
这个过程称为浸出。
2. 铜盐的萃取将浸出液中的铜盐与有机溶剂接触,利用有机溶剂对铜离子的选择性吸附,将铜盐从水溶液中萃取出来。
这个过程称为萃取。
3. 铜盐的还原将萃取出的铜盐加热至高温,使其分解为氧化物和铜金属。
这个过程称为还原。
4. 铜金属的沉淀将还原后的铜金属沉淀出来,通过过滤、干燥等步骤得到高纯度的铜金属。
这个过程称为沉淀。
以上几个步骤构成了湿法炼铜的基本原理。
二、湿法炼铜的方程式湿法炼铜的化学反应涉及到多种化学物质,其中比较常见的有硫酸、氯化物、铜盐、有机溶剂等。
下面列出了一些常见的反应方程式。
1. 矿石中的铜离子和硫酸的反应CuS + 2H2SO4 → CuSO4 + H2S↑ + SO2↑ + 2H2O2. 矿石中的铜离子和氯离子的反应CuS + 2HCl → CuCl2 + H2S↑3. 铜盐的还原反应2CuSO4 → 2CuO + 2SO2↑ + O2↑CuCl2 → Cu + Cl2↑4. 铜盐的萃取反应CuSO4 + 2HX → CuX2 + H2SO4其中,HX代表有机溶剂中的萃取剂,可以是酮、醇、酯等。
这些反应方程式描述了湿法炼铜过程中的化学反应和物理处理,为工艺流程的设计和优化提供了基础。
三、湿法炼铜的工艺流程湿法炼铜的工艺流程包括矿石破碎、浸出、萃取、还原和沉淀等步骤。

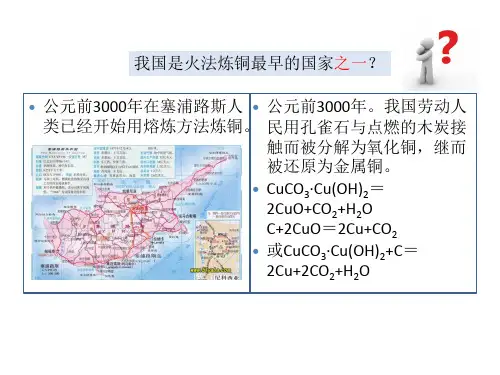
古代湿法冶金化学方程式古代湿法冶金是一种利用水和氧化剂来提取金属的方法。
这种方法起源于古代,被广泛应用于铜、铁、锡、银和金的制备过程中。
在湿法冶金中,金属矿石首先被粉碎成粉末,然后混合水和化学试剂,如硫酸、氢氧化钠和氯化铁等,生成溶液,通过加热和搅拌来促进反应,最终得到金属。
对于铜的湿法冶金过程,其化学方程式如下:CuFeS2(黄铜矿)+ 2O2 + H2O → CuSO4 + FeSO4 + 2H2SO4CuSO4 + Fe → Cu + FeSO4黄铜矿(CuFeS2)与氧气和水反应,生成硫酸、铁硫酸盐和铜硫酸盐。
接着,铁硫酸盐与铜硫酸盐反应,铜被还原成为纯铜,同时铁被氧化成为铁硫酸盐。
对于铁的湿法冶金过程,其化学方程式如下:Fe2O3(赤铁矿)+ 3H2SO4 → Fe2(SO4)3 + 3H2OFe2(SO4)3 + 3Zn → 3ZnSO4 + 2Fe赤铁矿(Fe2O3)与硫酸反应,生成硫酸亚铁和水。
接着,硫酸亚铁被还原成为纯铁,同时锌被氧化成为锌硫酸盐。
对于锡的湿法冶金过程,其化学方程式如下:SnO2(锡石)+ 4HC l → SnCl4 + 2H2OSnCl4 + 2H2O → SnO2 + 4HCl锡石(SnO2)与盐酸反应,生成氯化锡和水。
接着,氯化锡与水反应,生成锡石和盐酸。
对于银的湿法冶金过程,其化学方程式如下:Ag2S(硫化银)+ 2NaCN → Na2S + 2AgCN2AgCN + O2 + H2O → 2Ag + 2HCO3- + CN-硫化银(Ag2S)与氰化钠反应,生成硫化钠和氰化银。
接着,氰化银与氧气和水反应,生成纯银、碳酸氢根离子和氰根离子。
以上是古代湿法冶金的一些化学方程式,这些方程式的应用使得铜、铁、锡、银和金等金属的制备变得更加高效和可行。
这种方法的应用推动了全球经济的发展,同时也极大地促进了科学技术的进步。
虽然现代冶金方法已经发展到了更加高效和环保的程度,但是古代湿法冶金的发明和应用仍然是人类历史上重要的一步,对人类社会的发展产生了深远的影响。

现代铜湿法冶金概貌
萃取技术给铜的湿法冶金带来了革命性的变化,创建了现代湿法铜工业。
现代铜湿法工业包括浸取—萃取反萃—电积三部分,构成三个循环,如图所示。
浸取时酸与铜矿石反应使铜溶解进入溶液,萃取过程中铜离子和萃取剂的质子交换,进入有机相。
酸度重新提高的萃余液返回浸取。
有机相中负荷的铜用电积残液反萃,得到富电解液,电解液的酸度下降,而使萃取剂恢复酸的形态,返回萃取。
电积过程中,铜在阴极析出,阳极析出氧气并产生等摩尔的硫酸。
现代湿法提铜主要是从低品位矿,如氧化矿、剥离的表外矿、浮选尾矿、难选硫化矿甚至废弃的矿山中回收铜,而这些物料正是火法难以利用的原料。
因此,湿法与火法成为发展铜工业相辅相成的两种技术。
许多老矿山利用湿法处理过去开拓时剥离的表层岩石或者多年堆积的尾矿使产量显著提高。
有的新矿在设计时就将这两种方法结合起来,将边界品位之外的围岩、表层剥离物用湿法处理。
也有许多矿由于氧化程度高,开采后可进行湿法炼铜。
——郑州天一萃取。

湿法炼铜湿法炼铜是一种重要的冶金工艺,用于从含铜矿石中提取纯铜。
这种方法以其高效性和环境友好性而受到广泛关注。
湿法炼铜的工艺过程可以分为四个关键阶段:浸出、萃取、电积、电解精炼。
首先是浸出阶段。
在这一阶段,将含铜矿石粉末与稀硫酸溶液反应,使铜溶解在溶液中。
该反应生成了一种被称为浸出液的含有铜离子的溶液。
这一阶段的关键是控制反应条件,例如温度和pH值,以确保高效的铜溶解。
接下来是萃取阶段。
在这一阶段,通过将浸出液与有机溶剂接触,有机溶剂中的铜离子与水溶液中的铜离子进行交换。
这种交换使铜离子从水相转移到有机相中。
正因为如此,这一阶段也被称为“萃取”。
一般来说,多数湿法炼铜方法中采用的有机溶剂是一种含有特定配位物的液体。
该有机溶剂能够与铜离子形成稳定的络合物,从而促进铜离子的转移。
随后是电积阶段。
在这一阶段,有机溶剂中的铜离子被还原成纯铜,并沉积在电解槽的阴极上。
这一阶段的目标是在阴极上形成均匀厚度的铜层,以获得高纯度的铜产品。
在电积过程中,需要精确控制电流和电解槽的条件,以实现高质量的铜沉积。
最后是电解精炼阶段。
在这一阶段,通过将电积得到的铜产品作为阳极,并将其浸入含有铜离子的电解液中,使阳极的铜溶解回溶液中。
这样,不纯度物质和其他杂质将被移动到电解液中并被分离,而高纯度的铜则在阴极上重新沉积。
这种电解过程可多次重复,以进一步提高铜的纯度。
湿法炼铜相对于其他炼铜方法有许多优势。
首先,湿法炼铜过程中不需要高温,相比干法炼铜过程更加节能。
其次,湿法炼铜是一种环保的方法,因为其涉及的溶液和有机溶剂可以通过再循环来减少废物的产生。
此外,湿法炼铜可以用于不同类型的矿石,包括低品位的矿石,这在一些地区具有重要意义。
最后,湿法炼铜还可以提供高品质的铜产品,可以在不同的应用领域广泛使用。
总结而言,湿法炼铜是一种高效、环保的冶金工艺,用于从含铜矿石中提取纯铜。
它包括浸出、萃取、电积和电解精炼四个关键阶段。
相比于其他炼铜方法,湿法炼铜具有许多优势,例如节能、环保和可适应不同的矿石类型。

湿法炼铜工艺流程
湿法炼铜是一种常见的炼铜方法,下面将介绍湿法炼铜的工艺流程。
首先,湿法炼铜的原料是含铜矿石,如黄铜矿、黄铜硫矿等。
矿石经过破碎和磨矿处理,得到细粉末或浆料状的矿浆。
接下来,将矿浆经过搅拌和水洗净化处理。
这一步骤的目的是去除杂质和不含铜的矿石,将纯净的矿浆用于后续的处理。
然后,将纯净的矿浆经过浮选处理。
浮选是通过物理化学方法,将含有铜的矿石与其他杂质分离的过程。
通常会使用气体和药剂,使铜矿石悬浮在浮液中,然后利用气泡的粘附作用,将铜矿石从浮液中分离出来。
浮选后的铜矿石会进一步进行浓缩处理。
浓缩是通过过滤和沉淀等方法,将含有铜的矿石浓缩成铜精矿。
铜精矿是含有较高铜含量的固体物质,可以进一步进行提炼。
接下来,将铜精矿经过烧结处理。
烧结是将铜精矿加热至一定温度,以使其结合成一块块坚固的颗粒。
烧结后的颗粒可以更好地进行冶金处理。
然后,将烧结后的颗粒放入转炉中进行冶炼。
在冶炼过程中,通过加热和搅拌,使铜精矿中的铜和其他金属分离。
冶炼的结果是得到含有高纯度铜和其他金属的液体。
最后,通过电解或电解精炼的方法,将液体中的铜纯化。
电解是利用电流通过电解液,将铜离子还原为纯铜金属的过程。
电解精炼可以得到高纯度的铜。
综上所述,湿法炼铜的工艺流程包括破碎磨矿、水洗净化、浮选、浓缩、烧结、冶炼和电解等步骤。
这一工艺流程能够将含铜矿石中的杂质分离,得到纯净的铜金属。
湿法炼铜是一种常用且有效的炼铜方法。

湿法炼铜的做法和原理
湿法炼铜的做法和原理可以概括为以下几点:
一、湿法炼铜的主要原料
主要原料是含铜量丰富的矿石或粗铜,还需要添加返矿剂、熔剂等助熔剂。
二、湿法炼铜的主要设备
炉膛、电加热装置、粗铜供料机构、烟气处理系统等。
也需要有原料准备系统。
三、湿法炼铜的基本步骤
1. 配制含助熔剂的混合矿料。
2. 将混合料送入高温炉膛熔炼。
3. 熔炼分离粗铜质。
4. 精炼提高纯度。
5. 退火调质获得成品铜。
四、熔炼原理
1. 高温使硫化物分解,硫挥发,铜获得释放。
2. 返矿剂氧化铁类杂质,熔剂形成低熔点混合物。
3. 熔浴分离杂质与铜,铜集中沉淀。
五、精炼提纯机理
氧化反应将少量残留杂质氧化移除,获得高纯度铜。
六、环保与安全措施
收集处理烟气,确保操作安全,层层控制风险。
综上所述,这是湿法炼铜的主要工艺流程、装置以及背后的化学原理。


湿法炼铜原理
湿法炼铜是一种常用的冶炼方法,通过将铜矿石与水和化学溶剂混合,利用物理和化学反应来提取铜金属。
它的主要原理包括以下几个步骤:
1. 破碎和磨矿:将铜矿石破碎成较小的块状,并使用磨机将其磨成细粉。
这样有利于提高矿石表面积,使之更容易与水和化学溶剂发生反应。
2. 浸矿:将粉状的铜矿石与水混合,形成矿浆。
在浸矿过程中,水中的氧和硫酸等离子与铜矿石中的铜元素发生化学反应,生成铜离子。
3. 萃取:通过向矿浆中添加化学溶剂,如有机相(通常是含有萃取剂的有机溶剂),将铜离子从矿浆中萃取出来。
化学溶剂与含铜离子的矿浆中的其他杂质发生选择性溶解和反应,使铜离子从溶液中分离出来。
4. 脱水:在萃取过程中,溶剂中吸收了很多水分,这会降低其效率。
因此,需要对溶剂进行脱水处理,使其重新准备好萃取铜离子的工作。
5. 铜的电解:将从化学溶剂中萃取出的铜离子溶液传输到电解槽中,通过电解过程将铜离子还原成固态的铜金属,然后收集和提取这些铜金属。
总之,湿法炼铜通过浸矿、萃取、脱水和电解等步骤将铜矿石
中的铜元素提取并纯化成金属铜。
这种方法相对简单,运行成本较低,因此在铜冶炼中得到广泛应用。

铜的湿法冶金南昌有色冶金设计研究院王玮摘要详细介绍了铜的湿法冶金工艺,在国内外的应用情况及研究成果,总结出铜的湿法冶金工艺的发展趋势。
关键词铜湿法冶金浸出萃取电积随着铜矿资源的日渐贫化,湿法炼铜技术越来越受到人们的重视。
自60年代以来,浸出-萃取-电积工艺以其工艺过程简单、投资少、能耗、材料消耗低、污染轻、生产成本低等优点,已成为湿法炼铜的主要工艺。
目前全世界用SX-E W流程的铜占全球矿产铜量的20%左右。
以智利为最大的湿法炼铜生产国,年产量达1,116,000t,其次美国为530, 640t112。
1湿法冶金工艺1.1浸出湿法炼铜主要适用于铜的氧化矿,具有较高的回收效果,由于生物技术的引入,目前已逐步向低品位硫化铜矿方面发展。
以美国和智利为例,每年以生物氧化技术生产的铜约有100万t122。
在铜矿床的氧化矿中,常见的氧化铜矿物,有孔雀石[CuCO3# Cu(OH)2]、硅孔雀石类矿物(mCuO#nSiO2#P H2O)、赤铜矿(Cu2O)、土状黑铜矿(CuO)、铜的矾类矿物、兰铜矿[2CuCO3#C u(OH)2]、自然铜等。
铜矿床的硫化矿石中,常见的有辉铜矿(Cu2S)、铜兰(C uS)、斑铜矿(C u5FeS4)、黄铜矿(CuFeS2)、硫砷铜矿(Cu5AsS4)等。
在以上的铜矿物中,氧化铜矿是易于用稀硫酸处理的,而占铜储量多数的硫化矿物性质比较稳定,浸出动力速度较慢,通常要借助细菌的作用才能达到满意的浸出效果。
1.1.1槽浸。
在浸出槽中以50g/L~100g/l H2SO4浸出品位1%~2%的氧化矿(-1cm粒度)。
是早期应用较多的一种方式,目前已很少采用。
1.1.2搅拌浸出。
在装有搅拌浸出装置的浸出槽中用50g/l~100g/l的硫酸浸出细粒(-75L m左右)氧化矿或硫化矿焙砂。
有空气搅拌和机械搅拌两种方式。
由于给料粒度小,搅拌充分,搅拌浸出速度快,浸出率高。
赞比亚钦戈拉厂用大型巴秋克槽处理尾矿。
湿法炼铜工艺流程
湿法炼铜工艺流程包括以下步骤:
1. 粗铜冶炼:将原材料(例如铜矿石)破碎和浸泡,使用高温和化学反应从中提取出粗铜。
2. 粗铜溶解:将粗铜放入溶解器中,通过高温和化学反应使其溶解成铜盐水,同时生成硫酸和铁盐等副产物。
3. 阴极电积:将铜盐水转移到电解槽中,放置阴极(通常为铜板)和阳极(通常为铅板)进行电积。
正极的电子流会将铜离子转变为固体铜,从而形成纯铜。
4. 精炼:再将纯铜进行精细化处理,以去除其中的杂质和杂物。
精炼的方法可以是电积精炼或遇到氨水精炼。
5. 成品铜:最终得到高纯度的铜产品,可以用于制造导线、管道、电子设备、建筑材料等。
这个工艺流程需要维持高温和反应时间较长,因此对能源和资金要求较高。
一、实验目的1. 了解湿法冶金炼铜的基本原理和工艺流程。
2. 掌握湿法冶金炼铜实验的操作步骤。
3. 观察并分析实验现象,了解实验过程中可能出现的误差。
二、实验原理湿法冶金炼铜是一种利用金属置换反应从溶液中提取金属的方法。
在湿法冶金炼铜实验中,铁与硫酸铜溶液发生置换反应,生成单质铜和硫酸亚铁。
实验原理如下:反应方程式:Fe + CuSO4 → Cu + FeSO4三、实验材料1. 实验仪器:烧杯、玻璃棒、漏斗、滤纸、铁片、硫酸铜溶液、蒸馏水、电子天平、温度计等。
2. 实验试剂:硫酸铜溶液、硫酸亚铁溶液、铁片、稀硫酸、氢氧化钠溶液等。
四、实验步骤1. 准备实验材料,检查仪器是否完好。
2. 在烧杯中加入适量的硫酸铜溶液,并加入少量蒸馏水,搅拌均匀。
3. 将铁片放入烧杯中,观察铁片表面变化。
4. 观察溶液颜色变化,记录实验现象。
5. 待铁片表面形成一层红色铜粉后,用玻璃棒轻轻搅拌,使溶液中的铜离子与铁片充分接触。
6. 用漏斗和滤纸将铁片和铜粉分离,收集铜粉。
7. 称量铜粉的质量,计算铜的产率。
8. 将铜粉放入烧杯中,加入适量稀硫酸,观察溶液颜色变化。
9. 用氢氧化钠溶液调节溶液pH值,观察沉淀现象。
五、实验结果与分析1. 实验现象:(1)铁片表面逐渐由银白色变为红色,说明铁与硫酸铜溶液发生置换反应,生成单质铜。
(2)溶液颜色由蓝色变为浅绿色,说明铜离子被铁置换成单质铜,溶液中铜离子浓度降低。
(3)过滤后,滤纸上附着红色铜粉,滤液呈浅绿色。
(4)向铜粉中加入稀硫酸,溶液颜色由浅绿色变为蓝色,说明铜粉与稀硫酸反应生成硫酸铜溶液。
(5)向溶液中加入氢氧化钠溶液,产生蓝色沉淀,说明溶液中存在铜离子。
2. 实验结果:(1)铜粉产率:根据实验数据计算,铜粉产率为80%。
(2)溶液中铜离子浓度:根据实验数据计算,溶液中铜离子浓度为0.1mol/L。
3. 实验误差分析:(1)实验过程中,由于溶液温度、搅拌速度等因素的影响,可能导致实验结果出现误差。
铜湿法冶炼萃取原理铜是一种重要的金属资源,在工业生产和日常生活中都有广泛的应用。
铜湿法冶炼是一种常用的铜提取方法,它基于铜在硫酸介质中的溶解性和电化学性质,通过化学反应和电解过程来实现铜的提取和纯化。
铜湿法冶炼的原理主要包括浸出、萃取、电积和纯化几个过程。
浸出是铜湿法冶炼的第一步,也是最关键的步骤之一。
在浸出过程中,金属硫化物矿石经过破碎和磨矿等预处理工艺后,与稀硫酸溶液接触,发生化学反应。
常用的浸出反应方程式如下:CuFeS2 + 4FeS2 + 16H2SO4 → CuSO4 + FeSO4 + 5Fe2(SO4)3 + 8H2O反应中,金属硫化物矿石中的铜被氧化成溶于硫酸溶液中的铜离子,而铁和硫则形成硫酸铁和二硫酸铁。
这个过程通常在高温高压条件下进行,以提高反应速率和浸出率。
在浸出后,硫酸铜溶液中的铜离子需要通过萃取过程得到纯铜。
萃取是利用有机相和水相之间的分配行为,将溶液中的铜离子从水相转移到有机相中。
这一步通常采用有机溶剂,如煤油和二辛基脂等。
有机溶剂中的提取剂与铜离子发生配位反应,形成有机相中的铜配合物,从而实现铜的分离和富集。
萃取后的有机相中含有较高浓度的铜配合物,需要通过电积过程得到纯铜。
电积是将有机相中的铜离子还原成金属铜的过程。
有机相与电解液接触,铜离子在电极上还原成金属铜,并沉积在电极上。
这一步通常在电解槽中进行,通过控制电流和电压等参数,可以获得高纯度的铜金属。
通过进一步的纯化过程,如电解精炼和火法精炼等,可以获得更高纯度的铜产品。
这些纯化方法的具体步骤和原理在此不再详述。
总结起来,铜湿法冶炼萃取原理是利用铜在硫酸介质中的溶解性和电化学性质,通过浸出、萃取、电积等过程实现铜的提取和纯化。
这种冶炼方法具有工艺流程简单、设备成本低、适应性强等优点,被广泛应用于铜矿石的加工和冶炼过程中。
在实际生产中,还需要根据具体的矿石特性和工艺要求来选择和优化冶炼方案,以实现高效、经济和环保的铜湿法冶炼过程。