一级反应—过氧化氢分解
- 格式:docx
- 大小:43.74 KB
- 文档页数:8

过氧化氢的催化分解一、实验目的1、了解不同催化剂对过氧化氢(H2O2)催化分解速率的影响。
2、认知能催化分解H2O2的不同催化剂。
二、实验原理过氧化氢催化分解是一级反应:H2O2→H2O+1/2O2.。
(凡是反应速度只与反应浓度的一次方成正比的反应称为一级反应。
)实验证明,过氧化氢的反应机理为一级反应.化学反应速度取决于反应物的浓度、温度、反应压力、催化剂、搅拌速度等许多因素。
许多催化剂如Pt、Ag、Cr、MnO2、FeCl3、CuO、血液、铁丝、炭粉、土豆丝等都能加速H2O2分解。
用土豆丝来催化分解H2O2溶液,说明生物体内不断产生的过氧化氢酶,可促使H2O2迅速分解,这种酶广泛存在于动植物组织中。
三、实验仪器与药品仪器:试管(2个)、具支试管(1个)、锈铁丝、气球、土豆丝、药品:H2O2溶液,四、实验步骤1,过氧化氢溶液的制备用移液管吸取30℅H2O2溶液5ml,置于50ml容量瓶中,稀释至刻度线,摇匀定容,即得实验用的H2O2溶液。
2,酶催化作用的验证实验取两只试管,在一支试管中放入切成细条状的土豆丝。
分别向两支试管中注入3%的H2O2 5ml,注意观察现象(放入土豆丝的试管中迅速产生大量的气泡,泡沫很快充满试管;用玻璃棒桶开泡沫,)插入带火星的木条,则木条立即复燃,而另一支试管中无明显现象。
3,用抽动法做“催化剂对H2O2分解速度的影响”的实验①取一支具支试管,在具支试管中加入10ml浓度30%H2O2溶液,在支管上装上小气球,通过橡皮塞插入一根已生锈的绕成螺旋状的粗铁丝。
②将螺旋状的锈铁丝向下插入H2O2溶液中是,注意观察现象的变化。
(H2O2迅速分解,锈铁丝表面上,有大量气泡产生。
气球鼓起;把铁丝向上拉,离开H2O2溶液,则反应不明显。
)③取下塞子,用带火星木条放在试管口,注意观察现象变化。
(则木条立即复燃,说明有O2生成。
)五、注意事项1、实验过程中注意安全2、玻璃仪器轻拿轻放六、思考题1,催化剂对反应速度有何影响?2,常用催化剂有哪些?。

过氧化氢的催化分解一、实验原理过氧化氢水溶液在室温下,没有催化剂存在时,分解反应进行得很慢,但在含有催化剂I –的中性溶液中,其分解速率大大加快,反应式为:2H 2O 2 == 2H 2O + O 2(g)反应机理为: H 2O 2 + I – → H 2O + IO – k 1 (慢) (1) H 2O 2 + IO – → H 2O + O 2(g) + I – k 2 (快) (2) 整个分解反应的速率由慢反应(1)决定,速率方程为: 22-22H O 1H O I dc k c c dt-=因反应(2)进行得很快且很完全,I –的浓度始终保持不变,故上式可写成: 2222H O H O dc kc dt-=式中,-1I k k c =,k 为表观反应速率常数。
将上式积分得 0lnc kt c= 此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。
将上式积分得:01ln ln c t k c t +-=式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。
反应半衰期为: 112/1693.02ln k k t ==设H 2O 2完全分解时放出O 2的体积为V ∞,反应t 时放出O 2的体积为V , 则c 0∝V ∞,c ∝(V ∞ – V ),故 lnV kt V V ∞∞=-ln-V Vkt V ∞∞-= ln -+ln V V kt V ∞∞-=()以ln(V ∞ – V )对t 作图应得一直线,从直线斜率(– k )即可求得H 2O 2分解反应的速率常数。
故实验需测定反应不同时刻O 2的体积V 及H 2O 2完全分解时O 2的体积V ∞。
V ∞可用下法之一求出。
(a) 加热法 在测定若干个V 数据后,将H 2O 2溶液加热至50~60 ℃ 约15 min ,可以认为H 2O 2已分解完全,待冷却至室温后,记下量气管的读数,即为V ∞。
(b) 浓度标定法 用KMnO 4标准溶液对H 2O 2原始浓度进行标定,O 2近似按理想气体处理,则有2222222H O H O O O O 2c V RT RT V n p p ∞⋅=⋅=⋅ 式中,2O p 为O 2的分压,是外界大气压与实验温度下水的饱和蒸气压之差。

过氧化氢的催化分解一、实验原理过氧化氢水溶液在室温下,没有催化剂存在时,分解反应进行得很慢,但在含有催化剂I –的中性溶液中,其分解速率大大加快,反应式为:2H 2O 2 == 2H 2O + O 2(g)反应机理为: H 2O 2 + I – → H 2O + IO – k 1 (慢) (1) H 2O 2 + IO – → H 2O + O 2(g) + I – k 2 (快) (2) 整个分解反应的速率由慢反应(1)决定,速率方程为: 22-22H O 1H O I dc k c c dt-=因反应(2)进行得很快且很完全,I –的浓度始终保持不变,故上式可写成: 2222H O H O dc kc dt-=式中,-1I k k c =,k 为表观反应速率常数。
将上式积分得 0lnc kt c= 此式表明,反应速率与H 2O 2浓度的一次方成正比,故称为一级反应。
将上式积分得:01ln ln c t k c t +-=式中c 0、c t 分别为反应物过氧化氢在起始时刻和t 时刻的浓度。
反应半衰期为: 112/1693.02ln k k t ==设H 2O 2完全分解时放出O 2的体积为V ∞,反应t 时放出O 2的体积为V , 则c 0∝V ∞,c ∝(V ∞ – V ),故 lnV kt V V ∞∞=-ln-V Vkt V ∞∞-= ln -+ln V V kt V ∞∞-=()以ln(V ∞ – V )对t 作图应得一直线,从直线斜率(– k )即可求得H 2O 2分解反应的速率常数。
故实验需测定反应不同时刻O 2的体积V 及H 2O 2完全分解时O 2的体积V ∞。
V ∞可用下法之一求出。
(a) 加热法 在测定若干个V 数据后,将H 2O 2溶液加热至50~60 ℃ 约15 min ,可以认为H 2O 2已分解完全,待冷却至室温后,记下量气管的读数,即为V ∞。
(b) 浓度标定法 用KMnO 4标准溶液对H 2O 2原始浓度进行标定,O 2近似按理想气体处理,则有2222222H O H O O O O 2c V RT RT V n p p ∞⋅=⋅=⋅ 式中,2O p 为O 2的分压,是外界大气压与实验温度下水的饱和蒸气压之差。

实验31 一级反应动力学—H 2O 2催化分解速率系数的测定 预习要求1. 本实验中使用什么物质作为催化剂;其使用时的注意事项。
2. 本实验反应过程中反应物浓度的变化的表示方法。
3. 反应速率系数的概念及影响因素。
实验目的1.了解催化剂在催化反应中的作用特征。
2.测量H 2O 2催化分解反应的速率系数及表观活化能。
实验原理对于反应: a A + b B = y Y + z Z其反应速率与反应物的量浓度的关系可通过实验测定得到。
多数反应的速率方程的形式为:υA = k A c Aα c B β 若实验确定某反应物A 的消耗速率与反应物A 的浓度的一次方成正比,则该反应对A 为一级反应。
其反应速率方程为:—d c A / d t = k A c A (3-19) 以过氧化氢分解反应为例,H 2O 2 → H 2O + ½O 2实验证明过氧化氢分解反应的反应速率与H 2O 2(A )浓度的关系符合式(3-19)。
将式(3-19)积分得:ln (c A / c A ,0)= -k A t (3-20) 式中:k A ——反应速率系数;c A ——反应时刻为t 时H 2O 2的浓度;c A,0——反应开始前H 2O 2的浓度。
在反应不同时刻测得H 2O 2的浓度,代入式(3-20)即可求出反应速率系数k A 。
H 2O 2分解过程中有O 2放出。
若保持生成O 2的温度、压力不变,可通过测量放出O 2的体积,经过代换得到溶液中H 2O 2的浓度。
设浓度为c A ,0的H 2O 2全部分解放出的氧气体积为V ∞,反应时刻t 时H 2O 2分解放出的氧气体积为V t ,则c A ,0∝V ∞ ; c A ∝(V ∞ – V t )将以上关系式代入式(3-20)得:t k V V V t A ∞∞-=-ln(3-21) 或 V t k )V V (t ∞A ∞lg +2.303-=-lg (3-22) 以lg (V ∞-V t )对t 作图。
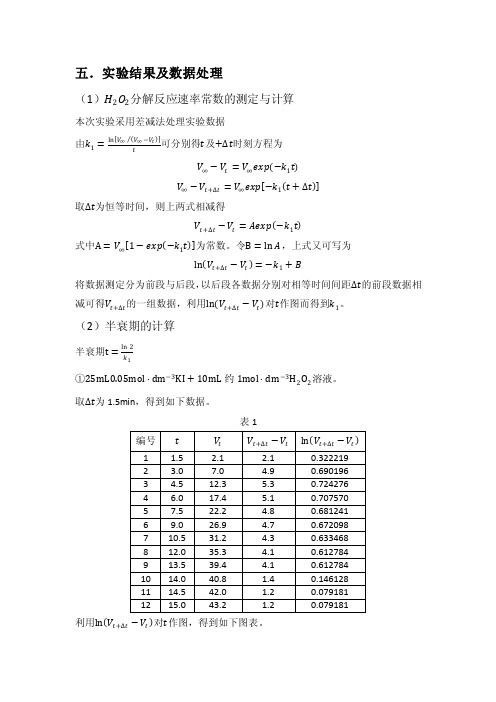
五.实验结果及数据处理(1)H2O2分解反应速率常数的测定与计算本次实验采用差减法处理实验数据可分别得t及+∆t时刻方程为由k1=ln V∞V∞−V ttV∞−V t=V∞exp−k1tV∞−V t+∆t=V∞exp−k1t+∆t取∆t为恒等时间,则上两式相减得V t+∆t−V t=Aexp−k1t式中A=V∞1−exp−k1t为常数。
令B=ln A,上式又可写为ln V t+∆t−V t=−k1+B将数据测定分为前段与后段,以后段各数据分别对相等时间间距∆t的前段数据相减可得V t+∆t的一组数据,利用ln V t+∆t−V t对t作图而得到k1。
(2)半衰期的计算半衰期t=ln2k1①25mL0.05mol∙dm−3KI+10mL约1mol∙dm−3H2O2溶液。
取∆t为1.5min,得到如下数据。
表1利用ln V t+∆t−V t对t作图,得到如下图表。
故k 1=0.0136t =ln 20.0136=50.97②25mL0.1mol ∙dm −3KI +10mL 约1mol ∙dm −3H 2O 2溶液。
取∆t 为1.0min ,得到如下数据。
表2利用ln V t +∆t −V t 对t 作图,得到如下图表。
故k 1=0.0262t =ln 20.0262=26.46③25mL0.1mol∙dm−3KI+5mL约1mol∙dm−3H2O2溶液+10mL约1mol∙dm−3H2O。
取∆t为1.5min,得到如下数据。
表3利用ln V t+∆t−V t对t作图,得到如下图表。
=25.96故k1=0.0267t=ln20.0267。

一级反应过氧化氢分解实验注意事项
进行过氧化氢分解实验时,需要注意以下事项:
1. 确保安全:实验室必须安全,操作必须谨慎。
使用过氧化氢时,必须遵循安全操作规程,包括佩戴个人防护装备、避免吸入气体、保持空气流通等。
2. 避免明火:过氧化氢遇明火会剧烈燃烧,因此必须避免任何明火的存在。
在实验过程中,必须防止火星或静电放电等可能引起明火的因素。
3. 控制温度:过氧化氢分解反应需要一定的温度,但过高的温度可能导致爆炸等危险。
因此,必须在实验室内安装温度控制系统,确保反应温度适当。
4. 正确使用催化剂:催化剂可以加速过氧化氢的分解反应,但不正确的催化剂使用可能导致爆炸等危险。
因此,必须正确选择和使用催化剂。
5. 收集和处理副产物:过氧化氢分解反应会产生氧气和氢气等副产物。
这些副产物必须及时收集和处理,以避免可能对实验室和环境造成污染或危险。
总结起来,进行过氧化氢分解实验时,必须充分考虑安全因素,并遵循严格的实验室操作规程。
同时,必须加强对实验过程的监督和管理,以确保实验的安全和有效性。
过氧化氢催化分解实验目的:1. 测定KI催化H2O2分解反应的速率常数和反应级数。
2. 掌握一级反应的特性,考察反应物浓度、催化剂浓度等对反应速率常数的影响。
3. 掌握由动力学数据确定反应速率常数及反应级数的方法。
实验内容:1.测定不同反应条件下H2O2分解产生氧气的速率,以产生一定体积的氧气所对应的时间计算。
2.准确标定H2O2溶液的初始浓度c0。
3.计算V∞的数值。
4.做ln(V∞-V t)-t图,由直线斜率求表观反应速率常数及相对应的半衰期。
实验进程:一、讲解内容1. 做好实验准备,在实验开始前要求学生将恒温水浴温度调节到(25±0.10)℃并打开循环水泵进行恒温。
2. 实验原理:过氧化氢是一种很不稳定的化合物,在没有催化剂存在时,分解很慢,加入催化剂可以加速其分解。
(1)提问:大家肯定已经学习过过氧化氢的分解反应,反应产物为?(1)在加入催化剂KI的条件下,H2O2的反应进程加快,讲解反应步骤:慢(2)快(3)由以上机理可知,KI和H2O2生成的中间产物改变了反应途径,降低了反应的活化能,从而加速了反应进程。
研究表明,反应(2)的速率远慢于反应(3),反应(2)为整个分解过程的控速步骤,而总反应(1)的速率就等于(2)的反应速率,故H2O2分解反应速率方程可表示为:(4)式中,c表示各物质浓度(mol / L);t为反应时间;k为反应速率常数,其职与温度、催化剂等有关。
反应中KI作为催化剂,浓度不发生改变,可令k=,式(4)可简化为:(5)k为表观反应速率常数,量纲为[时间]-1。
由式(5)可以看出,反应速率与反应物浓度的一次方成正比,故H2O2催化分解反应为一级反应,其表观反应速率常数k将随温度和KI浓度变化而变化。
将式(5)积分得:+(6)式中,c0为H2O2的初始浓度;c t为t时刻H2O2的浓度。
以对t作图若为一直线,则确定H2O2催化分解反应为一级反应,并可由直线斜率求出反应速率常数k。
过氧化氢的催化分解一、实验目的:1.用静态法测定H 2O 2分解反应的速度常数和半衰期。
2.熟悉一级反应特点,了解反应物浓度、温度、催化剂等因素对一级反应速度的影响。
3.掌握量气技术和体积校正,学会用图解计算法求出一级反应的速度常数。
二、实验原理:1. 凡反应速度只与反应物浓度的一次方成正比的反应,称为一级反应,实验证明H 2O 2的分解反应如下:2 H 2O 2 → 2 H 2O + O 2 (1) 2. 若该反应属于一级反应,则其速度方程应是:式中:C H2O2—时间t 时的H 2O 2浓度; k —反应速度常数。
3. 化学反应速度取决于许多因素,如反应物浓度、搅拌速度、反应压力、温度、催化剂等等。
某些催化剂可以明显的加速H 2O 2 的分解,它们有Pt 、Ag 、MnO 2、FeCl 3、碘化物。
本实验用I -(具体用KI )作为催化剂。
由于反应在均匀相(溶液)中进行,故称为均相催化反应。
设该反应为一级反应,且按下列式进行:H 2O 2 + I - → H 2O + IO - (A )H 2O 2 + IO - → H 2O + O 2 (B ) 则因及其总反应速度为上两式之和,即:则 k A C I - = k B C IO-[][]dtC d dtC d BO H AO H 2222-=-2222O H O H kC dtdC =-)2(()2222O H IO B I A O H C C k C k dtdC --+=-2222·H O A A H O I d C k C C dt -⎡⎤⎣⎦-=2222·H O B B H O IO d C k C C dt -⎡⎤⎣⎦-=亦即反应速度应为:由于催化剂在反应前后的浓度是不变的,C I-或C IO-就可视为常数,令k =2k A C I - = 2k B C IO –最后得:若反应(A )的速度慢于反应(B ),则整个反应速度决定于反应(A ),因而可假定其速度方程式,即为:从而亦可简化为: 2222H O A H O I dC k C C dt--=⋅式(3)表示,H 2O 2的分解反应为一级反应。
过氧化氢分解速率常数的测定Determ in ati On Of H2QDeComPoSition Rate Con Sta nt一.实验目的及要求1. 熟悉一级反应的特点2. 测定过氧化氢分解反应的速率常数和级数3. 了解各种因素对反应速率的影响4. 用图解法求过氧化氢分解反应的速率常数二.实验原理凡是反应速度只是与反应物浓度的一次方成正比的反应称为一级反应。
实验证明.过氧化氢分解的反应为H2O2一H^O+ 10?如果该反应属于一级反应.则其反应速度方程应遵守下式:^ =kC t ⑴式中:k为反应速度常数;G为时间为t式的反应物浓度。
将式(1)积分得:=-⅛+lnC" (2) InCt式中:为反应开始时H2O2的浓度。
如将⑵变换•可得:In总7 ⑶该式子式是InCt〜t的直线方程。
反应进行过程中.测定不同时刻t 时反应系统中H2Q的浓度G.取得若干组C .t数据后.以InCt对时间 t作图.可得一直线.表明该反应为一级反应.其斜率为反应速度常数得负值—k.截距为In-O三.实验方法1. 实验条件的设计:化学反应速度取决于许多因素.例如反应物的浓度、搅拌速度、反应压力、温度、催化剂等等。
某些催化剂可以明显地加快反应速度。
能加速H2O分解的催化剂Pt、Ag、碘化物等等。
本实验用KI作为催化剂.在静态装置里测定HQ分解反应的速度常数(实验装置见第三部分)。
HQ在水溶液中分解释放出氧气的速率较慢.加入KI时.速率加快.其反应按下面的步骤进行.即Kl+HO====KIQ+HQ (慢)(1)KIQ====KI+1∕2Q(快)⑵由于第一步的速率比第二步慢得多.所以第一步为反应得控制步骤。
因而可以假定其反应的速率方程式为式中.Ct为反应系统中反应到t时刻HQ浓度.因KI在反应过程中浓度不变.故上式可以简化为式中,k = k!×ca,将上式分离变量积分t = 0 时.Ct = C 定积分式为积分结果InC t = —kt + ln Co (5)式(5)是InC t〜t的直线方程。
过氧化氢分解速率常数的测定Determination of H2O2 DecompositionRate Constant一.实验目的及要求1.熟悉一级反应的特点2.测定过氧化氢分解反应的速率常数和级数3.了解各种因素对反应速率的影响4.用图解法求过氧化氢分解反应的速率常数二.实验原理凡是反应速度只是与反应物浓度的一次方成正比的反应称为一级反应。
实验证明,过氧化氢分解的反应为如果该反应属于一级反应,则其反应速度方程应遵守下式:式中:k为反应速度常数;C t为时间为t式的反应物浓度。
将式(1)积分得:式中:为反应开始时H2O2的浓度。
如将(2)变换,可得:该式子式是lnC t~t的直线方程。
反应进行过程中,测定不同时刻t 时反应系统中H2O2的浓度C t,取得若干组C t ,t数据后,以lnC t对时间t作图,可得一直线,表明该反应为一级反应,其斜率为反应速度常数得负值-k,截距为㏑。
三.实验方法1.实验条件的设计:化学反应速度取决于许多因素,例如反应物的浓度﹑搅拌速度﹑反应压力﹑温度﹑催化剂等等。
某些催化剂可以明显地加快反应速度。
能加速H2O2分解的催化剂Pt﹑Ag﹑碘化物等等。
本实验用KI作为催化剂,在静态装臵里测定H2O2分解反应的速度常数(实验装臵见第三部分)。
H2O2在水溶液中分解释放出氧气的速率较慢,加入KI时,速率加快,其反应按下面的步骤进行,即KI+H2O2====KIO+H2O (慢) (1)KIO====KI+1/2O2 (快)(2)由于第一步的速率比第二步慢得多,所以第一步为反应得控制步骤。
因而可以假定其反应的速率方程式为式中,C t为反应系统中反应到t时刻H2O2浓度,因KI在反应过程中浓度不变,故上式可以简化为当t=0时, C t=C0t=t时, C t=C t定积分式为积分结果lnC t=-kt+㏑C0(5)式(5)是 lnC t~t的直线方程。
反应进行过程中,测定不同时刻t时反应系统中H2O2的浓度 C t,取得若干组C t,t的数据后,以㏑C t对t作图,得一直线,表明该反应为一级反应(准一级反应),直线斜率为-k。
一级反应一过氧化氢分解一、实验目的1、 熟悉一级反应的特点。
2、 掌握静态量气法测定分解反应动力学参数的实验原理和方法。
3、 测定过氧化氢水溶液在碘化钾催化剂的作用下分解反应的速率常数。
二、实验原理实验证明H2O2的分解反应为一级反应。
许多催化剂如光的作用、KI 、MnO 2. FeCg 、Ag 、丹等都能大大加快此反应的反应速率。
H 2O 2分解反应的化学方程式为:HQ, T/O +丄O,・・ ・ 2・本实验用K/作为催化剂,按下列步骤进行反应:HQ 、+KI —^KIO + HQ (慢) KIO —^KI + -O.(快)2 二其中第一步基元反应为控速步骤。
因此,反应的速率方程可以表达为:r= r ^-c m^l = k x [H 2O 2][KI]由于反应过程中K7不断再生,其浓度[K/]保持不变,上式可以简化为:式中忍肛称为表观速率常数。
将上式积分得:(1)式中[比为丹2°2的初始浓度,[比° J 为反应时刻(时的比°2浓度。
dt= ^IH 2O 2]在弘。
2催化分解过程中,『时刻比。
2的浓度可以通过测左在相应时间内释 放出的氧气体积得出。
因分解过程中,放出氧气的体积与分解了的浓度成正比,其比 例常数为立值。
令匕表示H2O2全部分解释放岀的氧气体积,匕表示H2O2在r 时刻分解释放出的氧 气体积,贝'J[^26>2]0 ocV xt [H 2O 2]oc(V x -V ;)t 将该关系代入(1)式中得到:如果以ln(—-匕)~f 作图得一直线,即可验证是一级反应,由直线的斜率可以求岀灯址本实验匕.的测立采用KW H O。
滴泄法.测试方法可参考附录一。
本实验量气的平衡介 质为蒸慵水。
水在不同温度下的饱和蒸汽压见附录二。
化学元素原子量表见附录三。
本实验 中所有的气体均按理想气体模型处理。
图14.1测定装置幟7=%(14-1)ln(S —忙如r + ln —(14-2)A€D7>搅拌子 8.三通活務 量气管 10.水准瓶1. 磁力搅拌器2. 测温元件3. 恒温水槽4. 分解瓶5. 橡皮塞6. 半乒乓球三、仪器与药品恒温磁力搅拌器一台(配控温元件和搅拌子),结晶皿1只(恒温水槽),移液管(刻度)、10〃〃移液管各2支,25ml. 50ml移液管各1支,1(XW量筒1个,250ml锥形瓶3个,50ml酸式滴泄管1支,100〃”、250m!容虽:瓶各1只,256“/量气管1支,水准瓶1只,秒表一块,1/10刻度水银温度汁一支,放大镜一付,乒乓球一只,银子一把, 洗耳球一只,洗瓶一只,铁架台3付,铁夹4付,铁圈1付,蝴蝶夹一付,乳胶管2根,烧杯滴管回形针若干。
4% H2O2水溶液,0.1 ~ 0.2mol • dm^KI水溶液,0.02mol - dm~3KMnO A标准液,3mol cbn~- H2SO4水溶\0%MnSO4水溶液(苣滴瓶内,公用)。
四、实验步骤实验装置如图所示(14.1)。
1、按照装置图连接各部分。
自水准瓶装入适量的蒸馆水。
将三通活塞旋转至A状态,水准瓶降至最低位置,检查系统的气密性。
2、在恒温槽中放入适戢水和一只回形针(搅拌水浴用)。
调盯恒温水浴的温度髙于室温3^5°C 并恒泄之。
3、在洁净干燥的分解瓶中注入15O〃”H0和10加0.1 ~ 0.2niol dnr3KI水溶液,放入搅拌子。
4、小心地将半个乒乓球放入分解瓶中并漂浮在此液而上,在球中注入10皿?4%円2。
2水溶液,注意避免H2O2与KZ提前混合。
5、分解瓶置于恒温水浴中。
塞紧橡皮塞,再次检查系统的气密性。
三通活塞旋转至B状态,使系统通大气,调节水准瓶位苣,记录量气管的起始液面刻度匕。
6、旋转三通活塞至A状态,开启磁力搅拌,使半乒乓球中的与“混合,立即开始计时。
在反应过程中,不断移动水准瓶,使水位与量气管中的液而齐平,记录反应时间f 和反应体积F的数值,直至释放岀的气体体积超过理论值的70%或反应时间超过60分钟。
7、参考附录一的方法,自行设计实验方案,测泄所用的4%HO水溶液中的初始浓度。
要求测左两次,结果取平均值。
8、记录室温、大气压、恒温温度等常规实脸数据。
淸理实验仪器和实验台而。
五、数据记录与处理1、H2O2分解实验数据记录室温:测量前几= ________ ,测量后7= _________ ,平均室温『= ________实验温度:测量前兀= _______ ,测量后T = _______ ,平均温度沪= ________大气压强:测量前乩= ________________ ,测量后"= ________________ ,平均大气压强p= __________________K1溶液原始浓度C。
= ______________ mol - dm~3KI的反应液浓度C = _______________ mol • dm'3比。
2溶液原始浓度= _________________ mol • dm'3HQ的反应液浓度C' = mol - dm~y■ ■量气管初始读数VJmlz __________________(I)KMnO,滴左较禺。
?初始浓度的实验方案(提示:首先稀释待测溶液至合理的浓度)附录一过氧化氢含量的测定实验原理KMnO4是氧化还原滴左中最常用的氧化剂之一。
髙镭酸钾滴左法通常在酸性溶液中进行,反应时毎的氧化数由+7变到+2。
因为KMnO4溶液本身具有特殊的紫红色,极易察觉,故用它作为滴左液时,不需要另加指示剂。
HQ?是医药上的消毒剂,它在酸性溶液中很容易被KMnO4氧化而生成氧气和水,英反应如下:5H2O2 + 2MI1O4- + 6H+ = 2Mn2+ + 8H2O + 5O2在一般的工业分析中,常用KMnO4标准溶液测H2O2的含量。
试剂(1)H2SO4: 1:5 水溶液,约3.6 mol/L9(2)KM11O4:固体,AR。
(3)Na2C2O4:固体基准试剂,AR。
11(TC烘干2小时,放入干燥器冷却至室温,保存备用。
⑷H2O2: 30%水溶液分析步骤(1) 0.02 mol/L KMnO4溶液的配制和标泄用台秤称取1.7~1.8g KM11O4固体,溶在煮沸的500 mL蒸溜水中,保持微沸约1小时,静置冷却后用倾斜法倒入500 mL棕色试剂瓶中,注意不能把杯底的棕色沉淀倒进去。
标定前, 其上层的溶液用玻璃砂芯漏斗过滤。
残余溶液和沉淀则倒掉。
把试剂瓶洗净,将滤液倒回瓶内,摇匀。
精确称取0.15-0.20 g预先干燥过的Na2C2O4三份,分别置于400mL烧杯中,各加入80~90mL蒸饰水和20 mL 1:5 H2SO4使其溶解,慢慢加热直到有蒸气冒岀(约75~85。
0。
趁热用待标定的KMnCM溶液进行滴泄。
开始滴左时,速度宜慢,在第一滴KMnCh溶液滴人后,不断摇动溶液,当紫红色褪去后再滴人第二滴,在滴定过程中温度不得低于75£, 故可边加热边滴左。
待溶液中有Mn2+产生后,反应速率加快,滴泄速度也就可适当加快,但也决不可使KMnO4溶液连续流下。
接近终点时,紫红色褪去很慢,应减慢滴左速度同时充分摇匀,以防超过终点。
最后滴加半滴KMnOj溶液,在摇匀后半分钟内仍保持微红色不褪,表明己达到终点。
记下终读数并计算KMnO4溶液的浓度及相对平均偏差。
(2)过氧化氢含量的测定用移液管吸取1.00 mLH2O2样品,置于250 mL容量瓶中,加水稀释至刻度,摇匀。
吸取25.00 mL稀释液三份,分别置于三个250 mL锥形瓶中,各加1:5 H2SO45mL,滴入2 滴10% MnSO4溶液,用KMnO4标准溶液滴左至终点(半分钟内仍保持微红色不褪)。
计算未经稀释样品中H2O2的含量及相对平均偏差。
附录二不同温度下水的饱和蒸汽压18 15.477 2.0634 15.673 2.0896 15.8712.116016.071 2.1426 16.272 2.169419 16.477 2.1967 16.685 2.2245 16.894 2.2523 17.105 2.2805 17.319 2.309020 17.535 2.3378 17.753 2.3669 17.974 2.3963 18.197 2.4261 18.422 2.456121 18.650 2.4865 18.880 2.5171 19.113 2.5482 19.349 2.5796 19.587 2.611419.827 2.6434 20.070 2.6758 20.316 2.7068 20.565 2.7418 20.815 2.775123 21.068 2.8088 21342 2.8430 21.583 2.8775 21.845 2.9124 22.110 2.947824 22.377 2.9833 22.648 3.0195 22.922 3.0560 23.198 3.0928 23.476 3.129925 23.756 3.1672 24.039 3.2049 24.326 3.2432 24.617 3.2820 24.912 3.321326 25.209 3.3609 25.509 3.4009 25.812 3.4413 26.117 3.4820 26.426 3.523227 26.739 3.5649 27.055 3.6070 27.374 3.6496 27.696 3.6925 28.021 3.735828 28.349 3.7795 28.680 3.8237 29.015 3.8683 29.354 3.9135 29.697 3.959329 30.043 4.0054 30.392 4.0519 30.745 4.0990 31.102 4.1466 31.461 4.194430 31.824 4.2428 32.191 4.2918 32.561 4.3411 32.934 4.3908 33.312 4.441231 33.695 4.4923 34.082 4.5439 34471 4.5957 34.864 4.6481 35.261 4.701132 35.663 4.7547 36.068 4.8087 36.477 4.8632 36.891 4.9184 37.308 4.974033 37.729 5.0301 38.155 5.0869 38.584 5.1441 39.018 5.2020 39.457 5.260534 39.898 5.3193 40344 53787 40.796 5.4390 41.251 5.4997 41.710 5.560935 42.175 5.6229 42.644 5.6854 43.117 5.7484 43.595 5.8122 44.078 5.876636 44.563 5.9412 45.054 6.0087 45.549 6.0727 46.050 6.1395 46.556 6.206937 47.067 6.2751 47.582 6.3437 48.102 6.4130 48.627 6.4830 49.157 6.553738 49.692 6.6250 50.231 6.6969 50.774 6.7693 51.323 6.8425 51.879 6.916639 52.442 6.9917 53.009 7.0673 53.580 7.1434 54.156 7.2202 54.737 7.297640 55.324 7.3759 55.91 7.451 56.51 7.534 57.11 7.614 57.72 7.695 (2)滴左数据记录(3)用理想气体状态方程计算\0ml4%H2O2水溶液全部分解释放的氧气体积假泄量气管中的水蒸气的分压为室温下水的饱和蒸气压。