氨的基本常识
- 格式:docx
- 大小:18.64 KB
- 文档页数:3


液氨的使用与储存常识大全液氨是一种常用的化学品,在很多工业领域都有广泛的应用。
下面是关于液氨的使用和储存常识的详细介绍。
一、液氨的基本性质和用途液氨(NH3)是无色、有刺激性气味的气体,在常温下被压缩成液体形式。
液氨具有很高的蒸发热,因此常用于制冷和冷冻过程中。
同时,液氨也用作合成化学品的原料,例如硝酸、尿素等。
二、液氨的安全性1.液氨是一种高压气体,因此在使用和储存液氨时必须采取适当的防护措施,避免气体泄漏和爆炸。
2.液氨具有刺激性气味,容易引起呼吸道不适和眼睛刺激。
在接触液氨后,应立即远离并用清水冲洗受影响的区域。
3.液氨在空气中的爆炸限度为15%到28%。
因此,必须在通风条件下使用液氨,并远离火源和易燃物。
4.液氨的冷却效果很大,接触液氨可能导致组织冻伤。
在接触液氨时必须戴上适当的防护手套和护目镜。
三、液氨的使用常识1.在使用液氨之前,必须对设备进行检查,确保设备完整无损。
2.使用液氨时,应注意操作环境的通风情况,并及时清理氨气泄漏。
3.做好防护措施,穿戴适当的防护服、手套、面罩等。
4.液氨的存放容器应保持完整,有管道连接并储存于通风良好的地方。
5.液氨在储存和使用过程中应避免与氧化剂和可燃物混合,以免引发火灾或爆炸。
四、液氨的储存常识1.液氨的储存容器应是经过专门设计和检验的。
常见的液氨储存容器有钢瓶和液氨储罐。
2.液氨储存容器应放置在通风良好的区域,并远离火源和可燃物。
3.储存容器应定期检查、保养和维修,确保其安全性能。
4.液氨储罐的存储压力、温度和站内装置需要符合相关标准和规范。
5.储存液氨的场所应设有警示标识,并配备适当的泄漏监测和报警设备。
总结:液氨是一种常见的化学品,广泛应用于工业生产过程。
在使用和储存液氨时,必须注意安全性和防护措施,以防止事故发生。
只有正确使用和储存液氨,才能确保工作场所的安全。




液氨使用及管理常识1简介液氨,又称为无水氨,是一种无色液体。
氨作为一种重要的化工原料,应用广泛,为运输及储存便利,通常将气态的氨气通过加压或冷却得到液态氨。
氨易溶于水,溶于水后形成氢氧化铵的碱性溶液。
氨在20℃水中的溶解度为34%。
液氨在工业上应用广泛,而且具有腐蚀性,且容易挥发,所以其化学事故发生率相当高。
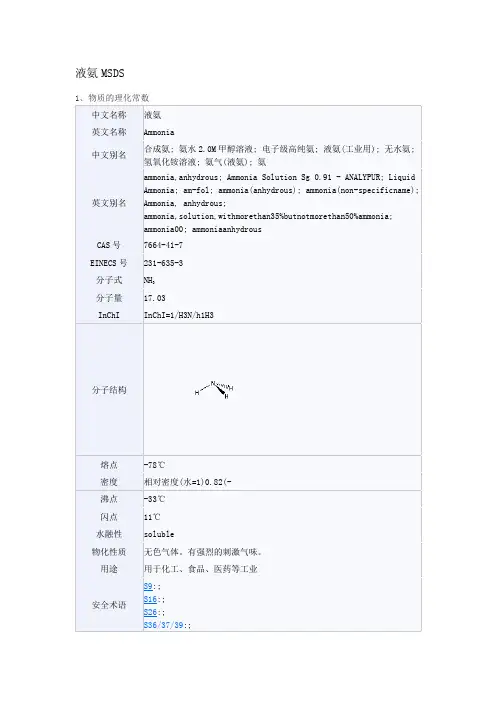
2理化性质CAS编号:7664-41-7分子式 : NH3生产方法为合成氨气经压缩制得。
液氨为无色液体,有强烈刺激性气味,极易气化为气氨。
密度0.617g/cm3;沸点为-33.5℃,低于-77.7℃可成为具有臭味的无色结晶。
气态氨相对密度(空气=1):0.59、分子量:17.04、液氨相对密度(水=1):0.7067(25℃) 、自燃点:651.11℃、熔点(℃):-77.7 、爆炸极限:16%~25%、沸点(℃):-33.4 ℃、水溶液PH值:11.7 蒸气压:882kPa(200℃) 、在常压下负33.4度以下或常温下(20度)8.46MPa氯为变为液体称液氨。
气化热很高,是一种广泛用的制冷剂。
NH3 无色的液体。
相对密度0.7710(0℃)。
熔点-77.7℃。
沸点-33.4℃。
是一种优良的溶剂。
蒸发热很大,在沸点时是每克1369.08焦(327卡)。
储于耐压钢瓶或钢槽中。
可供制冷,制冰等用,由气态氨液化而得。
3合成氨的制取(1) 原料气制取N2:物理方法为将空气液化,蒸发分离出。
化学方法为碳在空气中燃烧,充分反应后除去制取。
H2:用水蒸气和焦炭高温反应制得(2)原料气净化,除杂后,压缩通入合成塔(3) NH3的合成:合成塔中选择适宜条件进行(4)NH3的分离:N2、H2、NH3混合气中沸点明显高于、易液化,降温冷凝后液化分离出来,N2、H2混合气可循环使用。
4产品用途液氨主要用于生产硝酸、尿素和其他化学肥料,还可用作医药和农药的原料。
在国防工业中,用于制造火箭、导弹的推进剂。
可用作有机化工产品的氨化原料,还可用作冷冻剂。

职业病危害因素常识一、氨对人体有损害:1、理化特性:氨在常温常压下为具有特殊性恶臭的无色有毒液体,比空气轻。
沸点-33.5℃,熔点-77℃,爆炸极限(V%)16%~25%。
氨在常温下稳定,但是在高温下可分解为氢和氮。
一般在一个大气压下450-500℃时分解。
如果有铁、镍催化剂存在,可在300℃分解。
2、健康危害:轻度吸入氨中毒表现有鼻炎、咽炎、喉痛、发音嘶哑、咳嗽、咯痰、痰内有血。
严重时可咯血及肺水肿,呼吸困难、咯白色或血性泡沫痰,双肺布满大、中水泡音。
患者有咽灼痛、咳嗽、咳痰或咯血、胸闷和胸骨后疼痛等。
急性氨中毒主要表现为呼吸道粘膜刺激和灼伤。
痰中带血丝,轻度发绀,眼结膜充血明显,喉水肿,肺部有干湿性哕音。
高浓度蒸气对眼睛有强刺激性,可引起疼痛和烧伤,导致明显的炎症并可能发生水肿、上皮组织破坏、角膜混浊和虹膜发炎。
轻度病例一般会缓解,严重病例可能会长期持续,并发生持续性水肿、疤痕、永久性混浊、眼睛膨出、白内障、眼睑和眼球粘连及失明等并发症。
多次或持续接触氨会导致结膜炎。
3、应急处理:一旦泄露,须立即撤退区域内所有人员。
并向上风向转移,防止吸入蒸气,防止接触液体或气体。
应急处臵人员应佩戴自给正压式呼吸器。
禁止进入氨气可能汇集的局限空间,并加强通风。
只能在保证安全的情况下堵漏。
泄漏的容器应转移到安全地带,并且仅在确保安全的情况下才能打开阀门泄压。
可用砂土、蛭石等惰性吸收材料收集和吸附泄漏物。
收集的泄漏物应放在贴有相应标签的密闭容器中,以便废弃处理。
抢救氨中毒者,应立即移离现场,抬至空气新鲜处,解开领扣使其呼吸畅通,注意保暖。
然后联系防护站前来救援。
有缺氧现象时,给予吸氧,但对长时间吸入氨气的中毒者,抢救时不能作压迫式人工呼吸,极易导致肺部损伤。
4、急救措施:如果患者只是单纯接触氨气,并且没有皮肤和眼的刺激症状,则不需要清除污染。
假如接触的是液氨,并且衣服已被污染,应将衣服脱下并放入双层塑料袋内。
如果眼睛接触或眼睛有刺激感,应用大量清水或生理盐水冲洗20min以上。

液氨使用及管理常识1简介液氨,又称为无水氨,是一种无色液体。
氨作为一种重要的化工原料,应用广泛,为运输及储存便利,通常将气态的氨气通过加压或冷却得到液态氨。
氨易溶于水,溶于水后形成氢氧化铵的碱性溶液。
氨在20℃水中的溶解度为34%。
液氨在工业上应用广泛,而且具有腐蚀性,且容易挥发,所以其化学事故发生率相当高。
2理化性质CAS编号:7664-41-7分子式 : NH3生产方法为合成氨气经压缩制得。
液氨为无色液体,有强烈刺激性气味,极易气化为气氨。
密度0.617g/cm3;沸点为-33.5℃,低于-77.7℃可成为具有臭味的无色结晶。
气态氨相对密度(空气=1):0.59、分子量:17.04、液氨相对密度(水=1):0.7067(25℃) 、自燃点:651.11℃、熔点(℃):-77.7 、爆炸极限:16%~25%、沸点(℃):-33.4 ℃、水溶液PH值:11.7 蒸气压:882kPa(200℃) 、在常压下负33.4度以下或常温下(20度)8.46MPa氯为变为液体称液氨。
气化热很高,是一种广泛用的制冷剂。
NH3 无色的液体。
相对密度0.7710(0℃)。
熔点-77.7℃。
沸点-33.4℃。
是一种优良的溶剂。
蒸发热很大,在沸点时是每克1369.08焦(327卡)。
储于耐压钢瓶或钢槽中。
可供制冷,制冰等用,由气态氨液化而得。
3合成氨的制取(1) 原料气制取N2:物理方法为将空气液化,蒸发分离出。
化学方法为碳在空气中燃烧,充分反应后除去制取。
H2:用水蒸气和焦炭高温反应制得(2)原料气净化,除杂后,压缩通入合成塔(3) NH3的合成:合成塔中选择适宜条件进行(4)NH3的分离:N2、H2、NH3混合气中沸点明显高于、易液化,降温冷凝后液化分离出来,N2、H2混合气可循环使用。
4产品用途液氨主要用于生产硝酸、尿素和其他化学肥料,还可用作医药和农药的原料。
在国防工业中,用于制造火箭、导弹的推进剂。
可用作有机化工产品的氨化原料,还可用作冷冻剂。

高二化学氨的合成试题1. 合成氨时既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是( ) ①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合气中分离出NH 3 ⑥补充N 2或H 2 ⑦加催化剂 ⑧减小N 2或H 2的量 A .③④⑤⑦ B .②④⑥ C .②⑥ D .②③⑥⑦【答案】C【解析】合成氨是体积减小的、放热的可逆反应,所以既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是增大压强和反应物的浓度,答案选C 。
【考点】考查外界条件对反应速率、平衡状态的影响点评:该题是基础性试题的考查,难度不大,学生不难得分。
该题有利于培养学生分析问题、解决问题的能力,特别是灵活应用勒沙特列原理的能力。
2. 下面四个选项是四位同学在学习过化学反应速率理论和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是( )A .化学反应速率理论可指导怎样在一定时间内快出产品B .化学平衡理论可指导怎样使用有限原料多出产品C .化学反应速率理论可指导怎样提高原料的转化率D .正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益【答案】C【解析】化学反应速率理论可指导怎样在一定时间内快出产品,而化学平衡理论可指导怎样使用有限原料多出产品,因此选项C 不正确,其余选项都是正确的,答案选C 。
【考点】考查化学反应速率和化学平衡状态的判断点评:该题是常识性知识的考查,属于化学知识指导实际生产的代表,有利于培养学生的学习兴趣,调动学生的学习积极性。
3. 合成氨工业采用铁触媒作催化剂,这是因为( ) A .能提高H 2的转化率B .能提高平衡时NH 3的百分含量C .能提高N 2的利用率D .能加快反应速率【答案】D【解析】催化剂能够同等程度增大正逆反应速率,所以不能影响平衡状态,答案选D 。
【考点】考查催化剂对反应速率和平衡状态的影响点评:该题是基础性试题的考查,试题注重考查学生的基础,以及灵活应变能力,有利于提高学生的学习效率。

氨气安全常识氨气,无机化合物,常温下为气体,无色有刺激性恶臭的气味,易溶于水,氨溶于水时,氨分子跟水分子通过*氢键结合成一水合氨(NH3•H2O),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。
氨与酸作用得可到铵盐,氨气主要用作致冷剂及制取铵盐和氮肥。
氨对接触的皮肤组织都有腐蚀和刺激作用,可以吸收皮肤组织中的水分,使组织蛋白变性,并使组织脂肪皂化,破坏细胞膜结构。
氨的溶解度极高,所以主要对动物或人体的上呼吸道有刺激和腐蚀作用,常被吸附在皮肤粘膜和眼结膜上,从而产生刺激和炎症。
可麻痹呼吸道纤毛和损害粘膜上皮组织,使病原微生物易于侵入,减弱人体对疾病的抵抗力。
氨通常以气体形式吸入人体,氨被吸入肺后容易通过肺泡进入血液,与血红蛋白结合,破坏运氧功能。
进入肺泡内的氨,少部分为二氧化碳所中和,余下被吸收至血液,少量的氨可随汗液、尿液或呼吸排出体外。
氨对人体的作用,是对眼和呼吸道粘膜有刺激作用,低浓度时主要是刺激症状:异味、眼痒、眼干、打喷嚏、咽喉干燥、流鼻涕等,高浓度时可产生炎症。
对于呼吸系统有病的人要更加注意。
短期内吸入大量氨气后可出现流泪、咽痛、声音嘶哑、咳嗽、痰带血丝、胸闷、呼吸困难,可伴有头晕、头痛、恶心、呕吐、乏力等,严重者可发生肺水肿、成人呼吸窘迫综合症,同时可能发生呼吸道刺激症状。
若吸入的氨气过多,导致血液中氨浓度过高,就会通过三叉神经末梢的反射作用而引起心脏的停搏和呼吸停止,危及生命。
一般室内空气中氨气主要来自建筑施工中使用的混泥土添加剂。
添加剂中含有大量氨内物质,在墙体中随着温度、湿度等环境因素的变化而还原成氨气释放出来。
预防:1.加强安全教育,健全操作规程,定期检查生产设备,防止跑、冒、滴漏加强通风。
2.更应注意运输过程中的安全和个人防护等。
3.把好就业前体检关,凡有气管和心肺疾病不宜从事此类作业。
氨气泄漏自救措施;1、迅速撤离泄漏污染区人员至上风处,并立即进行隔离150米,严格限制出入,切断火源。
液氨使用及管理常识培训试题
1. 请简要介绍液氨的物理性质和化学性质。
2. 液氨的主要用途是什么?请列举至少三个应用领域。
3. 液氨在工业生产中的安全风险是什么?如何避免液氨泄漏和事故发生?
4. 对于液氨的储存和运输,有哪些特殊的要求和注意事项?
5. 在液氨使用过程中,应该采取哪些个人防护措施?请列举至少三种。
6. 如果发现液氨泄漏或意外事故,应该立即采取哪些紧急处理措施?
7. 液氨的处理和处置应该符合哪些环保和安全标准?请简要描述。
8. 在液氨使用过程中,应该如何正确操作和管理液氨的设备和
工具?
9. 液氨使用和管理过程中,应该建立哪些应急预案和安全管理制度?
10. 最后,液氨的使用和管理需要遵守哪些相关法律法规和标准?请简要介绍。
以上问题涵盖了液氨使用及管理的常识培训内容,可以帮助员工全面了解液氨的安全使用和管理要求。
氨理化性质和应急知识一、氨(气、液)的主要理化性质和有关常识1、氨的理化性质:氨(NH3)为无色,强碱性,极易挥发的气体,具有强烈的催泪性和刺激性,并伴有特殊的臭味。
比重为0.597,沸点-33.5℃,闪点:可燃气体<0℃,氨极易溶于水、乙醇、乙醚,在0℃时,1升水能溶1176升氨气,即90.7克的氨。
氨在空气中易变成碳酸铵,在氧气中易燃烧,火焰呈绿色。
与空气混合到一定比例时,遇明火、高热能引起燃烧爆炸,爆炸极限为15.7~27.4%,与氟、氯等能发生剧烈的化学反应,人对氨的嗅觉阀为0.5~1mg/m3。
2、氨中毒方式及症状。
氨主要是经呼吸道和皮肤粘膜侵入人体。
氨中毒根据症状的轻重可分为轻度、中度和重度中毒三型。
轻度中毒:眼和上呼吸道刺激症状,流泪、咽痛、声音嘶哑、咳嗽、乏力、肺部有干性罗音。
并可致角膜、皮肤灼伤。
中度中毒:咳嗽加剧、呼吸困难、肺部有干湿罗音,轻度紫绀,眼结膜及咽喉充血或水肿,化学性肺炎等。
重度中毒:咳嗽有粉红色泡沫痰、气急、心悸、胸闷、肺部干湿罗音。
常伴有烦躁、恶心、呕吐和窒息、昏迷。
肺水肿或有呼吸窘迫综合症,溅入眼内可致晶体浑浊,角膜穿孔甚至失明。
工业卫生允许浓度为30mg/m33、预防措施①生产或使用过程中应采取密闭装置,局部再装排风装置,加强工作场所通风。
②制定检修制度,合理编制检修周期,注意阀门和管道的泄漏。
③加强个人防护,接触氨时,必须戴防毒面具。
④用30%硫酸锌溶液浸过的沙布口罩,可有效地防止氨侵入。
4、急救与治疗4.1氨主要作用于呼吸系统,对粘膜有刺激和腐蚀作用。
低浓度时可使眼结膜、鼻咽部、呼吸道粘膜充血、水肿等。
高浓度时损伤肺泡毛细血管壁,引起肺水肿。
同时支气管、毛细支气管亦充血、水肿、痉挛。
严重的可引起成人呼吸窘迫综合症,也可通过神经反射引起心跳呼吸骤停。
皮肤、眼睛接触浓氨可引起灼伤。
4.2迅速将中毒者转移到空气新鲜的地方,去除领带、解开领扣、裤带,保持呼吸道通畅。
氨高中化学教案一、知识目标:1. 了解氨的物理性质和化学性质。
2. 掌握氨的制备方法及其反应机理。
3. 学会应用氨的性质及制备方法解决相关问题。
二、能力目标:1. 能够描述氨气的颜色、气味和溶解性等物理性质。
2. 能够描述氨气的与酸碱指示剂的反应,了解氨的碱性。
3. 能够根据氨的制备方法解答与氨相关的问题。
三、教学重点与难点:1. 教学重点:氨的物理性质、化学性质及制备方法。
2. 教学难点:氨的与酸碱指示剂的反应机理。
四、教学过程:1. 氨的物理性质:-让学生观察氨气在室温下的状态,包括颜色、气味和溶解性等。
-引导学生理解氨气的颜色为无色,气味为刺激性气味,易溶于水。
2. 氨的化学性质:-介绍氨气与酸碱指示剂的反应,观察溶液颜色的变化。
-解释氨气的碱性,引导学生理解碱性与酸碱指示剂的颜色变化之间的关系。
3. 氨的制备方法:-介绍氨的工业制备方法和实验室制备方法,包括氨的合成反应方程式和实验操作步骤。
-引导学生思考氨的制备方法与氨的应用之间的关系。
五、课堂练习:1. 请描述氨气的颜色、气味和溶解性等物理性质。
2. 氨气与酸碱指示剂的反应结果是什么?请解释其原因。
3. 环境中氨的主要来源是什么?如何利用氨的制备方法来进行环境治理?六、作业布置:1. 完成相关课后习题。
2. 思考氨的制备方法与应用之间的关系,并撰写一篇小论文。
七、教学反思:通过本节课的教学,学生应该能够全面了解氨的性质与制备方法,并能够灵活运用所学知识解决相关问题。
同时,教师也应及时总结教学过程中的不足,不断优化教学方法,提高教学效果。
化学实验安全常识一、化学实验基本安全常识良好的安全意识是杜绝安全隐患,保障人身和财产安全的关键。
进入实验室之前,应牢记以下实验室的安全注意事项:1.熟悉实验室内安全设施及水、电、气开关的位置。
2.熟悉防护眼镜、紧急喷淋器和洗眼器的位置和使用方法。
3.熟悉待做实验的注意事项,了解所用化学品的性质。
4.熟悉着火、爆炸、触电、烧伤、危险化学品中毒等事故应急处理方法和自救知识。
5.爱护实验设施和公共物品,保持环境卫生。
二、化学品安全(一)化学品保存实验室须建立化学品台账,及时更新库存并清理废旧试剂。
化学试剂储存场所宜阴凉、通风、干燥,远离火源和热源。
化学试剂可少量储存备用,禁止大量堆放。
危险化学品不应放在高处,避免取用时坠落发生意外。
所有化学品和配制试剂都应贴有明显标签,杜绝标签缺失、新旧标签共存、标签信息不全或不清等混乱现象。
配制的试剂、反应产物等应有名称、浓度或纯度、责任人、日期等信息。
1.危险化学品的存放要求(1)易挥发药品:远离热源火源,于避光阴凉处保存,通风良好,不能装满。
这类药品多属一级易燃物、有毒液体。
对这类药品贮存要特别注意,最好保存在防爆冰箱内。
(2)腐蚀性液体:腐蚀品应放在防腐蚀试剂柜的下层;或下垫防腐蚀托盘,置于普通试剂柜的下层。
(3)发生有毒气体或烟雾的药品:存放在通风橱中。
(4)剧毒化学品:只能存放在学校的剧毒化学品库中,实行“ 双人保管、双人领取、双人使用、双人双锁保管,双本账”的五双制度。
(5)致癌药品:有致癌药品的明显标志,上锁,并做好相关使用记录。
(6)特别保存的物品:金属钠、钾等碱金属,贮於煤油中。
黄磷,贮於水中。
上述两种药物,很易混淆,要隔离贮存。
苦味酸,湿保存,要时常检查是否放干了。
镁、铝(粉末或条片),避潮保存,以免积聚易燃易炸氢气。
吸潮物、易水解物,贮於干燥处,封口应严密。
易氧化易分解物,存於阴凉暗处,用棕色瓶或瓶外包黑纸盛装。
但双氧水不要用棕色瓶(有铁质促使分解)装,最好用塑胶瓶装外包黑纸。
氨基柱使用及维护常识2007年7月2日评论发表评论氨基柱是同时可以用于正相条件和反相条件的这一点很多用户都已经知道;但是要注意到的是:正相溶剂和反相溶剂往往是不互溶的,对这一点的忽略可能会带给使用者一些麻烦。
对于新购买到的柱子,首先请注意打开分析测试说明书,了解柱子的保存溶剂。
如果保存溶剂与你将要使用的流动相极性不同不会互溶,请先用异丙醇过渡。
过渡过程中注意因异丙醇粘度较大,会导致柱压很高,适当调低流速即可。
如果要使用的流动相中还含有缓冲盐类,建议在用分析流动相之前,先用不含缓冲盐的同比例流动相过渡,这样可避免缓冲盐在分析柱内的析出。
柱效检测:我用于判断一个用户是否有经验的指标之一,是用户是否习惯配制一些柱效检测标准溶液。
说到柱效检测,我可以向大家提供一个方法,而且很通用,你也可以用同样的标准溶液和流动相来检测硅胶柱和氰基柱。
流动相:10%乙酸乙酯+90%正己烷流速1.0标准溶液:乙苯(如乙苯找不动就用甲苯代替呗)+苯甲酸甲酯检测波长254nm这个方法特别适用于新购柱子(新购柱子往往保存在正相溶剂中)时即进行检测,如有问题,可及时与供应商沟通。
也适合在柱子在准备放置相当长一段时间之前进行充分清洗后进行检测作为记录留档。
在平常的使用过程中,如果分析物是固定重复的,我们当然可以从对分析物的分离分析情况来作出判断;但如果分析物和分析条件不同时,定期检测柱效可以避免柱效下降导致分离不佳再分析查找原因这样浪费人力物力的过程。
不过特别要注意的是,当氨基柱(或氰基柱)在反相条件中使用时,如用该条件检测,请注意流动相的换相过渡问题。
氨基柱的使用:需要注意的是,氨基柱的键合官能团氨丙基要比C18,C8柱的键合官能团C18,C8要容易水解,所以首先要做好其使用寿命稍逊的心理准备,特别是当你的使用条件是反相条件下时。
氨的基本常识
氨的基本常识液氨,又称为无水氨,是一种无色液体。
氨作为一种重要的化工原料,应用广泛,为运输及储存便利,通常将气态的氨气通过加压或冷却得到液态氨。
氨易溶于水,溶于水后形成氢氧化铵的碱性溶液。
氨在20℃水中的溶解度为34%。
液氨在工业上应用广泛,而且具有腐蚀性,且容易挥发,所以其化学事故发生率相当高。
为了促进对液氨危害和处置措施的了解,本文特介绍液氨的理化特性、中毒处置、泄漏处置和燃烧爆炸处置4个方面的基础知识。
一、氨的理化性质分子式:NH3 分子量:17.04 自燃点:651.11℃爆炸极限:16%~25% 二、接触途径及中毒症状1.吸入吸入是接触的主要途径。
氨的刺激性是可靠的有害浓度报警信号。
但由于嗅觉疲劳,长期接触后对低浓度的氨会难以察觉。
(1)轻度吸入氨中毒表现有鼻炎、咽炎、气管炎、支气管炎。
患者有咽灼痛、咳嗽、咳痰或咯血、胸闷和胸骨后疼痛等。
(2)急性吸入氨中毒的发生多由意外事故如管道破裂、阀门爆裂等造成。
急性氨中毒主要表现为呼吸道粘膜刺激和灼伤。
其症状根据氨的浓度、吸入时间以及个人感受性等而轻重不同。
(3)严重吸入中毒可出现喉头水肿、声门狭窄以及呼吸道粘膜脱落,可造成气管阻塞,引起窒息。
吸入高浓度可直接影响肺毛细血管通透性而引起肺水肿。
2.皮肤和眼睛接触低浓度的氨对眼和潮湿的皮肤能迅速产生刺激作用。
潮湿的皮肤或眼睛接触高浓度的氨气能引起严重的化学烧伤。
皮肤接触可引起严重疼痛和烧伤,并能发生咖啡样着色。
被腐蚀部位呈胶状并发软,可发生深度组织破坏。
三、急救措施1.清除污染如果患者只是单纯接触氨气,并且没有皮肤和眼的刺激症状,则不需要清除污染。
假如接触的是液氨,并且衣服已被污染,应将衣服脱下并放入双层塑料袋内。
如果眼睛接触或眼睛有刺激感,应用大量清水或生理盐水冲洗20分钟以上。
如在冲洗时发生眼睑痉挛,应慢慢滴入1~2滴0.4%奥布卡因,继续充分冲洗。
如患者戴有隐形眼镜,又容易取下并且不会损伤眼睛的话,应取下隐形眼镜。
应对接触的皮肤和头发用大量清水冲洗15分钟以上。
冲洗皮肤和头发时要注意保护眼睛。
四、泄漏处置1.少量泄漏撤退区域内所有人员。
防止吸入蒸气,防止接触液体或气体。
处置人员应使用呼吸器。
禁止进入氨气可能汇集的局限空间,并加强通风。
只能在保证安全的情况下堵漏。
泄漏的容器应转移到安全地带,并且仅在确保安全的情况下才能打开阀门泄压。
可用砂土、蛭石等惰性吸收材料收集和吸附泄漏物。
收集的泄漏物应放在贴有相应标签的密闭容器中,以便废弃处理。
2.大量泄漏疏散场所内所有未防护人员,并向上风向转移。
泄漏处置人员应穿全身防护服,戴呼吸设备。
消除附近火源。
向当地政府和“119”及当地环保部门、公安交警部门报警,报警内容应包括:事故单位;事故发生的时间、地点、化学品名称和泄漏量、危险程度;有无人员伤亡以及报警人姓名、电话。
禁止接触或跨越泄漏的液氨,防止泄漏物进入阴沟和排水道,增强通风。
场所内禁止吸烟和明火。
在保证安全的情况下,要堵漏或翻转泄漏的容器以避免液氨漏出。
要喷雾状水,
以抑制蒸气或改变蒸气云的流向,但禁止用水直接冲击泄漏的液氨或泄漏源。
防止泄漏物进入水体、下水道、地下室或密闭性空间。
禁止进入氨气可能汇集的受限空间。
清洗以后,在储存和再使用前要将所有的保护性服装和设备洗消。