质粒的小量提取(碱裂解法)
- 格式:doc
- 大小:12.50 KB
- 文档页数:1



碱裂解法抽提质粒原理碱裂解法从大肠杆菌制备质粒是分子生物学研究的常规技术,以下碱裂解法制备质粒的原理。
碱法质粒抽提用到三种溶液,溶液I:50 mM葡萄糖、25 mM Tris-Cl 、10 mM EDTA,pH 8.0;溶液II:0.2 N NaOH、1% SDS;溶液III :3 M 醋酸钾、2 M 醋酸。
1、溶液I的作用对于任何生物化学反应,首先要控制好溶液的pH,因此选用适当浓度和适当pH值的Tris-Cl溶液。
加入的葡萄糖可以使悬浮后的大肠杆菌不会快速沉积到管子底部。
EDTA是Ca2+和Mg2+等二价金属离子的螯合剂,可以抑制DNase的活性和微生物生长。
此步骤菌体一定要悬浮均匀,不能有结块,否则会降低抽提得率。
2、溶液II的作用NaOH是最佳的溶解细胞的试剂,不管是大肠杆菌还是哺乳动物细胞,碰到了碱后几乎在瞬间就会溶解,这是由于细胞膜发生了从bilayer (双层膜)结构向micelle(微囊)结构的相变化所导致。
SDS也呈碱性,但如果只用SDS,达不到彻底溶解细胞的作用,加入SDS主要为下一步做铺垫。
这一步操作要注意两点:第一,时间不能过长,因为在这样的碱性条件下基因组DNA片断会慢慢断裂;第二,必须温柔混合,不然基因组DNA也会断裂。
3、溶液III的作用SDS在高盐浓度下发生沉淀,同时SDS能与蛋白质结合,平均两个氨基酸上结合一个SDS分子,所以沉淀也将溶液中的大部分蛋白质沉淀下来。
溶液中的K+置换了SDS中的Na+而形成了不溶性的PDS,高浓度的盐使沉淀更完全。
同时,由于基因组DNA很长,容易被PDS共沉淀。
2 M的醋酸可以中和NaOH,因为长时间的碱性条件会打断DNA。
基因组DNA一旦发生断裂,小于100 kb的片断,就不容易与PDS共沉淀。
所以碱处理的时间要短,而且不得激烈振荡,否则最后得到的质粒上会有大量的基因组DNA污染。
这一步操作混合均匀后在冰上放置,可以使PDS沉淀更充分。

碱裂法小规模提取质粒DNA及琼脂糖凝胶电泳一.实验原理碱裂解抽提质粒DNA是基于染色体DNA与质粒DNA的变性和复性的差异而达到分离目的。
在碱性条件下,线性大分子细菌染色体DNA的氢键断裂,双螺旋结构互补链变性解开。
质粒DNA的大部分氢键也断裂,但超螺旋共价闭合环状结构的两条互补链不会完全分离。
当用pH4.8的NaAc高盐缓冲液调其pH值至中性,变性的质粒DNA又恢复到原来的构型,保存在溶液中为可溶状态。
而染色体DNA不能复性,形成缠连的网状结构。
通过离心将细胞碎片,染色体DNA与不稳定的大分子RNA,蛋白质-SDS复合物等一起沉淀下来被除去,质粒DNA及部分RNA,蛋白质则存在于上清中,再用RNaseA 处理,酚/氯仿抽提和乙醇沉淀而获得质粒DNA。
质粒(plasmid)通常指细菌中独立于染色体外,能自主复制的遗传因子,它能够稳定地遗传某些性状。
天然的质粒都是环状双链DNA,大小从5kb到400kb不等。
质粒虽然独立于染色体外自主复制和遗传,但其复制又依赖于宿主编码的酶和蛋白质复制因子。
质粒按照其稳定拷贝数的多少可分为严谨型和松弛型,严谨型质粒在每个细菌细胞中有1~5拷贝,松弛型质粒在每个细菌细胞中可达10~200个,甚至更多拷贝。
1.质粒的结构:(1)抗性基因(Antibiotic resistance gene,such as Ampicillin resistance gene, Kanamycine resistance gene)ori, Origin of replication); (2)启始复制子((3)多克隆位点(MSC, Multiple cloning site or polylinker)2.细菌裂解的方法:(1)碱裂解法:0.2molNaOH+1%SDS(2)煮沸裂解法:沸水煮沸40秒(3)SDS裂解法:10%SDS,一般用于质粒大量提取。
SDS是一种阴离子表面活性剂,它既能使细菌细胞裂解,又能使一些蛋白质变性,所以SDS处理细菌细胞后,会导致细菌细胞壁的破裂,从而使质粒DNA以及基因组DNA从细胞中同时释放出来。

一SDS碱裂解法制备质粒DNA质粒DNA的提取主要分为手工提取和试剂盒提取两类,试剂盒提取根据试剂盒说明即可,而手工提取主要是参考《分子克隆实验指南》(第二版)质粒DNA的小量制备-碱裂解法。
实验操作流程如下:1.细菌细胞的收获1)将2ml含有相应抗生素的LB加入到通气良好的试管中,然后接种一单菌落,于37℃剧烈振荡培养过夜。
2)吸去培养液,使细菌沉淀尽可能干燥。
(这一步很重要,如果培养液不能彻底除去,可能会导致制备的质粒DNA不能被限制酶切开。
)2.碱裂解法1)将所得的细菌沉淀重悬于100µl用冰预冷的溶液Ⅰ中,用枪吹打再旋涡振荡。
2)加200µl新配制的溶液Ⅱ。
盖紧管口,快速颠倒离心管5次,以混合内容物。
应确保离心管的整个内表面均与溶液Ⅱ接触。
不要振荡,将离心管放置于冰上。
3)加150µl的溶液Ⅲ。
盖紧管口,反复颠倒数次之后将管置于冰上3-5 min。
4)用微量离心机于4℃以12000g离心5 min,将上清转移到另一离心管中。
5)加等体积酚∶氯仿,振荡混合有机相和无机相,用离心机于4℃以12000g 离心2 min,将上清转移到另一离心管中。
6)用2倍体积的乙醇于室温沉淀双链DNA。
振荡混合,于室温放置2 min。
7)用离心机于4℃以12000g离心5 min。
8)小心吸去上清液,将离心管倒置于一张纸巾上,以使所有液体流出。
再将附于管壁的液滴除尽。
(这一步也很重要,因为如果除尽上清液,同样会影响以后的酶切。
)9)用1ml 70%乙醇于4℃洗涤双链DNA沉淀,除尽上清,在空气中使沉淀干燥10 min,风干酒精直至无任何液体。
10)加入30µlTE,再加1µlRNase(1mg/ml) 37℃水浴15 min。
注意事项:1.手工提取的质粒DNA的量较大,但是质量稍差,较难除尽RNA和杂蛋白;试剂盒提取的质粒DNA的量相对较少,但是质量很高。
2.操作时动作不能过于剧烈,尤其是细胞破碎以后。

碱裂解法提取质粒DNA溶液 I : 50 mM Glu / 25 mM Tris-CI / 10 mM EDTA (pH 8.0);重悬菌体,供应缓冲环境。
(pH 很重要)。
葡萄糖:最大的好处只是悬浮后的大肠杆菌不会快速沉积到管子的底部,增加粘稠度,削减 摇摆时对DNA 的机械剪切力。
如缺了葡萄糖对质粒的抽提本身而言,几乎没有任何影响。
所以 说溶液I 中葡萄糖是可缺的。
EDTA :它是Ca2+和Mg2+等二价金属离子的螯合剂,在分子生物学试剂中的主要作用是抑制 DNase 的活性和抑制微生物生长。
在溶液1中加入高达10 mM 的EDTA,就是要把E.coli 细胞中 的全部二价金属离子都螯合掉。
若不加EDTA,只要是在短时间里完成质粒抽提,也不怕DNA 会快速被降解,由于最终溶解质粒的TE 缓冲液中有EDTA 。
假如哪天你手上正好缺了溶液I,只要用等体积的水,或LB 培育基来悬浮菌体就可以了。
留 意菌体肯定要悬浮匀称,不能有结块。
NaOH :用新奇的NaOH,是为了保证NaOH 没有汲取空气中的CO2而减弱了碱性。
裂解细 胞的主要是碱,而不是SDS,所以才叫碱法抽提。
NaOH 是最佳的溶解细胞的试剂,不管是大肠 杆菌还是哺乳动物细胞,遇到了碱都会几乎在瞬间就溶解,这是由于细胞膜发生了从bilayer (双 层膜)结构向micelle (微囊)结构的相变化所导致。
用了不新奇的NaOH,即便有SDS 也无法有 效溶解大肠杆菌,自然就难高效率抽提得到质粒。
只用SDS 也能抽提得到少量质粒,由于SDS 也是弱碱。
加SDS 是为下一步操作做铺垫。
留意:一,时间不能过长,在这样的碱性条件下基因组DNA 片断会渐渐断裂;二,必需温 顺混合,不然基因组DNA 也会断裂。
溶液III : 3M KAc∕2M HAc o 加入后就会有大量的沉淀消失,与SDS 的加入有关系。
假如在溶液II 中不加SDS 时也会有很少量的沉淀,明显是盐析和酸变性沉淀出来的蛋白质。

质粒DNA的小量提取及DNA琼脂糖凝胶电泳一、前言质粒质粒是附加到细胞中的非细胞的染色体或核区DNA原有的能够自主复制的较小的DNA分子(即细胞附殖粒、又胞附殖粒)。
大部分的质粒虽然都是环状构型,它存在于许多细菌以及酵母菌等生物(多为原核生物)中,乃至于植物的线粒体等胞器中。
然而,1984年,在Streptomyces coelicoler(天蓝色链霉菌)等放线菌以及在Borrelia hermsii(赫氏蜱疏螺旋体)等原核生物中,又相继发现线形质粒。
天然质粒的DNA长度从数千碱基对至数十万碱基对都有。
质粒天然存在于这些生物里面,有时候一个细胞里面可以同时有一种乃至于数种的质粒同时存在。
质粒的套数在细胞里从单一到数千都有可能。
有时有些质粒含有某种抗药基因(如大肠杆菌中就有含有抗四环素基因的质粒)。
有一些质粒携带的基因则可以赋予细胞额外的生理代能力,乃至于在一些细菌中提高它的致病力。
一般来说,质粒的存在与否对宿主细胞生存没有决定性的作用。
它是基因工程最常见的运载体。
质粒在细胞的复制一般有两种类型:紧密控制型和松弛控制型。
前者只在细胞周期的一定阶段进行复制,当染色体不复制时,它也不能复制,通常每个细胞只含有一个或几个质粒分子,如F因子。
后者的质粒在整个细胞周期中随时可以复制,在每个细胞中有许多拷贝,一般在20个以上,如Col E1质粒。
在使用蛋白质合成抑制剂-氯霉素时,细胞蛋白质合成、染色体DNA复制和细胞分裂均受到抑制,紧密型质粒复制停止,而松弛型质粒继续复制,质粒拷贝数可由原来20多个扩增至1000-3000个,此时质粒DNA占总DNA的含量可由原来的2%增加至40-50%。
把一个有用的目的DNA片段通过重组DNA技术,送进受体细胞中去进行繁殖和表达的工具叫载体。
细菌质粒是重组DNA 技术中常用的载体。
质粒分子本身是含有复制功能的遗传结构。
质粒还带有某些遗传信息,所以会赋予宿主细胞一些遗传性状。
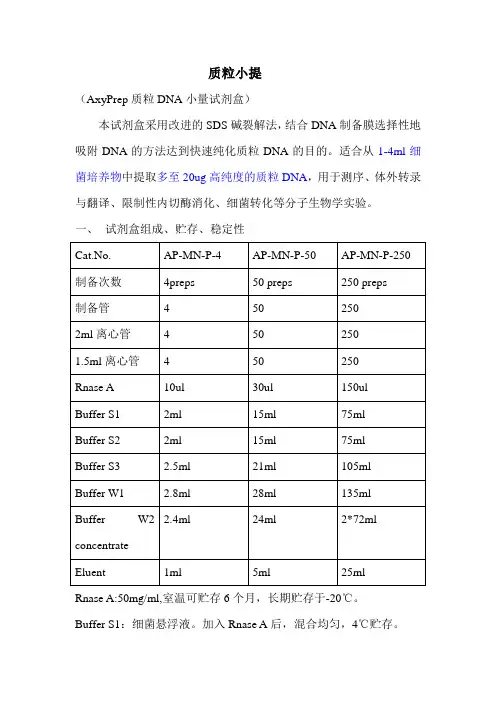
质粒小提(AxyPrep质粒DNA小量试剂盒)本试剂盒采用改进的SDS碱裂解法,结合DNA制备膜选择性地吸附DNA的方法达到快速纯化质粒DNA的目的。
适合从1-4ml细菌培养物中提取多至20ug高纯度的质粒DNA,用于测序、体外转录与翻译、限制性内切酶消化、细菌转化等分子生物学实验。
一、试剂盒组成、贮存、稳定性Rnase A:50mg/ml,室温可贮存6个月,长期贮存于-20℃。
Buffer S1:细菌悬浮液。
加入Rnase A后,混合均匀,4℃贮存。
Buffer S2:细菌裂解液(含SDS/NaOH),室温密闭贮存。
Buffer S3:中和液,室温密闭贮存。
Buffer W1:洗涤液,室温密闭贮存。
Buffer W2 concentrate:去盐液。
使用前,按试剂瓶上指定的体积加入无水乙醇(可用100%乙醇或95%乙醇)。
混合均匀,室温密闭贮存。
Eluent:洗涤液,室温密闭贮存。
二、注意事项Buffer S2、Buffer S3和Buffer W1含刺激性化合物,操作时要戴乳胶手套和眼镜,避免沾染皮肤、眼睛和衣服,谨防吸入口鼻。
若沾染皮肤、眼睛时,要立即用大量清水或生理盐水冲洗,必要时寻求医疗咨询。
三、实验准备1、第一次使用前,Rnase A全部加入Buffer S1中,4℃贮存。
2、准备无核酸和核酸酶污染的Tip头、离心管。
3、第一次使用前,Buffer W2 concentrate 中加入指定体积的无水乙醇。
4、使用前,检查Buffer S2是否出现沉淀,应于37℃温浴加热溶解并冷却至室温后再使用。
四、操作步骤1、取1-4ml在LB培养基中培养过夜的菌液(若使用丰富培养基,菌液体积应减半或更少),12000*g离心1min,弃尽上清。
2、加250ul Buffer S1悬浮细菌沉淀,悬浮需均匀,不应留有小的菌块。
*确认Buffer S1中已加入Rnase A3、加250ul Buffer S2,温和并充分的上下翻转4-6次混合均匀使菌体充分裂解,直至形成透亮的溶液。

SDS碱裂解法制备质粒DNA:小量制备(分子克隆)1.5ml LB (或添加相应抗生素)接菌,过夜培养37℃250rpm2. 离心菌体,12000rpm 30s 或8000rpm 5min3.弃上清,尽可能吸干培养液,加100μl Solution I(预冷)(+5μl RNaseA),vortex,重悬菌体4.加200μl solution II (新鲜配制),快速颠倒5次,勿振荡,室温放置≤5分钟5.加150μl solutionIII (预冷),颠倒数次,冰上放置3-5分钟6.12000rpm 15min 上清转移到新管中7.上清加等体积酚:氯仿(1:1),振荡混合,12000rpm 5min 离心,吸上清到新管,重复抽提至中间无白色8.上清加2-3倍体积无水乙醇+1/10体积NH4Ac ,混匀,冰上(或-20℃)放置15min,12000rpm离心15min9.小心倒去上清,加500μl-1ml 70%乙醇,冲洗DNA沉淀,不要将沉淀吹起,若吹起沉淀,则应重新离心10.37℃培养箱放置5-10min ,开口平放,吹干酒精11.溶于适量TE(可在TE中加RNaseA消化RNA,或于Solution I中加RNaseA过程中消化RNA)12.电泳检测附:1.LB培养基酵母粉(膏)0.5g蛋白胨 1.0gNaCl 1.0g水100mlpH7.2~7.4固体培养基加琼脂粉1.5~2.0g灭菌:121℃(0.1MPa) 20min常用抗生素浓度:Amp 母液浓度为100 mg/ml in 水工作浓度为100μg/ml(100ml LB+100μl Amp)Chl 母液浓度为20 mg/ml in 乙醇工作浓度为100μg/ml(100ml LB+500μl Chl)Kan 母液浓度为10 mg/ml in 水工作浓度为50μg/ml(100ml LB+500μl Kan)Tet 母液浓度为5 mg/ml in 水工作浓度为10μg/ml(100ml LB+200μl Tet)μμ2.TE:Tris-HCl 10mmol/LEDTA 1mmol/L (pH8.0)需灭菌取母液Tris-HCl(pH8.0)1M 1mlEDTA (pH8.0)0.5M 0.2ml加水至100ml(母液最好也灭菌)3.质粒提取solution I:50mM Glu25mM Tris-HCl(pH8.0)10mM EDTA (pH8.0)灭菌105℃4℃保存取母液:Glu 1M 10mlTris-HCl(pH8.0)1M 5mlEDTA (pH8.0)0.5M 4ml加水至200ml4.质粒提取solutionII: 0.2M NaOH --1%SDS(m/V)现用现配,室温下使用配制0.4M NaOH 2%SDS 1:1混合0.4M NaOH 100ml 取1.6g2%SDS 100ml 取2g5.质粒提取solutionIII: 4℃保存配5M KAc:取29.442g KAc 配60ml再加HAc 11.5ml水28.5ml用HCl调pH4.8 定容100ml。

一、大肠杆菌质粒DNA的提取质粒DNA的提取是从事基因工程工作中的一项基本实验技术,但提取方法有很多种,以下介绍一种最常用的方法:碱裂解法:此方法适用于小量质粒DNA的提取,提取的质粒DNA可直接用于酶切、PCR扩增、银染序列分析。
方法如下:1、接1%含质粒的大肠杆菌细胞于2ml LB培养基。
2、37℃振荡培养过夜。
3、取1.5ml菌体于Ep管,以4000rpm离心3min,弃上清液。
4、加0.lml溶液I(1%葡萄糖,50mM/L EDTA pH8.0,25mM/L Tris-HCl pH8.0)充分混合。
5、加入0.2ml溶液II(0.2 mM/L NaOH,1%SDS),轻轻翻转混匀,置于冰浴5 min 。
6、加入0.15m1预冷溶液III(5 mol/L KAc,pH4.8),轻轻翻转混匀,置于冰浴5 min 。
7、以10,000rpm离心20min,取上清液于另一新Ep管8、加入等体积的异戊醇,混匀后于?0℃静置10min。
9、再以10,000rpm离心20min,弃上清。
10、用70%乙醇0.5ml洗涤一次,抽干所有液体。
11、待沉淀干燥后,溶于0.05mlTE缓冲液中二、质粒DNA琼脂糖凝胶电泳鉴定琼脂糖是从海藻中提取出来的一种线状高聚物,应选用电泳纯的,琼脂糖此级产品筛除了抑制物和核酸酶,而且用溴化乙锭染色后荧光背景最小。
(1)琼脂糖凝胶电泳装置由于琼脂糖凝胶电泳既要求不高,而适应性又强,在过去15年里已成功地设计了形形色色及大大小小的电泳槽。
对这些装置的选择主要是依据个人的喜恶。
使用最普遍的装置是Walter Schaffner发明的水平板凝胶。
水平板凝胶通常在一块可安放于电泳槽平台的玻璃板或塑料盘上灌制。
在有些装置中,则可将凝胶直接铺在平台上。
凝胶恰好浸在缓冲液液面下进行电泳。
凝胶的电阻几乎与缓冲液的电阻相同,所以有相当一部分的电流将通过凝胶的全长。
(2)琼脂糖凝胶的制备琼脂糖凝胶的制备是将琼脂糖在所需缓冲液中熔化成清澈、透明的溶液。

质粒的小量提取(碱裂解法)材料与设备E.coli 菌株;冷冻离心机,高压灭菌锅,恒温培养箱,超净工作台试剂:试剂与配制1)质粒DNA碱裂解法试剂:溶液I:葡萄糖50 mmol/LEDTANa2 10 mmol/LTris-HCl (pH8.0)25 mmol/L溶液II:(临用时新配制)(是为了保证NaOH没有吸收空气中的CO2而减弱了碱性。
)NaOH 0.4 mol/LSDS(w/v)2%0.4mol/L NaOH 和2% SDS(w/v)对半混匀即可。
溶液III: 5 mol/L 醋酸钾60 mL冰醋酸11.5 mLDDW 28.5 mL溶液I、III都须高压灭菌。
2) 氯仿:异戊醇=24:13) 无水乙醇;70%乙醇;异丙醇4) TE(pH8.0):10 mmol/L Tris-HCl, 1 mmol/L EDTA操作步骤:(1)取菌液1.5mL, 4000 rpm离心5min,弃上清。
(2)加入预冷的100μl 溶液I。
震荡混匀。
室温放置5min。
(3)加入200μl溶液II,盖紧管口,轻轻快速颠倒离心管3-5次(不要剧烈震荡), 冰浴放置5min。
(4)加入预冷的150μl 溶液III。
温和震荡混匀,冰浴5min。
(5)12000rpm离心5min。
(6)取400ul上清至另一干净的EP离心管中,加入400μl 氯仿:异戊醇,混匀。
12000rpm 离心5min。
(7)轻轻取350ul上清至另一干净的EP离心管中,加入700μl无水乙醇充分混匀后,室温静置沉淀5~10min。
(8)12000rpm离心5min,弃上清。
(9)用500μl 70%的乙醇漂洗沉淀1次,5000rpm离心5min。
(10)沉淀物自然干燥后加入30μl 含RNAase的TE(pH8.0),以溶解质粒DNA。
(11)电泳检测实验结果。
第二课_碱裂解法小量提取质粒DNA
01 实验材料
•含适量抗生素的LB培养基
•含质粒的细菌克隆
•葡萄糖/Tris/EDTA (GTE)溶液
•NaOH/SDS溶液
•乙酸钾溶液,pH 4.8
•95%和70%乙醇
•TE缓冲液
02 实验步骤
1) 接种一个单菌落于5 ml无菌LB培养液中,在37℃
培养至饱和状态(过夜)。
2) 取1.5 ml培养液以最大转速离心20 s。
弃上清。
3)沉淀用100 μl GTE溶液彻底重悬并于室温静置5 min。
4)加入200 μl NaOH/SDS溶液,用指头敲击管壁混匀,于冰上放置5 min。
5)加入150 μl 乙酸钾溶液,在涡旋混合器上振荡2s
混匀,于冰上放置5 min。
6)离心3 min,然后吸取上清液移入干净的微量离心管中,加0.8 ml 95%乙醇,于室温静置2 min。
7)室温离心1 min,弃上清,用1 ml 70%的乙醇清洗沉淀,然后真空干燥。
8)沉淀用30 μl TE缓冲液重溶,于4℃短期保存,于-20℃或-70℃长期保存,取2.5~5 μl进行酶切分析。
如有必要,在酶切反应液中加入 1 μl 10 mg/ml RNA酶溶液(不含DNA酶)以去除污染的RNA。
质粒DNA的小量制备[摘要] 从大肠杆菌中抽提质粒dna的方法很多,可以在实验中根据不同的需要采用不同的方法,碱变性法因其抽提效果好,收得率高,因而被各实验室广泛采用。
[关键词] 质粒dna 碱裂解法快速提取(一)实验目的及原理从大肠杆菌中抽提质粒dna的方法很多,可以在实验中根据不同的需要采用不同的方法,碱变性法因其抽提效果好,收得率高,获得的dna可用于酶切、连接与转化,因而被各实验室广泛采用。
(二)试剂与器材1.器材:微量移液器、1.5ml离心管、各种移液器头、台式高速离心机、高压灭菌锅、冰块2.试剂:(1)溶液ⅰ:50mmol/l葡萄糖、10mmol/l edta,20mmol/l 25mmtris-hcl ph8.0。
(2)溶液ⅱ:0.4mol/l naoh(临用前用10mol/l naoh贮存液现用现稀解),2%sds sds(十二烷基硫酸纳)10%母液的配制。
(3)溶液ⅲ:60ml 5mol/l 醋酸钾,5ml冰醋酸,28.5ml h2o。
(4)te缓冲液:10mmol/l tris-hcl, 1mmol/l edta(ph8.0)。
(5)100%乙醇,70%乙醇。
(6)上样缓冲液(6×):0.25% 溴酚兰,40%(w/v)蔗糖水溶液或30%的甘油。
(7)5×tris-硼酸(tbe)缓冲液。
(8)5×tris-乙酸(tae)缓冲液。
3.材料:(1)含puc系列质粒的大肠杆菌;(2)琼脂糖。
(三)实验步骤1.质粒dna的小量提取。
(1)取四支1.5ml离心管,编号为1、2、3、4。
用加样枪加各个溶液。
(2)分别吸取200μl培养液加入这四个离心管中,在离心机(12 000r/min)离心10min,弃上清液,收集菌体。
(3)在1、2、3号分别加入200μl溶液ⅰ,4号加入用等量蒸馏水代替,在快速混匀器上使菌体均匀悬浮。
(4)在1、2、4号加入200μl溶液ii,在3号加入(未加naoh,只加了sds)的溶液ii轻柔颠倒混匀。
质粒的小量提取(碱裂解法)
材料与设备
E.coli 菌株;冷冻离心机,高压灭菌锅,恒温培养箱,超净工作台
试剂:
试剂与配制
1)质粒DNA碱裂解法试剂:
溶液I:葡萄糖50 mmol/L
EDTANa2 10 mmol/L
Tris-HCl (pH8.0)25 mmol/L
溶液II:(临用时新配制)(是为了保证NaOH没有吸收空气中的CO2而减弱了碱性。
)
NaOH 0.4 mol/L
SDS(w/v)2%
0.4mol/L NaOH 和2% SDS(w/v)对半混匀即可。
溶液III: 5 mol/L 醋酸钾60 mL
冰醋酸11.5 mL
DDW 28.5 mL
溶液I、III都须高压灭菌。
2) 氯仿:异戊醇=24:1
3) 无水乙醇;70%乙醇;异丙醇
4) TE(pH8.0):10 mmol/L Tris-HCl, 1 mmol/L EDTA
操作步骤:
(1)取菌液1.5mL, 4000 rpm离心5min,弃上清。
(2)加入预冷的100μl 溶液I。
震荡混匀。
室温放置5min。
(3)加入200μl溶液II,盖紧管口,轻轻快速颠倒离心管3-5次(不要剧烈震荡), 冰浴放置5min。
(4)加入预冷的150μl 溶液III。
温和震荡混匀,冰浴5min。
(5)12000rpm离心5min。
(6)取400ul上清至另一干净的EP离心管中,加入400μl 氯仿:异戊醇,混匀。
12000rpm 离心5min。
(7)轻轻取350ul上清至另一干净的EP离心管中,加入700μl无水乙醇充分混匀后,室温静置沉淀5~10min。
(8)12000rpm离心5min,弃上清。
(9)用500μl 70%的乙醇漂洗沉淀1次,5000rpm离心5min。
(10)沉淀物自然干燥后加入30μl 含RNAase的TE(pH8.0),以溶解质粒DNA。
(11)电泳检测实验结果。