华师物化实验报告材料 凝固点地测定测定
- 格式:doc
- 大小:380.00 KB
- 文档页数:12
![物化实验报告_凝固点降低法测定摩尔质量[1]](https://uimg.taocdn.com/6c753560b84ae45c3b358c77.webp)
凝固点降低法测定摩尔质量1.1实验目的1. 用凝固点降低法测定萘的摩尔质量。
2. 通过实验掌握溶液凝固点的测量技术,并加深对稀溶液艺术性之的理解。
1.2 实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,固体溶剂与溶液成平衡时的温度称为溶液的凝固点。
依数性即指定溶剂的种类和数量后,这些性质只取决于所含溶质的分子数目,而与溶质的本性无关。
它与溶液质量摩尔浓度的关系为:*×f f f f B T T T K b ∆=-=其中,f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××B f f Am T K M m ∆=即310Bff Am M K T m =∆ (*) 式中: f K ——溶剂的凝固点降低常数(单位为1-∙∙mol kg k );M ——溶质的摩尔质量(单位为1-∙mol g )。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
常用溶剂的f K 值见下表。
表1 常用溶剂的f K 值kg mol1.853 5.12 6.94于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。
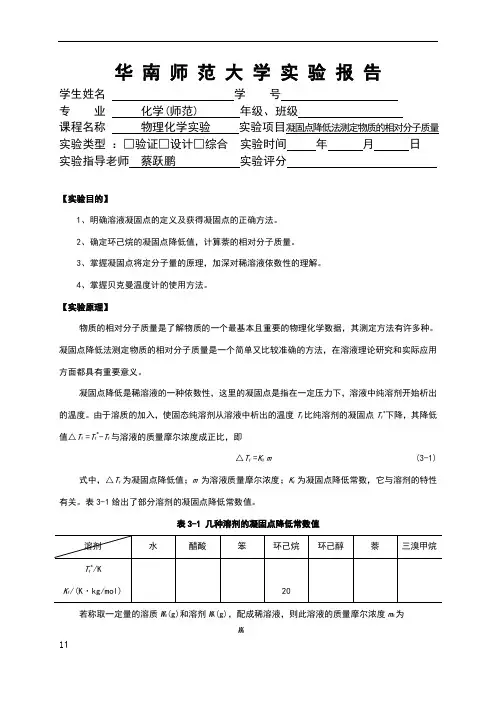
华南师范大学实验报告学生姓名学号专业化学(师范) 年级、班级课程名称物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型:□验证□设计□综合实验时间年月日实验指导老师蔡跃鹏实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T f*下降,其降低值△T f =T f*-T f与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f为凝固点降低值;m为溶液质量摩尔浓度;K f为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则此溶液的质量摩尔浓度m B为W Bm B = ×103 mol/kg (3-2)式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103 mol/kg (3-3)若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
![物化实验报告_凝固点降低法测定摩尔质量[1]](https://uimg.taocdn.com/6c753560b84ae45c3b358c77.webp)
凝固点降低法测定摩尔质量1.1实验目的1. 用凝固点降低法测定萘的摩尔质量。
2. 通过实验掌握溶液凝固点的测量技术,并加深对稀溶液艺术性之的理解。
1.2 实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,固体溶剂与溶液成平衡时的温度称为溶液的凝固点。
依数性即指定溶剂的种类和数量后,这些性质只取决于所含溶质的分子数目,而与溶质的本性无关。
它与溶液质量摩尔浓度的关系为:*×f f f f B T T T K b ∆=-=其中,f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××B f f Am T K M m ∆=即310Bff Am M K T m =∆ (*) 式中: f K ——溶剂的凝固点降低常数(单位为1-∙∙mol kg k );M ——溶质的摩尔质量(单位为1-∙mol g )。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
常用溶剂的f K 值见下表。
表1 常用溶剂的f K 值kg mol1.853 5.12 6.94于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。

物化实验报告-凝固点降低法测定摩尔质量凝固点降低法测定摩尔质量实验报告
实验时间:xxxx年xx月xx日
实验目的:
实验原理:
凝固点降低法是一种常用的定量分析方法,它的基本原理是利用当溶剂中加入指定的物质时其凝固点所发生的变化来确定物质的含量,进而来测定摩尔质量。
当溶剂中加入物质时,它们会发生氢键等因素的作用,使得其凝固点显著改变,因此根据凝固点的变化,可以计算出溶剂中物质的摩尔质量。
实验设备:
电子天平、显微镜、烧杯、数控酸碱度计、凝固点计等。
实验步骤:
1. 准备实验仪器及物质,按实验设计要求量取样品,把样品放入烧杯中,加入指定的溶剂,用电子天平微量称量。
2. 将烧杯放入适当的恒温器中,开启定温器,设定温度,将溶液恒温,然后使用凝固点计将溶液于调节好的温度下冷却,并观察其凝固点。
3. 根据实验设计要求,调整温度,重复上述步骤,直至求出实验样品的凝固点,并进行计算,求出摩尔质量。
4. 将摩尔质量与标准值进行比对,得出最终的实验结论。
实验结果:
实验结果表明,实验标准摩尔质量为xx.xx g/mol,实验样本的实验摩尔质量为
xx.xx g/mol,测量值与实验标准值吻合,结果满足要求。
本次实验采用凝固点降低法测定摩尔质量,成功地得出了实验样本的摩尔质量,实验结果与实验标准值接近,说明凝固点降低法是一种有效的测定摩尔质量的方法。

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f *下降,其降低值△T f =T f *-T f 与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为m B =×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103mol/kg (3-3) 若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是M B W AW B △T f W AK f W B将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。

华南师范大学实验报告课程名称 物理化学实验 实验项目 凝固点降低法测相对分子质量【实验目的】①测定环己烷的凝固点降低值,计算萘的分子量。
②掌握溶液凝固点的测定技术。
③技能要求:掌握冰点降低测定管、数字温差仪的使 用方法,实验数据的作图处理方法。
【实验原理】1、凝固点降低法测分子量的原理化合物的分子量是一个重要的物理化学参数。
用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。
稀溶液有依数性,凝固点降低是依数性的一种表现。
稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中物质的摩尔分数的关系式为:ΔT f = T f * - T f = K f m B (1)*式中,T f *为纯溶剂的凝固点,T f 为溶液的凝固点,m B 为溶液中溶质B 的质量摩尔浓度,K f 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。
已知某溶剂的凝固点降低常数K f,并测得溶液的凝固点降低值ΔT ,若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为:3AB BB 10W M W m ⨯=mol/kg (2)将(2)式代入(1)式,则:3Af Bf B 10W T W K M ⨯∆=g/mol (3)表1 几种溶剂的凝固点降低常数值因此,只要称得一定量的溶质(WB )和溶剂(WA )配成一稀溶液,分别测纯溶剂和稀溶液的凝固点,求得ΔT f ,再查得溶剂的凝固点降低常数,代入(3)式即可求得溶质的摩尔质量。
* 当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于强电解质稀溶液。
2、凝固点测量原理纯溶剂的凝固点是它的液相和固相共存时的平衡温度。
若将纯溶剂缓慢冷却,理论上得到它的步冷曲线如图中的 A , 但但实际的过程往往会发生过冷现象,液体的温度会下降到凝固点以下,待固体析出后会慢慢放出凝固热使体系的温度回到平衡温度,待液体全部凝固之后,温度逐渐下降,如图中的B 。

凝固点测定方法
一、测定原理:
冷却液态样品,当液体中有固体生成时,体系中固体、液体共存,两相成平衡,温度保持不变,在规定的实验条件下,观察液态样品在凝固过程中温度的变化,就可测出其凝固点。
二、测定步骤:
加样品与干燥的烧杯中,应在温度超其溶点的热浴内将其溶化,并加热至高于凝固点约10℃,插入搅拌装好温度计,使水银球距杯底15mm,勿使温度计接触杯壁,当样品冷却至高于凝固点3-5℃时开始搅拌并观察温度。
出现固体时,停止搅拌,这时温度突然上升,读取最高温度,准确至0.1℃,所得温度即为样品的凝固点。

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f *下降,其降低值△T f =T f *-T f 与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为m B = ×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103mol/kg (3-3)若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是M B W AW B △T f W AK f W B将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。

物理化学试验陈述武汉大学凝固点降低法测定摩尔质量一.试验目标1.用凝固点降低法测定某未知物的摩尔质量2.学会用步冷曲线对溶液凝固点进行校订3.经由过程本试验懂得控制凝固点降低法测定摩尔质量的道理,加深对稀溶液依数性的懂得.二.试验道理稀溶液具有依数性,凝固点降低是依数性的一种表示,它与溶液质量摩尔个中.溶液的凝固点.假如稀溶液是,则上式可写为:即(*)K·kg·mol-1)g/mol).,应用上式即可求出溶质的摩尔质量.试验中,要测量溶剂和溶液的凝固点之差.对于纯溶剂如图1(a)所示,将溶剂逐渐降低至过冷(因为新相形成须要必定的能量,故结晶其实不析出),温度降低至必定值时消失结晶,当晶体生成时,放出的热量使系统温度回升,尔后温度保持相对恒定.对于纯溶剂来说,在必定压力下,凝固点是固定不变的,直到全体液体凝固成固体后才会降低.相对恒定的温度即为凝固点.对于溶液来说,除温度外还有溶液浓度的影响.当溶液温度回升后,因为不竭析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低.是以,凝固点不是一个恒定的值.如把回升的最高点温度作为凝固点,这时因为已有溶剂晶体析出,所以溶液浓度已不是肇端浓度,而大于肇端浓度,这时的凝固点不是.要精确测量,应测出步冷曲线,按下一页图1(b)所示办法,.图1 溶剂和溶液的步冷曲线三.试验装配,仪器及操纵3.1 试验药品.仪器型号及测试装配示意图1.仪器周详数字温度计玻璃搅拌棒恒温浴槽冷阱大试管移液管(25ml)剖析天平盘算机2.药品待测药品蒸馏水3.测试装配示意图(见下图)图2 凝固点降低法测定摩尔质量试验装配示意图试验前提表2 试验前提试验温度(℃)大气压(kPa)3.3 试验操纵步调及办法要点1.按装配图将凝固点仪装配装配好.2.分层参加足量的冰块和食盐构成冰盐浴.3. 打开周详数字温度计开关.打开盘算机,打开盘算机,打开个中“凝固点”软件窗口.点击“开端画图”,盘算机即开端读取温度计读数,并且给每次读数编号.同时在左半部分温度—时光图中主动画出温度随时光变更图.4. 测定纯溶剂(水)的凝固点,用移液管取25ml蒸馏水直接浸入冰盐浴中搅拌,但须要控制温度,不要使水在管壁结成块状晶体,较渐变的办法是将凝固管从冰浴中瓜代的掏出和浸入.开端结晶时,先将凝固管外冰水擦干,然后拔出空气套管中搅拌(也可之间放入冰盐浴中进行搅拌,但须要控制冷却的温度)在温度回升至最高且保持均衡时(此时温度计读数起码15~20个点根本保持不变),点击“停滞画图”停滞试验并以excel格局保管所得到的试验数据.完成一组试验后,用手温热凝固管,使环己烷晶体全体熔解,从新置凝固管于冰浴中,如上法操纵反复进行三次.假如在测量进程中过冷现象比较轻微,可参加少量晶种,促使晶体析出,温度回升.5. 掏出大试管,用剖析天平秤取阁下(精确到)的未知物资参加到凝固管内,留意不要粘于管壁,使其消融,同上法测定溶液的凝固点着反复测定三次.试验留意事项留意留意过冷进程和搅拌速度!四.试验数据记载及画图五盘算的数据.成果①应用冷却曲线盘算溶液凝固点T f为得到精确的溶液凝固点,将溶液凝固后温度回升又降低的部分做反向延伸线,与开端的温度降低线订交,分离拔取线性程度较好的有用数据区进行线性拟合,所得到两条直线的交点即为溶液的凝固点T f.成果如下图3所示:图3步冷曲线有用数据区线性拟合成果.取开端温度降低段和再降温段进行线性拟合,所得直线的交点即为所求溶液的凝固点.依据试验测量所得到的成果,分离盘算拟合曲线的方程并联立得到溶液凝固点的温度值:组别温度降低段方程温度稳固段方程凝固点℃平均值℃纯水1 Y= 9358 -纯水2 Y=纯水3 Y=-0.0120x+1.0413待测溶液1Y= -待测溶液2Y= Y=-待测溶液3综上,用步冷曲线法得到纯水的凝固点为-℃,待测溶液的凝固点为-②依据凝固点变更盘算未知物的摩尔质量应用前述凝固点测定成果,可依据公式(*),即310Bff AmM KT m=∆盘算未知物的摩尔质量.由已知:ΔT f= T f*- T f= ℃℃℃K f= 1.84 K·kg·mol-1将以上数据代入前述盘算公式,得未知物的摩尔质量为M B= 1.84 × 1000 × 0.1000 / ()= 66.97 g/mol是以由试验测量盘算得到的未知物的摩尔质量为/mol.六试验评论辩论剖析①测定溶质凝固点的测量误差剖析:测定溶质凝固点时,对于三组数据进行误差剖析可得:平均误差:n xx ni i∑=-=1δ,可得δ = 1.7931×10-5尺度误差:,可得σ= 4.2345×10-3是以测量成果精确度可用尺度误差暗示为:T f*=-0.20164±0.00423(℃)②测定溶质(纯水)凝固点进程中产生误差的可能原因及剖析:对溶质的凝固点测量中,产生误差的可能原因如下:起首,在测定进程中的每一次测定的前提可能不合,从而导致测定成果的误差较大.例如,测准时固然我们十分留意仪器的装配,但假如大试管的管壁掉慎碰着了冷阱,很有可能导致所测定的温度不精确.同时,搅拌器的不平均或者半途产生变更可能导致溶质结晶进程中各部分的热传导率等物理化学性质不均一,从而导致测量误差.③测定未知物摩尔质量进程中的产生误差的可能原因及剖析:数据处理中的近似:在推导摩尔质量的盘算公式进程中,进行了须要的数学近似,例如以为纯溶剂的摩尔融化焓是常数,T f*×T f=(T f)2等.在一般试验前提下,这些处理固然不会对试验成果产生明显的影响,但是在测量进程较为精确时,则可能导致测量成果消失渺小的偏大.试验前提的转变:在测量溶剂和溶液的凝固点的时刻,试验前提很可能消失转变,这个中包含情形身分和工资身分的影响.比方情形温度的转变导致试验温度的转变,冷阱中轮回水的温度不稳固也可能导致试验前提的变更.测量系统的转变:在试验数据的处理进程中以为测量系统的构成没有变更,但是在现实情形中,很可能因为操纵原因转变测量系统的构成.具体而言,在参加萘的时刻可能会导致溶质环己烷有微量蒸发,或者在称取萘的进程中消失的操纵掉误.这些转变可能使得系统中m A减小或者m B增大,从而使得试验成果偏大.测定仪器的误差:测量进程中,周详温度计的数值其实不是很稳固,有时会消失摇动现象.此外,在记载进程中,数据是工资判读和记载的,所以测定的温度值可能与现实有所差别.如许会导致依据测定命据所作的步冷曲线与现实曲线有所不合,也可能导致最后测量成果的误差.④斟酌称量.移液和温度测量三项误差起源的误差盘算若Y为间接测量值,X k为直接测量值,则两者之间关系可以暗示为:Y=f(X k)称量进程的误差为2g,数字周详温度记测量误差为1℃,移液管误差为1ml,则有:从而,称量.移液和温度测量三项误差起源的误差分离为0.0014,0.0012和0.00040.由成果可知,误差的重要起源是称量和测温进程中所产生的误差.分解以上成果,得:M B=66.97×(12)=)g/mol七结论本次试验经由过程凝固点降低法测定未知物的摩尔质量,测定成果汇总如下:纯水纯溶剂凝固点:T f *=-℃.未知物溶液凝固点:T f = -℃.未知物的摩尔质量:M B =g/mol八试验思虑题①试验中所配溶液浓度,太浓或太稀都邑使试验成果产生较大的误差,为什么?在本次试验中,溶液的浓度应使得测定进程中有部分溶质凝固析出,但还有一部分残剩溶液,且其浓度应该保持在必定的值.是以,假如溶液太稀,可能在析出的时刻会完整析出,从而使得测量的凝固点温度不精确.另一方面,溶液浓度太小会使得凝固点的变更量太小,从而使试验中的误差对成果的影响很大,造成成果不精确.而假如溶液太浓,起首就会使得溶液的性质不相符稀溶液的依数性道理,使得盘算公式不实用于所测定的系统,造成较大的试验误差.②为什么会产生过冷现象?在凝固进程中,新生的固相在生成时因为其颗粒直径很小,比概况能较高,所以系统很难自觉地向能量较高的偏向进行.此时即便温度降低到相变点(凝固点)以下,相变进程也无法产生,从而导致系统的温度低于凝固点,即过冷现象(此系统成为过冷液体).在此状态下,若系统的能量升至很高或收到外界干扰(比方投入大小合适的晶核),液体即会敏捷凝固为固体,产生相变进程.③道理中盘算公式的导出作了哪些近似处理,若何断定本试验中这些假设的合理性? 答:在盘算公式的推导进程从*,21d ln d Af f l x T s m A A T H x T RT ∆=⎰⎰动身,进行了一下几项近似处理:a) 测定溶液相符稀溶液依数性,为幻想稀薄溶液(溶质分子在溶液中的活度近似等于1).b) 纯溶剂的摩尔熔解焓不随温度T 变更.c) T f *·T f =(T f )2d) 析出的第一粒固体是纯固体试验中溶剂的浓度很小,所以析出的固体可近似以为是纯固体.溶液可以近似以为是幻想稀薄溶液.因为T f 较小,其变更而导致摩尔融化热的变更可以疏忽,也是以可以近似以为T f *·T f =(T f )2.最终试验成果与理论值较吻合,解释推导进程中的这些近似是合理的.九参考文献[1]张连庆等.步冷曲线法-对凝固点降低测定摩尔质量的改良.大学化学.北京:大学化学编辑部,2006.第21卷.第二期.54~56.[2]H W Salzberg,et al. Physical chemistry[M]. New York:Macmillan Publishing Co.,1978:106-108,364-365[3]武汉大学化学与分子科学学院物理化学试验(第二版)[M]. 武汉大学出版社 2004[4]W J Popiel. Laboratory Manual of Physical Chemistry [M].London:English Universities Press LTD.,1964:71_73。

物理化学实验报告武汉大学凝固点降低法测定摩尔质量一、实验目的1. 用凝固点降低法测定某未知物的摩尔质量 2. 学会用步冷曲线对溶液凝固点进行校正3. 通过本实验了解掌握凝固点降低法测定摩尔质量的原理,加深对稀溶液依数性的理解。
二、实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f B T T T K b ∆=-=其中,f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××B f f Am T K M m ∆=即310Bff Am M K T m =∆ (*) 式中: f K ——溶剂的凝固点降低常数(单位为K·kg·mol -1)M ——溶质的摩尔质量(单位为g/mol )。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图1(a )所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
因此,凝固点不是一个恒定的值。
如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。
要精确测量,应测出步冷曲线,按下一页图1(b )所示方法,外推至f T 校正。

物化实验报告_凝固点实验报告摘要:本实验通过测量不同浓度的溶液的凝固点,探究溶液浓度对凝固点的影响。
实验结果表明,浓度越高,溶液的凝固点越低,呈现出反比关系。
通过实验数据的分析,还得出了K2SO4的凝固点与浓度的线性关系。
引言:凝固点是指溶液经过降温或者蒸发后凝固的温度,是物质纯度的一个重要指标。
溶液的凝固点随溶质浓度的改变而改变,这是因为溶质浓度的增加会降低溶剂的活动性,导致溶液的凝固点降低。
本实验旨在通过测量不同浓度的溶液的凝固点,探究溶液浓度对凝固点的影响。
实验材料与方法:材料:K2SO4粉末,蒸馏水,测温计,玻璃烧杯。
方法:1.准备不同浓度的K2SO4溶液:分别取少量K2SO4粉末与一定量的蒸馏水,在水浴加热中搅拌至完全溶解,得到一系列浓度不同的K2SO4溶液。
2.将不同浓度的溶液倒入装有温度计的玻璃烧杯中。
3.将玻璃烧杯放置在一个容器中,随着温度的降低,观察溶液的凝固点并记录。
4.重复上述步骤,得到多组数据。
实验结果与分析:通过一系列不同浓度的K2SO4溶液的测量,得到了溶液浓度与凝固点的关系数据,如下表所示:表1.不同浓度K2SO4溶液的凝固点数据浓度(摩尔/升)凝固点(℃)000.1-30.2-70.3-110.4-15根据数据可知,随着溶液浓度的增加,溶液的凝固点也降低,呈现出反比关系。
通过数据的分析,可以得出K2SO4的凝固点与浓度呈线性关系,凝固点随浓度的增加而线性变化。
结论:本实验通过测量不同浓度的溶液的凝固点,发现溶液的凝固点随溶质浓度的增加而降低。
通过实验数据的分析,得出K2SO4的凝固点与浓度呈线性关系。
这是因为溶质浓度的增加会降低溶剂的活动性,导致溶液的凝固点降低。
讨论与改进:本实验中所得的数据具有一定的误差,可能是由于实验操作中的温度测量不准确,或者溶液的混合不均匀所致。
为了提高实验的准确性,可以采用更精确的温度测量设备,或者通过增加搅拌时间来提高溶液的均匀性。
1. Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., & Walter, P. (2002). Molecular biology of the cell (Vol. 5). New York: Garland Science.2. Campbell, N. A., Reece, J. B., & Urry, L. A. (2024). Biology. Boston: Pearson.。
实验7 凝固点降低法测定摩尔质量姓名:憨家豪;学号:2012012026;班级:材23班;同组实验人员:赵晓慧 实验日期:2014-3-8;提交报告日期:2014-3-15 带实验的助教姓名:袁斌1. 引言1.1 实验目的1.用凝固点降低法测定尿素的摩尔质量。
2.学会用步冷曲线对溶液凝固点进行校正。
3.通过本实验加深对稀溶液依数性的认识。
1.2 实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:*×f f f f BT T T K b ∆=-=式中:f T ∆为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。
如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为:1000××Bf f A m T K M m ∆=即310Bff Am M K T m =∆ 式中: f K 为溶剂的凝固点降低常数(单位为K ·kg ·mol -1);M 为溶质的摩尔质量(单位为g ·mol -1)。
如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ∆,利用上式即可求出溶质的摩尔质量。
常用溶剂的f K 值见下表1。
表1 常用溶剂的f K 值实验中,要测量溶剂和溶液的凝固点之差。
对于纯溶剂如图1所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。
对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。
相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。
当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。
凝固点实验报告凝固点实验报告引言:凝固点是指物质从液态变为固态时的温度,是物质的一种特性。
通过凝固点实验可以了解物质的性质和纯度。
本次实验旨在通过测量不同物质的凝固点,探究物质的凝固性质和纯度对凝固点的影响。
实验材料和方法:实验材料:水、盐、糖、铁粉、酒精、石蜡。
实验仪器:温度计、玻璃杯、烧杯、搅拌棒。
实验方法:1. 将水、盐、糖、铁粉、酒精、石蜡分别放入不同的玻璃杯中。
2. 用温度计测量每种物质的初始温度。
3. 将每种物质加热,持续搅拌,直至完全溶解。
4. 记录每种物质的溶解温度。
5. 将溶解后的物质逐渐冷却,用温度计记录每种物质的凝固点。
实验结果:1. 水:初始温度为25℃,溶解温度为100℃,凝固点为0℃。
2. 盐:初始温度为25℃,溶解温度为100℃,凝固点为-5℃。
3. 糖:初始温度为25℃,溶解温度为120℃,凝固点为80℃。
4. 铁粉:初始温度为25℃,溶解温度为1535℃,凝固点为1535℃。
5. 酒精:初始温度为25℃,溶解温度为78℃,凝固点为-114℃。
6. 石蜡:初始温度为25℃,溶解温度为65℃,凝固点为45℃。
讨论与分析:1. 水的凝固点为0℃,符合常规认知。
水的凝固点是0℃,熔点是100℃,是许多物质中最常见的例子。
2. 盐的凝固点为-5℃,低于水的凝固点。
这是因为盐的加入降低了水的冰点,形成了冰的凝固点降低的现象。
3. 糖的凝固点为80℃,高于水的沸点。
糖的凝固点较高,说明糖分子间的相互吸引力较大,需要较高的温度才能使其形成固态。
4. 铁粉的凝固点为1535℃,远高于其他物质。
这是因为铁粉是金属,具有较高的熔点和凝固点。
5. 酒精的凝固点为-114℃,远低于其他物质。
酒精是一种挥发性液体,其分子间的相互作用力较弱,因此凝固点较低。
6. 石蜡的凝固点为45℃,较接近常温。
石蜡是一种有机化合物,具有较低的凝固点,适合用于制作蜡烛等产品。
结论:通过本次实验,我们了解了不同物质的凝固点特性。
华 南 师 大 学 实 验 报 告学生 学 号 专 业 年级、班级课程名称 实验项目 凝固点降低法测定物质的相对分子质量 实验类型 □验证 □设计 ■综合 实验时间 年 月 日 实验指导老师 实验评分一、实验目的:1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、测定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用。
二、实验原理:物质的相对分子质量是了解物质的一个最基本而且重要的物理化学数据,其测定方法有多种。
凝固点降低法成的物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要的意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度f T 比纯溶剂的凝固点*f T 下降,其降低值f f T T T -=∆*f 与溶液的质量摩尔浓度成正比,即f T ∆=m K f式中,f T ∆为凝固点降低值;m 为溶质质量摩尔浓度;f K 为凝固点降低常数,它与溶剂的特性有关。
表1 几种溶剂的凝固点降低常数值若称取一定量的溶质B W (g)和溶剂A W (g ),配成稀溶液,则此溶液的质量摩尔浓度B m 为3AB BB 10W M W m ⨯=mol/kg式中,B M 为溶质的相对分子质量。
则3Af Bf B 10W T W K M ⨯∆=g/mol若已知某溶剂的凝固点降低常数f K 值,通过实验测定此溶液的凝固点降低值f T ∆,即可计算溶质的相对分子量B M 。
通常测凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
纯溶剂步冷曲线:纯溶剂逐步冷却时,体系温度随时间均匀下降,到某一温度时有固体析出,由于结晶放出的凝固热抵消了体系降温时传递给环境的热量,因而保持固液两相平衡,当放热与散热达到平衡时,温度不再改变。
在步冷曲线上呈现出一个平台;当全部凝固后,温度又开始下降。
从理论上来讲,对于纯溶剂,只要固液两相平衡共存,同时体系温度均匀,那么每次测定的凝固点值应该不变。
但实际上由于过冷现象存在,往往每次测定值会有起伏。
当过冷现象存在时,纯溶剂的步冷曲线如图1-1(1)所示。
即先过冷后足够量的晶体产生时,大量的凝固热使体系温度回升,回升后在某一温度维持不变,此不变的温度作为纯溶剂的凝固点。
稀溶液的步冷曲线:稀溶液凝固点测定也存在上述类似现象。
没有过冷现象存在时,溶液首先均匀降温,当某一温度有溶剂开始析出时,凝固热抵消了部分体系向环境的放热,在步冷曲线上表现为一转折点,此温度即为该平衡浓度稀溶液的凝固点,随着溶剂析出,凝固点逐渐降低。
但溶液的过冷现象普遍存在。
当某一浓度的溶液逐渐冷却成过冷溶液,通过搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热抵消了体系降温时传递给环境的热量,当凝固放热与体系散热达到平衡时,温度不再回升。
此固液两相共存的平衡温度即为溶液的凝固点。
通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。
但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。
从相律看,溶剂与溶液的冷却曲线形状不同。
对纯溶剂,固-液两相共存时,自由度f=1-2+1=0,冷却曲线出现水平线段。
对溶液,固-液两相共存时,自由度f=2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段,此时应加以校正。
本实验通过测定纯溶剂与溶液的温度与冷却时间的关系数据,绘制冷却曲线,从而得到两者的凝固点之差∆T f,进而计算待测物的摩尔质量。
三、仪器与试剂:仪器:凝固点测定仪1套贝克曼温度计1支烧杯2个普通温度计(0—50℃)1支移液管(50mL)1支试剂:环己烷(AR)萘(AR)、冰四、实验步骤:1、仪器安装:连接凝固点测定仪、精密数字温度温差仪等;2、调节寒剂温度:调节寒剂温度为4℃左右。
3、溶剂凝固点的测定:仪器装置如图所示。
用移液管向清洁、干燥的凝固点管加入20mL环己烷,插入贝克曼温度计探头,不要碰壁与触底。
先将盛环己烷的凝固点管直接插入寒剂中,均匀搅拌,使环己烷的温度逐渐降低,当冷到6.6℃左右,要快速搅拌(以搅棒下端擦管底),幅度要尽可能的小,待温度回升后,恢复原来的搅拌速度,同时观察贝克曼温度计读数,直到温度回升稳定为止,此温度即为水的近似凝固点。
同时每隔15秒记录一个温度读数。
取出凝固点管,用手捂住管壁片刻,同时不断搅拌,使管中固体全部熔化,将凝固点管放在空气套管中,缓慢搅拌,使温度逐渐降低,当温度降至近似凝固点时,自支管加入少量晶种,并快速搅拌(在液体上部),待温度回升后,再改为缓慢搅拌。
直到温度回升到稳定为止,记下稳定的温度值,重复测定二次,每次之差不超过0.006℃,二次平均值作为环己烷的凝固点。
4、溶液凝固点的测定:取出凝固点管,如前将管中冰溶化,用分析天平精确称重0.1722 g萘,加入凝固点管中,待全部溶解后,测定溶液的凝固点。
测定方法与环己烷的相同,先测近似的凝固点,再精确测定,但溶液凝固点是取回升后所达到的最高温度。
重复二次,取平均值。
五、实验数据与处理:数据记录:室温:22.8℃大气压:101.810kPa纯环己烷26.5ml[ρ=0.778~0.779g/mL(20℃) ] 萘0.3100g环己烷第一次环己烷第二次次数 1 2 3 4 5 6 7 8 9 10 11 12 温度/℃13.099 11.658 10.297 9.266 8.503 7.937 7.52 7.216 6.99 6.784 6.657 6.556 次数13 14 15 16 17 18 19 20 21 22 23 24 温度/℃ 6.491 6.435 6.395 6.368 6.348 6.334 6.323 6.315 6.308 6.3 6.289 6.279 次数25 26 27 28 29 30 31 32 33 34 35 36 温度/℃ 6.268 6.258 6.244 6.232环己烷第三次次数 1 2 3 4 5 6 7 8 9 10 11 12 温度/℃12.93611.84810.7889.241 8.54 7.823 7.545 7.317 7.093 6.91 6.749 6.638 次数13 14 15 16 17 18 19 20 21 22 23 24 温度/℃ 6.56 6.501 6.432 6.433 6.444 6.444 6.444 6.443 6.441 6.435 6.427环己烷+萘第一次次数 1 2 3 4 5 6 7 8 9 10 11 12 温度/℃11.1899.786 8.675 7.78 7.043 6.377 5.829 5.412 5.109 4.868 4.526 4.313 次数13 14 15 16 17 18 19 20 21 22 23 24 温度/℃ 4.168 4.03 3.927 3.851 3.794 3.75 3.71 3.669 3.639 3.606 3.576环己烷+萘第二次次数 1 2 3 4 5 6 7 8 9 10 11 12 温度/℃13.26712.08510.96710.0169.246 8.55 7.944 7.436 6.96 6.531 6.146 5.813 次数13 14 15 16 17 18 19 20 21 22 23 24 温度/℃ 5.496 5.107 4.792 4.653 4.597 4.528 4.444 4.35 4.249 4.206 4.152 4.094 次数25 26 27 28 29 30 31 32 33 34 35 36 温度/℃ 4.026 3.965 3.913 3.866 3.826 3.795环己烷+萘第三次次数 1 2 3 4 5 6 7 8 9 10 11 12 13 温度/℃13.317 13.3 12.572 11.612 10.612 9.725 9.003 8.361 7.811 7.328 6.692 6.532 6.181 次数14 15 16 17 18 19 20 21 22 23 24 25 26 温度/℃ 5.878 5.589 5.309 4.955 4.705 4.519 4.384 4.269 4.184 4.119 4.061 4.008 3.973 次数27 28 29 30 31 32 33 34 35 36 37 38 39 温度/℃ 3.941 3.915 3.89 3.865 3.841 3.818 3.798 3.778 3.756 3.734 3.714数据处理W 环己烷=0.778g/mL ×26.5mL=20.617g 由环己烷萘萘W T W K M f ∆=f 得 20.6172.2237610^33100.020M ⨯⨯⨯= = 130.86g/mol参考文献的萘的相对分子质量为:128.18g/mol 相对误差为:2.144%六、思考与讨论:1、本次实验过程很快,参考记录数据大约为每组40个左右,而本组实验进行时仅仅记录30左右数据则已趋近平衡,没有记录的意义,则每组实验仅有30个数据。
冰槽很难控制在理想的温度,在测量时会有细微跳动。
过高会导致冷却太慢,过低则测不出正确的凝固点,导致实验也产生误差,本次就因为外部冷源温度过低,温差过大,导致温度降低过快,数据记录不完整。
直接导致了最终实验数据处理时误差较大,这是本次实验误差较大的主要原因。
2、本次成败关键是控制过冷程度和搅拌速度。
理论上,在恒压条件下纯溶剂体系只要两相平衡共存就可达到平衡温度。
但实际上只有固相充分分散到液相中,也就是固液两相的接触面相当大时,平衡才能达到。
因此控制过冷程度和确定搅拌速度十分重要。
但在实验中凝固点管中的磁子无法转动,使用管搅拌时触碰到贝克曼温度计,直接对实验产生较大的影响,这也是实验误差较大的原因之一。
3、环己烷容易挥发,萘容易升华,在测定过程中环己烷+萘溶液的浓度不断变化,难以动态测准其中浓度,也给实验造成了误差。
七、思考题:1、为什么要先测近似凝固点?答:因为凝固点的确定比较困难,先测一个近似凝固点,精确测量时,在接近近似凝固点时,降温速度减慢,到凝固点时快速搅拌。