锗元素
- 格式:pdf
- 大小:96.38 KB
- 文档页数:2

Ⅱ.关于矿物1.对锗元素的理解“神秘的元素—锗”“奇迹的元素—锗”“21世纪新物质—锗”“21世纪神赠予的最后礼物”这些都是对锗元素的赞美修饰。
由此我们不难看出锗是一个多么重用的元素。
1)锗元素的由来元素周期表的创始人—俄罗斯的化学家门捷列夫在研究当时广为认知的63中元素的排列顺序的过程中,发现了依据原子量的化学元素之间的相互关系,并在1869年俄罗斯的化学会议上发布了元素周期表。
这为化学发展史树立起一个里程碑,从而建立了近代化学。
在这个元素周期表中存在着一个空缺,他预言如果以后发现新元素的话会填入空缺位置,并预测了其原子量,比重及呈显的颜色。
此后1886年德国的化学家 C.温科勒和 A.布雷哈夫博士在研究被称为硫银锗矿(Argyrodite)的矿物质的时候发现了门捷雷夫博士所语言的与液化硅同质的物质,并根据祖国-德国的拉丁名GERMANIA将其命名为“锗”.2)锗的定义①在元素周期表中属于第4B族,是碳素族元素。
②元素记号:Ge③原子序号:32④原子量:72.59⑤溶解点:958℃⑥沸腾点:2700℃⑦比重:5.325(25℃)作为亚金属1948年美国贝尔实验室的巴丁博士和肖克博士发现了锗元素的半导体性质后,促进了电子工业的飞跃性发展。
电子工业发展的同时,科学家和医学家利用锗元素半导体性质进行在生命体内发挥其作用的人体校正医学范围的研究。
关于锗元素对人体校正医学范围研究的最高权威是日本的朝日博士,他不仅发表了包括著书“锗与我”在内的无数研究报告,而且把一生献给了锗的研究和治疗疑难证患者的身上。
并于1975年在全球首次研发了有机锗化合物,从而获得了诺贝尔奖。
3)锗的种类宏观上锗可以分为有机锗和无机锗,在地球上的大部分锗以矿物质形态的无机锗形式存在。
植物吸收矿物质形态的无机锗会促进成长,动物则以此类植物为食,这是最自然最安全的形态。
一般来讲,很多人对于锗元素会感到生疏,但事实上我们很早以前开始就在生活中广泛地接触过锗。

锗的有效态密度锗是一种化学元素,其化学符号为Ge,原子序数为32。
作为一种金属硅质元素,锗具有广泛的应用领域,包括半导体材料、光学器件和太阳能电池等。
在这篇文章中,我们将重点讨论锗的有效态密度,并探讨其在半导体材料中的重要性。
首先,让我们介绍一下有效态密度的概念。
在固体物理学中,有效态密度是指在能量范围内,每单位能量和每单位体积中的能级数目。
对于半导体材料来说,有效态密度是一个非常重要的参数,它决定了材料的电子结构和导电性能。
有效态密度越大,材料的导电性能越好。
锗的有效态密度与其晶体结构密切相关。
锗具有钻石晶体结构,每个原子都与四个邻近的原子形成共价键。
在锗中,电子的能级分布与能带结构密切相关。
能带是指在固体中,电子的能量分布范围。
锗的能带结构是由价带和导带决定的。
在绝对零度下,锗的能带结构可分为价带和导带。
在价带中,所有价态都被填满,因此这些电子不能在电流中移动。
在导带中,电子处于较高的能量状态,可以自由地在电流中移动。
导带上的电子数量取决于有效态密度。
对于锗来说,其价带和导带之间的能隙较大,是一个间接带隙材料。
这意味着电子从价带跃迁到导带需要吸收一定的能量,并不容易发生。
因此,在室温下,锗的导电性并不是很高。
然而,通过掺杂可以改变锗的导电性能。
掺杂是向材料中引入杂质,改变材料的电子结构和导电性能的过程。
在锗中,常见的掺杂元素包括磷(P)、硼(B)和锡(Sn)等。
磷的掺杂可以形成n型锗,即在导带中引入额外的电子。
这些额外的电子增加了锗的有效态密度,提高了导电性能。
因此,n型锗通常用于半导体器件和集成电路等应用中。
相反,硼的掺杂可以形成p型锗,即在价带中引入额外的空穴(正电荷)。
这些额外的空穴也会增加锗的有效态密度,改善导电性能。
因此,p型锗通常用于制备PN结、二极管和其他电子器件。
除了掺杂外,温度也对锗的有效态密度有影响。
随着温度的升高,锗的导电性能会逐渐提高。
这是因为高温下,部分电子会跃迁到导带中,增加了导电性能。

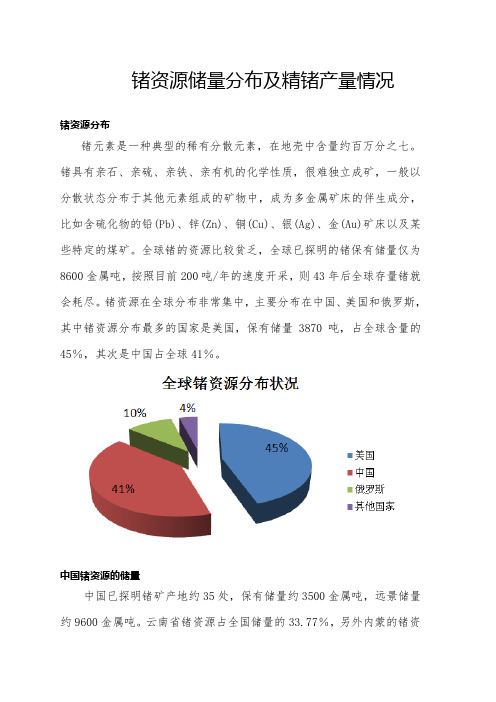
锗资源储量分布及精锗产量情况锗资源分布锗元素是一种典型的稀有分散元素,在地壳中含量约百万分之七。
锗具有亲石、亲硫、亲铁、亲有机的化学性质,很难独立成矿,一般以分散状态分布于其他元素组成的矿物中,成为多金属矿床的伴生成分,比如含硫化物的铅(Pb)、锌(Zn)、铜(Cu)、银(Ag)、金(Au)矿床以及某些特定的煤矿。
全球锗的资源比较贫乏,全球已探明的锗保有储量仅为8600金属吨,按照目前200吨/年的速度开采,则43年后全球存量锗就会耗尽。
锗资源在全球分布非常集中,主要分布在中国、美国和俄罗斯,其中锗资源分布最多的国家是美国,保有储量3870吨,占全球含量的45%,其次是中国占全球41%。
中国锗资源的储量中国已探明锗矿产地约35处,保有储量约3500金属吨,远景储量约9600金属吨。
云南省锗资源占全国储量的33.77%,另外内蒙的锗资源也非常丰富,但是品位较低,可开采性较差。
我国锗资源分布具体情况如下表所示:云南锗资源的储量云南省的锗资源主要分布在铅锌矿和含锗褐煤中,含锗铅锌矿主要分布在会泽县,会泽县是我国主要的铅锌锗生产基地,也是川滇黔成矿三角区富锗铅锌矿的典型代表。
滇西褐煤矿中,现已发现锗资源具备工业开采价值的矿区有4个,包括帮卖(大寨和中寨)、腊东(白塔)矿区、芒回矿区、等嘎矿区,煤田勘探估算锗储量共计2177吨,其中最大的锗矿位于帮卖的大寨和中寨,储量约1620吨,前3个矿区锗储量为1990吨,等嘎矿区已开采30余年,现资源已近枯竭。
内蒙锗资源储量内蒙的优质锗发现于20世纪70年代,位于胜利煤田,经1997年以来的两次较大范围勘查,确认胜利煤田锗金属量1919吨。
另外,位于内蒙古呼伦贝尔盟的伊敏煤田早期也曾发现锗含量异常,但其后一直没有进一步的勘探及开采。
勘探和综合评价结果表明,内蒙地区锗资源量异常丰富,预计将超过4000吨,未来有可能成为中国的锗资源中心。
精锗产量美国地质调查局2015年资料显示,2013年全球精锗产量共计155吨,2014年165吨。

锗的比热容一、锗的基本概述锗是一种化学元素,属于碳族元素,原子序数为32,化学符号为Ge。
它的外观是银灰色半金属,具有良好的导电性和热导性。
锗在自然界中很少出现,通常以硫化锗或氧化锗的形式存在于矿物中。
二、比热容的概念比热容是指物质在吸收或释放热量时所需要吸收或释放的单位质量热量。
它是一个物质特性参数,通常用J/(kg·K)表示。
三、锗的比热容1. 实验方法测量锗的比热容可以采用差示扫描量热法(DSC)或恒定压力加热法。
其中DSC法是通过测量样品与参考样品之间温度差异来计算比热容值;恒定压力加热法则是在恒定压力下加热样品并记录温度变化来计算比热容值。
2. 实验结果根据文献资料可知,锗在不同温度下的比热容值如下表所示:温度(K)比热容(J/(kg·K))300 321400 329500 336600 343700 350800 3573. 结论分析从上表可以看出,随着温度的升高,锗的比热容也逐渐增加。
这是因为随着温度升高,物质内部分子的运动速度加快,分子间距离缩小,导致物质内部能量密度增加,从而使比热容增大。
此外,锗的比热容值相对较小,说明其在吸收或释放热量时所需要吸收或释放的单位质量热量相对较少。
四、锗比热容的应用1. 工业应用方面:锗作为一种重要的半导体材料,在电子工业中有广泛应用。
同时,由于其良好的导电性和热导性,在制造电子元器件和传感器等方面也有广泛应用。
2. 科学研究方面:测量物质比热容是了解物质内部结构和性质的一种重要手段。
因此,在材料科学、化学、物理等领域中都有关于比热容测量和应用的相关研究。
五、总结锗作为一种重要的半导体材料,在电子工业中有广泛应用。
同时,其比热容值相对较小,说明其在吸收或释放热量时所需要吸收或释放的单位质量热量相对较少。
测量物质比热容是了解物质内部结构和性质的一种重要手段,在材料科学、化学、物理等领域中都有相关研究。

锗及其化合物锗(旧译作鈤)是一种化学元素,它的化学符号是Ge,原子序数是32,原子量72.64。
在化学元素周期表中位于第4周期、第IVA族。
锗单质是一种灰白色准金属,有光泽,质硬,属于碳族,化学性质与同族的锡与硅相近,不溶于水、盐酸、稀苛性碱溶液,溶于王水、浓硝酸或硫酸,具有两性,故溶于熔融的碱、过氧化碱、碱金属硝酸盐或碳酸盐,在空气中较稳定,在自然界中,锗共有五种同位素:70,72,73,74,76,在700℃以上与氧作用生成GeO2,在1000℃以上与氢作用,细粉锗能在氯或溴中燃烧,锗是优良半导体,可作高频率电流的检波和交流电的整流用,此外,可用于红外光材料、精密仪器、催化剂。
锗的化合物可用以制造荧光板和各种折射率高的玻璃。
锗、锡和铅在元素周期表中是同属一族,后两者早被古代人们发现并利用,而锗长时期以来没有被工业规模的开采。
这并不是由于锗在地壳中的含量少,而是因为它是地壳中最分散的元素之一,含锗的矿石是很少的。
锗粉末状呈暗蓝色,结晶状,为银白色脆金属。
化合价+2和+4。
第一电离能7.899电子伏特,是一种稀有金属,重要的半导体材料,不溶于水。
基本信息锗化学性质稳定,常温下不与空气或水蒸汽作用,但在600~700℃时,很快生成二氧化锗。
与盐酸、稀硫酸不起作用。
浓硫酸在加热时,锗会缓慢溶解。
在硝酸、王水中,锗易溶解。
碱溶液与锗的作用很弱,但熔融的碱在空气中,能使锗迅速溶解。
锗与碳不起作用,所以在石墨坩埚中熔化,不会被碳所污染。
锗在元素周期表上的位置正好夹在金属与非金属之间,因此具有许多类似于非金属的性质,这在化学上称为“亚金属”,外层电子排布为4s²4p²。
但它的化学性质类似于临近族的元素,尤其是砷和锑。
化学上或毒物学上重要的锗化合物很少。
锗的二氧化物,一种微溶于水的白色粉末,形成锗酸,这类似于硅酸。
四氯化锗是一种不稳定的液体,四氟化锗是一种气体,它们很容易在水中水解。
氢化锗(锗烷)是一种相对稳定的气体。
锗的同位素-回复锗的同位素是指锗元素原子核中具有相同质子数(即原子序数)但质量数不同的同种原子。
同位素是由于原子核中中子数不同而形成的。
在自然界中,锗有五个稳定同位素:锗-70、锗-72、锗-73、锗-74和锗-76。
此外,还存在一些不稳定同位素,其中最重要的是锗-68、锗-69、锗-71、锗-75和锗-77。
首先,让我们了解一下锗的基本性质。
锗是一种化学元素,属于周期表中的第14族元素,原子序数为32。
它是一种灰色非金属,具有类似金属的特性,有较高的电导率和热导率。
锗具有稳定的结构和较高的熔点,被广泛用于半导体材料和光电领域。
锗的同位素主要通过自然放射性衰变和人工合成两种方式形成。
自然放射性衰变是指原子核中不稳定同位素放射性衰变为稳定同位素的过程。
例如,锗-68通过α衰变变为镓-64,而锗-69和锗-71则通过贝塔衰变分别变为砷-69和砷-71。
人工合成同位素是指通过人工方法,如粒子加速器或核反应堆,将不同的原子核聚变而生成新的同位素。
锗的同位素在科学研究和工业应用中具有重要意义。
其中,锗-74是最广泛使用的同位素之一,用于生产高纯度锗和半导体器件。
锗-76则用于核反应堆中的控制棒。
此外,锗还广泛用于红外光学、激光器、太阳能电池等领域。
同位素的研究对于了解原子核结构、核反应及放射性衰变等核物理现象具有重要意义。
通过研究不同同位素的衰变链和半衰期,科学家可以了解核反应的规律,并应用于放射性同位素的医学诊断和治疗,例如放射性同位素的肿瘤治疗和核医学成像等。
不稳定同位素的衰变可以用作放射性测年的方法。
例如锗-68的衰变可以用来测定地质样品的年龄。
通过测量锗-68和其衰变产物镓-64之间的比例,可以推算出样品的年龄,从而了解地球的演化历史。
总结起来,锗的同位素是指锗元素原子核中质子数相同而质量数不同的同种原子,其中有稳定和不稳定同位素。
同位素的研究对于核物理学、材料科学和医学等领域具有重要意义,广泛应用于科研和工业生产中。
锗的化学键
锗是一种稀有金属元素,其原子序数为32,是金属元素第四多的元素,也是八大稀有元素之一。
化学键是物质原子之间的极性键,也是物质分子形成的基本类型的牢固的化学链接
方式。
锗的化学键包括共价键、共用电子对结构和质子键。
首先,锗中的共价键是其最基本的化学键。
在其原子核周围,每个原子都有4个结合位点,因此型号Se (32)的共价键为4。
因为每个原子的层次电子数相同,所以他们可以以相同
的方式进行排列,在以上位置上共享电子,形成共价键。
其次,锗中的共用电子对结构。
首先,电子数必须为4,因此存在2个共用电子对,在Se 中,则代表1个锗原子中存在2个共用电子对,因此可以构成一些有机分子,如H2SeO3。
第三,锗中的质子键。
Se中有4个结合电子,与其他原子结合时,可产生质子键。
如
H2Se的格式结构中的一个H键,由与锗原子的2个电子组成,是一种质子键。
以此类推,Se与其他元素结合时可产生质子键。
总之,锗的化学键可分为共价键、共用电子对结构和质子键三种,在熔合金属的矿藏中,
锗具有很强的稀有性,从而发挥着重要的影响,并且具有可重复利用性。
锗的五元环-概述说明以及解释1.引言1.1 概述概述:锗是一种化学元素,其化学符号为Ge,原子序数为32。
它属于碳族元素,与碳、硅等元素存在一定的相似性。
作为一种半金属,锗具有特殊的电学、光学及热学性质。
锗在自然界中主要以矿物锗石的形式存在,同时也在很多金属矿石中发现。
由于其特殊的物理和化学性质,锗在现代科学技术领域有着广泛的应用。
在过去的几十年中,锗的研究取得了显著的进展。
人们发现,锗可以形成多种不同的化合物和化学键型,其中五元环化合物是其中一种重要的结构类型。
锗的五元环化合物具有独特的稳定性和化学活性,因此引起了许多科学家的关注。
本文将对锗的五元环化合物进行详细研究和探讨。
首先,将介绍锗的基本性质,包括其物理性质、化学性质以及在自然界中的分布情况。
然后,将阐述锗的化学反应,特别是与其他元素的反应,以及这些反应过程中所产生的化合物。
最后,我们将探讨锗五元环的合成方法和相关的研究进展,以及锗五元环在各个领域中的应用前景。
通过对锗五元环的研究,我们可以更深入地了解这种化合物的特性和性质,为其应用领域的发展提供更加坚实的基础。
同时,通过探索锗五元环的合成方法,我们也能够为锗化学的发展做出积极的贡献。
相信通过本文的阐述,读者可以对锗五元环有更全面、深入的认识,并对其重要性和应用前景有更清晰的了解。
1.2文章结构文章结构部分的内容应包括本文的主要章节和每个章节的内容概述。
在本文中,文章结构可根据目录分为以下部分:1. 引言- 1.1 概述:介绍整篇文章的背景和内容。
- 1.2 文章结构:概述本文的章节安排和各个章节的内容。
- 1.3 目的:说明撰写本文的目标和意义。
2. 正文- 2.1 锗的基本性质:详细介绍锗元素的物理性质、化学性质、结构特点等相关内容。
- 2.2 锗的化学反应:探讨锗在不同环境下的化学反应和反应机理,包括与其他元素的反应、氧化还原反应等。
- 2.3 锗的合成方法:介绍锗的合成方法、制备工艺和优化研究,包括物理、化学方法等。
锗元素的实验原理是
锗元素的实验原理可以通过以下步骤进行:
1. 选取纯净的锗样品,可以是锗晶体或锗粉末。
2. 将锗样品加入到实验设备中,可以是反应瓶、燃烧装置或其他相应的装置中。
3. 运用适当的实验方法和条件,例如加热、通入气体或溶解等,使锗样品发生一定的化学反应或物理性质改变。
4. 观察和记录实验过程中的现象和结果,可以是温度变化、颜色变化、气体生成等。
5. 根据实验现象和结果,可以得出关于锗元素的性质和特点的结论。
锗元素的实验原理主要是通过对锗样品进行实验操作和观察,以确定其化学和物理性质。
这样的实验可以揭示锗元素的某些特性和用途,为科学研究或工程应用提供基础数据和理论依据。