尿素生产简图(彩色工艺流程图)
- 格式:doc
- 大小:319.04 KB
- 文档页数:11


尿素生产工艺流程尿素是一种重要的化肥,广泛应用于农业生产中。
下面是尿素生产的工艺流程。
尿素生产的工艺流程主要包括合成氨、尿素合成和后处理三个步骤。
第一步是合成氨。
合成氨是尿素生产的基础,也是最关键的环节。
合成氨工艺主要有煤气化法、重整法、电解法和催化氢化法等。
其中,催化氢化法是目前较为常用的合成氨方法。
第二步是尿素合成。
在尿素合成过程中,合成氨和二氧化碳反应生成尿素。
尿素合成反应主要有两个步骤:尿素化和解离。
尿素化反应是指将合成氨和二氧化碳在高温高压条件下进行反应,生成尿素。
解离反应是指将合成好的尿素溶液经过蒸汽加热分解,生成氨和二氧化碳,然后冷却结晶得到尿素结晶。
尿素化反应和解离反应需要通过催化剂来促进。
第三步是后处理。
尿素生产后处理主要包括尿素浓缩、破乳、析出、离心、干燥和固化等工序。
尿素浓缩是通过真空蒸发或加热蒸发的方法,将尿素溶液中的水分蒸发掉,得到浓缩尿素溶液。
破乳是将浓缩尿素溶液中的微小气泡破裂,得到较为纯净的尿素液体。
析出是将尿素液体通过冷却结晶,得到尿素结晶。
离心是将尿素溶液中的固体颗粒与溶液分离。
干燥是将分离的尿素结晶通过加热蒸发溶剂,去除溶剂中的水分。
固化是将干燥后的尿素结晶通过造粒或均化等处理,制成颗粒状的尿素肥料。
总的来说,尿素生产的工艺流程包括合成氨、尿素合成和后处理三个步骤。
合成氨是尿素生产的基础环节,尿素合成是将合成氨和二氧化碳反应生成尿素,后处理是对尿素溶液进行浓缩、破乳、析出、离心、干燥和固化等处理。
这些工艺流程的顺利进行,能够确保尿素的质量和产量,为农业生产提供优质的化肥。
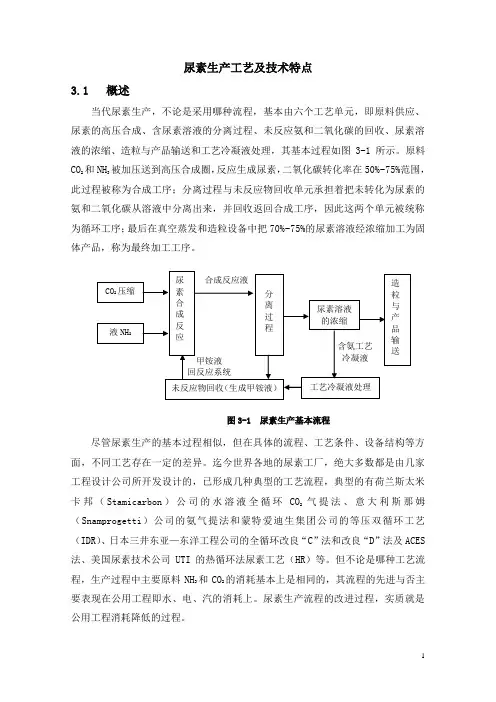
尿素生产工艺及技术特点3.1 概述当代尿素生产,不论是采用哪种流程,基本由六个工艺单元,即原料供应、尿素的高压合成、含尿素溶液的分离过程、未反应氨和二氧化碳的回收、尿素溶液的浓缩、造粒与产品输送和工艺冷凝液处理,其基本过程如图3-1所示。
原料CO2和NH3被加压送到高压合成圈,反应生成尿素,二氧化碳转化率在50%~75%范围,此过程被称为合成工序;分离过程与未反应物回收单元承担着把未转化为尿素的氨和二氧化碳从溶液中分离出来,并回收返回合成工序,因此这两个单元被统称为循环工序;最后在真空蒸发和造粒设备中把70%~75%的尿素溶液经浓缩加工为固体产品,称为最终加工工序。
图3-1 尿素生产基本流程尽管尿素生产的基本过程相似,但在具体的流程、工艺条件、设备结构等方面,不同工艺存在一定的差异。
迄今世界各地的尿素工厂,绝大多数都是由几家工程设计公司所开发设计的,已形成几种典型的工艺流程,典型的有荷兰斯太米卡邦(Stamicarbon)公司的水溶液全循环CO2气提法、意大利斯那姆(Snamprogetti)公司的氨气提法和蒙特爱迪生集团公司的等压双循环工艺(IDR)、日本三井东亚—东洋工程公司的全循环改良“C”法和改良“D”法及ACES 法、美国尿素技术公司UTI的热循环法尿素工艺(HR)等。
但不论是哪种工艺流程,生产过程中主要原料NH3和CO2的消耗基本上是相同的,其流程的先进与否主要表现在公用工程即水、电、汽的消耗上。
尿素生产流程的改进过程,实质就是公用工程消耗降低的过程。
目前国内建有尿素装置200多套,规模分为大型(48万吨/年以上)、中型(11万吨/年以上)、小型 (4万吨/年以上)。
中、小型尿素装置均采用国内的水溶液全循环技术,大型装置多采用国外引进工艺技术。
在国内的大型尿素装置工艺技术中,多数采用CO 2气提工艺和氨气提工艺。
目前设计的采用CO 2气提工艺和氨气提工艺的尿素装置,其尿素氨耗基本接近于理论水平,公用工程消耗更低,相对于传统的设计,其投资更低。


摘要由于具有生产工艺简单,生产操作易于掌握;生产设备容易制造,投资较省;施用后见效快,增产显著等特点,尿素在各种肥料新品种不断涌现的情况下产销量仍持高不下。
本设计介绍了尿素的性质、用途、生产方法和发展状况,详细描述了水溶液全循环法生产尿素的工艺流程,重点介绍了尿素的工业生产的过程,并对单位质量参加反应的原料进行物料衡算和热量衡算,以期获得低耗能、低污染、高产出的尿素生产工艺。
关键词:尿素,全循环,发展,工艺流程一、概述(一)尿素的物理化学性质和用途1.尿素的物理性质分子式:CO(NH2)2,分子量60.06,因最早由人类及哺乳动物的尿液中发现,故称尿素。
纯净的尿素为无色、无味针状或棱柱状晶体,含氮量为46.6%,工业尿素因含有杂质而呈白色或浅黄色,工业或农业品为白色略带微红色固体颗粒无臭无味。
密度1.335g/cm3。
熔点132.7℃。
超过熔点则分解。
尿素较易吸湿,贮存要注意防潮。
尿素易溶于水和液氨,其溶解度随温度升高而增大。
2.尿素的化学性质易溶于水、醇,不溶于乙醚、氯仿。
呈微碱性。
可与酸作用生成盐。
有水解作用。
在高温下可进行缩合反应,生成缩二脲、缩三脲和三聚氰酸。
加热至160℃分解,产生氨气同时变为氰酸。
因为在人尿中含有这种物质,所以取名尿素。
尿素含氮(N)46%,是固体氮肥中含氮量最高的。
尿素在酸、碱、酶作用下(酸、碱需加热)能水解生成氨和二氧化碳。
对热不稳定,加热至150~160℃将脱氨成缩二脲。
若迅速加热将脱氨而三聚成六元环化合物三聚氰酸。
(机理:先脱氨生成异氰酸(HN=C=O),再三聚)。
在氨水等碱性催化剂作用下能与甲醛反应,缩聚成脲醛树脂。
与水合肼生成氨基脲2NH3+CO2→NH2COONH4→CO(NH2)2+H2O粒状尿素为粒径1~2毫米的半透明粒子,外观光洁,吸湿性有明显改善。
20℃时临界吸湿点为相对湿度80%,但30℃时,临界吸湿点降至72.5%,故尿素要避免在盛夏潮湿气候下敞开存放。

尿素生产工艺图文详解1性质:尿素:学名为碳酰二胺,分子式为CO(NH2)2,相对分子量为60.06。
因最早由人类及哺乳动物的尿液中发现,故称为尿素。
纯净的尿素为无色、无味、无臭的针状或棱柱状的晶体,含氮量46.6%,工业尿素因含有杂质而呈白色或浅黄色。
尿素的熔点在常压下为132.6℃,超过熔点则分解。
尿素较易吸湿,其吸湿性次于硝酸铵而大于硫酸铵,故包装、贮存要注意防潮。
尿素易容于水和液氨,其溶解度随温度升高而增大,尿素还能容于一些有机溶剂,如甲醇、苯等。
2用途:尿素的用途非常的广泛,它不仅可以用作肥料,而且还可以用作工业原料以及哺乳动物的饲料。
2.1尿素是目前使用的固体氮肥含氮量最高的化肥;2.2在有机合成工业中,尿素可用来制取高聚物合成材料,尿素甲醛树脂可用于生产塑料漆料和胶合剂等;在医药工业中,尿素可作为生产利尿剂、镇静剂、止痛剂等的原料。
此外,在石油、纺织、纤维素、造纸、炸药、制革、染料和选矿等生产中也要尿素;2.3尿素可用作牛、羊等动物的辅助饲料,哺乳动物胃中的微生物将尿素的胺态氮转变为蛋白质,使肉、奶增产。
但作为饲料的尿素规格和用法有特殊的要求,不能乱用。
3原料来源:生产尿素的原料主要是液氨和二氧化碳气体,液氨是合成氨厂的主要产品,二氧化碳气体是合成氨原料气净化的的副产品。
合成尿素用的液氨要求纯度高于99.5%,油含量小于10PPm,水和惰性气体小于0.5%并不含催化剂粉、铁锈等固体杂质。
要求二氧化碳的纯度大于98.5%,硫化物含量低于15mg/Nm3。
4生产方法:水溶液全循环法.5生产原理:5.1化学及热、动力学原理:液氨和二氧化碳直接合成尿素的总反应式为: 2NH3(l)+CO2=CO(NH2)2+H2O这是一个放热体积减小的反应,其反应机理目前有很多的解释,但一般认为,反应在液相中是分两步进行的.首先液氨和二氧化碳反应生成甲铵,故称其为甲铵生成反应:2NH3(l)+CO2(g)=NH4COONH2(l)该反应是一个体积缩小的强放热反应.在一定的条件下,此反应速率很快,容易达到平衡.且此反应二氧化碳的转化率很高.然后是液态甲铵脱水生成尿素,称为甲铵脱水反应:NH4COONH2(l) =CO(NH2)2(l)+H2O该反应是微吸热反应,平衡转化率不是很高,一般为50%-70%.此步反应的速率很慢是尿素合成中的控制反应.5.2工艺条件选择:根据前述尿素合成的基本原理可知,影响尿素合成的主要因素有温度、原料的配方压力、反映时间等.5.2.1温度尿素合成的控制反应是甲铵脱水,它是一个微吸热反应,故提高温度、甲铵脱水速度加快.温度每升10℃,反应速度约增加一倍,因此,从反应速率角度考虑,高温是有利的.目前应选择略高于最高平衡转化率时的温度,故尿素合成塔上部大致为185~200℃;在合成塔的下部,气液两相间的平衡对温度起者决定性的作用.操作温度要低于物系平衡的温度.5.2.2氨碳比工业生产上,通过综合考虑,一般水溶液全循环法氨碳比应选择在4左右,若利用合成塔副产蒸汽,则氨碳比取3.5以下. 5.2.3水碳比水溶液全循环法中,水碳比一般控制在0.6~0.7;(1)操作压力一般情况下,生产的操作压力要高于合成塔顶物料和该温度下的平衡压力1~3Mpa.对于水溶液全循环法,当温度为190℃和NH3/CO2等于4时,相应的平衡压力是18Mpa左右,故其操作压力是一般为20Mpa左右.反应时间对于反应温度为180~190℃的装置,一般反应时间是40~60min,其转化率可达平衡转化率的90~95%.对于反应温度为200℃个装置,反应时间一般为30min左右,其转化率也接近于平衡转化率.6工艺流程:由于目前普遍采用水溶液全循环法生产尿素下面就简述水溶液循环法生产尿素的流程.图3-19是目前在我国得到广泛应用的中压、低压两段分解水溶液全循环法直接造粒尿素工艺流程图。

尿素的生产工艺流程
尿素是一种常用的无机化合物,广泛应用于化肥、化工、医药等领域。
其生产工艺流程通常包括以下几步:
1. 合成气制备:通过天然气、石油或煤炭等燃料的气化反应,产生合成气(一氧化碳和氢气的混合物)。
2. 氨制备:将合成气经过催化转化反应,生成氨气。
常用的氨合成催化剂是铁、镍、铑的合金。
3. 尿素合成:将氨气与二氧化碳反应生成尿素。
尿素合成反应通常采用一种称为“尿素合成反应”的过程,该过程包括高温高压、催化和再循环等步骤。
4. 氨回收:由于尿素合成反应中的氨气未完全转化为尿素,剩余的氨气需要从尿素产物中回收利用。
常用的回收方法是采用蒸汽脱氨或萃取等工艺。
5. 精制和成品制备:通过混合、结晶、干燥等工艺对尿素进行精制和成品制备。
最终得到的尿素产品可以根据需要进行粒度调整、添加剂等工艺。
需要注意的是,尿素的生产工艺流程可能会根据不同的生产厂家和技术路线有所差异,上述流程仅为一般性描述。
另外,为了提高生产效率和产品质量,尿素生产工艺流程中常常采用先进的自动化控制系统和能源回收装置。




尿素生产工艺流程
一、氨合成
1.原料:天然气、煤、重油等。
2.反应原理:在高温高压下,原料经过催化反应生成氨气。
3.反应过程:将原料经过压缩、加热、催化等反应过程,最终生成氨气。
4.注意事项:控制反应温度、压力等参数,避免催化剂中毒等问题的发生。
二、尿素合成
1.原料:氨气、二氧化碳。
2.反应原理:在高温高压下,氨气和二氧化碳经过催化反应生成尿素。
3.反应过程:将氨气和二氧化碳分别压缩到高压下,加入催化剂进行反应,生
成尿素。
4.注意事项:控制反应温度、压力等参数,保持催化剂的活性。
三、后处理
1.原料:尿素溶液。
2.处理过程:将尿素溶液进行蒸发、结晶、干燥等处理,得到尿素产品。
3.注意事项:控制蒸发温度、结晶时间等参数,确保产品质量符合要求。
1
同一段差不多
3.
去常压吸收塔
氨水来自氨水槽
6.氨水解吸
解吸废水
去界区
中压蒸汽来自外管250℃2.4Mpa
流程说明
1、液氨加压
来自界区的液氨在取样分析后由高压泵加压到14Mpa送往高压喷射器
2、反应阶段
液氨作为喷射动力,将来自高压洗涤器的甲铵液一起带入高压甲铵冷凝器,在其中生成甲铵CO2+2NH3 ⇌NH4•COONH2反应放热,回收一部分热量让反应平衡向正反应偏移;反应后的气体跟液体直接通往合成塔底部,在合成塔(14Mpa 183℃)中生成尿素NH4•COONH2 ⇌CO (NH2)2+H2O 反应吸热,而气体CO2+2NH3 ⇌NH4•COONH2反应放热,所以合成塔中自热平衡,且合成塔中设有多层塔板,防止返混;反应生成的尿素-甲铵液体从合成塔底部取样分析后去汽提塔顶部,与下层来的高压CO2逆流接触,在高温以及CO2气体带动下,甲铵液被进一步分解,尿素及甲铵液从汽提塔底部取样分析后去往精馏塔,在精馏塔中循环加热,促进甲铵液进一步分解,出来的尿素溶液浓度大约为68%,取样分析后进入闪蒸罐(常压),闪蒸出CO2/NH3/H20,尿素溶液流进尿素贮罐。
3、尿素造粒
尿素贮罐的尿素溶液取样后打到一段蒸发加热器(0.03Mpa 13 0℃)尿素溶液中的气体水分充分分解、蒸发,出一段加热器的尿素溶液浓度大约为95%,然后流进二段蒸发加热器(0.003MPa 140℃)
. 继续加热浓缩,出来的尿素为熔融状态(99.7%),取样后送到造粒系统直接做成颗粒状,包装存储。
4、其他说明
过程中产生的气体回收利用,或者去排气筒,用过程中产生的溶液吸收后返回氨水槽,不能吸收的气体排大气。
.;。
化肥厂生产过程及工艺流程煤制合成氨、尿素C+0.5O2→COC+O2→CO2CO+H2O→CO2+H2H2+N2→NH3CO2+2NH3→CO(NH2)21全厂流程简介煤空气供热站蒸汽渣蒸气N2N2空分硫回收S煤备煤煤气化变换低温甲醇洗液氮洗合成压缩CO2氨尿素合成尿素煤制合成氨、尿素流程简图2过程工艺描述(1)水煤浆气化制合成气装置由水煤浆制备工序来的水煤浆送入煤浆槽储存待用。
浓度约为63%的水煤浆通过煤浆给料泵加压输送到气化炉顶部工艺烧嘴,并与空分装置来的纯氧分别进入气化炉在6.5MPa(G),约1400℃工艺条件下,水煤浆与纯氧进行部分氧化反应,生成粗合成气。
反应后的粗合成气和溶渣进入气化炉下部的激冷室。
在激冷室中,粗合成气经冷却、洗涤,将粗合成气中的大部分碳黑洗去,并和粗渣分开。
出激冷室的粗合成气直接进入文丘里洗涤器和碳洗塔进一步洗涤,除去粗合成气中残留的碳黑,然后将水蒸汽/干气比约1.3~1.5的合成气送至变换工序。
溶渣被激冷室底部通过破渣机进入锁斗,定期排入渣池,渣池设有捞渣机将粗渣捞出,装车运往园区免烧砖项目。
渣池中含细渣的灰水通过渣池泵送至真空闪蒸器。
碳洗塔的液位通过控制进入塔内的灰水量来维持,碳洗塔内的黑水分两股排出,一股黑水去高压闪蒸器;另一股由灰水循环泵送至气化炉也进入高压闪蒸器,黑水经减压,闪蒸出黑水中溶解的气体并通过变换冷凝液加热器回收闪蒸汽的热量,通过高压闪蒸分离器,闪蒸出的气体至变换或火炬,水送入脱氧水槽。
(2)净化装置a.变换变换工序主要反应式为:COS+H2O——CO2+H2S+QCO+H2O——CO2+H2+Q由气化送来粗煤气经煤气水分离器分离掉少量的冷凝液及灰尘后,经中温换热器温度升高至250℃,进第一中温变换炉。
第一中温变换炉分上、下两段,炉内装有两段三层耐硫变换触媒,层间配有煤气激冷管线调温,出第一中温变换炉变换气CO含量为24%(干),温度为420℃左右。