分析化学酸碱滴定公式整理
- 格式:doc
- 大小:370.12 KB
- 文档页数:3


酸碱滴定的酸碱度计算方法酸碱滴定作为一种常用的分析化学方法,在确定溶液的酸碱度方面有着重要的应用。
本文将介绍酸碱滴定的酸碱度计算方法,包括酸度计算和碱度计算。
1. 酸度计算方法酸度是指溶液中酸性物质的浓度。
酸度计算方法可以通过酸碱滴定中所需的滴定量和滴定试剂的浓度来确定。
首先,根据所需滴定试剂的性质选择适当的指示剂。
常见的指示剂有酚酞、甲基橙、溴酚蓝等。
然后,用滴定管准确地加入所需试剂,滴定到溶液的终点出现颜色变化。
记录滴定所需的体积,用其与滴定试剂的浓度做乘积,得到溶液中酸性物质的物质量或浓度。
举例来说,假设需要测定一溶液中硫酸的浓度。
设溶液体积为V,滴定试剂NaOH的浓度为C,滴定滴数为N,滴定的终点是由指示剂甲基橙呈酸性颜色变为橙色。
则酸度的计算公式为:酸度 = 滴定试剂的浓度 ×滴定滴数 ×滴定试剂体积2. 碱度计算方法碱度是指溶液中碱性物质的浓度。
碱度计算方法与酸度计算方法类似,也是利用滴定试剂的浓度和滴定量来确定溶液中碱性物质的浓度。
选择适当的指示剂,并将滴定试剂准确地加入溶液中,滴定至指示剂出现颜色变化的终点。
记录滴定所需的体积,用其与滴定试剂的浓度做乘积,得到溶液中碱性物质的物质量或浓度。
举例来说,假设需要测定一溶液中氢氧化钠的浓度。
设溶液体积为V,滴定试剂HCl的浓度为C,滴定滴数为N,滴定的终点是由指示剂溴酚蓝呈碱性颜色变为酸性颜色。
则碱度的计算公式为:碱度 = 滴定试剂的浓度 ×滴定滴数 ×滴定试剂体积需要注意的是,在进行酸碱滴定之前,应首先进行标准化处理。
标准化是将测定试剂的浓度与已知浓度的标准溶液进行比较,以确定其准确浓度的过程。
通过标准化处理,可以提高酸碱滴定的准确性和可靠性。
综上所述,酸碱滴定的酸碱度计算方法主要涉及酸度和碱度的计算。
利用滴定试剂的浓度和滴定量,结合适当的指示剂,可以准确地测定溶液中酸性物质和碱性物质的浓度。
在进行酸碱滴定之前,标准化处理是必不可少的步骤,以确保结果的准确性与可靠性。

滴定naoh溶液的公式滴定NaOH溶液的公式引言:在化学试验中,滴定是一种重要的分析方法。
滴定的本质是将一种容易反应的化学物质(称作“滴定液”)加入到要测定物中,观察两者在一定条件下反应的情况,并确定它们反应滴定过程中所需要的滴定量。
本文将详细介绍滴定NaOH溶液的公式。
一、NaOH和酸的反应方程式NaOH和酸反应,会产生水和相应的盐酸。
在NaOH和HCl的反应中,反应方程式为:NaOH + HCl →H2O + NaCl方程式表明,在1mol NaOH与1mol HCl反应时,可以产生1mol水和1mol NaCl。
二、滴定NaOH溶液的公式滴定NaOH溶液的公式是指测定酸性样品时,向其中滴加NaOH标准溶液,最终达到酸性和碱性物质相互抵消的状态的公式。
1.标准溶液浓度计算标准溶液的浓度一般通过以下公式计算得到:标准浓度 = 重量 ÷(分子量×溶液容量)其中,重量表示物质的质量,单位为克;分子量指的是溶液中分子的相对分子量,单位为克/摩尔;溶液容量指的是在标准状况下,溶液的总体积,单位为升(1L)或毫升(1mL)。
2.滴定公式的计算在滴定NaOH溶液时,需要先用该标准溶液进行滴定,直到酸性物质中的酸和其滴加的NaOH完全反应,从而得到反应滴定量。
通过该量,可以计算出NaOH的浓度,即:滴定盐酸溶液的浓度(单位:mol/L) ×滴定NaOH溶液的体积(单位:L) × 1 = NaOH溶液的摩尔浓度其中,滴定盐酸溶液的浓度是已知的,滴定NaOH溶液的体积需要通过实验测定得到,1表示反应中需要用1mol NaOH反应1mol盐酸。
三、实验注意事项1.选择合适的指示剂滴定过程需要选择合适的指示剂,它能够与酸性和碱性物质反应,从而产生颜色变化,指示此时溶液达到终点。
常用的指示剂有甲基红、溴酚蓝等。
2.控制滴定速度在滴定NaOH溶液时,需要逐渐添加NaOH滴液,且控制滴定速度,一般每次滴定1-2滴,并轻摇容器使混合均匀。
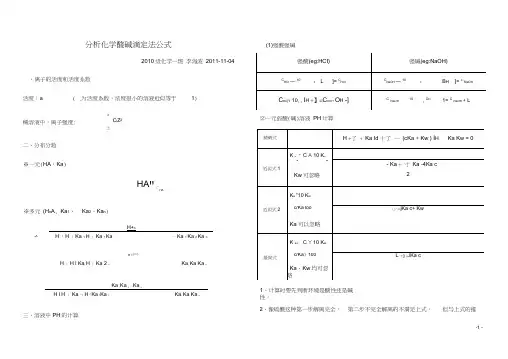
分析化学酸碱滴定法公式(1)强酸强碱、离子的活度和活度系数活度:a i(稀溶液中,离子强度: 二、分布分数※一元(HA,Ka)※多元(H n A, Ka1、n A 2010级化学一班李海波2011-11-04i为活度系数,浓度很小的溶液近似等于1)nC i Z2i 土HA"「HAKa2、Ka n)H+nH 『H 丨Ka 1 H 丨Ka 1 Ka 亠Ka 1 Ka 2 Ka nH +尸©H 丨H l Ka, H 丨Ka 2 2Ka, Ka Ka nKa ,Ka 2…Ka nH l H 丨°Ka 勺H『Ka t Ka 2Ka, Ka Ka n三、溶液中PH的计算⑵一元弱酸(碱)溶液PH计算1、计算时要先判断环境是酸性还是碱性。
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推导过程类似,应用质子守恒列方程, [0H -]太小,忽略。
(3)多元弱酸(碱)溶液 一般都按二元酸处理, Ka 太小省略掉。
(4)两性物质溶液pH 的计算①酸式盐,eg : NaHA②弱酸弱碱盐(1:1 型),eg : CH 2CIC00NH 4 (CH 2CICOOH *a , NH 3^Ka')(非1:1 ), eg : (NH4)2CO3 (1、溶液弱碱性,H2CO3、H+可忽略,只要是c不是很小,Kw 也可忽略)HCO 37:“ N H3 1 T ':HCO _c =、:NH3%(5)混合溶液①两种弱酸:H丄Ka! c, Ka 2c2②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
③一种弱碱和一种弱酸:H Ka Ka C酸1 2 c碱(6)缓冲溶液(弱酸HA浓度c i,共轭碱A-浓度C2)※标准缓冲溶液要考虑离子强CK ai _10 -,冰玄2 10 - 可准确滴定HA-六、终点误差公式(以NaOH滴定酸为例)强酸(HCI)滴定兀弱酸(HA)滴定sp epC HA C HAspCHAE t10 ■p H i0』H多元弱酸(H2A )滴定10 •叩_.10款HA和HB混酸(K HA>K HB)10拽_10少E tK CI. HA HA-K CHB HB。



化学酸碱滴定公式整理酸碱滴定是化学实验中常用的一种分析方法,用于确定溶液中的酸碱度。
在酸碱滴定过程中,滴定剂与被滴定物发生化学反应,通过滴定剂的消耗量来确定被滴定物的浓度。
一般情况下,酸碱滴定反应可以表示为以下的化学方程式:酸 + 碱→ 盐 + 水下面将整理各种常见的酸碱滴定反应公式以及其相关物质的性质和用途。
1. 强酸与强碱滴定反应:HCl + NaOH → NaCl + H2O2HCl + 2NaOH → 2NaCl + 2H2O该反应中,强酸盐酸(HCl)与强碱氢氧化钠(NaOH)在适当条件下反应,生成氯化钠(NaCl)和水(H2O)。
这是一种常见的酸碱滴定反应,用于测定酸或碱的浓度,常用于中学和大学化学实验中。
2. 碳酸与强酸滴定反应:HCl + H2CO3 → H2O + CO2↑ + Cl-2HCl + Na2CO3 → 2NaCl + H2O + CO2↑这种滴定反应中,碳酸和强酸反应产生水、二氧化碳气体和相应的盐。
该反应常被应用于测定饮用水中的碳酸饮料浓度和含盐量的分析。
3. 酸与碱滴定反应:HCl + KO H → KCl + H2OHCl + NH3 → NH4Cl在这种情况下,酸和碱反应生成盐和水。
这种酸碱滴定反应常用于确定酸和碱的浓度。
例如,盐酸(HCl)与氢氧化钾(KOH)反应生成氯化钾(KCl)和水(H2O),氯化钾是一种常见的盐。
4. 硝酸与碱滴定反应:HNO3 + NaOH → NaNO3 + H2OHNO3 + NH3 → NH4NO3硝酸(HNO3)与碱反应会生成相应的盐和水。
硝酸和氢氧化钠、氢氧化铵等碱的滴定反应常被用于测定硝酸盐或亚硝酸盐的浓度,以及水样中硝酸盐的含量。
5. 磷酸与氨(溶液)滴定反应:H3PO4 + NH3(aq) → NH4H2PO4磷酸和氨的滴定反应可生成磷酸氢铵。
这种反应常用于测定磷酸铵(NH4H2PO4)或磷酸盐的浓度,用于土壤和植物营养的分析。



分析化学四大滴定总结滴定分析法又称为容量分析法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
这其中又有重要的四大滴定方法。
以下是店铺整理的分析化学四大滴定总结,欢迎查看。
一、酸碱滴定原理:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、碱和两性物质。
其基本反应为H﹢+OH﹣=H2O也称中和法,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
标定它们的基准物质是碳酸钠Na2CO3。
方法简介:最常用的碱标准溶液是氢氧化钠,有时也用氢氧化钾或氢氧化钡,标定它们的基准物质是邻苯二甲酸氢钾KHC8H4O6或草酸H2C2O·2H2O:OH+HC8H4O6ˉ→C8H4O6ˉ+H2O如果酸、碱不太弱,就可以在水溶液中用酸、碱标准溶液滴定。
离解常数 A和Kb是酸和碱的强度标志。
当酸或碱的浓度为0.1M,而且A或Kb大于10-7时,就可以准确地滴定,一般可准确至0.2%。
多元酸或多元碱是分步离解的,如果相邻的离解常数相差较大,即大于104,就可以进行分步滴定,这种情况下准精确度不高,误差约为1%。
盐酸滴定碳酸钠分两步进行:﹢ˉCO32-+H→HCO3HCO3ˉ+H﹢→CO2↑+H2O相应的滴定曲线上有两个等当点,因此可用盐酸来测定混合物中碳酸钠和碳酸氢钠的含量,先以酚酞(最好用甲酚红-百里酚蓝混合指示剂)为指示剂,用盐酸滴定碳酸钠至碳酸氢钠,再加入甲基橙指示剂,继续用盐酸滴定碳酸氢钠为二氧化碳,由前后消耗的盐酸的体积差可计算出碳酸氢钠的含量。
某些有机酸或有机碱太弱,或者它们在水中的溶解度小,因而无法确定终点时,可选择有机溶剂为介质,情况就大为改善。
这就是在非水介质中进行的酸碱滴定。
有的非酸或非碱物质经过适当处理可以转化为酸或碱。
然后也可以用酸碱滴定法测定之。
分析化学酸碱滴定公式整理
酸碱滴定公式整理如下:
1.酸碱滴定终点公式:滴定过程中,当滴加的酸和碱的摩尔比满足滴
定反应的化学方程式时,滴定终点达到。
酸碱滴定终点公式的一般形式为:n(A)/V(A)=n(B)/V(B)
其中,n(A)和n(B)分别表示酸和碱的摩尔数,V(A)和V(B)分别表示
滴加的酸和碱的体积。
2.酸碱滴定的标准溶液浓度计算公式:标准溶液是使用称量准确浓度
已知的物质溶解在溶剂中得到的溶液。
标准溶液的浓度可以使用以下公式
计算:
C(B)=(n(B)×M(B))/V(B)
其中,C(B)表示基准溶液浓度,n(B)表示溶液中物质的摩尔数,M(B)
表示物质的摩尔质量,V(B)表示溶液的体积。
3.酸碱滴定中的滴定反应计算公式:酸碱滴定反应可以通过平衡反应
方程式表示。
一般而言,酸碱滴定反应是一种酸和碱发生中和反应的过程,其一般形式为:
HA+BOH→H2O+BA
其中,HA表示酸,BOH表示碱,H2O表示水,BA表示盐。
4.酸碱滴定指示剂选择公式:在酸碱滴定中,往往会使用指示剂来标
定滴定终点。
指示剂的选择通常依赖于溶液的pH值。
常用的指示剂有酚酞、溴酚蓝、甲基橙等。
酸碱指示剂选择的公式如下:
pH = pKa + log ([A-]/[HA])
其中,pH表示溶液的酸度或碱度,pKa表示指示剂的酸性常数,[A-]和[HA]分别表示酸性和无色形式的指示剂浓度。
总之,酸碱滴定涉及到了一系列的公式和计算,这些公式帮助我们理解滴定过程、测定物质浓度和选择指示剂。
掌握这些公式,可以更加准确和方便地进行酸碱滴定分析。
酸碱滴定法计算公式
关于酸碱滴定法、酸碱的分布系数、酸碱溶液PH的计算以及两性物质溶液的PH计算(NaHA)的基础知识和公式。
1.酸碱滴定法:
酸碱滴定法是一种常用的化学分析方法,通过滴定计量液体中的酸碱物质含量。
2.酸碱滴定法的基本公式是:
计量反应的化学计量数= 滴定计量数/ 被测组分的摩尔质量
3.酸碱的分布系数:
酸碱的分布系数是指酸碱物质在溶液中分布的比例。
4.分布系数的计算公式为:
分布系数= (各型体的浓度之和) / (各型体的浓度之和+ 未离解的酸或碱的浓度)
5.酸碱溶液PH的计算:
PH是指溶液中氢离子浓度的负对数。
6.PH的计算公式为:
PH = -lg[H+])
7.两性物质溶液的PH计算(NaHA):
对于两性物质,如NaHA,其溶液的PH需要分别计算酸式解离和碱式解离的贡献。
8.酸式解离的平衡常数表达式为:
K1 = [H+][A-] / [HA]
9.碱式解离的平衡常数表达式为:
K2 = [OH-][A-] / [HA]
然后,利用这两个平衡常数计算溶液的总PH。
分析化学PH公式总结分析化学是一门研究化学现象和过程的学科,其重要内容之一就是测定物质的浓度,其中一个常用的方法就是pH值的测定。
pH公式是用来计算溶液的酸碱度的工具,常用于检测化学物质溶液中的酸碱性。
本文将总结分析化学中常用的pH公式。
1.pH的定义pH定义为-pH=log[H+]其中[H+]表示氢离子的浓度,pH的取值范围从0到14,pH<7表示酸性溶液,pH>7表示碱性溶液,pH=7表示中性溶液。
2.强酸溶液的pH计算对于浓度为C的强酸溶液,如果完全离解,即[H+]=C,则pH=-logC。
例如,浓度为0.1M的HCl溶液,其pH=-log(0.1)=-13.强碱溶液的pH计算对于浓度为C的强碱溶液,如果完全离解,即[OH-]=C,则pOH=-logC。
其中,pOH和pH有以下关系:pOH+pH=14因此,强碱溶液的pH可以通过pOH来计算,如pOH=-log(0.01)=-2,那么pH=14-2=124.弱酸溶液的pH计算对于浓度为C的弱酸HA,其在水中会部分离解成[H+]和[A-]。
设弱酸HA的摩尔浓度为C,其离解程度由酸解离常数Ka决定。
在等温度下,Ka=[H+][A-]/[HA]。
根据电荷平衡原理,若HA离解后[H+]增加x,则[A-]=x,[HA]=C-x。
代入酸解离常数公式,可以得到:Ka=(x)(x)/(C-x)由于HA的离解程度很小,可以近似认为C-x≈C,得到近似酸解离常数公式:Ka=x^2/C根据pH的定义,pH=-log[H+],可以推导出[H+]=10^(-pH)。
代入近似酸解离常数公式,可以得到:Ka=(10^(-pH))^2/C由此可以求得弱酸溶液的pH值。
5.弱碱溶液的pH计算弱碱的溶液中,碱对水的解离可近似为:B+H2O⇌OH-(水解作用)设弱碱B的摩尔浓度为C,其水解程度由碱解离常数Kb决定。
在等温度下,Kb=[OH-][B]/[B(OH)]。
;.分析化学 酸碱滴定法 公式2010级化学一班 李海波 2011-11-04一、离子的活度和活度系数活度:i i i c a γ= (i γ为活度系数,浓度很小的溶液近似等于1)稀溶液中,离子强度:2121i n i i z c I ∑==二、分布分数δ※一元(HA ,Ka )[][]+++=H Ka H HA δ []++=HKa KaAδ []HA C HA δ⋅= []-⋅=-A C A δ ※多元(H n A ,Ka 1、Ka 2、Ka n ) [][][][]nn n nnA H Ka Ka Ka Ka Ka H Ka H H H n2121211++++=-+-+++δ[][][][]nn n nn AHKaKa Ka Ka Ka H Ka H H KaH n 2121211111++++=-+-++-+--δ [][][]nn n nnA Ka Ka Ka Ka Ka HKa H H Ka Ka Ka n 212121121++++=-+-++-δ 三、溶液中PH 的计算(1)强酸 强碱(2)一元弱酸(碱)溶液PH 计算1、计算时要先判断环境是酸性还是碱性。
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推;.导过程类似,应用质子守恒列方程,[OH -]太小,忽略。
(3)多元弱酸(碱)溶液 一般都按二元酸处理,Ka 太小省略掉。
(4)两性物质溶液pH 的计算①酸式盐,eg :NaHA②弱酸弱碱盐(1:1型),eg :CH 2ClCOONH 4(CH 2ClCOOH →Ka ,NH 3→Ka');.(非1:1),eg :(NH 4)2CO 3 (1、溶液弱碱性,H2CO3、H+可忽略,只要是c 不是很小,Kw 也可忽略) [][]33NH HCO ≈-→ c c NH HCO 233⋅=⋅-δδ(5)混合溶液①两种弱酸:[]2211c Ka c Ka H ⋅+⋅=+②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
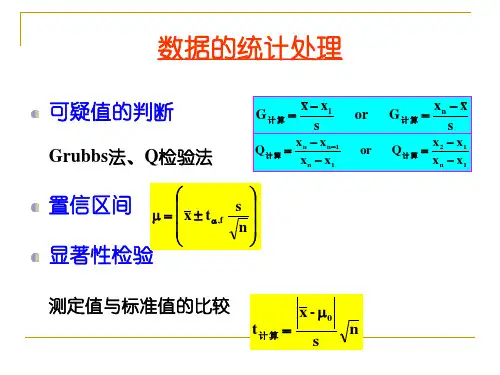
1、准确度:指测量值与真值之间相互接近的程度,用“误差”来表示;1、绝对误差:测量值x 与真值μ的差值,δ=x -μ2、相对误差:指绝对误差在真值中所占的比值,以百分率表示:%100%⨯=μδ%2、精密度:指对同一样品多次平行测量所得结果相互吻合的程度,用“偏差”来表示;1、绝对偏差:d=x i -xx i 表示单次测量值,x 表示多次测量结果的算术平均值平均偏差:d =n d d d d n ++++......321=nx x ni i ∑=-12、相对偏差:xd ×100%相对平均偏差:xd ×100%3、标准偏差:样本标准偏差S=1)(21--∑=n x xni i相对标准偏差RSD%=xs×100%例:测定铁矿石中铁的质量分数以%表示,5次结果分别为:%,%,%,%和%;计算:⑴平均偏差⑵相对平均偏差⑶标准偏差⑷相对标准偏差⑸极差 解:套以上公式4、平均值的精密度:用平均值的标准偏差来表示ns s x x=平均值的置信区间:nts x ±=μ 5、异常值的取舍:Q 检验:Q=最小最大紧邻可疑x x x x --G 检验:sx x Gq -=6、t 检验和F 检验⑴题目提供的数据与具体数值μ权威数据比较,t 检验:t=n sx μ-,如计算出来的值小于查表值,说明无显着性差⑵题目提供两组数据比较,问两组数据是否有显着性差异时,检验:F 检验:判断精密度是否存在显着性差异;F=2221s s 1s 是大方差,2s 是小方差,即1s 〉2s ,计算值小于,说数据的精密度不存在显着性差异,反之就有; 两组数据F 检验无显着性差异后,进行两个样本平均 值的比较:212121n n n n s x x tR+•-=,)1()1()1()1(21222121-+--+-=n n n s n s s R ,如果计算出来值小于查表值,表示两测量平均值之间无显着性7、t f ,α,例,t 8,05.0表示置信度为95%,自由度为8的t 值;▲两组数据有无显着性差异的计算步骤:①利用以上公式求出各组数据的平均值x 、标准差s ==1∑=ni 及各组数据的个数n ②F 检验的公式套进去,注意大小分差分别是放在分子和分母F 值③与题目提供的F 值比较大小,如果计算出来的F 值小于的话个结论:F 计算<F,所以两组数据的精密度无显着性差异④利用上面的公式求)1()1()1()1(21222121-+--+-=n n n s n s s R,代入212121n n n n s x x t R+•-= ⑤把计算出来的t 值与题目提供的比较,如果是小于的话就给论:无显着性差异.具体步骤看书上第25页的例题.8、滴定终点误差:TE% =%1001010⨯-X∆-X ∆tp p ck强酸强碱滴定:K t =1/K w =101425℃, c=c 2sp强酸碱滴定弱碱酸: K t =K a / K w 或K b / K w , c=c sp 配位滴定:K t =K MY ′, c=c )(sp M ;例:L 的NaOH 滴定的L 的HCl,以酚酞为指示剂pHep=,计算滴定误差; 解:根据已知条件计算 1 c sp=ml2pHep=,强酸强碱的pHsp=, ΔpH =1410=t K ,c=c 2sp3带入公式,求得:TE% 9、滴定度TBT V m T B=/,例: FeO Cr KT /722=ml,表示每消耗1ml 722O Cr K 标准溶液可与的Fe 完全作用;HCL NaOH T /=ml,表示用NaOH 标准溶液滴定HCl 试样,每消耗1ml NaOH 标准溶液可与完全反应. 例 若用T HCl NaOH /=ml NaOH 的标准溶液测定盐酸,用去该标准溶液,求试样中HCl 的质量;解:m HCl =V NaOH ·T HCl NaOH /= x g/ml =10、分布系数:溶液中某型体的平衡浓度在溶质总浓度中所占的分数,又称为分布分数,以δi ,下标i 说明它所属型体;[]ci i=δ[][]aHAKH H +=++δ,[]aa A K H K +=+-δ,1=+-A HA δδ 例:计算pH =时,HAcL 中HAc 和Ac-的分布系数及平衡浓度; 解:HAc 的Ka 值可查表得到51076.1-⨯=a K ,=HACδ[][]aKH H +++=36.01076.11000.11000.1555=⨯+⨯⨯---[]036.01000.036.0=⨯=•=c HAc HAc δmol/L[]064.01000.064.0=⨯=•=--c Ac AC δmol/L11、多元酸各型体的分布系数: 12、配位平衡体系中累积稳定常数:[][][]nn n n L M ML K K K =•=...21β 13、强酸强碱溶液的pH 值计算: 强酸:若C a ≥20O H-,[][]c A H ==+_,[]c H =+,[]c H pH lg lg -=-=+强碱:若C b ≥20 H+,[]c OH =-,ppK pH w -=14、弱酸碱溶液的pH 计算:若a aK c •≥ 20w K ,a Kc /则:[]aa K c H •=+,[]bb Kc OH •=-15、多元酸碱溶液的pH 计算:若C a K a1≥20K w ,/a Kc 500,[]a ac H c ≈-+,则[]aa c K H •=+1,[]bb c K OH •=-116、两性物质溶液的pH 计算:若2a cH ≥20w K ,c ≥20K1a K +c ≈c , 得最简式:[]21a a K K H =+,()2121a a pK pK pH +=17、弱酸弱碱混合溶液的pH 计算:若b ac c ≈,则有:[]'aa K K H =+18、缓冲溶液的pH 计算:若a c ,b c 较大, a c ≥20[]+H 20[]+H ,最简式:[]ba ac c KH =+,ab ac c pK pH lg+=若溶液为碱性pH >8,[]+H 忽略, ac≥20[]-OH , bc≥20[]-OH ,最简式: []ba ac c KH =+19、指示剂的变色范围:1±=HIn PK PH20、强酸碱的滴定:例:NaOHL →HCl L, 在滴定过程中pH 值的变化⑴滴定开始前,b V =0,组成为:HCl[]+H =ac= L, pH=2b V <a V , 组成为NaCl,HClSP 前%时,加入NaOH[]+H =C ·a V-b V /a V +b V=× =×10-5mol/L 即,pH=3 b V =a V SP, 组成为NaCl[]+H =[]-OH =w K =710-mol/L pH=4 b V >a V :SP 后%,加入,组成为NaCl,NaOH[]-OH =C aV-b V /a V +b V= =× 10-5 mol/LpOH=, pH=21、一元弱酸碱的滴定:例:NaOHCb :L →HAcCa :L,Va : 滴定过程溶液pH 的变化; 1滴定开始前b V =0,组成:HAc,[]aa K c H •=+pH=2sp 前,加入NaOH ,组成HAc, NaAc,缓冲液abac c pK pH lg +==HAcAca c c pK -+lg-Ac c -=×+=×10-2mol/LHAc c =× =×10-5mol/LpH=3SP 时,a V =b V ,组成:NaAc 弱碱b c =2=LpOH =, ∴pH=4SP 后,加入b V =,即SP 后%时,组成:NaAc,NaOH 按照强碱计算:[]b ab ab c V V V V OH +-=-pOH = ∴ pH=22、滴定终点误差:强酸滴定强碱时的终点误差公式:[][]%100(%)⨯-=-+spepepc OH H TE强碱滴定强酸时的终点误差公式:[][]%100(%)⨯-=+-spepepc H OH TE例:求用L NaOH 滴定LHCl 至pH =用甲基橙作指示剂和pH =用酚酞作指示剂时的终点误 差;解:1甲基橙变色pH =:[]+H =×410-mol/L ;[]-OH =×1010-mol/L ;C =2=L%10005.0101101(%)410⨯⨯-⨯=--TE =%2酚酞变色pH =:[]+H =×910-mol/L ;[]-OH =×510-mol/L ;C =2=L%10005.0100.110 ×1.0(%)9-5⨯⨯-=-TE =%弱酸碱的滴定终点误差公式:23、强碱滴定一元弱酸:[]100%⨯⎪⎭⎪⎬⎫⎪⎩⎪⎨⎧-=-HA sp c OH TE δ强酸滴定一元弱碱: []%100%⨯⎪⎭⎪⎬⎫⎪⎩⎪⎨⎧-=B sp c H TE δ 例:用NaOHL 溶液滴定 HAcL 溶液;Ka=×510-1如用酚酞作指示剂,滴定到pH =时为终点2滴定到pH =为终点;分别计算滴定误差; 解:1滴定到pH =时:[]+H = 810- mol/L,[]-OH = 610- mol/LCsp=1/2CHAc =2= mol/L[]%100%⨯⎪⎭⎪⎬⎫⎪⎩⎪⎨⎧-=-HA sp c OH TE δ,[][][]aspepHA KH H c HA +==++δ%100107.1101005000.010%5886⨯⎭⎬⎫⎩⎨⎧⨯+-=----TE =-% 2滴定到pH =时:[]+H =910- mol/L,[]-OH =510- mol/LCsp=1/2CHAc =2= mol/L同理,得TE%=%100107.1101005000.010%5995⨯⎭⎬⎫⎩⎨⎧⨯+-=----TE =-%%24、酸效应与酸效应系数由于H +与Y 4-的结合使主反应的程度降低,这种现象称为酸效应;酸效应的大小用酸效应系数来衡量; 25、共存离子效应和共存离子效应系数其它共存金属离子N 与Y 配位使主反应的程度降低,这种现象称为共存离子效应;共存离子效应的大小用共存离子效应系数 来衡量;26、当酸效应和共存离子效应同时发生时,EDTA 总的副反应系数是 27、金属M 离子的副反应和副反应系数其它配位剂L 与M 发生配位反应,使主反应的程度降低,这种现象称配位效应,其大小用配位效应系数 来衡量; 例:计算pH11,[]L mol NH /1.03=时的Zn α值;解:+243)(NH Zn 的 41lg ~lg ββ分别是、、和()[][][][]10.5406.9301.7261.4127.243433323231101010101010101010113=⨯+⨯+⨯+⨯+=++++=----NH NH NH NH NH Zn ββββα又查得,pH=11时,4.5lg )(=OH Zn α故6.54.51.5)((101101013≈-+=-+=OH Zn NH Zn Znααα)28、配合物的条件稳定系数:Y M MY MY K K ααlg lg lg lg'--=29、化学计量点'PM 值的计算:[]')('MY sp M spKc M =例:用EDTA 溶液×102-mol/L 滴定相同浓度的+2Cu,若溶液pH 为10,游离氨浓度为L,计算化学计量点时的'pCu ;解:化学计量点时,)/(100.1)100.2(2122)(L mol c sp Cu --⨯=⨯⨯==459.12348.10261.713.410.01010.01010.01010.0101⨯+⨯+⨯+⨯+≈62.810pH=10时,7.1)(10=OH Cu α﹤﹤62.810故)(OH Cu α可以忽略,62.810≈Cu αPH=10时,45.0lg )(=H Y α所以Cu H Y CuY CuYK K ααlg lg lg lg )('--==、配位滴定终点误差:%1001010%')(''⨯-=∆-∆MYSP M pMpM Kc TE配位滴定能准确滴定的条件:lg 6)lg(''≥MYMY K cK 或31、只有酸效应下,能否实现准确滴定的条件:8lg -lg 'lg )(MY MY ≥=H Y K K α——计算最高酸度M 易受溶剂中OH-的影响,nMsp c K OH =-][——计算最低酸指示剂变色点:)(MIn MIn t lg lg 'lg pM H In K K α-==—佳酸度P96例5-7、5-8 32、条件电位能斯特方程:Ox d d Ox dOnn Re Re Re /0.0lg 059.0++=αγαγφφθθ常用公式1:oxdn ααϕϕθθRe lg 059.0'+=2][Re ][lg 059.0'd Ox n +=θθϕϕ69、+--334Fe PO F与或有较强配位能力,而-4ClO 基本上配合物;33、酸效应:[][]+++==H KH aHAsO12δα34、氧化还原滴定突越范围:)(H Y α)(N Y α)(L M α)(3059.0~)(3059.01'122'V n V n ⨯-⨯+θθϕϕ35、朗伯-比尔定律:是描述物质对单色光吸收的强弱与吸光物质的浓度和厚度间关系的定律;吸光度A=-lgT=Ecl,其中T=I/I 0,为透光率,E 是吸光系数,c 是浓度,l 是溶液厚度; 36、摩尔吸光系数M E 、ε:%1110cm E M •=ε例1:用氯霉素M 为纯品配制100ml 含有的溶液,以厚的吸收池在278nm 处测得透光率为%,求ε 解:=%11cmE -lgT/cl=-=307,ε=10⨯=%11cm E 9921;例2:取维生素溶于100ml 的L 硫酸溶液中,再准确量取此溶液稀释至100ml,取此溶液于1cm 吸收池中,在m ax λ245nm 处测得A 值为,求试样中维生素C 的质量分数; 解:维生素C%=%4.98%10005.050560551.0%10005.000.2100%11=⨯⨯=⨯⨯•ml ml l E Acm例3、安络血的分子量236,将其配成100ML 含的溶液,装于1cm 吸收池中,在λmax 为355nm 处测量A 值为试计算安络血的分光光度系数E 和摩尔吸光系数ε 解:11231104962.0557.,3%11%11=⨯⨯===-o cl A E cl E A cm cm 37、两次测量法公式:059.0s x s x E E pH pH -+=例:25℃,将pH 玻璃电极与饱和甘汞电极浸入pH=的标准缓冲溶液中,测得电动势为,将该电极浸入到待测pH 的溶液中,测得电动势为,计算待测溶液的pH.解:059.0s x s x E E pH pH -+==+059.0386.0508.0-=V38、离子浓度定量分析法公式:)lg (lg 303.2s x s x c c nFRTE E -=-m注意:阳离子取“-”号,阴离子取“+”; 39、分离度:21)(212W W t t R R R +-=,为了能获得较好的精密度与准确度,应使R ≥.。
分析化学酸碱滴定公式整理酸碱滴定是化学分析中常用的一种定量分析方法。
它通过在溶液中滴加一种已知浓度的酸或碱溶液,来确定待测溶液中的酸碱成分的浓度。
酸碱滴定公式指的是酸碱滴定反应中所使用的化学方程式。
在不同的酸碱滴定反应中,采用的滴定公式也有所不同。
下面将对常见的酸碱滴定反应进行整理。
1.强酸与弱碱的滴定强酸与弱碱的滴定通常用于测定弱碱或其它不易溶于水的碱的含量。
滴定过程中,强酸和弱碱之间发生完全的酸碱中和反应,所以滴定公式为:H₃O⁺(aq) + OH⁻(aq) → 2H₂O(l)2.强碱与弱酸的滴定强碱与弱酸的滴定可用于测定溶液中弱酸的浓度。
滴定过程中,强碱和弱酸之间发生完全的酸碱中和反应,所以滴定公式为:OH⁻(aq) + HA(aq) → A⁻(aq) + H₂O(l)3.酸碱中和反应在一般的酸碱滴定中,酸碱中和反应是最核心的反应类型。
酸碱中和反应的滴定公式根据使用的酸和碱的性质而不同。
下面列举几个常见的酸碱中和反应滴定公式:-强酸与强碱的滴定:H₃O⁺(aq) + OH⁻(aq) → 2H₂O(l)-弱酸与强碱的滴定:HA(aq) + OH⁻(aq) → A⁻(aq) + H₂O(l)-二元强酸与强碱的滴定:H₂A(aq) + 2OH⁻(aq) → 2A⁻(aq) + 2H₂O(l)-强酸与酸性盐的滴定:H₃O⁺(aq) + A⁻(aq) → HA(aq) + OH⁻(aq)4.缓冲溶液的滴定缓冲溶液中的酸和碱能够相互中和,从而在一定范围内保持溶液pH的稳定。
滴定公式在滴定相应的酸或碱时,需要根据缓冲溶液中的酸碱反应进行调整。
例如,对于含有弱酸与其盐的缓冲溶液的滴定,滴定公式为:HA(aq) + OH⁻(aq) → A⁻(aq) + H₂O(l)以上是常见的几种酸碱滴定反应和滴定公式。
每种滴定反应都有其独特的滴定公式,需要根据实际情况进行选择和调整。
在实际分析中,要注意选择合适的指示剂和滴定终点的判断方法,以确保滴定结果的准确性和可靠性。
分析化学 酸碱滴定法 公式
2010级化学一班 李海波 2011-11-04
一、离子的活度和活度系数
活度:i i i c a γ= (i γ为活度系数,浓度很小的溶液近似等于1)
稀溶液中,离子强度:2
1
21i n i i z c I ∑==
二、分布分数δ ※一元(HA ,Ka ) [][]
+
+
+=
H Ka H HA
δ []
+
+=H
Ka Ka A
δ []HA C HA δ⋅= []
-⋅=-A C A δ ※多元(H n A ,Ka 1、Ka 2、Ka n ) [][][][]n
n n n
n
A
H Ka
Ka Ka Ka Ka H Ka H H H n ΛΛ2
1
2
1
2
1
1
++++=-+-+++δ
[][][][]n
n n n
n A
H
Ka
Ka Ka Ka Ka H Ka H H Ka
H n ΛΛ2
1
2
1
2
1
1
1
1
1++++=-+-++-+--δ [][]
[]
n
n n n
n
A Ka Ka Ka Ka Ka H
Ka H H Ka Ka Ka n ΛΛΛ21212
11
21++++=
-+-++-
δ
三、溶液中PH 的计算
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推
导过程类似,应用质子守恒列方程,[OH -]太小,忽略。
(4)两性物质溶液pH的计算
2423
42 3
Kw也可忽略) [][]3
3
NH
HCO≈
-→c
c
NH
HCO
2
3
3
⋅
=
⋅-δ
δ
(5)混合溶液
①两种弱酸:[]22
1
1
c
Ka
c
Ka
H⋅
+
⋅
=
+
②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
③一种弱碱和一种弱酸:[]
碱
酸
c
c
Ka
Ka
H
2
1
⋅
=
+
(6)缓冲溶液(弱酸HA浓度c1,共轭碱A-浓度c2)※标准缓冲溶液要考虑离子强度。
四、缓冲溶液的缓冲容量
精品文档
五、酸碱滴定基本原理
六、终点误差公式(以NaOH 滴定酸为例)。