第二章 理想气体性质
- 格式:ppt
- 大小:797.00 KB
- 文档页数:47




热学第二版课后习题答案热学第二版课后习题答案热学是物理学中的一门重要学科,研究热量的传递、热力学规律以及热力学系统的性质等。
在学习热学的过程中,课后习题是检验学生对知识掌握程度的重要手段。
下面将为大家提供热学第二版课后习题的答案。
第一章:热力学基础1. 什么是热力学第一定律?它的数学表达式是什么?热力学第一定律是能量守恒定律的推广,它表明能量可以从一种形式转化为另一种形式,但总能量守恒。
数学表达式为ΔU = Q - W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做功。
2. 什么是热容?如何计算物体的热容?热容是物体吸收或释放单位温度变化时所需的热量。
计算物体的热容可以使用公式C = Q/ΔT,其中C表示热容,Q表示吸收或释放的热量,ΔT表示温度变化。
3. 什么是等容过程?等容过程的特点是什么?等容过程是指在恒定体积条件下进行的热力学过程。
在等容过程中,系统对外界做功为零,因为体积不变。
等容过程的特点是内能变化等于吸收的热量,即ΔU = Q。
第二章:理想气体的热力学性质1. 理想气体的状态方程是什么?它的含义是什么?理想气体的状态方程是PV = nRT,其中P表示气体的压强,V表示气体的体积,n表示气体的物质量,R表示气体常数,T表示气体的温度。
这个方程表示了理想气体的状态与其压强、体积、物质量和温度之间的关系。
2. 理想气体的内能与温度有何关系?理想气体的内能与温度成正比,即U ∝ T。
当温度升高时,理想气体的内能也会增加。
3. 理想气体的等温过程与绝热过程有何区别?等温过程是指在恒定温度条件下进行的热力学过程,绝热过程是指在没有热量交换的情况下进行的热力学过程。
在等温过程中,气体的温度保持不变,而在绝热过程中,气体的内能保持不变。
第三章:热力学第二定律1. 热力学第二定律的表述是什么?它有哪些等效表述?热力学第二定律的表述是热量不会自发地从低温物体传递到高温物体。
它有三个等效表述:卡诺定理、克劳修斯不等式和熵增原理。





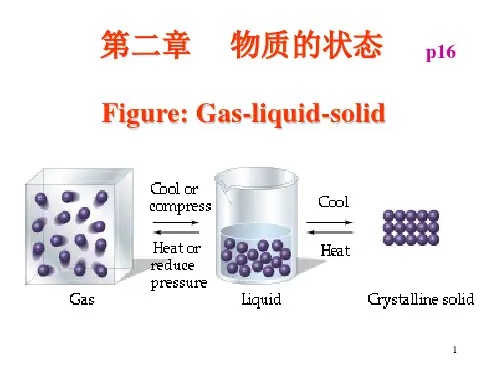
第二章气体的热力性质理想气体与实际气体理想气体比热容混合气体的性质实际气体状态方程对比态定律与压缩因子图理想气体实际气体问题的提出及研究的重要意义热能向机械能转换要靠工质的膨胀来实现,气体具有最好的膨胀性,是最适宜的工质。
因此,气体工质的性质是热力学研究的主要内容气体按工作参数分为:任务:理想气体及其混合物的热力性质基本要求:1. 熟练掌握并正确应用理想气体状态方程。
2. 正确理解理想气体比热的概念。
3. 熟练掌握并正确应用平均比热、定值比热来计算过程热量。
4. 掌握理想气体混合物的成分、摩尔质量和气体常数以及比热的计算。
§2-1 理想气体与实际气体一、理想气体与实际气体△定义:分子是一些弹性的、本身不占体积的质点,分子之间没有相互作用力。
△当气体处于高温低压时,上述假设可以成立△实质:实际气体p→0,或v→∞时的极限状态,理想气体与实际气体没有明显的界限△适用条件:远离液态的气体二、理想气体状态方程的导出由分子运动论可知:nBT c m n p 322322== k B 23=k 是玻尔兹曼常数(J/K);式中:---分子平移运动均方根速度c n --- 1m 3 体积内的分子数;m --- 一个分子的质量;理想气体状态方程式的推导nkT kT n nBT p ===233232等式两边同乘以v 得:RTnvkT pv ==nvkR =nv 是1千克气体所具有的分子数目,它只与气 体的种类有关。
所以R 仅仅与气体的种类有关,而 与气体的状态无关,称为气体常数。
式中: p —绝对压力 P a v —比体积 m 3/kg T —热力学绝对温标 K R —气体常数J /(kg·K )理想气体状态方程式pv =RT △1kg 气体几种常见气体的气体常数见表2-1理想气体状态方程式pV =mRT△mkg 气体: mpv =mRT 式中:V=mv —气体体积 m 3式中: M —千摩尔质量 kg /kmol V m = Mv —千摩尔体积 m 3/k mol R = MR —摩尔气体常量J /(kmol·K )pV m =R 0 T △1kmol 气体:pMv =MRTR 0 与气体的状态及种类无关,是一个特定的常数摩尔气体常量通用气体常数理想气体状态方程式式中: V=nV m —气体体积 m 3p V mA /T=R 0A =p V mB /T=R 0B同温、同压下各种气体, V mA =V mBpV=nR 0 T△n kmol 气体:标准状态下: p 0 =101325Pa T 0 =273.15K 时任何气体:V m 0 =22.4m 3/kmolR 0 =p 0 V m 0 /T 0 = 8314 .5 J /(kmol·K )三、气体常数与通用气体常数1、通用气体常数的导出∵R 0 =MR ∴R=R 0 /M=8314 . 5/M (J /kg·K )2、气体常数的计算(注意单位)m 8.3143kJ 0.287kg K 28.97R R M ===⋅空气空气R m 与R 的区别R m ——通用气体常数m kJ8.3143 []kmol KR =i R ——气体常数m [kJ /kg.K]R R M=例如与气体种类无关与气体种类有关四、使用状态方程的注意点¾状态方程反映平衡态状态参数之间的数量关系,它只能用于平衡态,不能用于过程计算。

第二章理想气体的性质2-1 已知氮气的摩尔质量 M=28.1×10-3kg/mol,求(1) N2 的气体常数 Rg;(2)标准状态下 N2 的比体积 v0 和密度ρ0;(3)标准状态 1 米3 N2的质量 m0 ;(4)p=0.1MPa,t=500℃时 N2 的比体积 v 和密度ρ;(5)上述状态下的摩尔体积 Vm 。
解:(1)通用气体常数R=8.3145J/(mol·K),由附表查得MN2 =28.01×10-3kg/mol。
RgN2 = R/ M=8.3145J/(mol·K)/ 28.01×10-3kg/mol=0.297 kJ/(kg·K)(2)1mol 氮气标准状态时体积为 Vm N2=Mv N2 =22.4×10-3 m 3 /molv N2 = Vm N2/ M=22.4×10-3m3/mol/28.01×10-3kg/mol=0.8m 3 /kg(标准状态)ρN2 =1/ vN2=1/0.8m3 / kg=1.25kg/m 3(标准状态)(3)标准状态下 1 米 3 气体的质量即为密度ρ,等于 1.25kg。
(4)由理想气体状态方程式 pv=RgT,可得v= RgT/ p=297J/(kg·K)×(500 + 273)K/0.1×106Pa= 2.296m3/kgρ =1/ v=1/2.296m3 / kg= 0.4356kg/m3(5)V m =Mv=28.01×10-3 kg/mol × 2.296m3/kg=64.29×10-3 m 3 /mol2-2 压力表测得储气罐中丙烷 C3H8 的压力为 4.4MPa, 丙烷的温度为 120℃,问这时比体积多大?若要储气罐存 1000kg 这种状态的丙烷,问储气罐的体积需多大?解:由附表查得MC3H8 =44.09×10-3kg/molRg,C3H8 =R/ MC3H8=8.3145J/(mol·K)/ 44.09×10?3kg/mol=189J/(kg·K)由 1kg 理想气体状态方程式 pv=RgT 可得v =RgT/ p=189J/(kg·K)×(120 + 273)K/4.4×106Pa= 0.01688m3/kgV=mv=1000kg× 0.01688m3/kg=16.88m 3或由理想气体状态方程 pV=mRgT 可得V = mRgT/ p =1000kg×189J/(kg·K)×(120 + 273)K /4.4×106Pa =16.88m32-3 绝热刚性容器被分隔成两相等的容积,各为1m 3(见图2.1),一侧盛有100℃,2bar 的N 2,一侧盛有20℃,1bar 的CO 2,抽出隔板,两气混合成均匀混合气体。
第2章理想气体的性质本章基本要求:熟练掌握理想气体状态方程的各种表述形式,并能熟练应用理想气体状态方程及理想气体定值比热进行各种热力计算。
并掌握理想气体平均比热的概念和计算方法。
理解混合气体性质,掌握混合气体分压力、分容积的概念。
本章重点:气体的热力性质,状态参数间的关系及热物性参数,状态参数(压力、温度、比容、内能、焓、熵)的计算。
2.1 理想气体状态方程一、理想气体与实际气体定义:气体分子是一些弹性的,忽略分子相互作用力,不占有体积的质点,注意:当实际气体p→0 v→∞的极限状态时,气体为理想气体。
二、理想气体状态方程的导出状态方程的几种形式1.RTpv=适用于1千克理想气体。
式中:p—绝对压力Pav—比容m3/kg,T—热力学温度K2.mRTpV=适用于m千克理想气体。
式中V—质量为m kg气体所占的容积3.T=适用于1千摩尔理想气体。
RpVM0式中V M=M v—气体的摩尔容积,m3/kmol;R0=MR—通用气体常数,J/kmol·K4.T=适用于n千摩尔理想气体。
nRpV式中V —nKmol 气体所占有的容积,m 3;n —气体的摩尔数,M m n =,kmol 5.222111T v P T v P = 6.222111T V P T V P = 仅适用于闭口系统 状态方程的应用:1.求平衡态下的参数2.两平衡状态间参数的计算3.标准状态与任意状态或密度间的换算4.气体体积膨胀系数例1:体积为V 的真空罐出现微小漏气。
设漏气前罐内压力p 为零,而漏入空气的流率与(p 0-p )成正比,比例常数为α,p 0为大气压力。
由于漏气过程十分缓慢,可以认为罐内、外温度始终保持T 0不变,试推导罐内压力p 的表达式。
解:本例与上例相反,对于罐子这个系统,是个缓慢的充气问题,周围空气漏入系统的微量空气d m '就等于系统内空气的微增量d m 。
由题设条件已知,漏入空气的流率ατ='d d m (p 0-p ),于是: )(p p m m -='=0d d d d αττ (1) 另一方面,罐内空气的压力变化(d p )与空气量的变化(d m )也有一定的关系。