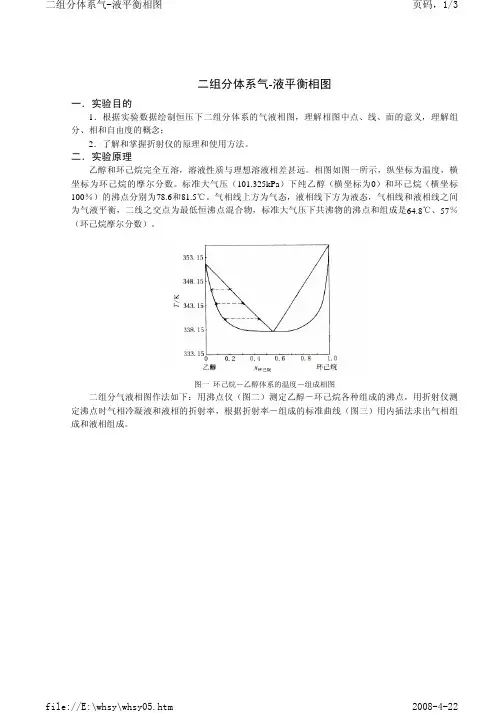
液平衡相图
- 格式:ppt
- 大小:302.00 KB
- 文档页数:22


双液系的气-液平衡相图一实验目的1.绘制在pθ下环己烷-异丙醇双液系的气-液平衡相图,了解相图和相律的基本概念;2.掌握测定双组分液体的沸点及正常沸点的方法;3.掌握用折光率确定二元液体组成的方法。
二实验原理在常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例互溶,则称完全互溶双液体系,若只能部分互溶,则称部分互溶双液体系。
液体的沸点是指液体的蒸汽压与外界压力相等时的温度,在一定的外压下,纯液体的沸点有其特定值,但双液系的沸点不仅与外压有关而且还与两种液体的相对含量有关。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图中于 (a)。
而实际溶液由于A 和B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图2-4-1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验是用回流冷凝法测定环已烷—异丙醇体系的沸点—组成图。
其方法是用阿贝折射仪测定不同组成的体系,在沸点温度时气、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制沸点—组成图。
三仪器和试剂沸点仪1套;恒温槽1台;阿贝折射仪1台;量筒8个;玻璃漏斗8个;滴管2个;环己烷(分析纯);异丙醇(分析纯);实验装置如下:四实验步骤1.工作曲线的绘制配制环己烷的质量百分数0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70, 0.80和0.90的环己烷-异丙醇溶液。
计算所需环己烷和异丙醇的质量,并用分析天平准确称取。
为避免样品挥发带来的误差,称量应尽可能的迅速。
各种溶液的确切组成要按照实际称样结果精确计算。
调节超级恒温水浴的温度为35度,使阿贝折光仪上温度与其保持一致。
分别测定上述九个溶液以及异丙醇和环己烷的折光率。
根据这些数据作出折光率-组成工作曲线。

实验四 双液系的气-液平衡相图的绘制一、目的要求1.用沸点仪测定大气压下乙醇—环己烷或异丙醇-环己烷双液系气-液平衡时气相与液相组成及平衡温度,绘制温度—组成图,确定恒沸混合物的组成及恒沸点的温度。
2.了解物化实验中光学方法的基本原理,学会阿贝折光仪的使用。
3.进一步理解分馏原理。
二、预习要求1.理解分馏原理,了解影响双液系气-液平衡的因素。
2.熟悉阿贝折光仪的使用方法,了解折射率与物系组成的关系。
3.掌握如何由实验数据绘制t x -相图的方法。
三、实验原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系。
两种液体若能按任意比例互相溶解,称为完全互溶的双液系;若只能在一定比例范围内互相溶解,则称部分互双液系。
双液系的气液平衡相图t x -图可分为三类。
如图4.1。
图 4.1 二元系统t x -图这些图的纵轴是温度(沸点),横轴是代表液体B 的摩尔分数B x 。
在t x -图中有两条曲线:上面的曲线是气相线,表示在不同溶液的沸点时与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
例如图4.1(a)中对应于温度t 1的气相点为y 1,液相点为1l ,这时的气相组成y 1点的横轴读数是g B x ,液相组成点1l 点的横轴读数为lB x 。
y 1l 1t 1g B x l B x A B t/℃(a )气液t/℃A B B x →(b )t/ ℃气液A B B x →(c )如果在恒压下将溶液蒸馏,当气液两相达平衡时,记下此时的沸点,并分别测定气相图。
(馏出物)与液相(蒸馏液)的组成,就能绘出此t x图4.1(b)上有个最低点,图4.1(c)上有个最高点,这些点称为恒沸点,其相应的溶液称为恒沸混合物,在此点蒸馏所得气相与液相组成相同。
四、仪器和药品1.仪器玻璃沸点仪一套;阿贝折光仪一台;WLS系列可调式恒流电源一台;SWJ型精密数字温度计一台;SYC超级恒温槽一台。
2.药品无水乙醇(AR)或异丙醇(AR);环己烷(AR)。


双液体系气—液平衡相图的绘制一、实验目的1. 绘制环己烷—异丙醇双液体系的沸点组成图,确定其恒沸组成和恒沸温度。
2. 掌握回流冷凝管法测定溶液沸点的方法。
3.掌握阿贝折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不 同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
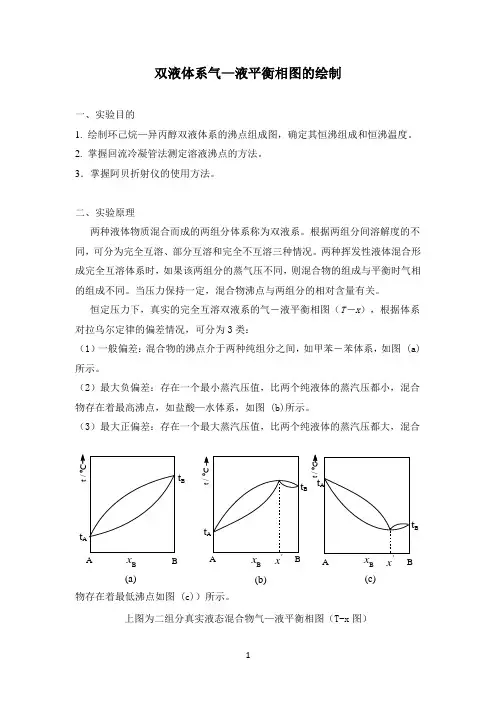
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图 (a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图 (b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图 (c))所示。
上图为二组分真实液态混合物气—液平衡相图(T-x 图)t At AtAt Bt B t Bt / o Ct / o t / o x Bx Bx BABAABB(a)(b)(c)x 'x '后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-异丙醇为体系,该体系属于上述第三种类型,在沸点仪中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
本实验中两相的成分分析均采用折光率法测定。
三、仪器与试剂1、仪器:沸点仪1台;调压变压器1台;阿贝折射仪1台;温度计(0-100℃) 1支;长滴管1个;短滴管2支;2、试剂:环己烷(分析纯);异丙醇(分析纯)异丙醇—环己烷标准溶液(异丙醇分别为0.20,0.40,0.50,0.60,0.80,0.90)四、主要实验步骤1. 测定环己烷、异丙醇及标准溶液的折射率调节阿贝折射仪,用一支干燥的短滴管吸取环己烷数滴,注入折射仪的加液孔内,测定其折射率n,读数两次,取其平均值。
实验四双液系气液平衡相图的绘制姓名:谭成彬班级:生物工程学院生物工程07级四班学号;07041010428一、实验目的1.测定常压下环己烷—乙醇二元系统的气液平衡数据,绘制沸点—组成相图。
2.掌握双组份沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝斯折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组间分溶解度不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合成完全互溶体系时,如果该两组分的蒸汽压不同,则混合物的组成于平衡的气相的组成不同。
当压力保持一定,混合物沸点与两组分的含量有关。
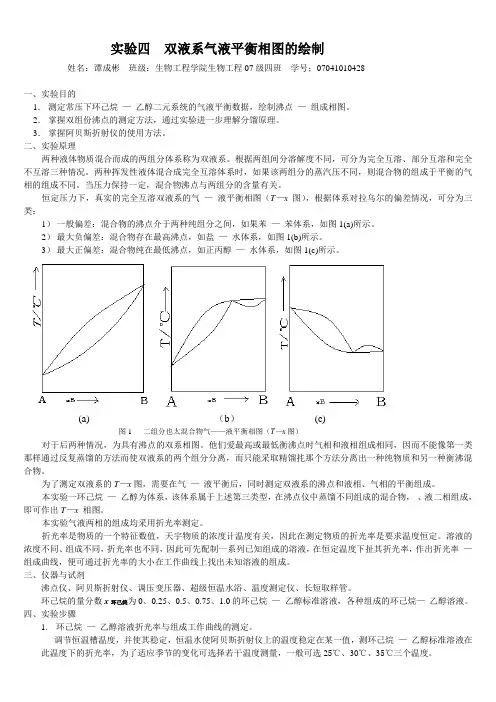
恒定压力下,真实的完全互溶双液系的气—液平衡相图(T—x图),根据体系对拉乌尔的偏差情况,可分为三类:1)一般偏差:混合物的沸点介于两种纯组分之间,如果苯—苯体系,如图1(a)所示。
2)最大负偏差:混合物存在最高沸点,如盐—水体系,如图1(b)所示。
3)最大正偏差:混合物纯在最低沸点,如正丙醇—水体系,如图1(c)所示。
(a) (b)(c)图1 二组分也太混合物气——液平衡相图(T—x图)对于后两种情况,为具有沸点的双系相图。
他们爱最高或最低衡沸点时气相和液相组成相同,因而不能像第一类那样通过反复蒸馏的方法而使双液系的两个组分分离,而只能采取精馏扥那个方法分离出一种纯物质和另一种衡沸混合物。
为了测定双液系的T—x图,需要在气—液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验一环己烷—乙醇为体系,该体系属于上述第三类型,在沸点仪中蒸馏不同组成的混合物,、液二相组成,即可作出T—x 相图。
本实验气液两相的组成均采用折光率测定。
折光率是物质的一个特征数值,天宇物质的浓度计温度有关,因此在测定物质的折光率是要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同,因此可先配制一系列已知组成的溶液,在恒定温度下扯其折光率,作出折光率—组成曲线,便可通过折光率的大小在工作曲线上找出未知溶液的组成。


双液系气——液平衡相图实验项目改进措施探讨
双液系气-液平衡相图实验是一种常用的实验手段,可以用来检测液体和气体之间的相互作用机理。
为了更好地提高实验效果,可以采取一些措施进行改进。
1. 优化实验设备:双液系气-液平衡相图实验需要使用到高精度的设备,如温度传感器、压力传感器等,这些设备的准确性对实验结果影响较大。
因此,为了提高实验结果的准确性,应该优化实验设备,使其能够准确的测量和记录实验数据。
2. 增加实验次数:双液系气-液平衡相图实验需要进行多次实验,以便获得更多的数据,从而更准确地分析实验结果。
因此,建议增加实验次数,以获得更多的实验数据。
3. 调整实验参数:双液系气-液平衡相图实验的实验参数,如温度、压力等,对实验结果也有很大的影响。
因此,在实验中,应根据实验需要,适当调整实验参数,以获得更准确的实验结果。
4. 加强实验记录:双液系气-液平衡相图实验要求将实验数据准确记录下来,以便日后分析比较实验结果。
因此,建议加强实验记录,使实验数据准确可靠。