DPPH自由基SOP
- 格式:doc
- 大小:30.00 KB
- 文档页数:3

氮⾃由基(DPPH)清除⼀.实验原理:DPPH(11-Diphenyl-2-picrylhydrazyl radical)即11-⼆苯基-2-苦基肼基⾃由基,DPPH⾃由基是⼀种较稳定的含氮⾃由基,有⼀个单电⼦,在517nm下有强吸收,如果有其他物质提供⼀个电⼦使此单电⼦配对,其吸收会消失褪⾊,褪⾊程度与接受电⼦的量呈正⽐。
即反应物清除氮⾃由基的能⼒与试剂在517nm的吸光值成反⽐。
⼆.实验仪器:分光光度计三.实验试剂:试剂⼀:DPPH试剂1mL×1瓶试剂⼆:100µg/mL 维⽣素C标准溶液 20mL×1瓶四.溶液配制:试剂⼀:37℃平衡20min以上,待试剂融化后,在试剂瓶中加⼊100ml 95%⼄醇或⽆⽔⼄醇,剧烈震荡使试剂充分溶解。
注意:溶解⼀定要充分,如有条件可采⽤超声波助溶。
试剂⼆应⽤液:根据是否需要制作阳性对照标准曲线有两种配制⽅法。
1. 如仅需要将维⽣素C作为质控品,可取100µL 试剂⼆,加⼊900µL样品稀释液,充分混匀;2. 如需测定维⽣素C的IC50,可分别移取0,0.5,1.0,1.5,2.0,2.5,3.0,4.0,5.0mL 试剂⼆于空离⼼管中,再依次加⼊10.0,9.5,9.0,8.5,8,7.5,7.0,6.0,5.0ml样品稀释液,充分混匀。
配制成0,5,10,15,20,25,30,40,50 µg/mL 维⽣素C样品。
五.实验步骤:六.清除能⼒计算:氮(DPPH)⾃由基清除清除能⼒(%)=[空⽩孔吸光值-(测定孔吸光值-对照孔吸光值)]/空⽩孔吸光值*100%七.注意事项:1. 如样品中⾊素物质不是分析对象,建议先通过SEP C18柱进⾏脱⾊处理,处理后样品可不做对照孔;2. 如不确定样品的氮⾃由基清除能⼒,可先做不同浓度的稀释液进⾏摸索,并选择适宜浓度进⾏测定,⾼浓度下,浓度与清除率间并不线性相关。

DPPH法测定黄苓黄酮的抗氧化活性抗氧化就是任何以低浓度存在就能有效抑制自由基的氧化反应的物质,其作用机理可以是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。
目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中DPPH法是体外模型中最常用的方法。
DPPH又称1,1-二苯基-2-三硝基苯肼,是一种很稳定的氮中心的自由基,他的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。
它的无水乙醇溶液呈紫色,在517nm波长处有最大吸收,吸光度与浓度呈线性关系。
向其中加入自由基清除剂时,可以结合或替代DPPH •使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力。
即通过在517nm波长处检测样品清除DPPH •的效果,来计算抗氧化能力。
实验研究表明,黄苓黄酮中清除DPPH自由基活性的主要成分是黄苓苷[1],黄苓苷中含有羧羟基和酚羟基能与DPPH反应,反应式如下:O2NN02 NO2DPPH与抗氧化剂反应原理材料:DPPH( 1,1-二苯基-2-三硝基苯肼);无水乙醇;仪器:分光光度计1. DPPH贮备液的制备准确称取DPPH试剂3 . 5mg,用无水乙醇溶解,并定量转入10mL容量瓶中,用无水乙醇定容至刻度,取2mL至100ml容量瓶中,摇匀得浓度为0.0178mmol / L DPPH贮备液,置于冰箱中冷藏备用。
2. 试液的制备(只作参考)准确称取5.2mg干燥的黄酮提取物(32.75%),用无水乙醇溶解,并定量转入50ml容量瓶中,用无水乙醇定量至刻度,取10ml至100ml容量瓶中,摇匀得浓度为0.0233mmol/L 试液。
3. DPPH-清除率的测定在10mL比色管中依次加入 4.0mLDPPH溶液和黄酮提取液,再加入无水乙醇至刻度,混匀立即用1cm比色皿在517nm波长处测吸光值(A),吸光值记为Ai,再在温室避光保存30min后测吸光值,记为Aj,对照试验为只加DPPH的乙醇溶液,其吸光值记为Ac。

DPPH·自由基清除法(修改版)李熙灿(广州中医药大学中药学院, 2019.6)【原理】1,1-二苯基-2-苦基肼基自由基, 1,1-Diphenyl-2-picrylhydrazyl radical, 简称为DPPH·自由基。
由于分子中存在大π键,所以,该自由基能稳定存在。
且在519nm处,有最大吸收波长。
当DPPH·自由基被清除时,其在519nm处的吸光度(A519nm),会相应地减少。
因此,通过检测A519nm值,可以判断DPPH·是否被清除。
如果某个样品能清除DPPH·,就具有一定的自由基清除活性(或称“抗氧化活性”)。
【操作图解】【计算公式】【说明】1. 样品溶液的浓度,也是可以调整的。
不过,为了方便实验,宜配高浓度(如3mg/mL)。
2. 操作图解中的用量,都是可以调整的,需要自行摸索。
3. 当样品溶液的加入量为0 μL 时,所测得的A值即为A0。
4. 实验最好做三个平行样,以减少误差。
【实例】二氢杨梅素的DPPH清除实验的结果二氢杨梅素样品:浓度:0.1mg/ml 溶剂:95%乙醇数据整理:二氢杨梅素原始数据:水溶液中“普用”自由基清除的实验操作图2019.6 【参考文献】Xican Li. 2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl 3-oxide (PT IO•) Radical-scavenging: A New and Simple Antioxidant. Journal of Agricultural & Food Chemistry. 2017, 65, 6288−6297.【简介】“普用”自由基,原名是PTIO自由基。
它是一种能溶于水的自由基,所以,可以在水溶液中进行自由基的清除实验。
这比DPPH自由基清除实验更合理;因为DPPH自由基清除只能是有机溶剂(如乙醇、甲醇)中进行。

2024DPPH清除自由基方法2024年,一种新的清除自由基的方法被引入,该方法使用DPPH试剂。
DPPH(1,1-二苯基-2-三甲基-苦基-2-脒基),是一种广泛应用于生物医学研究中的人工氧化剂。
DPPH试剂呈紫色,并且可与捕获自由基反应后转变成无色。
因此,通过测量DPPH试剂的颜色变化,可以评估抗氧化物质对自由基的清除能力。
DPPH清除自由基方法是一种简单、快速且经济的方法。
它适用于各种类型的样品,包括天然产物、食品、药物和化妆品。
使用DPPH试剂测定抗氧化能力的方法主要有两种:溶液试剂法和固相试剂法。
溶液试剂法是最常用的DPPH清除自由基方法之一、在这种方法中,首先将DPPH试剂以适当浓度溶解在溶剂中,通常使用甲醇或乙醇。
然后,将样品与DPPH溶液混合,反应一定时间。
在反应过程中,DPPH试剂将与样品中的抗氧化物质反应,使DPPH试剂转变为无色。
通过测量反应溶液的吸收光谱或测定其吸光度的变化,可以计算出样品的清除自由基能力。
固相试剂法是一种近年来发展起来的新方法。
在这种方法中,固定DPPH试剂在固相载体上,通常使用硅胶或其他吸附剂。
样品溶液被滴加到载体上,自由基会与固相DPPH试剂发生反应,并转变成无色。
然后,通过测量吸附剂的颜色变化或对比吸附剂的吸光度,可以确定样品的清除自由基能力。
DPPH清除自由基方法的优点之一是它不需要复杂的仪器设备,因此可以应用于各种实验室条件。
此外,DPPH试剂的制备相对简单,价格也相对较低。
这使得DPPH清除自由基方法成为研究抗氧化剂的吸引人选择。
然而,DPPH清除自由基方法也存在一些限制。
首先,DPPH试剂只能评估清除自由基的能力,而不能提供有关抗氧化物质的详细信息。
此外,该方法不能区分不同类型的自由基,因此不能用于研究具体自由基类型的清除能力。
最后,溶液试剂法和固相试剂法都需要一定时间的反应才能得到准确的结果,这可能会造成实验中的误差。
总的来说,DPPH清除自由基方法是一种简单有效的方法,用于评估样品的抗氧化能力。
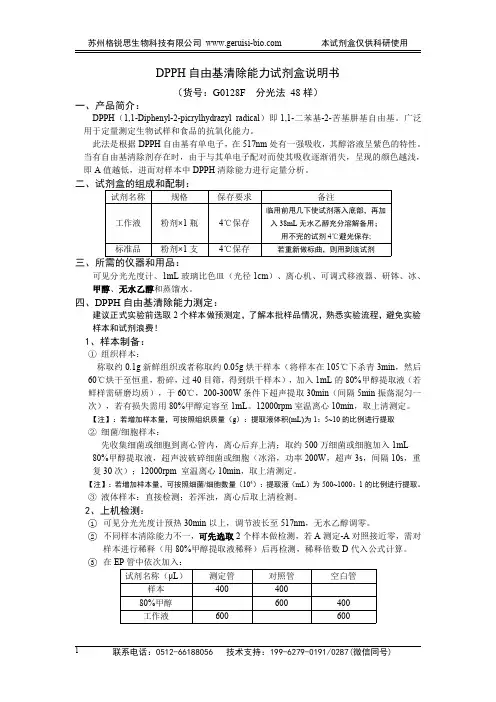
DPPH自由基清除能力试剂盒说明书(货号:G0128F分光法48样)一、产品简介:DPPH(1,1-Diphenyl-2-picrylhydrazyl radical)即1,1-二苯基-2-苦基肼基自由基。
广泛用于定量测定生物试样和食品的抗氧化能力。
此法是根据DPPH自由基有单电子,在517nm处有一强吸收,其醇溶液呈紫色的特性。
当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,呈现的颜色越浅,即A值越低,进而对样本中DPPH清除能力进行定量分析。
二、试剂盒的组成和配制:试剂名称规格保存要求备注工作液粉剂×1瓶4℃保存临用前甩几下使试剂落入底部,再加入38mL无水乙醇充分溶解备用;用不完的试剂4℃避光保存;标准品粉剂×1支4℃保存若重新做标曲,则用到该试剂三、所需的仪器和用品:可见分光光度计、1mL玻璃比色皿(光径1cm)、离心机、可调式移液器、研钵、冰、甲醇、无水乙醇和蒸馏水。
四、DPPH自由基清除能力测定:建议正式实验前选取2个样本做预测定,了解本批样品情况,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①组织样本:称取约0.1g新鲜组织或者称取约0.05g烘干样本(将样本在105℃下杀青3min,然后60℃烘干至恒重,粉碎,过40目筛,得到烘干样本),加入1mL的80%甲醇提取液(若鲜样需研磨均质),于60℃,200-300W条件下超声提取30min(间隔5min振荡混匀一次),若有损失需用80%甲醇定容至1mL。
12000rpm室温离心10min,取上清测定。
【注】:若增加样本量,可按照组织质量(g):提取液体积(mL)为1:5~10的比例进行提取②细菌/细胞样本:先收集细菌或细胞到离心管内,离心后弃上清;取约500万细菌或细胞加入1mL 80%甲醇提取液,超声波破碎细菌或细胞(冰浴,功率200W,超声3s,间隔10s,重复30次);12000rpm室温离心10min,取上清测定。

主要目的:——为了测定样品清除DPPH自由基的能力。
主要原理:——自由基清除剂与DPPH单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用酶标仪进行快速的定量分析。
实验室签章一、试剂——1 ,1-二苯基-1-苦味肼基自由基(DPPH)——甲醇(分析纯)二、仪器设备——96孔酶标板——UV-Vis可见多功能酶标仪——移液枪——200 µL量程枪头三、实验方法◆前期准备配置2 g/L 的DPPH甲醇标准溶液。
◆DPPH自由基清除能力参照Brand-Williams (1995)[1]报道的方法,将其稍加改动后应用在96孔酶标板中[2]。
在酶标板的每孔中,依次加入不同体积(10、20、30、40、50、60、70、80、90和100 µL)的样品溶液和200 μL的DPPH标准溶液(2 g/L),最后用甲醇溶液补齐至总体积300 µL。
室温反应30 min后,于515 nm下用UV-Vis可见多功能酶标仪测定其吸光度(EL 340, Bio-Tek Instruments, Inc., Winooski, VT, USA)。
番茄样品消除自由基的能力表示为EC50(清除1 µg DDPH至50 %所需的样品用量(µg干重))。
EC50越小,表示抗氧化活性越高。
平行测定三次,取平均值计算。
清除DPPH自由基能力用如下公式计算:清除率%=(1-Ac AjAi)×100%其中:Ai为样品溶液加DPPH试剂混合液的吸光度,Aj为样品溶液加甲醇的吸光度,Ac为DPPH溶液加样品溶剂的吸光度。
[1] Brand-Williams W, Cuvelier M E. Berset C. Use of a free radical method to evaluateantioxidant activity [J]. LWT - Food Science and Technology, 1995, 28(1): 25-30.[2] Verma A R, Vijayakumar M, Rao C V. Mathela C S. In vitro and in vivo antioxidant propertiesand DNA damage protective activity of green fruit of Ficus glomerata [J]. Food and Chemical Toxicology, 2010, 48(2): 704-709.。
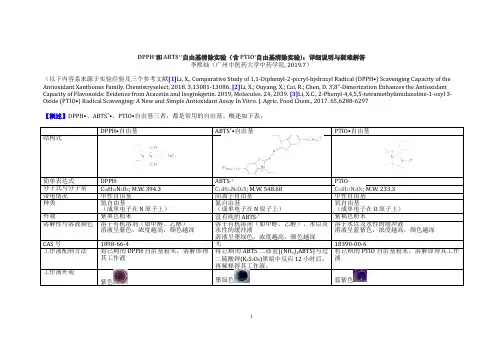
DPPH•和ABTS+•自由基清除实验(含PTIO•自由基清除实验):详细说明与疑难解答李熙灿(广州中医药大学中药学院, 2019.7)(以下内容系来源于实验经验及三个参考文献[1]Li, X., Comparative Study of 1,1-Diphenyl-2-picryl-hydrazyl Radical (DPPH•) Scavenging Capacity of the Antioxidant Xanthones Family. Chemistryselect, 2018. 3,13081-13086. [2]Li, X.; Ouyang, X.; Cai, R.; Chen, D. 3’,8”-Dimerization Enhances the Antioxidant Capacity of Flavonoids: Evidence from Acacetin and Isoginkgetin. 2019, Molecules. 24, 2039. [3]Li, X.C., 2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl 3-Oxide (PTIO•) Radical Scavenging: A New and Simple Antioxidant Assay In Vitro. J. Agric. Food Chem., 2017. 65,6288-6297【概述】DPPH•、ABTS+•、PTIO•自由基三者,都是常用的自由基。
概述如下表:ABTS•自由基ABTS·+再稀释得其工作液。
紫色墨绿色蓝紫色1(50 μg/mL) (50 μg/mL)(0.07mM (NH)ABTS+0.03mM K S O)2(2)其抗氧化活性,实际上是清除氮自由基的活性(而不是氧自由基)。
(3)虽然DPPH的清除主要是HAT抽制,但是在不同溶剂中,其抗氧化机制是不同的,还可能有ET等。

DPPH法测定黄芩黄酮的抗氧化活性抗氧化就是任何以低浓度存在就能有效抑制自由基的氧化反应的物质,其作用机理可以是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。
目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中DPPH法是体外模型中最常用的方法。
DPPH又称1,1-二苯基-2-三硝基苯肼,是一种很稳定的氮中心的自由基,他的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。
它的无水乙醇溶液呈紫色,在517nm波长处有最大吸收,吸光度与浓度呈线性关系。
向其中加入自由基清除剂时,可以结合或替代DPPH·,使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力。
即通过在517nm波长处检测样品清除DPPH·的效果,来计算抗氧化能力。
实验研究表明,黄芩黄酮中清除DPPH自由基活性的主要成分是黄芩苷[1],黄芩苷中含有羧羟基和酚羟基能与DPPH反应,反应式如下:N N+O2NO2NNO2H+N NHO2NO2NNO2 DPPH与抗氧化剂反应原理材料:DPPH(1,1-二苯基-2-三硝基苯肼);无水乙醇;仪器:分光光度计1.DPPH贮备液的制备准确称取DPPH试剂3.5mg,用无水乙醇溶解,并定量转入10mL容量瓶中,用无水乙醇定容至刻度,取2mL至100ml容量瓶中,摇匀得浓度为0.0178mmol/L DPPH贮备液,置于冰箱中冷藏备用。
2.试液的制备(只作参考)准确称取5.2mg干燥的黄酮提取物(32.75%),用无水乙醇溶解,并定量转入50ml容量瓶中,用无水乙醇定量至刻度,取10ml至100ml容量瓶中,摇匀得浓度为0.0233mmol/L 试液。
3.DPPH·清除率的测定在10mL比色管中依次加入4.0mLDPPH溶液和黄酮提取液,再加入无水乙醇至刻度,混匀立即用1cm比色皿在517nm波长处测吸光值(A),吸光值记为Ai,再在温室避光保存30min后测吸光值,记为Aj,对照试验为只加DPPH的乙醇溶液,其吸光值记为Ac。

DPPH 自由基清除能力检测试剂盒说明书可见分光光度法货号:BC4750 规格:50T/24S产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称 规格 保存条件 提取液 液体50 mL×1瓶 2-8℃保存 试剂一 液体60 mL×1瓶(自备)常温保存 试剂二 粉剂×1瓶 2-8℃保存 试剂三粉剂×1支2-8℃保存溶液的配制:1、 试剂一:无水乙醇自备;2、 试剂二:粉剂置于瓶内EP 管中。
临用前加入6.08 mL 试剂一振荡溶解,用不完的试剂可于-20℃保存1个月,建议分装保存,避免反复冻融;临用前根据试验所需量按照试剂二:试剂一(V:V )= 4:21的比例配制成工作液,现配现用,用不完的工作液可于2-8℃保存一周;3、 试剂三:10 mg 维生素C 。
临用前加入1 mL 提取液,充分振荡溶解,配成10 mg/mL 维生素C 溶液,2-8℃保存两周;用于阳性对照。
产品说明:DPPH 自由基一种很稳定的氮中心的自由基,是样本抗氧化能力的重要指标之一,广泛应用于抗氧化类食品、保健品及药品的研究中。
DPPH 自由基有单电子,其醇溶液呈紫色,在515 nm 处有强吸收。
当有抗氧化剂存在时,DPPH 自由基被清除,其溶液颜色变浅,515 nm 的吸光度下降,在一定范围内其吸光度的变化与自由基被清除的程度成正比。
本试剂盒中,通过吸光度下降的程度来反映样本清除DPPH 自由基的能力。
DPPH · DPPH ·H注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、1 mL 玻璃比色皿、恒温水浴锅、台式离心机、无水乙醇、研钵/粉碎机、烘干箱、30~50目筛和蒸馏水。
操作步骤:一、样本的制备(可适当调整待测样本量,具体比例可以参考文献)(1)植物样本的制备:将新鲜样本置于60℃烘箱烘干至恒重,研钵研碎(或粉碎机粉碎),过30~50目筛。

dpph自由基清除原理
DPPH自由基清除原理是指通过DPPH(2,2-二苯基-1-苦味肼)这种常用的自由基抗氧化剂来评价植物提取物或化合物的抗氧化性能。
DPPH是一种紫色自由基分子,其在溶液中呈金黄色。
当遇到捕获电子的抗氧化物质时,DPPH自由基中的氮原子上
的单独电子会被转移给抗氧化剂,使DPPH自由基变为无色。
这个转变过程可以通过测量溶液的吸光度变化来定量评估抗氧化能力。
在实验中,通常用DPPH溶液滴加待测物质溶液,
并观察溶液的颜色变化。
颜色越浅,表示抗氧化能力越强。
通过测量DPPH清除率,可以定量评估化合物或提取物的抗氧
化活性。
该方法简单、迅速且成本较低,因此被广泛应用于抗氧化剂的筛选与评价。
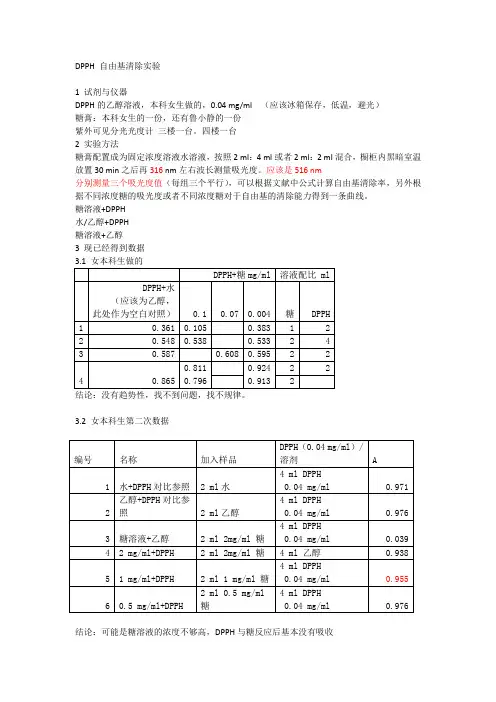
DPPH 自由基清除实验1 试剂与仪器DPPH的乙醇溶液,本科女生做的,0.04 mg/ml (应该冰箱保存,低温,避光)糖膏:本科女生的一份,还有鲁小静的一份紫外可见分光光度计三楼一台。
四楼一台2 实验方法糖膏配置成为固定浓度溶液水溶液,按照2 ml:4 ml或者2 ml:2 ml混合,橱柜内黑暗室温放置30 min之后再316 nm左右波长测量吸光度。
应该是516 nm分别测量三个吸光度值(每组三个平行),可以根据文献中公式计算自由基清除率,另外根据不同浓度糖的吸光度或者不同浓度糖对于自由基的清除能力得到一条曲线。
糖溶液+DPPH水/乙醇+DPPH糖溶液+乙醇3 现已经得到数据3.2 女本科生第二次数据结论:可能是糖溶液的浓度不够高,DPPH与糖反应后基本没有吸收3.3 鲁小静师姐样品结论:DPPH可能浓度偏大,与相应的DPPH相比,10 mg/ml浓度糖溶液与DPPH反应刚刚合适,按照网上公示计算,大概清除率为48 %4 试验计划4.1 存在问题:DPPH浓度太高了,吸光度太高,需要降低DPPH浓度,或者是改变糖溶液与DPPH配比。
糖溶液的浓度需要重新调节。
使之差不多能达到3.3中A=0.509的比例10 mg/ml 糖溶液,吸光度A=0.509时溶液具体分析:4.2 试验计划10mg/ml浓度的糖与DPPH混合得到吸光度大概0.509,相对应如果按照2 ml加入2 ml 可能需要糖的浓度降低一倍。
计划:每个浓度要测三组吸光度值,每组三个重复A0:水(2mL)+DPPH(2mL)A1:糖(2mL)+DPPH(2mL)A2:糖(2mL)+水(2mL)。
1 DPPH 自由基清除/PTIO 自由基清除实验:实验流程图2018.4【前言】体内(细胞内)的自由基,可以分为两类:活性氧(ROS ,Reactive oxygen species )和活性氮(RNS ,Reactive nitrogen species )。
ROS 主要有羟基自由基·OH ,过氧自由基(·O 2-),脂质过氧自由基(LOO ·)等;RNS 主要有一氧化氮(·NO )等。
这些ROS 和RNS 如果过量堆积,会引起氧化应激,发生各种病变,加速机体衰老。
许多植物(特别是中药),对ROS 和RNS 都有较强的清除作用,这种清除作用可以缓解氧化应激,故称为抗氧化。
为了评价抗氧化活性的强弱,生物化学家建立了一系列的评价方法。
最常见的是DPPH 自由基清除法。
DPPH 自由基结构如下: NH N O 2N O 2NNO 2.其全称有数个:(1)1,1-二苯基-2-三硝基苯肼基自由基;(2)1,1-二苯基-2-苦肼基自由基;(3)2,2-二苯基-1-苦肼基自由基;(4)2,2-二苯基-1-三硝基苯肼基自由基;(5)α,α-二苯基-β-苦肼基自由基。
尽管如此,其简称都是“DPPH 自由基”。
RNS 和ROS 都是不稳定的(如·OH ,·O 2-, LOO ·,·NO ),很难直接评价。
不过,DPPH 自由基较稳定,因为N 原子上那个成单电子,可以与苯环形成p-π共轭。
稳定的DPPH 自由基的甲醇或乙醇溶液呈深紫红色,并在519 nm 范围有最大吸收峰。
当向DPPH 自由基溶液中加入自由基清除剂(抗氧化剂)时,成单被配对,深紫色的DPPH 自由基被还原成黄色DPPH-H 分子,其褪色程度与所接受的电子数量成定量关系,因而可以通过吸光度的变化进行定量分析。
当DPPH 自由基与抗氧化剂反应后,519nm 波长处的吸收值降低,其降低的程度与接收的电子(抗氧化剂清除自由基活性)呈定量关系,可以用分光光度计测定。
DPPH自由基自由基是一种具有未成对电子的高度活性分子或离子,它们在生物体内的氧化还原反应中扮演着重要角色。
DPPH自由基是一种被广泛应用于评估抗氧化性能的化学试剂。
本文将探讨DPPH自由基的特性、作用机制以及在科研领域中的应用。
DPPH自由基的特性DPPH自由基全称2,2-二苯基-1-苦味肼,是一种具有深紫色的自由基。
其核心结构中包含一个氮原子和一个苯环,使其与其他自由基发生反应产生有机物的变化。
DPPH自由基通常用于测定食品、植物提取物等样品的抗氧化性能,因其简便、可靠被广泛应用于生物化学研究领域。
DPPH自由基的作用机制DPPH自由基的作用机制是通过捕捉其未成对电子,从而形成稳定的双电子产物。
在反应中,DPPH自由基的深紫色逐渐消退,从而使得反应物溶液由紫色转变为无色。
该反应可通过光谱法进行监测,根据吸光度变化定量分析待测物中的抗氧化成分含量。
DPPH自由基的应用DPPH自由基在科研领域中具有广泛应用,主要包括以下几个方面:•评估抗氧化性能: DPPH自由基可以用作评估样品的抗氧化性能的指标。
通过与待测物样品发生反应后测定残留DPPH自由基的含量,可以间接反映样品中抗氧化物质的含量和活性。
•筛选抗氧化剂: DPPH自由基反应可直观地显示待测物对自由基的清除能力,可用于筛选具有较高抗氧化活性的抗氧化剂,并用于研究新型抗氧化剂的发现。
•研究氧化还原反应: DPPH自由基还可用于研究氧化还原反应机理和动力学过程,帮助深入了解自由基参与的生物化学反应。
结语DPPH自由基在抗氧化研究领域中扮演着不可或缺的角色,其作用机制简单、易操作,并被广泛应用于抗氧化物质的评估和筛选。
通过对DPPH自由基的深入研究,可以更好地认识自由基反应的特征和生物体内氧化还原反应的机理,为开发新型抗氧化剂和保健食品提供重要参考。
欢迎广大读者深入阅读DPPH自由基相关文献,更全面地了解其在科研领域中的重要价值和应用前景。
DPPH自由基清除实验教学(详细版) —以高香草酸为例【仪器与试剂】1.仪器可见分光光度计;SB3200D超声波清洗机;电子天平(BS110S);BIOHIT单道手动可调移液器(10-100μL、100-1000μL、1000-5000μL);微量比色皿。
2.试剂高香草酸(AR)、DPPH(AR)、无水乙醇(AR);【原理】根据文献[1]可知,DPPH(1,1-Diphenyl-2-picrylhydrazyl radical)即1,1-二苯基-2-三硝基苯肼,别名1,1-二苯基-2-苦肼基自由基,是一种其溶液呈紫色的稳定氮自由基。
这是因为其分子中,存在多个吸电子的硝基-NO2,还有苯环的π66共轭大π键。
图1. DPPH结构式图2. DPPH自由基的比例模型(斯陶特模型)DPPH自由基在波长519nm处有最大吸收。
随着自由基减少,其溶液在519nm处吸收会减少,其溶液的颜色也会变浅。
因为DPPH溶液吸光度和自由基浓度之间存在着正比关系,所以可以通过吸光度来计算自由基清除率。
因此DPPH自由基清除实验常用来检测抗氧化剂在体外清除自由基能力的强弱。
【实验对象】高香草酸(Homovanillic acid),学名“4-羟基-3-甲氧基苯乙酸”,分子式为C9H9O4,为儿茶酚胺(肾上腺素、去甲肾上腺素)的代谢产物。
高香草酸作为酚酸类物质,理论上应具有不错抗氧化活性,我们选取它作为实例来进行DPPH自由基清除实验步骤的详细介绍。
图3.高香草酸结构式图4.高香草酸的比例模型(斯陶特模型)【实验操作】清除DPPH能力检测本实验采用文献[1]的方法,并视情况改动。
大致过程如下:1. DPPH测试液的配置取DPPH 0.5mg溶于约20mL溶剂(无水乙醇、95乙醇或甲醇)中,超声5min,充分振摇,务使上下各部分均匀。
取1mL 该DPPH溶液,在519nm处测A值,使A 在0.9左右。
该DPPH溶液最好避光保存,3.5小时内用完。
DPPH自由基清除测定dpph法测定黄芩黄酮的抗氧化活性抗氧化作用是指任何能在低浓度下有效抑制自由基氧化反应的物质。
其作用机理是直接或间接地作用于自由基,消耗易形成自由基的物质,以防止进一步的反应。
目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中dpph法是体外模型中最常用的方法。
DPPH,也称为1,1-二苯基-2-三硝基苯肼,是氮中心非常稳定的自由基。
它的稳定性主要来自三个苯环的空间势垒,具有共振稳定性,因此夹在中间氮原子上的未配对电子不能发挥其应有的电子配对作用。
其无水乙醇溶液呈紫色,在517nm波长处有最大吸收。
吸光度与浓度成线性关系。
加入自由基清除剂后,可结合或取代DPPH,减少自由基数量,降低吸光度,使溶液颜色变浅,从而评价其清除自由基的能力。
也就是说,通过检测样品在517 nm波长下去除DPPH的效果来计算抗氧化能力。
实验研究表明,黄芩黄酮中清除dpph自由基活性的主要成分是黄芩苷[1],黄芩苷中含有羧羟基和酚羟基能与dpph反应,反应式如下:O 2NN+O 2nno 2H+nnho 2NDPH与抗氧化剂的反应原理no2o2n材料:dpph(1,1-二苯基-2-三硝基苯肼);无水乙醇;仪器:分光光度计1.DPPH储备溶液的制备准确称取dpph试剂3.5mg,用无水乙醇溶解,并定量转入10ml容量瓶中,用无水乙醇定容至刻度,取2ml至100ml容量瓶中,摇匀得浓度为0.0178mmol/ldpph贮备液,置于冰箱中冷藏备用。
2.试液的制备(只作参考)准确称取5.2mg干黄酮提取物(32.75%),用无水乙醇溶解,定量移入50ml容量瓶中,用无水乙醇定量至刻度,取10ml至100ml容量瓶中,摇匀,得浓度为0.0233mmol/l 的供试品溶液。
3.dpph清除率的测定将4.0mL PPH溶液和黄酮提取物依次加入10mL比色管中,然后向刻度盘中加入无水乙醇,搅拌均匀,立即用1cm比色皿测量517nm波长处的吸光度值(a),吸光度值记录为AI,然后在温室中黑暗保存30分钟后测量吸光度值,记录为AJ。
[修订]DPPH自由基清除测定DPPH法测定黄芩黄酮的抗氧化活性抗氧化就是任何以低浓度存在就能有效抑制自由基的氧化反应的物质,其作用机理可以是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。
目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中DPPH法是体外模型中最常用的方法。
DPPH又称1,1-二苯基-2-三硝基苯肼,是一种很稳定的氮中心的自由基,他的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。
它的无水乙醇溶液呈紫色,在517nm波长处有最大吸收,吸光度与浓度呈线性关系。
向其中加入自由基清除剂时,可以结合或替代DPPH?,使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力。
即通过在517nm波长处检测样品清除DPPH?的效果,来计算抗氧化能力。
[1]实验研究表明,黄芩黄酮中清除DPPH自由基活性的主要成分是黄芩苷,黄芩苷中含有羧羟基和酚羟基能与DPPH反应,反应式如下:ONON22+H+NNONNONNH22NONO22DPPH与抗氧化剂反应原理材料:DPPH(1,1-二苯基-2-三硝基苯肼);无水乙醇;仪器:分光光度计1.DPPH贮备液的制备准确称取DPPH试剂3(5mg,用无水乙醇溶解,并定量转入10mL容量瓶中,用无水乙醇定容至刻度,取2mL至100ml容量瓶中,摇匀得浓度为0.0178mmol,L DPPH贮备液,置于冰箱中冷藏备用。
2.试液的制备(只作参考)准确称取5.2mg干燥的黄酮提取物(32.75%),用无水乙醇溶解,并定量转入50ml容量瓶中,用无水乙醇定量至刻度,取10ml至100ml容量瓶中,摇匀得浓度为0.0233mmol,L试液。
3.DPPH?清除率的测定在10mL比色管中依次加入4.0mLDPPH溶液和黄酮提取液,再加入无水乙醇至刻度,混匀立即用1cm比色皿在517nm波长处测吸光值(A),吸光值记为Ai,再在温室避光保存30min后测吸光值,记为Aj,对照试验为只加DPPH的乙醇溶液,其吸光值记为Ac。
DPPH 实验步骤 一、原理:DPPH 是一种很稳定的氮中央的自由基,它的稳定性主要来自3个苯环的共振稳定作用及空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用.作为一种稳定的自由基,DPPH 可以捕获〔"去除"〕其他的自由基.因此通过参加DPPH 后观察某一化 学反响的速率是否减慢,来作为这一反响是否具有自由基反响本质的指标.由于DPPH 自由基在以520nm 为中央处具有强烈的吸收,因此在溶液中呈现深紫色,并且在被中和之后会 变为无色或浅黄色.DPPH 在有机溶剂中是一种稳定的自由基,其醇溶液呈紫色,且需低温避光储藏,具有 单一电子,故能接受一个电子或氢离子,在波长为517nm 下具有最大吸收.有自由基去除剂存在时,DPPH 的单电子被捕捉而使其颜色变浅,在最大光吸收波长处的吸光值下降,且 下降程度呈线性关系,吸光度水平的降低说明抗氧化性的增加,从而以评价试验样品的抗氧化水平.此抗氧化水平用抑制率来表示,抑制率越大,抗氧化性越强. 二、实验步骤:1 .配制0.1mM 的DPPH 溶液:配两次,每次取0.002gDPPH 溶于50mL 乙醇,避光保存.2 .配制0.5mg/mL 的Vc 溶液,至少2mL 〔设为阳性对照,选择性做〕3 .配制一定浓度的样品溶液,至少2mL 母液〔也可以配制不同溶度梯度样品,计算IC50〕5 .检测并计算去除率测517nm 处的吸光度,取平均值,计算每个浓 度的DPPH 去除率,做出折线图.去除率=〔1 - 〔 A sample - A blank 〕 / A control 〕 X 100% 4.上板〔避光操作,上完板后,室温避光30分钟,测吸光度〕 96孔板,三组,每组设 3个复孔,每孔参加量及 96孔板分布如下: sample 〔样品组〕:样品溶液100uL+ DPPH 醇溶液100uL 〔每个浓度3个孔〕 blank 〔空白组〕:样品溶液100uL+无水乙醇100uL 〔每个浓度3个孔〕 control 〔对照组〕:DPPH 醇溶液100uL+水100uL 〔一块板可共用一个对照组 ,3个孔〕 消除氧%〞 〔1-j 二为吧〕x1帆。
主要目的:
——为了测定样品清除DPPH自由基的能力。
主要原理:
——自由基清除剂与DPPH单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用酶标仪进行快速的定量分析。
实验室签章
一、试剂
——1 ,1-二苯基-1-苦味肼基自由基(DPPH)——甲醇(分析纯)
二、仪器设备
——96孔酶标板
——UV-Vis可见多功能酶标仪
——移液枪
——200 µL量程枪头
三、实验方法
◆前期准备
配置2 g/L 的DPPH甲醇标准溶液。
◆DPPH自由基清除能力
参照Brand-Williams (1995)[1]报道的方法,将其稍加改动后应用在96孔酶标板中[2]。
在酶标板的每孔中,依次加入不同体积(10、20、30、40、50、60、70、80、90和100 µL)的样品溶液和200 μL的DPPH标准溶液(2 g/L),最后用甲醇溶液补齐至总体积300 µL。
室温反应30 min后,于515 nm下用UV-Vis可见多功能酶标仪测定其吸光度(EL 340, Bio-Tek Instruments, Inc., Winooski, VT, USA)。
番茄样品消除自由基的能力表示为EC50(清除1 µg DDPH至50 %所需的样品用量(µg干重))。
EC50越小,表示抗氧化活性越高。
平行测定三次,取平均值计算。
清除DPPH自由基能力用如下公式计算:
清除率%=(1-
Ac Aj
Ai
)×100%
其中:Ai为样品溶液加DPPH试剂混合液的吸光度,Aj为样品溶液加甲醇的吸光度,Ac为DPPH溶液加样品溶剂的吸光度。
[1] Brand-Williams W, Cuvelier M E. Berset C. Use of a free radical method to evaluate
antioxidant activity [J]. LWT - Food Science and Technology, 1995, 28(1): 25-30.
[2] Verma A R, Vijayakumar M, Rao C V. Mathela C S. In vitro and in vivo antioxidant properties
and DNA damage protective activity of green fruit of Ficus glomerata [J]. Food and Chemical Toxicology, 2010, 48(2): 704-709.。