ch4 扭转-习题-答案
- 格式:pdf
- 大小:337.70 KB
- 文档页数:5

目录之马矢奏春创作第一章绪论0第二章饱和烃1第三章不饱和烃5第四章环烃13第五章旋光异构21第六章卤代烃26第七章波谱法在有机化学中的应用31第八章醇酚醚41第九章醛、酮、醌50第十章羧酸及其衍生物61第十一章代替酸68第十二章含氮化合物74第十三章含硫和含磷有机化合物82第十四章碳水化合物85第十五章氨基酸、多肽与蛋白质96第十六章类脂化合物101第十七章杂环化合物109Fulin 湛师第一章 绪论1.1简明归纳范例的以离子键形成的化合物与以共价键形成的化合物的物理性质. 答案:1.2 NaCl 相同?如将CH4及CCl4各1mol 混在一路,与CHCl3及CH3Cl 各1mol 的混淆物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同.因为两者溶液中均为Na+,K+,Br -, Cl -离子各1mol.因为CH4与CCl4及CHCl3与CH3Cl 在水中是以分子状态消掉,所所以两组不合的混淆物.1.3碳原子核外及氢原子核外各有几个电子?它们是若何分布的?画出它们的轨道外形.当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道外形及甲烷分子的外形. 答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式.a.C2H4b.CH3Clc.NH3d.H2Se.HNO3f.HCHOg.H3PO4h.C2H6 i.C2H2 j.H2SO4答案:a.C C H H H HCC HH HH 或 b.H C H H c.H N H Hd.H S H e.H O NOf.OC H Hg.O P OO O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OOH H或1.5下列各化合物哪个有偶极矩?画出其标的目的.a.I2b.CH2Cl2c.HBrd.CHCl3e.CH3OHf.CH3OCH3 答案:b.ClClc.HBrd.HCe.H 3COHH 3COCH 3f.1.6 按照S 与O 的电负性不同,H2O 与H2S 比拟,哪个有较强的偶极-偶极传染感动力或氢键? 答案:电负性O>S,H2O 与H2S 比拟,H2O 有较强的偶极传染感动及氢键. 1.7 下列分子中那些可以形成氢键?a.H2b. CH3CH3c. SiH4d. CH3NH2e. CH3CH2OHf. CH3OCH3 答案:d.CH3NH2e.CH3CH2OH1.8 醋酸分子式为CH3COOH,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O 和OH 两种极性基团,按照相似相容道理,可以溶于极性水.第二章饱和烃2.1 卷心菜叶概略的蜡质中含有29个碳的直链烷烃,写出其分子式.答案:C29H602.2 用系统命名法(假如可能的话,同时用通俗命名法)命名下列化合物,并指出(c)和(d)中各碳原子的级数.a.CH 3(CH 2)3CH(CH 2)3CH 3C(CH 3)2CH 2CH(CH 3)2 b.C H H C HH CH HH C H HC H H CHHH c.CH 322CH 3)2CH 23d.CH 3CH 2CH CH 2CH 3CHCH CH 2CH 2CH 3CH 3CH 3e.C CH 3H 3C CH 3Hf.(CH 3)4Cg.CH 3CHCH 2CH 3C 2H 5h.(CH 3)2CHCH 2CH 2CH(C 2H 5)21。

第四章思考题与例题1. 设有一条内径为30mm的厚壁管道,被厚度为0.1mm的铁膜隔开,通过向管子一端向管内输入氮气,以保持膜片一侧氮气浓度为1200mol/m3,而另一侧的氮气浓度为100mol/m3。
如在700℃下测得通过管道的氮气流量为2.8×10-4mol/s,求此时氮气在铁中的扩散系数。
12. 简要说明在金属或合金中的晶粒内部,原子扩散的机理是什么?3. Cu-Al组成的互扩散偶发生扩散时,标志面会向哪个方向移动?34.设纯Cr和纯Fe组成的扩散偶,扩散1小时后Matano平面移动了1.52×10-3cm。
已知C Cr=0.478时,əC/əx=126/cm,互扩散系数D=1.43×10-9cm2/s,试求Matano平面移动速度和Cr、Fe的本征扩散系数D Cr、D Fe。
(实验测得Matano平面移动距离的平方与扩散时间之比为常数。
)45. 工业生产中经常采用渗碳的方法来提高钢铁零件的表面硬度。
表面含碳量越高,钢的硬度越高。
例如将含碳量0.2%的钢置于Ws=1.3%的气氛中渗碳,渗碳温度为927℃,保温10h,已知碳在γ-Fe中的Dc=2.21×10-7 cm²·s-1,求:(1) 距表面x=0.04㎝处的碳浓度(1.0265%);(2)若已知渗层某处的碳浓度为0.65%时,求x值(0.104㎝)。
6. 对于同一扩散系统、扩散系数D与扩散时间t的乘积为常数。
例如:已知Cu 在Al中扩散系数D,在500℃和600ºC分别为4.8×10-14m²s-1和5.3×10-13m²s-1,假如一个工件在600ºC需要处理10h,若在500ºC处理时,要达到同样的效果,需要多少小时?7. 对于钢铁材料进行渗碳处理时,x与t的关系是t∝x²。
例如:假设对-Wc=0.25%的钢件进行渗碳处理,要求渗层0.5㎜处的碳浓度为0.8%,渗碳气体浓度为Wc=1.2%,在950ºC进行渗碳,需要7小时,如果将层深厚度提高到1.0㎜,需要多长时间?8 钢在进行渗碳处理时,表面很快达到较高浓度,然后逐步向中间扩散,设在1000℃时,测得工件离表面1mm和2mm之间的碳浓度(原子浓度)从5at.%降到4at.%,试计算碳原子在该区域的流量(γ-Fe在1000℃时密度为7.63g/cm3,扩散系数γD=c (2.0×10-5m2/s)×exp[(-142000J/mol)/RT]),以原子/m2·s为单位。

勒夏特列原理典例分析下列不能用勒夏特列原理解释的事实是加压后颜色先变深后变浅2B氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深C黄绿色的氯水光照后颜色变浅D合成氨工业使用高压以提高氨的产量【参考答案】B【试题解析】A项,涉及NO2与N2O4的平衡转化,可以用勒夏特列原理解释;B项,加压后平衡不移动,但体积缩小,碘蒸气的浓度增大使颜色变深,不能用勒夏特列原理解释;C项,光照后,次氯酸见光分解,使氯气与水的反应平衡向正反应方向移动,可以用勒夏特列原理解释;D项,合成氨工业加压使平衡向正反应方向移动,可以用勒夏特列原理解释。
【名师点拨】不能用勒夏特列原理解释的问题:①若外界条件改变后,无论平衡向正反应方向移动或向逆反应方向移动都无法减弱外界条件的变化,则平衡不移动。
如H2gBr2g 2HBrg,由于反应前后气态物质体积不变,则压强改变,平衡不发生移动。
②催化剂能同等程度地改变正、逆反应速率,所以催化剂不会影响化学平衡。
③当外界条件的改变对平衡移动的影响与生产要求不一致时,不能用勒夏特列原理解释,如工业合成氨条件的选择。
解题必备勒夏特列原理如果改变影响平衡的一个条件如浓度、压强或温度,则平衡将向着能够减弱这种改变的方向移动。
注意:“减弱”不等于“消除”,更不是“扭转”,即平衡移动不能将外界影响完全消除,而只能减弱。
强化训练1.工业合成氨N23H22NH3ΔH0,测得c CH4随反应时间t的变化如图所示。
下列判断正确的是A.10 min时,改变的外界条件可能是升高温度B.反应进行到12 min时,CH4的转化率为25%C.0~5 min内,v H2=01 mo·L·min-1D.恒温下,缩小容器体积,平衡后H2浓度减小3.下列不能..用勒夏特列原理解释的是A.工业合成氨:500 ℃比室温更有利B.SO2催化氧化成SO3的反应,往往加入过量的空气C.可用浓氨水和氢氧化钠固体快速制取氨气D.实验室中常用排饱和食盐水的方法收集氯气4.根据v-t图分析外界条件改变对可逆反应Ag+3Bg 2Cg ΔH<0的影响。


1、催化剂定义催化剂是一种能够改变化学反应速度而不能改变反应的热力学平衡位置,且自身不被明显消耗的物质。
2、催化剂活性、表示方法(1)活性定义:一般,指定条件下(压力、温度)一定量催化剂上的反应速率(来衡量)。
(2)表示方法:对于反应, ,速率3、催化剂选择性、表示方法(1)定义:当反应可以按照热力学上几个可能的方向进行时,催化剂可以选择性地加速其中的某一反应。
4、载体具有哪些功能和作用?8①分散作用,增大表面积,分散活性组分;②稳定化作用,防止活性组分熔化或者再结晶;③支撑作用,使催化剂具备一定机械强度,不易破损;④传热和稀释作用,能及时移走热量,提高热稳定性;⑤助催化作用,某些载体能对活性组分发生诱导作用,协助活性组分发生催化作用。
5、催化剂选择考虑因素:选择性>寿命>活性>价格工业催化剂:6、催化剂一般组成1)活性组份或称主催化剂2)载体或基质3)助催化剂7.催化剂分类按物相均一性:均相催化、多相催化、酶催化按作用机理:氧化还原催化,酸碱催化(离子型机理,生成正碳离子或负碳离子)配位催化:催化剂与反应物分子发生配位作用而使反应物活化。
按反应类型分类:加氢、脱氢、部分氧化、完全氧化、水煤气、合成气、酸催化、氯氧化、羰基化、聚合8、多相催化反应的过程步骤可分为哪几步?实质上可分为几步?(1)外扩散—扩散—化学吸附—表面反应—脱附—扩散—外扩散(2)物理过程—化学过程—物理过程9、吸附是如何定义的?物理吸附与化学吸附的本质不同是什么?吸附:气体与固体表面接触时,固体表面上气体的浓度高于气相主体浓度的现象。
固体表面吸附:物理吸附:作用力:van der Waals力静电力:具有永久偶极矩的分子间的静电吸引力诱导力:容易极化的分子被极性分子诱导产生的诱导偶极子和永久偶极子之间的作用力色散力:原子电子密度的瞬时诱导邻近原子产生偶极而致的两个瞬时偶极子之间的相互作用力化学吸附:作用力:价键力,形成化学键本质:二者不同在于其作用力不同,前者为德华力,后者为化学键力,因此吸附形成的吸附物种也不同,而且吸附过程也不同等诸多不同。

ch4 刚体的定轴转动作业题答案7. 如图所示,一半径为r ,质量为m 1的匀质圆盘作为定滑轮,绕有轻绳,绳上挂一质量为m 2的重物,求重物下落的加速度。
解:设绳中张力为T对于重物按牛顿第二定律有22m g T m a -= (1)对于滑轮按转动定律有212T r m r β=(2)由角量线量关系有a r β= (3)联立以上三式解得8. 如图所示,两个匀质圆盘同轴地焊在一起,它们的半径分别为r 1、r 2,质量为1m 和2m ,可绕过盘心且与盘面垂直的光滑水平轴转动,两轮上绕有轻绳,各挂有质量为3m 和4m 的重物,求轮的角加速度β。
解:设连接3m 的绳子中的张力为T1,连接4m 的绳子中的张力为T2。
对重物3m 按牛顿第二定律有 3133m g T m a -= (1) 对重物4m 按牛顿第二定律有 2444T m g m a -= (2)对两个园盘,作为一个整体,按转动定律有112211221122T r T rm r m r β⎛⎫-=+⎪⎝⎭(3) 由角量线量之间的关系有31a r β= (4)42a r β= (5)联立以上五式解得31422222112231421122m r m r m r m r m r m r β-=+++11. 如图所示,主动轮A 半径为r 1,转动惯量为1I ,绕定轴1O 转动;从动轮B 半径为r 2,转动惯量为2I ,绕定轴2O 转动;两轮之间无相对滑动。
若知主动轮受到的驱动力矩为M ,求两个轮的角加速度1β和2β。
解:设两轮之间摩擦力为f 对主动轮按转动定律有:111M fr I β-= (1)对从动轮按转动定律有222fr I β= (2)由于两个轮边沿速率相同,有1122r r ββ= (3)联立以上三式解得 221221221M r I r I r β=+121221221M r r I r I r β=+13. 一质量为m 、半径为R 的自行车轮,假定质量均匀分布在轮缘上,可绕轴自由转动.另一质量为0m 的子弹以速度0v 射入轮缘(如题2-31图所示方向). (1)开始时轮是静止的,在质点打入后的角速度为何值?(2)用m ,0m 和θ 表示系统(包括轮和质点)最后动能和初始动能之比. 解: (1)射入的过程对O 轴的角动量守恒ωθ2000)(sin R m m v m R +=∴ Rm m v m )(s i n 000+=θω(2)2020200020sin 21])(sin ][)[(21m m m v m Rm m v m R m m E E k k +=++=θθ14. 如图所示,长为l 的轻杆,两端各固定质量分别为m 和2m 的小球,杆可绕水平光滑固定轴O 在竖直面内转动,转轴O 距两端分别为13l 和23l .轻杆原来静止在竖直位置.今有一质量为m 的小球,以水平速度0υ与杆下端小球m 作对心碰撞,碰后以021υ 的速度返回,试求碰撞后轻杆所获得的角速度.解:碰撞过程满足角动量守恒:00212323m v l m v l I ω=-⋅+ 而 222212()2()333I m l m l m l=+=所以 2023m v l m l ω=由此得到:032v lω=16. 有一半径为R 的均匀球体,绕通过其一直径的光滑固定轴匀速转动,转动周期为0T .如它的半径由R 自动收缩为R 21,求球体收缩后的转动周期.(球体对于通过直径的轴的转动惯量为J =2mR2 / 5,式中m 和R 分别为球体的质量和半径).解:(1) 球体收缩过程满足角动量守恒: 0022I I ωω= 200202225421()52m R I I m R ωωωω=== 所以 022244T T ππωω===m 1v 0v。

第一章绪论一、选择题1、下列属于化石能源的是(石油、天然气、煤炭)2、最大的煤生产和消费国是(中国)3、下列能源属于二次能源的是(城市煤气)4、民用燃气的热值一般为(4620kg/m3)5、二次世界大战后,煤炭汽化工业发展缓慢的原因是(石油和天然气的发展)6、下列属于新型煤化工特点的是(煤炭-能源-化工一体化)7、下列属于碳一化学品的是(CO 、CO2 、CH3OH 、HCHO )8、下列说法正确的是(煤气化产物不是煤化工的最终产品)9、煤属于(混合物)10、城市煤气要求CO低的原因是(CO有毒)二、复习思考题1、何为煤化工?答:煤化工是以煤为原料经过化学加工,实现煤的转化并进行综合利用的工业。
煤化工包括炼焦工业、煤炭气化工业、煤炭液化工业、煤制化学品工业以及其他煤加工制品工业等。
2、什么是煤气化?包含的内容有那些,有什么特点?答:煤的气化是煤或煤焦与气化剂在高温下发生化学反应将埭或煤焦中有机物转变为煤气的过程。
煤炭气化技术广泛应用于下列领域。
(1)作为工业燃气(2)作为民用煤气(3)作为化工合成和燃料油合成的原料气(4)作为冶金用还原气(5)作为联合循环发电的燃气(6)作煤炭气化燃料电池(7)煤炭气化制氢(8)煤炭液化的气源3、试述煤炭气化产品——煤气为原料,说明碳一化学的发展方向和趋势。
答:碳-化学是以含有一个碳原子的物质(如CO、CO2、CH3、CH3OH、HCHO)为原料合成化工产品或液体燃料的有机化工生产过程。
碳-化学是一个很大的领域,其产品包括由合成气台成燃料、甲醇及系列产品,合成低碳醇、醋酸及系列产品,合成低碳烯烃、燃料添加剂等方面。
4、煤炭气化工艺课程的学习内容有那些?本课程与本专业主要专业基础课、专业课有何区别和联系。
答:具体内容可分为以下几部分。
①气化原理。
讨论气化方法、气化热力学、动力学过程对气化过程的影响。
②煤炭性质对气化的影响。
介绍了煤种及煤质对气化的影响a③气化炉。
讨论各类气化炉结构特点、工艺流程、工艺条件选择对气化的影响等。

第四章习题试解1. 一维单原子晶格,在简谐近似下,考虑每一原子与其余所有原子都有作用,求格波的色散关系.解:设原子质量为m ,周期为a ,第n 个原子偏离平衡位置的位移为μn ,第n-k 与n+k 个原子偏离平衡位置的位移分别为μn-k ,μn+k ,其与第n 个原子间的弹性恢复力系数为β-k ,βk .n-k n-1 n n+1 n+k显然:k k ββ-=第n 个原子受n-k 和n+k 原子的合力为:第n 个原子受所有原子的合力为:振动的运动学方程可写为:代入振动的格波形式的解()i qna t nq Ae ωμ-= 有2()[()][()]()()(2)i qna t i q n k a t i q n k a t i qna t k km i Ae Ae Ae Ae ωωωωωβ-+----=+-∑色散关系即为2.聚乙烯链…—CH =CH —CH =CH…的伸张振动,可以采用一维双原子链模型来描述,原胞两原子质量均为M,但每个原子与左右邻原子的力常熟分别为β1和β2,原子链的周期为a .证明振动频率为证:如图,任意两个A 原子〔或B 原子〕之间的距离为a,设双键距离b 2,单键距离b 1 …—CH =CH —CH =CH —CH =CH —CH =CH —CH =CH …2n-2 2n-1 2n 2n+1 2n+2 AB Ab2 b1只考虑近邻作用的A,B 两原子的运动方程为A :222121221()()n n n n n M μβμμβμμ+-=---B : 21122212212()()n n n n n M μβμμβμμ++++=---将格波解()2i qna t n Ae ωμ-= 和2[()]21i q na b t n Be ωμ+-+= 代入以上运动方程,有 化简得:1221212()()0iqb iqb M A e e B ββωββ-+--+=同理:1221212()()0iqb iqb e e A M B ββββω--+++-=化为以A 、B 为未知数的线性齐次方程组,它的有解条件是从而得到3.求一维单原子链的振动模式密度g<ω>,若格波的色散可以忽略,其g<ω>具有什么形式,比较这两者的g<ω>曲线.解:一维情况q 空间的密度约化为L/2π,L=Na 为单原子链的长度,其中a 为原子间距,N 为原子数目.则在dq 间隔内的振动模式数目为2L dq π.dω频率间隔内的振动模式数目为 等式右边的因子2来源于ω〔q 〕具有中心反演对称,q ﹥0和q ﹤0区间是完全等价的.从而有 对于一维单原子链,只计入最近邻原子之间的相互作用时,有其中ωm 为最大频率.代入g <ω>得考虑ω=cq 〔德拜近似〕由q →0〔德拜近似下〕, 有111()222m m q qa qa a q ωωω==⋅=⋅ 即12m c a ω=⋅ 则有:12m d a dq ωω=⋅ 121()12m m NaN g a ωππωω==⋅ 〔常数〕考虑ω=ω0〔爱因斯坦近似〕显然有()000g ωωωωω∞=⎧=⎨≠⎩ 4.金刚石〔碳原子量为12〕的杨氏模量为1012N·m -2,密度ρ=3.5g·cm -3.试估算它的德拜温度ΘD =? 解:德拜温度D D B k ωΘ=223231()4()(2)2j V V g c c c ωωπωππ==, 2233()2V g c ωωπ== 近似看作弹性介质时,1/2410/C m s ⎛⎫=⨯ ⎪⎝⎭杨氏模量密度 每摩尔原子数目为N=6.02×1023,摩尔质量m=12g,则摩尔体积代入,得ωm =57.97×1013最后得 ΘD =4427K5.试用德拜模型求晶体中各声频支格波的零点振动能. 解:根据量子理论,各简谐振动的零点能为12ω 德拜近似下2233()2V g C ωωπ= 总零点能为034232301()2331444m m m E g d VV d C C ωωωωωωωωππ===⎰⎰ 由自由度确定的21/3[6()]m NC V ωπ=代回上式中6.一根直径为3mm 的人造蓝宝石晶体的热导率,在30K 的温度达到一个锐的极大值,试估计此极大值.〔蓝宝石在T ﹤﹤ΘD =1000K 时,c V =10-1T 3J·m -3·K -1〕解:m D B k ωΘ=→ωm =1.31×1014λ与晶格常数10-10m 近似时约为2.09×103,近似作为平均声速代入 热导率35.643103c l υκυ==⨯ 7.Na 和Cl 的原子量分别为23和37.氯化钠立方晶胞边长为0.56nm,在[100]方向可以看做是一组平行的离子链.离子间距d=0.28nm.NaCl 晶体的杨氏模量为5×1010N·m -2,如果全反射的光频率与q=0的光频模频率相等,求对应的光波波长.解:当q=0时,光频支频率为杨氏模量10510a β=⨯,且90.2810a -=⨯m故201.7910β=⨯,再同两原子质量一同代入频率式则波长02c πλω==1.53×10-14m8.立方晶体有三个弹性模量C 11,C 12和C 44.铝的C 11=10.82×1010N·m -2,C 44=2.85×1010N·m -2,铝沿[100]方向传播的弹性波纵波速度l υ=,横波速度t υ=,Al 的密度ρ=2.70×103kg·m -3.求德拜模型中铝的振动模式密度g<ω>.解:由题条件知36.3310l υ=⨯,33.2510t υ=⨯若所考虑的晶体体积为V,则。

新能源考试试题库含答案1、自动驾驶L1 和L2 级阶段,实现车辆对道路的高识别性、高可靠性、实时的信息交换需要解决的两个共性技术问题,即单传感器简单环境识别技术( )问题和车辆底层控制实现的可靠性问题。
A、显著性B、时效性C、传递性D、准确性答案:D2、对于间接触电可采用( )等措施。
A、电气隔离B、漏电保护装置C、布置安全电压D、切断电源答案:A3、在信息感知方面,根据信息对驾驶行为的影响和相互关系分为驾驶相关类信息和()。
A、车辆状态相关类信息B、环境相关类信息C、道路相关类信息D、非驾驶相关类信息答案:D4、燃料电池是燃料(如CO、H2、CH4 等)跟O2(或空气)反应,将化学能转化为电能的装置,电解质溶液是强碱溶液。
下列关于CH4 燃料电池的说法正确的是( )。
A、负极反应式为:CH4+10OH--8e=CO32-+7H2OB、负极反应式为:O2+2H2O+4e=4OH-C、随着放电的进行,溶液的pH 不变D、放电时溶液中的阴离子向正极移动答案:A5、实现汽车轻量化的基本原理( )。
A、保证足够的刚度、保证足够的强度、保持良好的疲劳耐久性能B、保证足够的韧性、保证足够的轻、保持良好的疲劳耐久性能C、保证足够的安全性、保证足够的弹性、保持良好的疲劳耐久性能D、以上都是答案:A6、减少车身骨架及车身钢板的( ),确保汽车在满足性能的前提下减轻自重。
A、质量B、结构C、链接D、数量答案:A7、极化指数是指( )。
A、测量开始10min 后的绝缘电阻与1min 后的绝缘电阻之间的比率B、测量开始1min 后的绝缘电阻与30s 后的绝缘电阻之间的比率C、测量开始1min 后的绝缘电阻与1min 后的绝缘电阻之间的比率D、测量开始10min 后的绝缘电阻与30s 后的绝缘电阻之间的比率答案:A8、智能网联汽车推动了车用传感器的快速发展,()目前已经成熟的应用到各量产车上,其技术相对成熟。
A、超声波雷达B、激光雷达C、毫米波雷达D、红外传感器答案:A9、新能源汽车动力电池性能指标主要有储能密度、循环寿命、充电速度、抗高低温和安全性等,其中( )和安全性最受关注,也因此磷酸铁锂电池和三元锂电池跻身主流市场,分别应用于客车市场和乘用车市场。

甲烷烷烃复习1.下列物质在一定条件下可跟CH4发生化学反应的是()A.酸性高锰酸钾溶液B.溴水C.氢氧化钠溶液D.溴蒸气答案:D解析:在通常情况下,CH4的化学性质比较稳定,不与强酸、强碱、强氧化剂发生反应,不能使酸性高锰酸钾溶液、溴水褪色,但在光照条件下能与溴蒸气发生取代反应。
2.将1 mol甲烷和适量的Cl2混合后光照,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为() A.1.5 mol B.3 molC.4.5 mol D.6 molB解答此题宜用原子守恒法。
CH3Cl、CH2Cl2、CHCl3、CCl4中的碳原子都是从CH4中来的,故这四种取代物共1 mol,设CH3Cl的物质的量为x,则x+(x+0.1 mol)+(x+0.2 mol)+(x+0.3 mol)=1 mol,得x=0.1 mol,即CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次为0.1 mol、0.2 mol、0.3 mol、0.4 mol,含Cl原子的物质的量共为0.1 mol×1+0.2 mol×2+0.3 mol×3+0.4 mol×4=3 mol。
而一个Cl2分子中只有一个Cl原子参加取代反应,因此消耗的Cl2也为3 mol。
3.把1 mol甲烷和4 mol氯气组成的混合气体充入到大试管中将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,一段时间后,推测可能观察到的现象①黄绿色逐渐消失②试管壁上有油珠③试管内水面上升④水槽内有少量晶体析出A.只有①③B.只有①②③C.只有①③④D.①②③④D氯气被消耗后,黄绿色消失。
生成的CH2Cl2、CHCl3、CCl4均为油状液体,又因为氯气被消耗,气体的体积减小,试管内水面上升。
生成的HCl溶于水降低了NaCl的溶解度,有NaCl析出。
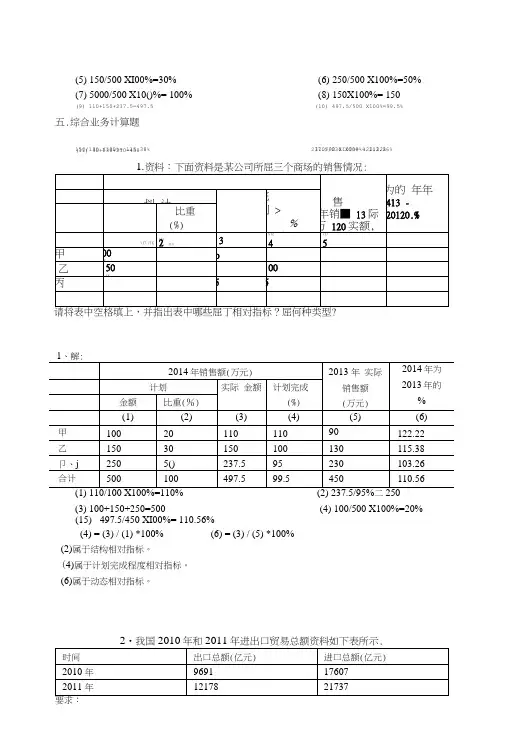
(5) 150/500 XI00%=30% (7) 5000/500 X10()%= 100%(9) 110+150+237.5=497.5(6) 250/500 X100%=50% (8) 150X100%= 150(10) 497.5/500 X100%=99.5%(11) 90+130+230=450110/90 XI00%= 122.22%150/130 XI00%= 115.38% 237.5/230 XI00%= 103.26% 五.综合业务计算题资料:下面资料是某公司所屈三个商场的销售情况:请将表中空格填上,并指出表中哪些屈丁相对指标?屈何种类型?、解:二(3) 100+150+250=500(4) 100/500 X100%=20%(15) 497.5/450 XI00%= 110.56% (4) = (3) / (1) *100% (6) = (3) / (5) *100% (2)属于结构相对指标。
(4)属于计划完成程度相对指标。
(6)属于动态相对指标。
•我国年和年进出口贸易总额资料如下表所示.要求:(1)分别计算2011年的进出口贸易差额和进出口总额的发展速度(2)计算2011年进出口额比例相对数及出口额结构相对数(3)分析我国进出口贸易状况答:(1)贸易差额二出口■进口2011年的进口额二进出口总额•出口总额=21737-12178=95592011年的进出口贸易差额=12178-9559=2619进出口总额的发展速度=2011年进出口总额/2010年进出口总额=21737/17607* 100%= 123.5%(2) 2011 年进出口额比例相对数二出口/进口 = 12178/9559* 100%= 127.4% 2011年出口额结构相对数二出口 /进出口总额=12178/21737* 100%=56%3、根据下表,计算2010年和2011年强度相对数的正指标和逆指标,并根据正指标数值分析该地区商业网点的变动情况答:正指标:2010年每万人对应的商业网点数二商业网点数/人口数=40/120.4=0.33 2011年每万人对应的谕业网点数二商业网点数/人口数=76/223.5二0.34逆指标:2010年每个商业网点服务的人数二人口数/商业网点数=120.4/40=3.01 2011年每个商业网点服务的人数二人口数/商业网点数=223.5/76=2.9428-13_ 200 + (28-13)+ (28-14)x(300-200) = 251.72_ S m-\ M, =L+ ---------- x 〃 = 200 + f合计| 60试根据上述资料,分别计算中位数和众数。
第四章 扭 转4-5 一受扭薄壁圆管,外径D = 42mm ,内径d = 40mm ,扭力偶矩M = 500N •m ,切变模量G =75GPa 。
试计算圆管横截面与纵截面上的扭转切应力,并计算管表面纵线的倾斜角。
解:该薄壁圆管的平均半径和壁厚依次为mm 122 mm 5.20)22(210=-==+=dD d D R δ,于是,该圆管横截面上的扭转切应力为189.4MPa Pa 10894.1m001.00.02052πN 500π282220=⨯=⨯⨯==δτR T 根据切应力互等定理,纵截面上的扭转切应力为MPa 4.189=='ττ该圆管表面纵线的倾斜角为rad 102.53rad 1075104.189396-⨯=⨯⨯==G τγ 4-7 试证实,在线弹性范围内,且当R 0/δ≥10时,薄壁圆管的扭转切应力公式的最大误差不超过4.53%。
解:薄壁圆管的扭转切应力公式为δR Tτ20π2= 设βδR =/0,按上述公式计算的扭转切应力为3220π2π2δβTδR T τ==(a)按照普通空心圆轴考虑,轴的内、外直径分离为 δR D δR d +=-=002 2,极惯性矩为 )4(2π])2()2[(32π)(32π2200404044p δR δR δR δR d D I +=--+=-=由此得)14(π)12()2()4(π)2(23022000p max ++=++=+=ββδβδδδT R R R TδR I T τ (b)比较式(a)与式(b),得)12(214)12()14(ππ222332max++=++⋅=ββββββδδβT Tττ当100==δβR 时,9548.0)1102(10211042max =+⨯⨯⨯+⨯=ττ可见,当10/0≥δR 时,按薄壁圆管的扭转切应力公式计算τ的最大误差不超过4.53%。
4-8 图a 所示受扭圆截面轴,材料的γτ-曲线如图b 所示,并可用m C /1γτ=表示,式中的C 与m 为由实验测定的已知常数。
第二章化学反应速率与化学平衡本章复习提升易混易错练易错点1混淆外界因素对化学反应速率和化学平衡的影响1.(2024四川宜宾二中月考)关于一定条件下的化学平衡H2(g)+I2(g)2HI(g)ΔH<0,下列说法正确的是()A.恒温恒容,充入H2,v(正)增大,平衡右移B.恒温恒容,充入He,v(正)增大,平衡右移C.加压(缩小容器容积),v(正)、v(逆)不变,平衡不移动D.升温,v(正)减小,v(逆)增大,平衡左移2.(2024福建厦门期中)湿法烟气脱氮工艺中常用到尿素,其反应原理为NO(g)+NO2(g)+CO(NH2)2(s) 2N2(g)+CO2(g)+2H2O(g)ΔH<0,达到平衡后改变某一条件,反应速率(v)与时间(t)的关系如图所示,下列说法错误的是()A.t4~t5引起变化的原因可能是升高温度B.CO2含量最高的时间段是t1~t2C.t2~t3引起变化的原因可能是增加反应物浓度D.t6时引起变化的原因可能是加入催化剂易错点2错误理解化学平衡移动方向与转化率的关系3.在一定条件下,取一定量的A和B在恒容密闭容器中发生反应:a A(g)+b B(s)m M(g)+n N(g)ΔH=Q kJ·mol-1,达到平衡状态时,M的浓度与温度和容器容积的关系如图所示。
下列有关判断一定正确的是()A.a>m+nB.达到平衡状态后,增大B的量将会提高A的转化率C.E点的平衡常数小于F点的平衡常数D.Q<04.(2024吉林长春月考)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。
下列说法正确的是()A.反应2NO(g)+O2(g) 2NO2(g)的ΔH>0B.图中X点所示条件下,延长反应时间能提高NO转化率C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K<2 000思想方法练利用变化观念与平衡思想破解化学平衡及其移动方法概述化学变化需要一定的条件,并遵循一定的规律,化学变化有一定限度、速率,是可以调控的。
催化剂与催化作⽤_参考答案1、催化剂定义催化剂是⼀种能够改变化学反应速度⽽不能改变反应的热⼒学平衡位置,且⾃⾝不被明显消耗的物质。
2、催化剂活性、表⽰⽅法(1)活性定义:⼀般,指定条件下(压⼒、温度)⼀定量催化剂上的反应速率(来衡量)。
(2)表⽰⽅法:对于反应, ,速率3、催化剂选择性、表⽰⽅法(1)定义:当反应可以按照热⼒学上⼏个可能的⽅向进⾏时,催化剂可以选择性地加速其中的某⼀反应。
4、载体具有哪些功能和作⽤?8①分散作⽤,增⼤表⾯积,分散活性组分;②稳定化作⽤,防⽌活性组分熔化或者再结晶;③⽀撑作⽤,使催化剂具备⼀定机械强度,不易破损;④传热和稀释作⽤,能及时移⾛热量,提⾼热稳定性;⑤助催化作⽤,某些载体能对活性组分发⽣诱导作⽤,协助活性组分发⽣催化作⽤。
5、催化剂选择考虑因素:选择性>寿命>活性>价格⼯业催化剂:6、催化剂⼀般组成1)活性组份或称主催化剂2)载体或基质3)助催化剂7.催化剂分类按物相均⼀性:均相催化、多相催化、酶催化按作⽤机理:氧化还原催化,酸碱催化(离⼦型机理,⽣成正碳离⼦或负碳离⼦)配位催化:催化剂与反应物分⼦发⽣配位作⽤⽽使反应物活化。
按反应类型分类:加氢、脱氢、部分氧化、完全氧化、⽔煤⽓、合成⽓、酸催化、氯氧化、羰基化、聚合8、多相催化反应的过程步骤可分为哪⼏步?实质上可分为⼏步?(1)外扩散—内扩散—化学吸附—表⾯反应—脱附—内扩散—外扩散(2)物理过程—化学过程—物理过程9、吸附是如何定义的?物理吸附与化学吸附的本质不同是什么?吸附:⽓体与固体表⾯接触时,固体表⾯上⽓体的浓度⾼于⽓相主体浓度的现象。
固体表⾯吸附:物理吸附:作⽤⼒:van der Waals⼒静电⼒:具有永久偶极矩的分⼦间的静电吸引⼒诱导⼒:容易极化的分⼦被极性分⼦诱导产⽣的诱导偶极⼦和永久偶极⼦之间的作⽤⼒⾊散⼒:原⼦内电⼦密度的瞬时诱导邻近原⼦产⽣偶极⽽致的两个瞬时偶极⼦之间的相互作⽤⼒化学吸附:作⽤⼒:价键⼒,形成化学键本质:⼆者不同在于其作⽤⼒不同,前者为范德华⼒,后者为化学键⼒,因此吸附形成的吸附物种也不同,⽽且吸附过程也不同等诸多不同。
单位内部认证转炉炼钢工考试(试卷编号181)1.[单选题]吹炼中期,炉渣的矿物组成主要是( )。
A)橄榄石B)二硅钙和三硅钙C)三硅钙及游离CaO答案:B解析:2.[单选题]( )是各种炉外精炼方法都采用的基本手段。
A)渣洗B)真空C)搅拌答案:C解析:3.[单选题]下列属于冷却剂的物质是 。
A)石灰B)氧化铁皮C)沥青焦答案:B解析:4.[单选题]真空脱碳效率不受( )因素的影响。
A)真空度B)脱碳时间C)钢水量答案:C解析:5.[单选题]目前冶炼过程中用得最多的造渣方法是 。
A)单渣法B)双渣法C)留渣法答案:A解析:6.[单选题]含碳量为0.57%的铁碳合金称为() 。
A)亚共析钢7.[单选题]耐火材料刚玉料的主要成份是( )。
A)Al2O3B)SiO2C)MgO答案:A解析:8.[单选题]金属喷溅的形成原因有()。
A)CO气体在炉内不能排出,大量积聚B)渣层不能很好的覆盖金属液面C)瞬时产生大量的CO气体答案:B解析:9.[单选题]下列属于碱性氧化物的是 。
A)Al2O3B)MgOC)P2O5答案:B解析:10.[单选题]脱氧产物与钢液间界面张力小不利于A)脱氧产物颗粒聚合B)脱氧产物分解C)脱氧产物在钢液内存在答案:A解析:11.[单选题]生产IF钢,可以用下列( )种装置。
A)LFB)RHC)CAS-OB答案:B解析:12.[单选题]炉帽有正口、偏口之分,近代转炉大多采用 炉帽。
A)正口13.[单选题]LF炉电极横臂材料是( )。
A)铝质B)钢质C)铜质答案:A解析:14.[单选题]吹炼后期炉渣中的碱度和氧化铁都增加,二者对炉渣的熔化性温度影响( )A)相同B)相反C)均无影响答案:B解析:15.[单选题]从炉内取出钢液样,样模内的外观和凝固过程呈表面凹入、光滑发黑。
说明钢液中含碳量为 ()。
A)0.10~0.12%B)0.12~0.14%C)0.14~0.15%答案:C解析:16.[单选题]经验表明,较大范围内调节送粉速度宜采用 的方法。
一、解答题1.最近有媒体报道,北极圈有大量甲烷释放出来,由此带来的灾难可能不可估量。
但甲烷的合理利用可以给人类带来福利,因为甲烷是重要的燃料和工业原料。
回答下列问题:I.利用甲烷的还原性,可以对大气中的氮氧化合物进行处理。
已知一定条件下:①4NO2(g)+2N2(g)=8NO(g)△H1=+586kJ·mol-1②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ·mol-1则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=___kJ·mol-1,该反应___(填“能”或“不能”)自发进行。
II.利用CH4可制备合成气,反应为CO2(g)+CH4(g)2CO(g)+2H2(g),在一定条件下,在恒容密闭容器中通入CH4与CO2,使其初始物质的量浓度均为1.0mol·L-1,测得CH4的平衡转化率与温度及压强的关系如图所示:(1)该反应的△H___0(填“>”、“<”或“=”)。
(2)下列描述能说明上述反应已达到化学平衡状态的是___(选填序号)。
①2v(CO2)=v(CO)②容器中混合气体的密度不随时间而变化③容器中气体压强不随时间而变化④容器中混合气体的平均相对分子质量不随时间而变化(3)压强p1、p2、p3、p4由大到小的关系为___。
压强为p4时,在b点:v(正)___v(逆)(填“>”、“<”或“=”)。
(4)对于气相反应,用某组分(B)的平衡压强p(B)代替其平衡时的物质的量浓度c(B)也可表示平衡常数(记作K p),若p4=0.36MPa,求a点的平衡常数K p=___(MPa)2(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)若1100℃、p4压强下反应达平衡后,再充入等物质的量浓度的CH4与CO2,则CH4的平衡转化率___80%(填“>”、“<”或“=”)。