高考化学复习“等电子”微粒的思维方法及应用PPT(完整版)
- 格式:ppt
- 大小:1.58 MB
- 文档页数:12



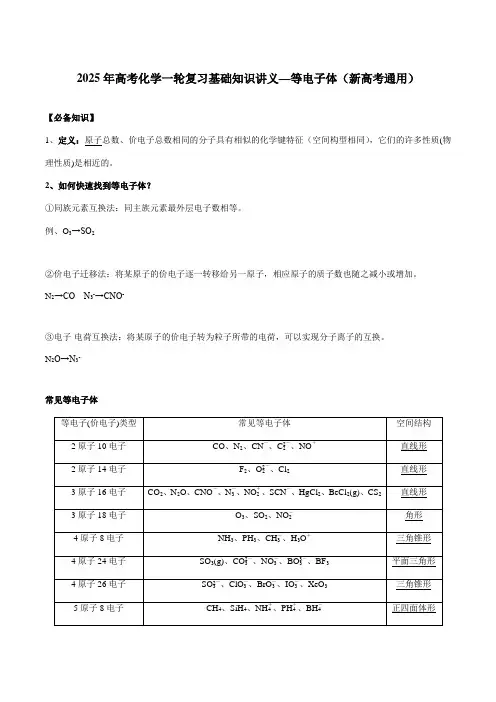
2025年高考化学一轮复习基础知识讲义—等电子体(新高考通用)【必备知识】1、定义:原子总数、价电子总数相同的分子具有相似的化学键特征(空间构型相同),它们的许多性质(物理性质)是相近的。
2、如何快速找到等电子体?①同族元素互换法:同主族元素最外层电子数相等。
例、O3→SO2②价电子迁移法:将某原子的价电子逐一转移给另一原子,相应原子的质子数也随之减小或增加。
N2→CO N3-→CNO-③电子-电荷互换法:将某原子的价电子转为粒子所带的电荷,可以实现分子离子的互换。
N2O→N3-常见等电子体5原子32电子CCl4、SiF4、SiO4-4、SO2-4、ClO-4正四面体形12原子30电子C6H6、N3B3H6(俗称无机苯) 平面六边形3、等电子体的应用预测分子空间的构型和性质例、在N2、CO2、CO 、N2O之间互为等电子体的是谁?请预测:N2O的几何构型?CO中的共价键类型?【答案】N2与CO、CO2与N2O互为等电子体。
N2O为直线形。
CO中存在碳氧三键。
【跟踪练习】1、下列几组微粒互为等电子体的是()①N2和CO②NO和O2+③CO2和CS2④N2O和N3-⑤NO2-和O3⑥BF3和SO3A.①②③B.④⑤⑥C.①③④⑥D.①②③④⑤⑥【答案】D2、下列物质的分子与O3分子的结构最相似的是()A.H2O B.CO2C.SO2D.BeCl2【答案】 C【解析】H2O分子中氧原子采用sp3杂化方式;CO2中碳原子采用sp杂化方式;BeCl2中Be原子采用sp 杂化方式。
3、(2022·福州高级中学月考)美国科学家合成了含有N+5的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V形,如图所示。
以下有关该物质的说法不正确的是()A.每个N+5中含有35个质子和34个电子B.该离子中有非极性键和配位键C.该离子中含有4个π键D.与PCl+4互为等电子体【答案】D【解析】1个氮原子中含有7个质子、7个电子,则1个N5分子中含有35个质子、35个电子,N+5是由N5分子失去1个电子得到的,则1个N+5离子中有35个质子,34个电子,故A项正确;N+5中氮氮三键是非极性共价键,中心的氮原子有空轨道,两边的2个氮原子提供孤电子对形成配位键,故B项正确;1个氮氮三键中含有2个π键,所以该离子中含有4个π键,故C项正确;N+5和PCl+4具有相同原子数,但价电子数分别为24、27,不是等电子体,故D项错误。






