二组分理想液态混合物的沸点
- 格式:docx
- 大小:10.51 KB
- 文档页数:1

物理化学试题及答案一、选择题:1. 二组分体系恒温时.可能同时存在的最大相数为 ( )(A) Φ=2 (B) Φ=3 (C) Φ=42. 在α、β两项中都含有A 和B 两种物质,当达相平衡时,下列哪种情况正确( )A B A A A B A B (A ) (C) (D) (B )αααβαβββμμμμμμμμ====3. 在101325Pa 下,水、冰和水蒸气平衡的系统中,自由度为 ( )(A) 0 (B) 1 (C) 24. 在密闭容器中有食盐饱和溶液,并且存在着从溶液中析出的细小食盐结晶,则系统的自由度是 ( )(A) 0 (B) 1 (C) 2 (D) 35. 系统是N 2和O 2两种气体的混合物时,自由度应为 ( )(A) 1 (B) 2 (C) 3 (D) 46. 在101325 Pa 下,水和水蒸气呈平衡的系统,其自由度f 为 ( )(A) 0 (B) 1 (C) 2 (D) 37. NH 4Cl(s)在真空容器中分解达到平衡NH 4Cl(s) → HCl(g) + NH 3(g) ( )(A) K =3, Φ=2, f =2 (B) K =2, Φ=2, f =1(C) K =1, Φ=2, f =1 (D) K =4, Φ=2, f =18. 25 ℃及标准压力下,NaCl(s)与其水溶液平衡共存 ( )(A) K =1, Φ=2, f =1 (B) K =2, Φ=2, f =1(C) K =2, Φ=2, f =0 (D) K =4, Φ=2, f =19. 已知在318 K 时纯丙酮的的蒸气压为43.063 kPa ,今测得氯仿的摩尔分数为0.30的丙酮-氯仿二元溶液上丙酮的蒸气压为26.77 kPa ,则此溶液: ( )(A) 为理想液体混合物 (B) 对丙酮为负偏差(C) 对丙酮为正偏差 (D) 无法确定10. 苯(A)与甲苯(B)形成理想混合物,当把5 mol 苯与5 mol 甲苯混合形成溶液,这时,与溶液相平衡的蒸汽中,苯(A)的摩尔分数是: ( )(A) y A = 0.5 (B) y A < 0.5(C)y A > 0.5 (D) 无法确定11. 二组分理想溶液的沸点的论述正确的是:()(A) 沸点与溶液组成无关(B)沸点在两纯组分的沸点之间(C) 小于任一纯组分的沸点(D) 大于任一纯组分的沸点12. 由A及B二种液体组成理想溶液,A、B的饱和蒸气压分别为p*A、p*B,x为液相组成,y为气相组成,若p*A > p*B( *表示纯态),则:()(A) x A > x B(B) x A > y A(C) 无法确定(D)x A < y A13. 液体A与B混合形成非理想混合物,当A与B分子之间作用力大于同种分子之间作用力时,该混合物对拉乌尔定律而言:()(A) 产生正偏差(B)产生负偏差(C) 不产生偏差(D) 无法确定14. H2O、K+、Na+、Cl- 、I- 体系的组分数是:()(A) K = 3 (B) K = 5(C)K = 4 (D) K = 215. 压力升高时,单组分体系的熔点将如何变化:()(A) 升高(B) 降低(C) 不变(D)不一定16. 硫酸与水可组成三种化合物:H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s),在p下,能与硫酸水溶液共存的化合物最多有几种:()(A) 1 种(B) 2 种(C) 3 种(D) 0 种17. 两组分理想溶液,在任何浓度下,其蒸气压:()(A) 恒大于任一纯组分的蒸气压(B) 恒小于任一纯组分的蒸气压(C)介于两个纯组分的蒸气压之间(D) 与溶液组成无关18.具有最低恒沸温度的某两组分体系,在其T-x相图最低点有()(A)f=0; x g=x l(B) f=1; x g = x l(C) f=0; x g > x l(D) f=1; x g > x l19. 一定温度下,二元理想液态混合物中若纯B的饱和蒸汽压大于纯A的饱和蒸汽压(p B*>p A*),则当x B增大汽液两相达平衡时,系统压力()(A) 不变(B) 减少(C)增大(D) 不一定20. 由A、B二组分组成一理想液态混合物。

二组分溶液沸点一组成图的绘制一内容提要本实验采用回流冷凝法测定不同浓度的环己烷-乙醇溶液的沸点和气液两相的平衡浓度,绘制沸点—组成图,并从图上确定体系的最低恒沸物及其相应的组成。
二目的要求1.掌握沸点一组成图的绘制方法。
2.掌握阿贝折光仪及超级恒温槽的使用方法。
三实验关键1.在测定工作曲线步骤中,配制液体时要求使用移液管准确移液,从而保证绘制工作曲线的准确性。
每种浓度样品其沸腾状态应尽量一致,即以气泡“连续”、“均匀”冒出为好,不要过于激烈也不要过于缓慢。
2.由于液体的折射率受温度影响很大,折射仪采和用温槽恒温,恒温水在回路中要保持循环畅通。
用阿贝折光仪测液体折射率时,用滴管滴数滴液体于棱镜上,待整个镜面浸润后再进行观察。
3.蒸馏瓶中电热丝一定要被溶液浸没后方能通电加热,否则电热丝易烧断或燃烧着火。
四预备知识1.杠杆原则.当组成以物质的量分数(x)表示时,两相的物质的量反比于系统点的两个相点线段的长度。
2.在恒定压力下,实验测定一系列不同组成液体的沸腾温度及平衡时气液两相的组成,即可绘出该压力下的温度-组成图。
最大正偏差系统的温度-组成图上出现最低点,在此点气相线和液相线相切,由于对应于此点组成的液相在指定压力下沸腾时产生气相与液相组成相同,故沸腾时温度恒定,且这一温度又是液态混合物的最低温度,故称之为最低恒沸点,与此类似,最大负偏差系统的温度—组成图上出现最高点,即为最高恒沸点。
恒沸混合的组成取决于压力,压力一定,恒沸混合物的组成一定;压力改变,恒沸混合物的组成改变,甚至恒沸点可以消失,这证明恒沸混合物不是一种化合物。
五实验原理在恒压下完全互溶的二组分溶液体系的沸点一组成图可分三类:1.理想的二组分溶液,其沸点介于两组分沸点之间,如苯-甲醇体系。
2.对拉乌尔定律发生负偏差的溶液,其溶液有最高恒沸点,如丙酮—氯仿、硝酸—水体系。
3.对拉乌尔定律发生正偏差的溶液,其溶液有最低恒沸点,如苯—乙醇、乙醇—水体系。

复习题1.在一个密闭绝热的房间里放置一台电冰箱,将冰箱门打开,并接通电源使其工作,过一段时间之后,室内的平均气温将如何变化?(A) 升高(B) 降低(C) 不变(D) 不一定2.一可逆热机与另一不可逆热机在其他条件都相同时,燃烧等量的燃料,则可逆热机牵引的列车行走的距离。
(A)较长(B)较短(C)一样(D)不一定3.在101.3kP a、373K下,1mol H2O(l)变成H2O(g)则()(A)Q<0(B)△U=0(C)W>0(D)△H>04.溶胶和大分子溶液。
(A)都是单相多组分系统(B)都是多相多组分系统(C)大分子溶液是单相多组分系统,溶胶是多相多组分系统(D)大分子溶液是多相多组分系统,溶液是单相多组分系统5. 当理想气体反抗一定的外压做绝热膨胀时,则.(A) 焓总是不变的(B)热力学能总是不变的(C)焓总是增加的(D) 热力学能总是减小的6.将克拉佩龙方程用于H2O的液固两相平衡,因为V m(H2O,1)<V m(H2O,s),所以随着压力的增大,则HO(1)的凝固点将:()2(A)上升(B)下降(C)不变7.下述化学势的公式中,不正确的是。
(A)(B)(C)(D)8.在373K,200kPa,液态水和气态水化学势的大小为。
(A)μl=μg=0(B)μl=μg<0(C)μl>μg(D)μl<μg9.二组分理想液态混合物的蒸气总压()(A)与溶液的组成无关(B)介于两纯组分的蒸气压之间(C)大于任一纯组分的蒸气压(D)小于任一纯组分的蒸气压10.纯液体在正常相变点凝固,则下列量减小的是。
(A)S;(B)G;(C)蒸汽压;(D)凝固热。
11.今有A(s) B(s) C(l)三组分相图,图中三相平衡区为。
(A) AFE(B) CFED(C) AEB(D) BED12.反应2NO(g)+O2(g)==2NO2(g)是放热的,当反应在某温度、压力下达平衡时,若使平衡向右移动。

第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x B 呈线性关系。
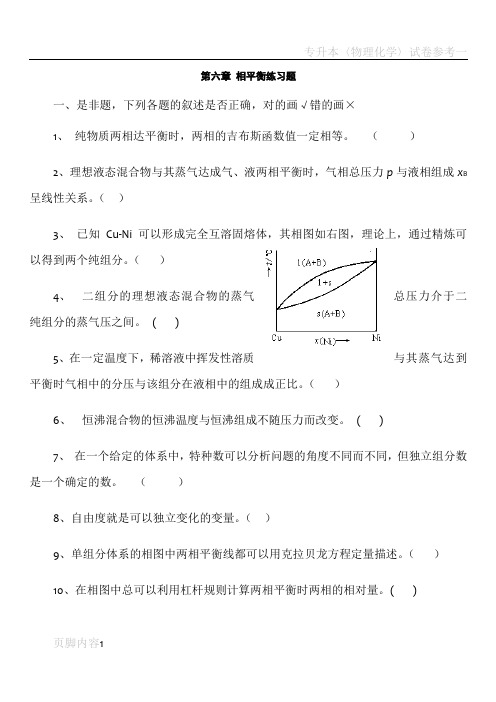
()3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于373.2 K;(2)必高于373.2 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(1) 3种;(2) 2种;(3) 1种;(4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的?(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。

双液系的气液平衡相图1.引言1.1实验目的本实验采用沸点仪测定常压下环己烷—乙醇的气液平衡相图;掌握阿贝折射仪的使用方法。
1.2 实验原理将两种蒸气压不同的挥发性液体混合,溶液的组成与其平衡气相的组成不同。
在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。
沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。
第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
第(1)类混合物可用一般精馏法分理处这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。
图1 沸点组成图[1]为了测定二元液系的T—x图,需在气液两相达到平衡后,同事测定溶液的沸点、气相和液相组成。
本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T—x图。
方法是用沸点仪(图2)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折射仅测定其折射率。
为了求出相应的组成,必须先测定已知组成的溶液的折射率,作出折射率对组成的工作曲线,在此曲线上即可查得对应于样品折射率的组成。
沸点仪的种类很多,本实验采用一种带有电阻丝加热的沸点仪。
沸腾的溶液由喷嘴喷向温度计,因此可以测得蒸气与液相平衡时的温度。
气相经冷凝后贮存在小泡内。
图2 沸点仪[1]2. 实验操作2.1 实验用品沸点仪、XT—600S60KT调压器、阿贝折射仪、超级恒温槽、数显温度计、胶头滴管、锥形瓶(带瓶塞),电子分析天平、洗耳球、10 mL移液管。
物理化学练习题一、选择题1. 理想气体模型的基本特征是(A) 分子不断地作无规则运动、它们均匀分布在整个容器中(B) 各种分子间的作用相等,各种分子的体积大小相等(C) 所有分子都可看作一个质点, 并且它们具有相等的能量(D) 分子间无作用力, 分子本身无体积2. 理想气体状态方程pV=nRT表明了气体的p、V、T、n、这几个参数之间的定量关系,与气体种类无关。
该方程实际上包括了三个气体定律,这三个气体定律是(A) 波义尔定律、盖-吕萨克定律和分压定律(B) 波义尔定律、阿伏加德罗定律和分体积定律(C) 阿伏加德罗定律、盖-吕萨克定律和波义尔定律(D) 分压定律、分体积定律和波义尔定律3.热力学第一定律ΔU=Q+W 只适用于(A) 单纯状态变化(B) 相变化(C) 化学变化(D) 封闭物系的任何变化4.关于焓的性质, 下列说法中正确的是(A) 焓是系统内含的热能, 所以常称它为热焓(B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功(D) 焓的增量只与系统的始末态有关5.下列哪个封闭体系的内能和焓仅是温度的函数(A) 理想溶液(B) 稀溶液(C) 所有气体(D) 理想气体6.下列过程中, 系统内能变化不为零的是(A) 不可逆循环过程(B) 可逆循环过程(C) 两种理想气体的混合过程(D) 纯液体的真空蒸发过程7.第一类永动机不能制造成功的原因是(A) 能量不能创造也不能消灭(B) 实际过程中功的损失无法避免(C) 能量传递的形式只有热和功(D) 热不能全部转换成功8.下面的说法符合热力学第一定律的是(A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化(B) 在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关(C) 封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关(D) 气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关9.关于热平衡, 下列说法中正确的是(A) 系统处于热平衡时, 系统的温度一定等于环境的温度(B) 并不是所有热力学平衡系统都必须满足热平衡的条件(C) 若系统A与B成热平衡, B与C成热平衡, 则A与C直接接触时也一定成热平衡(D) 在等温过程中系统始终处于热平衡10.在一个循环过程中,物系经历了i步变化,则(A) ∑Qi=0 (B) ∑Qi-∑Wi=0(C) ∑Wi=0 (D) ∑Qi+∑Wi=011.关于热力学可逆过程,下面的说法中不正确的是(A) 可逆过程不一定是循环过程(B) 在等温可逆过程中,系统做功时,系统损失的能量最小 (C) 在等温可逆过程中,环境做功时,系统得到的功最小 (D) 可逆过程中的任何一个中间态都可从正逆两个方向到达 12. 对于理想气体,下列关系中哪个是不正确的:(A ) 0 (B )0(C ) 0 (D ) 0pT TTU U T V H U p p ∂∂⎛⎫⎛⎫== ⎪ ⎪∂∂⎝⎭⎝⎭⎛⎫⎛⎫∂∂== ⎪ ⎪∂∂⎝⎭⎝⎭13. 一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V 1、V 2。
1.对于一封闭系统的循环过程,若整个变化过程中Q = 100 J,则W= A 。
A. -100 JB. 100 JC. 0 JD. 不确定2. 在一个绝热刚瓶中,发生一个放热的化学反应,那么 C 。
A. Q > 0,W > 0,∆U > 0B. Q = 0,W = 0,∆U < 0C. Q = 0,W = 0,∆U = 0D. Q < 0,W > 0,∆U < 03. 1mol双原子理想气体的()V T∂是 C 。
H∂A. 1.5RB. 2.5RC. 3.5RD. 2R4. 下列气体溶于水中,不能用亨利定律的是 B 。
A. N2B. N O2C. O2D. C O5.下列偏摩尔量表达式中,正确的是 B 。
A. (əV m/ən B)T, P, n C (C ≠ B)B. (əA/ən B)T, P, n C (C ≠ B)C. (əG/ən B)T, V, n C (C ≠ B)D. (əH/ən B)V, P, n C (C ≠ B) 6.在298.2K、101325Pa压力下,二瓶体积均为1dm3的蔗糖水溶液,第一瓶中含蔗糖1mol;第二瓶中含蔗糖0.5mol。
若以μ1及μ2分别表示二瓶中蔗糖的化学势,则 A 。
A. μ1 > μ2B. μ1 < μ2C. μ1 = μ2D. 不能确定7.30%的乙醇水溶液,常压下在精馏塔中精馏时,塔顶得到的是 D 。
A. 纯水B. 纯乙醇C. 纯水或纯乙醇D. 恒沸混合物8.若下列反应气体都是理想气体,反应平衡常数之间有K c=K p=K x的反应是 B 。
(1) 2HI(g) = H2(g) + I2(g);(2) N2O4(g) = 2NO2(g);(3) CO(g) + H2O(g) = CO2(g) + H2(g);(4) C(s) + CO2(g) = 2CO(g)。
A. (1)(2)B. (1)(3)C. (3)(4)D. (2)(4)9.在恒温恒压下,某一化学反应正向自发进行,一定是 D 。