游离a-氨基酸含量的测定
- 格式:ppt
- 大小:173.00 KB
- 文档页数:14

保护氨基酸检验指导书发放号:编写: 审核:批准:1. 检验流程1.1 成品置于待测区1.2 检验员取样1.3 成品检测(外观、纯度、质谱、旋光、熔点、澄清度等)1.4 备注:A. 产品粉碎并包装置于待测区后,取样检测出的数据写入检验报告。
B. 研发部提供的生产过程中的图谱 (MS、HPLC) ,可做参考,有权进行复查。
2 检验项目2.1 外观:目测法(须为白色或类白色粉末或结晶性类白色粉末)2.2 光学纯度的测定2.2.1 仪器和试剂液相色谱仪、输液泵、检测器、色谱柱、记录装置、进样阀、微量注射器、超声波发生器、蒸馏水、乙晴、三氟乙酸2.2.2 分析步骤A. 称取一定量的样品溶于10ml容量瓶中,直至完全溶解,然后将其过滤。
B. 用微量注射器吸取一定量试样溶液进入色谱系统,利用梯度洗脱使样品达到分离。
C. 各组分经过紫外检测器,通过色谱工作站记录各组分的紫外吸收、并转换为电信号。
D. 在线色谱工作站记录各组分的各项参数,如保留时间、峰高、峰面积,通过面积归一法计算出各组分的百分含量。
2.2.3 注意事项A. 氨基酸样品分析必须打空白,谱图中不允许出现未积分的小杂峰,若是空白中有的,必须以基线相减的方式处理掉;如果处理不掉,必须进行复测。
B. 基线尽量保持一条直线。
C. 谱图中不允许出现负峰。
2.2.4 要求及规定A. 氨基酸样品分析必须打空白,谱图中不允许出现未积分的小杂峰,若是空白中有的,必须以基线相减的方式处理掉;如果处理不掉,必须进行复测。
B. 基线尽量保持一条直线。
C. 谱图中不允许出现负峰。
D. 尽量安排同一产品的测试使用同一分析条件,这样可加强可比性。
E. 比较数据的重复性时,安排统一产品测试的时间不要间隔很久。
F . 若单项杂质在1%±0.05%,复测确定数据的重复性。
G. 若同一批次产品分包装送样检测,混合样数据应在各分包装测试数据的范围内。
例如:分包装测试的数据分别为:98.5%、98.6%、98.7%,若混合样数据不在98.5%-98.7%范围内,则复测确定数据的重复性。
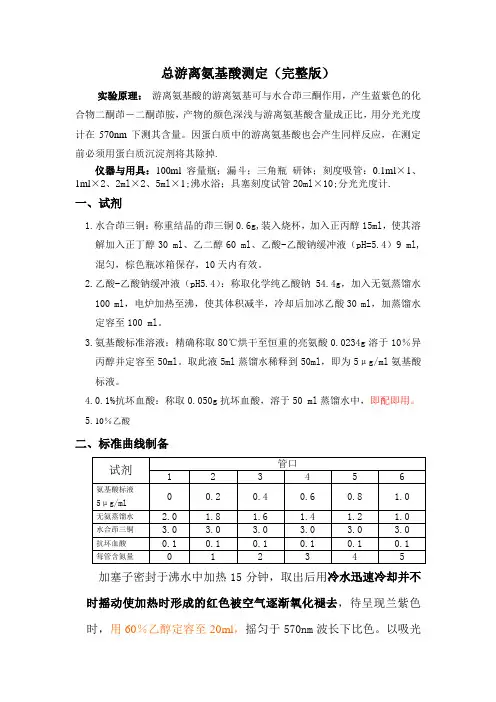
总游离氨基酸测定(完整版)实验原理:游离氨基酸的游离氨基可与水合茚三酮作用,产生蓝紫色的化合物二酮茚-二酮茚胺,产物的颜色深浅与游离氨基酸含量成正比,用分光光度计在570nm下测其含量。
因蛋白质中的游离氨基酸也会产生同样反应,在测定前必须用蛋白质沉淀剂将其除掉.仪器与用具:100ml容量瓶;漏斗;三角瓶研钵;刻度吸管:0.1ml×1、1ml×2、2ml×2、5ml×1;沸水浴;具塞刻度试管20ml×10;分光光度计.一、试剂1.水合茚三铜:称重结晶的茚三铜0.6g,装入烧杯,加入正丙醇15ml,使其溶解加入正丁醇30 ml、乙二醇60 ml、乙酸-乙酸钠缓冲液(pH=5.4)9 ml,混匀,棕色瓶冰箱保存,10天内有效。
2.乙酸-乙酸钠缓冲液(pH5.4):称取化学纯乙酸钠54.4g,加入无氨蒸馏水100 ml,电炉加热至沸,使其体积减半,冷却后加冰乙酸30 ml,加蒸馏水定容至100 ml。
3.氨基酸标准溶液:精确称取80℃烘干至恒重的亮氨酸0.0234g溶于10%异丙醇并定容至50ml。
取此液5ml蒸馏水稀释到50ml,即为5μg/ml氨基酸标液。
4.0.1%抗坏血酸:称取0.050g抗坏血酸,溶于50 ml蒸馏水中,即配即用。
5.10%乙酸二、标准曲线制备加塞子密封于沸水中加热15分钟,取出后用冷水迅速冷却并不时摇动使加热时形成的红色被空气逐渐氧化褪去,待呈现兰紫色时,用60%乙醇定容至20ml,摇匀于570nm波长下比色。
以吸光度为纵坐标,氨基氮ug数为横坐标,绘标准曲线三、实验步骤:1.烟末0.5g于研钵中加入5 ml10%乙酸,研磨匀浆后用蒸馏水定容100 ml,用滤纸过滤到三角瓶中备用。
2.1ml滤液加入到20ml 干燥试管中,加1 ml蒸馏水,水合茚三铜3ml, 0.1%抗坏血酸0.1ml, 加塞子密封于沸水中加热15分钟,取出后用冷水迅速冷却并不时摇动使加热时形成的红色被空气逐渐氧化褪去,待呈现兰紫色时,用60%乙醇定容至20ml,摇匀于570nm波长下比色。

游离氨基酸的测定方法
游离氨基酸咋测定呢?其实有不少方法呢!比如说茚三酮比色法。
先准备好样品,把它处理成合适的状态。
然后加入茚三酮试剂,经过一系列反应后,通过比色来确定游离氨基酸的含量。
这过程中可得小心操作,要是弄错了一步,那结果可就不靠谱啦!那安全性咋样呢?只要按照正确的步骤来,一般没啥大问题。
稳定性嘛,只要试剂没问题,操作规范,结果还是挺稳定的。
这方法能用到好多地方呢!像食品检测领域,你想想,要是不知道食品里的游离氨基酸含量,咋能保证食品的质量和营养呢?优势也不少呢!操作相对简单,成本也不高。
咱举个实际案例哈。
有个食品加工厂,用这个方法检测产品中的游离氨基酸含量,及时调整了生产工艺,提高了产品质量。
这效果多棒啊!
游离氨基酸的测定方法真的超实用,能帮我们了解各种物质中的氨基酸情况,为我们的生活和生产带来很多好处。
咱可得好好利用这些方法,让它们发挥更大的作用。

蘑菇中游离氨基酸含量的测定实验报告一、引言在食品营养学中,游离氨基酸是评价食品蛋白质质量的重要指标之一。
游离氨基酸的含量可以反映食品的蛋白质水平,也可以为食品品质的评价提供依据。
蘑菇是一种常见的食材,其营养价值较高,其中游离氨基酸含量的测定对于评价蘑菇的蛋白质质量非常重要。
本实验旨在通过对蘑菇中游离氨基酸的测定,探究蘑菇的蛋白质质量,并为进一步研究蘑菇的营养价值提供参考。
二、实验方法1. 实验材料准备•蘑菇样品:取新鲜的蘑菇作为实验样品。
•无水无氧乙酸:用于提取蘑菇中的游离氨基酸。
•pH 2.2缓冲液:用于调节提取液的酸碱度。
2. 实验步骤1.将蘑菇样品洗净并切碎成小块。
2.取20克蘑菇样品加入100 mL pH 2.2缓冲液中。
3.加入适量的无水无氧乙酸,使pH值控制在2.2左右。
4.进行超声波提取,提取时间为30分钟。
5.将提取液离心,收集上清液。
6.将上清液过滤,得到待测样品。
3. 游离氨基酸含量测定1.取1 mL 待测样品加入氨基酸分析仪样品瓶中。
2.将样品瓶放入氨基酸分析仪,按照仪器操作说明进行测定。
3.记录并计算游离氨基酸的含量。
三、实验结果根据实验测定,蘑菇中游离氨基酸含量为:•脯氨酸:5.2 mg/g•缬氨酸:3.8 mg/g•苏氨酸:2.5 mg/g•赖氨酸:1.9 mg/g•…四、实验讨论根据实验结果可以看出,蘑菇中游离氨基酸的含量较高,表明蘑菇具有较高的蛋白质质量。
其中以脯氨酸和缬氨酸的含量最高,说明蘑菇富含这两种氨基酸。
与其他食材相比,蘑菇中游离氨基酸的含量可能有所差异。
这可能是由于蘑菇的生长环境、品种等因素所致。
进一步的研究可以探究不同蘑菇品种中游离氨基酸含量的差异。
游离氨基酸的含量对于食物的品质和营养价值具有重要的影响。
蘑菇作为一种营养价值较高的食材,其富含的游离氨基酸有助于提供人体所需的必需氨基酸,并具有重要的保健作用。
五、结论通过本实验的测定,我们得出了蘑菇中游离氨基酸的含量,并得出以下结论:1.蘑菇中富含游离氨基酸,特别是脯氨酸和缬氨酸。

氨基酸总量的测定(茚三酮比色法)一、方法原理:氨基酸的游离氨基与水合茚三酮作用后,可产生二酮茚一二酮茚胺的取代盐等蓝紫色化合物,其颜色深浅与氨基酸含量成正比,据此可以比色测定氨基酸含量。
二、试剂:1.2%茚三酮溶液:1g茚三酮(C9H403·2H2O)溶于25ml热水中,加入40mg氯化亚锡;(SnCl2·2H2O),搅拌溶解,滤去残渣,滹液放在冷暗处过夜,用水定容为50ml,保存声冷暗处。
如茚三酮有微红色,配成的溶液也带红色,将影响比色测定,需将茚三酮重结晶后再用方法是:取5g茚三酮溶于20ml热水中,加入0.2g活性炭,轻轻摇动,放三十分钟后过滤,滤液置冰箱中过夜,次日过滤,用1ml冷水淋洗结晶,然后放在干燥器中干燥,装瓶保存。
2。
磷酸盐缓冲液(pH8.0):①1/15mol/l磷酸二氢钾溶液:取KH2P04 0.9070g溶于lOOml水中。
②1/15mol/l磷酸氢二钠溶液:取磷酸氢二钠(Na2HP04·12H20)23.876g溶于水,加水至1000ml。
取①50ml与②95ml混匀即得。
3.10%醋酸:取lOml冰醋酸加水至lOOml。
4,氨基酸标准溶液(200ppm):称取干燥的氨基酸(白氨酸,或其它的氨基酸)0.2000g溶解于水,定容为1000ml。
三、仪器:水浴,721分光光度计。
四、操作步骤:(一)标准曲线绘制:分别吸取氨基酸标准溶液(200ppm)0、0.5、1.0、1.5、2.0、2.5ml各置于25ml容量瓶中,加水补充至4.0ml,各加入缓冲液lml,加入茚三酮lml,摇匀。
置沸水浴中加热15分钟,取出迅速冷却至室温,—用水定容。
放置15分钟,在570nm波长下测定,绘制标准曲线。
氨基酸浓度分别为0,4.0,8.0,12.0,16.0,20.Oppm。
(二)样品测定:l提取样品:称取1.0 ~2.0g植物样品(新鲜样或干样),加5m1 10%醋酸,在研钵中研碎,用水洗移入lOOml容量瓶,水定容,过滤到三角瓶中,取滤液测定。

氨基酸测定方法的研究进展一、本文概述氨基酸作为生物体内蛋白质的基本构成单元,其种类、数量及比例对于蛋白质的功能和生物体的生命活动具有决定性的影响。
因此,氨基酸的测定方法一直以来都是生物化学和生物学研究的重要领域。
随着科学技术的不断发展,氨基酸测定方法也取得了显著的进步,从早期的传统化学分析法,到现代的仪器分析法,再到近年来的生物信息学方法,氨基酸测定的准确性和效率得到了显著的提升。
本文将对近年来氨基酸测定方法的研究进展进行综述,旨在为读者提供全面的氨基酸测定方法的知识,并展望未来的发展方向。
我们将简要介绍氨基酸测定方法的发展历程,从传统的化学分析法到现代的仪器分析法,以及最新的生物信息学方法。
随后,我们将重点综述近年来氨基酸测定方法的研究进展,包括新的测定技术、方法的优化和改进,以及在不同领域的应用。
我们还将讨论氨基酸测定方法目前面临的挑战和未来的发展趋势,以期为相关领域的研究提供参考和借鉴。
二、传统氨基酸测定方法传统氨基酸测定方法主要包括色谱法、电泳法、光谱法以及衍生化法等。
这些方法各有特点,并在不同的历史阶段对氨基酸的测定和研究起到了重要作用。
色谱法:色谱法是一种经典的氨基酸测定方法,其基本原理是利用氨基酸在固定相和移动相之间的分配平衡进行分离。
常见的色谱法包括纸色谱、薄层色谱以及高效液相色谱(HPLC)等。
其中,HPLC具有较高的分辨率和灵敏度,能够同时分离多种氨基酸,因此在氨基酸测定中得到了广泛应用。
电泳法:电泳法是一种基于氨基酸带电性质进行分离的方法。
在电场作用下,氨基酸会根据其带电性质和分子量大小在凝胶或溶液中移动,从而实现分离。
电泳法操作简单,分辨率高,特别适用于小分子氨基酸的测定。
光谱法:光谱法主要利用氨基酸的特殊光谱性质进行测定。
例如,氨基酸与某些试剂反应后会产生特征性的颜色变化,通过比色法可以测定氨基酸的含量。
氨基酸还具有紫外吸收和荧光性质,可以利用紫外-可见光谱和荧光光谱法进行测定。


饲料中游离氨基酸的检测方法
饲料中游离氨基酸的检测方法主要包括以下几种:
1. 比色法:利用氨基酸与重金属离子或某些化学试剂形成特定颜色的配合物,通过比色反应来定量测定游离氨基酸的含量。
2. 色谱法:常用的色谱方法包括气相色谱(GC)和高效液相色谱(HPLC)。
色谱法可以对多种氨基酸进行分离和定量,具有准确、灵敏、高效的特点。
3. 生物传感器法:利用生物传感器对游离氨基酸进行检测。
常用的生物传感器包括酶传感器、抗体传感器和细胞传感器等,这些传感器具有高灵敏度和高选择性。
4. 光谱法:包括紫外光谱、红外光谱和质谱等分析方法,可以利用氨基酸的特征吸收峰或质谱图谱进行定量测定。
以上方法在游离氨基酸的检测中都有各自的优缺点,在实际应用中可以根据需要选择合适的方法进行分析。

氨基酸测定
氨基酸测定介绍:
氨基酸是构成蛋白质的基本单位。
组成人体蛋白质的氨基酸有21种,除了脯氨基酸为亚氨基酸外,其他氨基酸均为α氨基酸。
组成蛋白质分子的氨基酸都是L-氨基酸,但近年内证实了它们可以异构为D-氨基酸,具体机制还未研究。
氨基酸测定正常值:
氨基酸测定临床意义:
见表2。
氨基酸测定注意事项:
(1)临床上测定血清或血浆的氨基酸,要避免食物消化吸收的影响,应在清晨空腹采血。
(2)标本溶血时不宜采用,以免由于红细胞中的氨基酸进入血血浆导致假性增高。
氨基酸测定检查过程:
暂无相关信息。

一、实验目的1.了解植物组织中叶绿素的分布及性质。
2.掌握测定叶绿素含量的原理和方法。
二、实验原理叶绿素广泛存在于果蔬等绿色植物组织中,并在植物细胞中与蛋白质结合成叶绿体。
当植物细胞死亡后,叶绿素即游离出来,游离叶绿素很不稳定,对光、热较敏感;在酸性条件下叶绿素生成绿褐色的脱镁叶绿素,在稀碱液中可水解成鲜绿色的叶绿酸盐以及叶绿醇和甲醇。
高等植物中叶绿素有两种:叶绿素a 和b ,两者均易溶于乙醇、乙醚、丙酮和氯仿。
叶绿素的含量测定方法有多种,其中主要有:1.原子吸收光谱法:通过测定镁元素的含量,进而间接计算叶绿素的含量。
2.分光光度法:利用分光光度计测定叶绿素提取液在最大吸收波长下的吸光值,即可用朗伯—比尔定律计算出提取液中各色素的含量。
叶绿素a 和叶绿素b 在645nm 和663nm 处有最大吸收,且两吸收曲线相交于652nm 处。
因此测定提取液在645nm 、663nm 、652nm 波长下的吸光值,并根据经验公式可分别计算出叶绿素a 、叶绿素b和总叶绿素的含量。
三、仪器、原料和试剂仪器分光光度计、电子顶载天平(感量0.01g)、研钵、棕色容量瓶、小漏斗、定量滤纸、吸水纸、擦境纸、滴管。
原料新鲜(或烘干)的植物叶片试剂1. 96%乙醇(或80%丙酮)2. 石英砂3. 碳酸钙粉四、操作步骤取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,去除中脉剪碎。
称取剪碎的新鲜样品2g ,放入研钵中,加少量石英砂和碳酸钙粉及3mL95%乙醇,研成均浆,再加乙醇10mL ,继续研磨至组织变白。
静置3~5min 。
取滤纸1张置于漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗,滤液流至100mL 棕色容量瓶中;用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。
用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。
直至滤纸和残渣中无绿色为止。
最后用乙醇定容至100mL ,摇匀。
取叶绿体色素提取液在波长665nm 、645nm 和652nm 下测定吸光度,以95%乙醇为空白对照。

血清中游离氨基酸的测定血清中游离氨基酸的测定是一种重要的生化分析方法,可以用来评估人体的营养状况、肝脏功能以及某些代谢疾病的诊断和监测。
本文将介绍游离氨基酸测定的原理、方法和一些相关应用。
一、原理在正常生理状态下,游离氨基酸主要由肠道摄入的蛋白质分解产生,也可由肝脏合成。
血清中游离氨基酸的浓度与体内摄入和代谢的平衡相关。
游离氨基酸的测定常采用高效液相色谱(HPLC)或气相色谱(GC)方法。
HPLC法:该方法利用高效液相色谱技术,将游离氨基酸样品进行分离和定量。
通过样品的前处理、有机溶剂的洗脱和柱温的控制,可以有效地分离血清中的游离氨基酸。
GC法:该方法利用气相色谱技术,将游离氨基酸样品中的氨基酸成分进行分离。
通过取样、衍生化、柱温控制和检测器的选择,可以得到准确的游离氨基酸浓度。
二、方法1. 样品准备首先,需要收集被测者的血清样品。
采集血清样品时应注意避免任何污染,以确保测定的准确性。
2. 样品处理将收集到的血清样品离心,得到澄清液。
然后,使用合适的方法进行样品的前处理,例如蛋白质沉淀、酸水解或衍生化。
3. 色谱条件设置对于HPLC法,需要准备一个合适的色谱柱和流动相。
流动相的pH值和组成应根据实验需要进行优化。
对于GC法,需要选择合适的柱和检测器,同时设置适当的柱温和气体流速。
4. 校准曲线绘制制备一系列已知浓度的游离氨基酸标准溶液,将其进行色谱分析,并记录各峰的相对峰面积。
5. 样品分析将经过前处理的血清样品注入色谱仪中,进行色谱分析。
记录各氨基酸的峰面积,并利用已知浓度标准曲线进行定量计算。
三、应用1. 营养评估游离氨基酸的测定可用于评估人体的蛋白质营养状况。
蛋白质供应不足或消化吸收障碍会导致血清游离氨基酸浓度下降,从而反映出人体的蛋白质代谢情况。
2. 代谢疾病监测某些代谢疾病,如肝功能异常、糖尿病和肾功能损害,会对游离氨基酸的代谢产生影响。
通过监测血清中游离氨基酸的浓度变化,可以帮助医生进行疾病的诊断和监测。
氨基酸测定方法一、引言氨基酸是构成蛋白质的基本组成单位,对于生命体的生长和发育起着重要的作用。
因此,准确测定氨基酸的含量和组成对于研究蛋白质结构和功能具有重要意义。
本文将介绍一些常用的氨基酸测定方法,包括色谱法、光谱法和化学法等。
二、色谱法测定氨基酸2.1 气相色谱法气相色谱法是测定氨基酸含量和组成的常用方法之一。
该方法通过将氨基酸样品转化为易挥发的衍生物,然后使用气相色谱仪进行分析。
气相色谱法具有分离效果好、灵敏度高和操作简便等优点。
2.1.1 衍生化反应在气相色谱法中,常用的氨基酸衍生化反应包括酯化、酰化和取代反应等。
这些反应能够将氨基酸转化为易挥发的衍生物,便于后续的气相色谱分析。
2.1.2 气相色谱仪气相色谱仪是进行气相色谱分析的关键设备。
它由进样系统、色谱柱和检测器等部分组成。
进样系统用于将样品引入色谱柱,色谱柱用于分离氨基酸衍生物,检测器用于检测分离后的化合物。
2.2 液相色谱法液相色谱法也是测定氨基酸含量和组成的常用方法之一。
该方法通过将氨基酸样品溶解在溶剂中,然后使用液相色谱仪进行分析。
液相色谱法具有分离效果好、灵敏度高和选择性强等优点。
2.2.1 色谱柱选择在液相色谱法中,选择合适的色谱柱对于分离氨基酸非常重要。
常用的色谱柱包括离子交换柱、反相柱和手性柱等。
不同的色谱柱具有不同的分离机理和选择性,可以根据需要选择合适的色谱柱。
2.2.2 梯度洗脱条件在液相色谱法中,通过调整洗脱溶剂的组成和流速等参数,可以实现对氨基酸的有效分离。
梯度洗脱条件可以根据氨基酸的亲水性和极性等特性进行优化。
三、光谱法测定氨基酸3.1 紫外-可见光谱法紫外-可见光谱法是测定氨基酸含量和组成的常用方法之一。
该方法通过测量氨基酸在紫外-可见光波段的吸收特性,来推断其含量和组成。
紫外-可见光谱法具有操作简便、灵敏度高和选择性强等优点。
3.1.1 吸收峰特征不同氨基酸在紫外-可见光谱中具有不同的吸收峰特征。
通过测量氨基酸的吸收峰强度和位置,可以推断其含量和组成。
SOD,POD,CAT,MDA,可溶性蛋白用同一提取液。
磷酸缓冲液配制:A液(Na2HPO40.2M):Na2HPO4.2H2O=35.61g(或Na2HPO4.12H2O=71.64g)定容1000MLB液(NaH2PO4 0.2M):NaH2PO4.H2O=27.6g(或NaH2PO4.2H2O=31.21g)定容到1000ml浓度mol/l PH值A液体积ml B液体积ml 定容体积ml0.05 7.8 91.5 8.5 4000.1 7.5 84 16 2000.1 7.0 61 39 2000.1 6.0 12.3 87.7 2001/15 7.0 61 39 300130mmol/l甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml0.75mmol/l氮蓝四唑(NBT)溶液:称0.06133gNBT用磷酸缓冲液定容至100ml避光保存0.1mmol/LEDTA-Na2溶液:取0.03721gEDTA-Na2用磷酸缓冲液定容至1000ml0.02mmol/l核黄素溶液:取0.00753g核黄素定容至1000ml避光保存反应液组成水:磷酸:Met:NBT:EDTA-Na2:FD=5:30:6:6:6:6150ml反应液的组成是水12.7ml+磷酸(0.05M,PH=7.8)76.3ml+Met15.25ml+NBT15.25ml+EDTA=Na215.25ml+FD15.25mlSOD:称取0.5g鲜样,加1ml磷酸缓冲液(0.05mol/L PH=7.8),冰浴研磨,研磨后再加入1ml缓冲液倒入离心管,再用2ml缓冲液冲洗研钵,倒入离心管中,平衡后低温(0-4℃)10000rpm离心后10min冷藏保存。
取相同型号的试管,加入20μl上清液(2支对照管加缓冲液),分别加3ml反应液,其中一支对照放于暗处,其余在4000lux下反应20-30min(温度高时时间短,温度低时时间长)后再560nm下进行比色。
第十章 蛋白质和氨基酸的测定第一节 概述蛋白质是生命的物质基础,是构成生物体细胞组织的重要成分,是生物体发育及修补组织的原料。
一切有生命的活体都含有不同类型的蛋白质。
人体内的酸、碱及水分平衡,遗传信息的传递,物质代谢及转运都与蛋白质有关。
人及动物只能从食物中得到蛋白质及其分解产物,来构成自身的蛋白质,故蛋白质是人体重要的营养物质,也是食品中重要的营养成分。
蛋白质在食品中含量的变化范围很宽。
动物来源和豆类食品是优良的蛋白质资源。
部分种类食品的蛋白质含量见表10-1表10-1 部分食品的蛋白质含量蛋白质是复杂的含氮有机化合物,摩尔质量大,大部分高达数万~数百万,分子的长轴则长达1nm ~100nm ,它们由20种氨基酸通过酰胺键以一定的方式结合起来,并具有一定的空间结构,所含的主要化学元素为C 、H 、O 、N ,在某些蛋白质中还含有微量的P 、Cu 、Fe 、I 等元素,但含氮则是蛋白质区别于其它有机化合物的主要标志。
不同的蛋白质其氨基酸构成比例及方式不同,故各种不同的蛋白质其含氮量也不同。
一般蛋白质含氮量为16%,即1份氮相当于6.25份蛋白质,此数值(6.25)称为蛋白质系食 品 种 类 蛋白质的质量分数(以湿基计)/% 食 品 种 类 蛋白质的质量分数(以湿基计)/%谷类和面食大米(糙米、长粒、生) 7.9大米(白米、长粒、生、强化) 7.1小麦粉(整粒) 13.7玉米粉(整粒、黄色) 6.9意大利面条(干、强化) 12.8玉米淀粉 0.3乳制品牛乳(全脂、液体) 3.3牛乳(脱脂、干) 36.2切达干酪 24.9酸奶(普通的、低脂) 5.3水果和蔬菜苹果(生、带皮) 0.2芦笋(生) 2.3草莓(生) 0.6莴苣(冰、生) 1.0土豆(整粒、肉和皮) 2.1 豆类 大豆(成熟的种子、生) 36.5 豆(腰子状、所有品种、 23.6 成熟的种子、生) 豆腐(生、坚硬) 15.6 豆腐(生、普通) 8.1 肉、家禽、鱼 牛肉(颈肉、烤前腿) 18.5 牛肉(腌制、干牛肉) 29.1 鸡(可供煎炸的鸡胸肉、 23.1 生) 火腿(切片、普通的) 17.6 鸡蛋(生、全蛋) 12.5 鱼(太平洋鳕鱼、生) 17.9 鱼(金枪鱼、白色、罐 26.5 装、油浸、滴干的固体)数。
不同光谱的LEDs对蝴蝶兰组培苗生长的影响戴艳娇;王琼丽;张欢;代大勇;文民操;徐志刚【摘要】研究新型光源LEDs(Light emitting diodes)辐射的红蓝等光进行不同光质配比组合后,对蝴蝶兰组培苗各形态指标、色素含量、碳氮代谢及抗氧化酶系活性的影响.结果表明,单色红光处理的蝴蝶兰组培苗徒长,RBG(红光/蓝光/绿光)处理组全部生根,单色蓝光处理的组培苗根系活力最高.红蓝组合和单色蓝光处理的叶片色素含量高于白光,叶绿素a/b比值、叶绿素a/类胡萝卜素比值随着R/B比率的降低而减小.可溶性糖、蔗糖、游离氨基酸和淀粉的含量及C/N(碳氮比)在单色蓝光下均高于单色红光处理.【期刊名称】《江苏农业科学》【年(卷),期】2010(000)005【总页数】5页(P227-231)【关键词】发光二极管(LEDs);光质;蝴蝶兰;植物组织培养【作者】戴艳娇;王琼丽;张欢;代大勇;文民操;徐志刚【作者单位】南京农业大学农学院,江苏南京,210095;南京农业大学农学院,江苏南京,210095;南京农业大学农学院,江苏南京,210095;南京农业大学农学院,江苏南京,210095;南京农业大学农学院,江苏南京,210095;南京农业大学农学院,江苏南京,210095【正文语种】中文【中图分类】S682.310.4+3蝴蝶兰(Phalaenopsis ssp.),兰科蝴蝶兰属植物,原产于中国台湾、菲律宾、印尼、泰国、马来西亚等地[1]。
其株型美观,花型奇特似蝶,花色鲜艳,花期持久,在热带兰中有“兰花皇后”之美誉,有较高的观赏和经济价值,深受国内外花卉市场的欢迎。
由于其典型的单茎性气特性,既无匍匐茎,也无假球茎,极少发育侧枝,故不易进行分株繁殖,又其形成种子少且该种子无胚乳,种子繁殖非常困难,为满足蝴蝶兰与日俱增的市场需求量,组织培养作为蝴蝶兰高效繁殖的重要手段越来越受到重视[2]。
光谱对植物的生长发育、形态建成、光合作用、物质代谢以及基因表达均有调控作用[3],通过光质调节和控制植株形态建成和生长发育,可使植株在一定程度上满足人们生产需要。
2010年版新增的''氨基酸检测方法"如下:新增附录附录XX 氨基酸分析法氨基酸分析法是指用于测定蛋白质、肽及其他药物制剂的氨基酸组成或含量的方法。
根据氨基酸组成分析可以对蛋白质及肽进行鉴别,氨基酸分析法可用于确定蛋白质、肽及氨基酸的含:及测定可能存在于蛋白质及肽中的非典型氨基酸。
进行氨基酸分析前,必须将蛋白质及肽水解成单个氨基酸,具体水解方法由各品种项下规定。
蛋白质及肽水解后,其氨基酸分析过程与用于其他药物制剂中游离氨基酸的分析过程相同。
本法包括四种柱前衍生法,分別为异硫氛酸苯酯(PITC)法、6-氨基唾咻一N—疑基琥珀酰亚氨基氨基甲酸酯(AQC)法、邻苯二醛(OPA)和9-茹甲基氯甲酸甲酯(FMOC)法、2, 4- 二硝基氟苯(DNFB)法,以及一种苗三酗柱后衍生法。
不同的品种应针对自身所含的氨基酸种类及各氨基酸的含量选择适宜的氨基酸分析方法并做相应的方法学验证。
由于本法衍生过程中衍生溶液量较少,且容易挥发,外标法极易出现较大的误差,建议采用内标法进行测定,内标的确定由各品种项下规定。
在本法中,由于半胱氨酸或胱氨酸的衍生产物不稳定,因此对于含半胱氨酸或胱氨酸的样品衍生后应尽快测定,或者在衍生前对半胱氨酸或胱氨酸进行适当的处理,使其转化为稳定地产物(如磺基丙氨酸或半胱氨酸-硫代丙酸)后再衍生测定, 具体方法由各品种项下规定。
在测定过程中,可根据所用的仪器、色谱柱品牌、色谱柱的长度及要分离的氨基酸种类,对流动相的有机溶剂和洗脱梯度作适当调整以获得较好的分离度。
第一法PITC柱前衍生氨基酸分析法本法系根据氨基酸与异硫亂酸苯酯(PITC)反应,生成有紫外响应的氨基酸衍生物苯氨基硫甲酰氨基酸(PTC-氨基酸),PTC-氨基酸经反相髙效液相色谱分离后用紫外检测,在一定的范币内其吸光值与氨基酸浓度成正比。
本方法的线性浓度范围为0.025〜1.25pmol/ml。
试剂(1)流动相A 0.1mol/L醋酸钠溶液(取无水醋酸钠8.2g,加水900ml溶解,用冰醋酸调pH至6.5,然后加水至1000 ml)-乙睛(93:7)。
五种绿茶中游离氨基酸的测定和分析刘凯;雷学昌;赖飞;王震;张宝林【摘要】通过对石阡苔茶、都匀毛尖、凤冈锌硒茶、安顺瀑布毛峰、湄潭翠芽五种贵州名优绿茶,相同方法处理过后茶汤中游离氨基酸通过全自动氨基酸分析仪进行测定和分析,发现不同绿茶中游离氨基酸种类均较丰富,游离氨基酸和茶氨酸含量因不同品种而不同。
五种茶叶中仅有湄潭翠芽的茶氨酸含量占氨基酸总量为54.12%。
通过对这几种贵州地区名优绿茶的氨基酸进行分析,获得大量的氨基酸基础数据,为贵州绿茶的品质研究提供一定的参考。
【期刊名称】《农技服务》【年(卷),期】2015(000)008【总页数】2页(P81-81,80)【关键词】贵州绿茶;游离氨基酸;茶氨酸;分析【作者】刘凯;雷学昌;赖飞;王震;张宝林【作者单位】贵州省农产品质量安全监督检验测试中心,贵州贵阳 550004;贵州省农产品质量安全监督检验测试中心,贵州贵阳 550004;贵州省农产品质量安全监督检验测试中心,贵州贵阳550004;贵州省农产品质量安全监督检验测试中心,贵州贵阳 550004;贵州省农产品质量安全监督检验测试中心,贵州贵阳 550004【正文语种】中文茶叶是贵州重要的经济作物,茶叶种植在贵州发展迅猛,到2013年贵州全省茶叶面积40.7万公倾,其中绿茶面积已居于全国第一位,2014年贵州省人民政府办公厅发布关于《贵州省茶产业提升三年行动计划(2014-2016)》的通知(黔府办发【2014】19号),本文积极响应文件精神,对贵州绿茶品质提供基础性研究资料。
茶叶中的茶氨酸(Theanine,N-乙基-γ-L-谷氨酰胺)是从绿茶中分离出的一种茶树特征性游离氨基酸,是绿茶中有效的呈味物质,是茶树中具有重要生理活性的次生代谢产物[1-3]。
具有焦糖的香味和类似味精的鲜爽味,对绿茶滋味具有重要作用[1]。
茶基酸的含量直接决定茶叶的品质。
无论何等茶叶,茶氨酸都占茶叶游离氨基酸的50%以上,茶氨酸在干茶叶中含量大约为1%-2%[1-3]。