30
循环型蒸发器
列文式蒸发器
加热室上增设沸腾室, 溶液的沸腾传热有加热 室转移到沸腾室.
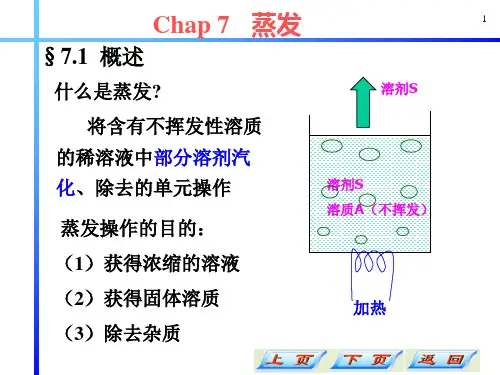
过 程 原
优点:避免加热管表面 结晶和结垢,适于粘度
理 大的溶液,传热系数大
与 装
缺点:液柱静压头引起
备 的温差损失大。
31
单程型蒸发器
升
膜
式
蒸
过 程 原
发 器
理
与
装
备
降 膜 式 蒸 发 器
33
单程型蒸发器
E1 E2
W1
W2
则 W1=D W2=W1-E1=D-E1
D t1
t2
过 程
W3=W2-E2=D-E1-E2
原 水蒸发总量:W= W1 + W2 + W3=3D-2E1-E2
理 与
D W 2 E1 1 E2
装
33 3
备 推广至n效: D W n 1 E1 n 2 E2 1 En 1
5
单效蒸发 物料衡算
水分蒸发量W
总物料衡算: F = L +W
过 溶质不变: F x0 Lx F W x
程
原 理
水分蒸发量:
W
F
1
x0 x
与
装 备
完成液浓度:
x F x0 F W
F x0 t0 h0 c0
D, Ts , Hs
W, T, H
蒸发室
加 热 L , x, 室 t , c, h
D, Ts, hs
装
备
35
单程型蒸发器 刮板式冷凝器
过 程 原 理 与 装 备
36
浸没燃烧式蒸发器
过 程 原 理 与 装 备
37
除沫器、冷凝器和真空装置 除沫器