有机物的空间结构
- 格式:doc
- 大小:62.50 KB
- 文档页数:4

高考化学专题复习----有机物结构的分析与判断金点子:有机结构的分析包括:空间结构的分析;结构简式的分析。
(1)空间结构的分析此类试题主要考查考生对原子共平面或共直线的分析与判断。
所采用的方法主要是迁移类比法,也即将甲烷、乙烯、乙炔、苯等有机物的结构迁移到新的物质中。
(2) 结构简式的分析。
主要为判断及书写结构简式。
要求考生能将题中碳链或官能团通过互换位置来确定新的结构,有时还会涉及到利用官能团所发生的化学反应来确定结构的问题。
经典题:例题1 :1,2,3-三苯基环丙烷的三个苯基可以分布在环丙烷环平面的上下,因此有如下两个异构体:据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是()A.4 B.5 C.6 D.7方法:空间结构比较分析。
捷径:根据题意:五个氯原子在环戊烷平面上可分成五上(或五下),四上一下(或四下一上),三上二下(或三下二上)三种情况。
其中前两种情况,分别只有一种结构,而三上二下有两种同分异构体。
所以共有四种同分异构体。
显然答案为A。
总结:在解题时要充分考虑到三上二下有两种同分异构体,必要时可画出草图分析。
例题2 :描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是( )A.6个碳原子有可能都在一条直线上B.6个碳原子不可能都在一条直线上C.6个碳原子有可能都在同一平面上D.6个碳原子不可能都在同一平面上方法:将甲烷、乙烯、乙炔的结构迁移到题示物质,画出结构图示进行分析即可。
捷径:已知乙烯结构中两个碳原子和四个氢原子在同一平面上,不在同一直线上。
若将—CH3代替乙烯中的某个氢原子,则这三个碳原子必然不在同一直线上。
所以A必错,B 正确。
若上述替换后,其键角仍能保持120°,则CH3—CH=CH—C≡C—CF3中四个碳原子在同一平面内(根据乙烯的结构作出的判断)。
同理根据乙炔中两个碳原子与两个氢原子在同一直线上,可认为CH3—CH=CH—C≡C—CF3中四个碳原子在同一直线上。


有机物结构的表示方法1、结构简式书写:不能用碳干结构表示,碳原子连接的氢原子个数要正确,官能团不能略写,要注意官能团中各原子的结合顺序不能随意颠倒。
2、键线式:将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个碳原子,称为键线式。
每个交点、端点代表一个碳原子,每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数既是氢原子个数。
注意事项: (1)一般表示3个以上碳原子的有机物;(2)只忽略C-H键,其余的化学键不能忽略;(3)必须表示出C=C、C≡C键等官能团;(4)碳氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中氢原子)。
(5)计算分子式时不能忘记顶端的碳原子。
3、碳原子的成键方式与分子空间构型的关系(1)当一个碳原子与其它4个原子连接时,这个碳原子将采取sp3杂化取向与之成键;当碳原子之间或碳原子与其它原子之间形成双键时,形成该双键的原子以及与之直接相连的原子处于同一平面上;当碳原子之间或碳原子与其它原子之间形成叁键时,形成该叁键的原子以及与之直接相连的原子处于同一平面上。
(2)有机物的代表物基本空间结构:甲烷是正四面体结构(5个原子不在一个平面上);乙烯是平面结构(6个原子位于一个平面);乙炔是直线型结构(4个原子位于一条直线);苯环是平面结构(12个原子位于一个平面)。
(3)杂化轨道理论:C原子的sp、sp2、sp3杂化4、有机分子空间构型解题规律规律Ⅰ:以碳原子和化学键为立足点,若氢原子被其它原子所代替,其键角基本不变。
规律Ⅱ:若两个平面型结构的基团之间以单键相连,这个单键可以旋转,则两个平面可能共面,但不是“一定”。
规律Ⅲ:若两个苯环共边,则两个苯环一定共面。
规律Ⅳ:若甲基与一个平面型结构相连,则甲基上的氢原子最多有一个氢原子与其共面。
若一个碳原子以四个单键与其它原子直接相连,则这四个原子为四面体结构,不可能共面。
同时,苯环对位上的2个碳原子及其与之相连的两个氢原子,这四原子共直线。

有机物的空间结构有机分子中最为常见的元素是碳(C)和氢(H),也会包含其他元素如氧(O)、氮(N)、硫(S)等。
当有机分子由多个原子组成时,原子之间的排列方式会影响分子的立体构型。
有机分子的立体构型包括平面构型和立体构型。
平面构型是指有机分子中原子的排列方式使得整个分子处于一个平面上,最常见的例子是乙烯分子(C2H4)。
乙烯分子由两个碳原子和四个氢原子组成,两个碳原子位于同一平面上,而氢原子则位于平面的上下两侧。
立体构型是指有机分子中原子的排列方式不再处于同一平面上,而是存在三维空间的立体结构。
立体构型包括手性和立体异构体两种类型。
手性是指有机分子的镜像异构体不能完全重合,具有非重合的镜像关系。
手性分子有两个互为镜像异构体的立体异构体,一个为左旋体(L-),一个为右旋体(D-)。
手性分子中最经典的例子是葡萄糖(C6H12O6),它具有四个不同的取代基围绕着一个手性碳原子排列而成,形成两个非重合的镜像异构体(D-和L-葡萄糖)。
立体异构体是指有机分子的空间构型上存在不同的排列方式,具有相同的化学组成和分子式,但性质和活性可能不同。
立体异构体主要包括构象异构体和对映异构体。
构象异构体是指有机分子在空间中的自由旋转下能够存在不同的构象,但化学键的切换和断裂不发生。
构象异构体主要发生在双键、环状化合物和季节性桥键上。
例如,正戊烷(C5H12)和异戊烷(C5H12)就是构象异构体,它们由相同的原子组成,但由于碳原子的旋转,整个分子的构象也发生了变化。
对映异构体是指有机分子的镜像异构体无法通过旋转、振动等方式完全重合。
对映异构体的存在是由于分子中含有手性碳原子,导致分子的镜像关系不存在旋转对称性。
对映异构体的存在对于化学活性和生物活性有着重要的影响。
例如,草酸(C2H2O4)就存在对映异构体,它的两个羧酸基围绕着手性碳原子排列而成,形成D-草酸和L-草酸两个不重合的对映异构体。
总之,有机物的空间结构是有机化学的重要内容之一,它影响着有机分子的性质、活性和反应。

有机物结构的表示方法1、结构简式书写:不能用碳干结构表示,碳原子连接的氢原子个数要正确,官能团不能略写,要注意官能团中各原子的结合顺序不能随意颠倒。
2、键线式:将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个碳原子,称为键线式。
每个交点、端点代表一个碳原子,每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数既是氢原子个数。
注意事项: (1)一般表示3个以上碳原子的有机物;(2)只忽略C-H键,其余的化学键不能忽略;(3)必须表示出C=C、C≡C键等官能团;(4)碳氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中氢原子)。
(5)计算分子式时不能忘记顶端的碳原子。
3、碳原子的成键方式与分子空间构型的关系(1)当一个碳原子与其它4个原子连接时,这个碳原子将采取sp3杂化取向与之成键;当碳原子之间或碳原子与其它原子之间形成双键时,形成该双键的原子以及与之直接相连的原子处于同一平面上;当碳原子之间或碳原子与其它原子之间形成叁键时,形成该叁键的原子以及与之直接相连的原子处于同一平面上。
(2)有机物的代表物基本空间结构:甲烷是正四面体结构(5个原子不在一个平面上);乙烯是平面结构(6个原子位于一个平面);乙炔是直线型结构(4个原子位于一条直线);苯环是平面结构(12个原子位于一个平面)。
(3)杂化轨道理论:C原子的sp、sp2、sp3杂化4、有机分子空间构型解题规律规律Ⅰ:以碳原子和化学键为立足点,若氢原子被其它原子所代替,其键角基本不变。
规律Ⅱ:若两个平面型结构的基团之间以单键相连,这个单键可以旋转,则两个平面可能共面,但不是“一定”。
规律Ⅲ:若两个苯环共边,则两个苯环一定共面。
规律Ⅳ:若甲基与一个平面型结构相连,则甲基上的氢原子最多有一个氢原子与其共面。
若一个碳原子以四个单键与其它原子直接相连,则这四个原子为四面体结构,不可能共面。
同时,苯环对位上的2个碳原子及其与之相连的两个氢原子,这四原子共直线。
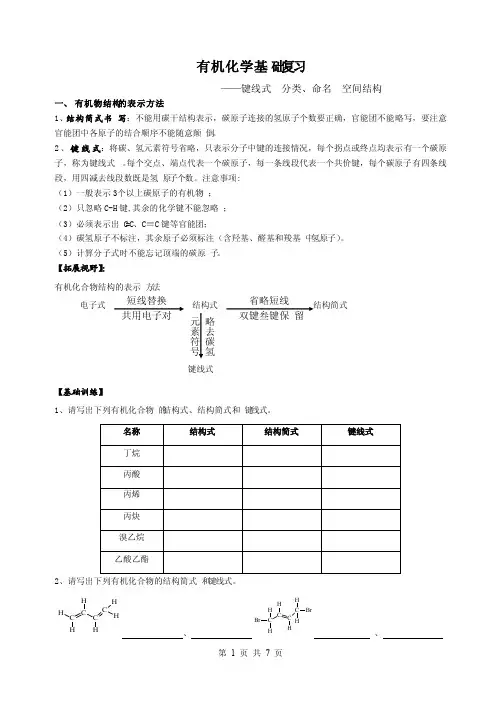
有机化学基础复习——键线式 分类、命名 空间结构一、 有机物结构的表示方法1、结构简式书写:不能用碳干结构表示,碳原子连接的氢原子个数要正确,官能团不能略写,要注意官能团中各原子的结合顺序不能随意颠倒。
2、键线式:将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个碳原子,称为键线式。
每个交点、端点代表一个碳原子,每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数既是氢原子个数。
注意事项: (1)一般表示3个以上碳原子的有机物; (2)只忽略C-H 键,其余的化学键不能忽略; (3)必须表示出C =C 、C ≡C 键等官能团;(4)碳氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中氢原子)。
(5)计算分子式时不能忘记顶端的碳原子。
【拓展视野】:有机化合物结构的表示方法电子式结构式 结构简式键线式【基础训练】1、请写出下列有机化合物的结构式、结构简式和键线式。
2、请写出下列有机化合物的结构简式和键线式。
C CC C HHHHH H、C C C CH BrH BrHHH H、略去碳氢元素符号短线替换 共用电子对省略短线 双键叁键保留CH 3CH 2CH 2CH3CH 3CHCH 2CH 3CH3CH 3CH CHCH3C C C C HH HH HH H H 、3、有机化合物的结构简式可进一步简化,如:请写出下列有机物分子的分子式:⑪ ; ⑫ ;⑬Cl;⑭ ;(5)OO; (6)OOH。
二、 有机物命名1、系统命名法命名含官能团的简单有机物的基本步骤是: (1) __________________。
A 、选择官能团中没有碳原子数,则母体的必须_________的碳链作主链。
B 、官能团中俼碳原子,则母体的必须尽可能多地 。


高一有机物空间结构知识点有机物是由碳元素构成的化合物,它们的空间结构对于物质的性质和反应起着重要的影响。
在高中化学学习的过程中,我们需要掌握有机物的空间结构知识点,以便更好地理解有机化合物的性质和反应规律。
一、有机物的空间构型有机物的空间构型指的是分子中原子之间的空间排列方式。
有机物的空间构型分为线性构型、平面构型和立体构型三种。
1. 线性构型:分子中的原子排列成一条直线,如H-C≡C-H。
2. 平面构型:分子中的原子排列在同一个平面上,如正丁烷(CH3-CH2-CH2-CH3)。
3. 立体构型:分子中的原子排列在三维空间中,形成立体构型,有平面构型以外的构型,如氯代乙烷(CH3-CHCl-CH3)中的氯原子可以在氢原子上或者在乙基基团的后面。
二、立体异构立体异构是指分子中的原子在空间中的排列方式不同,而化学式相同的现象。
立体异构分为构造异构和空间异构两种。
1. 构造异构:构造异构是指分子中原子的连接方式不同,可以分为链式异构、官能团异构和位置异构。
- 链式异构:分子链的长度或分支方式不同。
如正丁烷和异丁烷的立体异构。
- 官能团异构:分子中的官能团的种类和位置不同。
如丙酮和乙醛的立体异构。
- 位置异构:分子中某个官能团的位置不同。
如2-丁醇和2-甲基-1-丙醇的立体异构。
2. 空间异构:空间异构是指分子中原子在空间中的排列方式不同,可以分为手性异构和环状异构。
- 手性异构:分子镜像对称但不能完全重合的两种异构体,被称为手性异构体。
如L-丙氨酸和D-丙氨酸的立体异构。
- 环状异构:分子中存在环状结构,但其结构、位置等方面有区别。
如环己烷和苯的立体异构。
三、立体异构的影响立体异构对有机物的性质和反应有很大影响。
1. 物理性质:立体异构体之间的相互作用力不同,导致物理性质的差异。
2. 化学性质:立体异构可能导致反应速率和选择性的变化,例如对光的旋光性的变化。
3. 药理活性:不同立体异构体的药理活性可能不同。

化学有机结构知识点总结有机结构是有机化学的重要内容之一,它是有机化学家研究的重要对象。
有机结构的知识点包括有机化合物的命名规则、结构特点及其物理和化学性质等内容。
下面我们将对有机结构的相关知识点进行总结。
一、有机化合物的基本结构1、碳的四价碳是有机化合物的基础元素,在有机化合物中以sp3、sp2和sp杂化态存在。
sp3杂化的碳原子形成了四个单键,sp2杂化的碳原子形成了一个π键和三个σ键,sp杂化的碳原子形成了一个π键和两个σ键。
碳原子的四个官能团包括羟基、氨基、羰基和硫醇基。
2、键的构象有机化合物中有不同种类的键:单键、双键、三键。
单键是由两个原子共用一个电子对而形成的共价键;双键是由四个原子共用两对电子而形成的共价键;三键是由六个原子共用三对电子而形成的共价键。
3、立体化学有机化合物的立体化学是研究有机化合物空间结构和其影响性质的一门学科。
有机化合物的空间结构包括构象异构和立体异构。
构象异构是指同分子式、相同官能团的有机化合物,由于键轴可转动的存在,存在构象不同而其他性质相同的异构体。
立体异构是指分子中存在手性中心,其镜像体是不重合的异构体。
二、有机物的命名有机化合物的命名规则是化学家对有机化合物进行命名的规范,其目的是为了便于沟通和资料查阅。
有机物的命名分为通用命名法和系统命名法。
通用命名法是由化合物的来源、性质等因素构成的名称。
系统命名法则是由化合物的结构构成的名称。
常用的有机物命名规则包括:基本碳环、侧链、双键位置、取代基位置等。
三、结构与性质1、取代基的位置和性质取代基的位置对有机物的物理性质和化学性质有着很大的影响。
取代基可以影响有机物的溶解度、熔点、沸点、密度等物理性质,也可以影响有机物的化学反应。
取代基的位置常常决定了有机物的反应性。
2、官能团对有机物性质的影响有机化合物的官能团对有机化合物的性质有着重要的影响。
不同官能团所具有的化学性质不同,其化学反应也不同。
官能团的类型可以决定化合物的分类和一些化学性质。
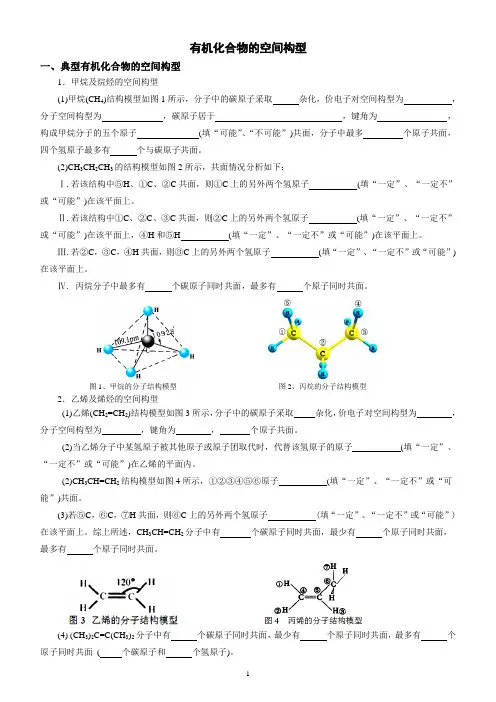
有机化合物的空间构型一、典型有机化合物的空间构型1.甲烷及烷烃的空间构型(1)甲烷(CH4)结构模型如图1所示,分子中的碳原子采取杂化,价电子对空间构型为,分子空间构型为,碳原子居于,键角为,构成甲烷分子的五个原子(填“可能”、“不可能”)共面,分子中最多个原子共面,四个氢原子最多有个与碳原子共面。
(2)CH3CH2CH3的结构模型如图2所示,共面情况分析如下:Ⅰ.若该结构中⑤H、①C、②C共面,则①C上的另外两个氢原子(填“一定”、“一定不”或“可能”)在该平面上。
Ⅱ.若该结构中①C、②C、③C共面,则②C上的另外两个氢原子(填“一定”、“一定不”或“可能”)在该平面上,④H和⑤H (填“一定”、“一定不”或“可能”)在该平面上。
Ⅲ.若②C,③C,④H共面,则③C上的另外两个氢原子(填“一定”、“一定不”或“可能”)在该平面上。
Ⅳ.丙烷分子中最多有个碳原子同时共面,最多有个原子同时共面。
图1、甲烷的分子结构模型图2、丙烷的分子结构模型2.乙烯及烯烃的空间构型(1)乙烯(CH2=CH2)结构模型如图3所示,分子中的碳原子采取杂化,价电子对空间构型为,分子空间构型为,键角为,个原子共面。
(2)当乙烯分子中某氢原子被其他原子或原子团取代时,代替该氢原子的原子(填“一定”、“一定不”或“可能”)在乙烯的平面内。
(2)CH3CH=CH2结构模型如图4所示,①②③④⑤⑥原子(填“一定”、“一定不”或“可能”)共面。
(3)若⑤C,⑥C,⑦H共面,则⑥C上的另外两个氢原子 (填“一定”、“一定不”或“可能”)在该平面上。
综上所述,CH3CH=CH2分子中有个碳原子同时共面,最少有个原子同时共面,最多有个原子同时共面。
(4) (CH3)2C=C(CH3)2分子中有个碳原子同时共面,最少有个原子同时共面,最多有个原子同时共面( 个碳原子和个氢原子)。
3.乙炔及炔烃的空间构型(1)乙炔(CH≡CH)结构模型如图5所示,分子中的碳原子采取杂化,价电子对空间构型为,分子空间构型为,键角为,个原子共直线,个原子共面。

一. 四种基本构型及简单变换:甲烷、乙烯、乙炔、苯1.甲烷的正四面体结构:在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三原子共面(称为三角形规则)。
当甲烷分子中某氢原子被其他原子或原子团取代时,,可将它看作是原来氢原子位置。
CH 3CH 3左侧甲基和②C 构成“甲烷”分子,此分子中④H 、①C 、②C 构成三角形,同理①C 、②C 、③H 也构成了三角形,即乙烷分子中最多有2个碳原子(①C 、②C )和2个氢原子(③H 、④H )4个原子共面。
CH 3CH 2CH 3其结构式可写成如图2所示。
左侧甲基和②C 构成“甲烷分子”。
此分子中⑤H ,①C ,②C 构成三角形。
中间亚甲基和①C ,③C 构成“甲烷”分子。
此分子中①C ,②C ,③C 构成三角形,同理②C ,③C ,④H 构成三角形,即丙烷分子中最多三个碳原子(①C ,②C ,③C )两个氢原子(④H ,⑤H)五原子可能共面。
2.乙稀的平面结构:乙烯分子中的所有原子都在同一平面内,键角为120°。
当乙烯分子中某氢原子被其他原子或原子团取代时,则代替氢原子的原子一定在乙烯的平面内。
其结构式可写成如图4所示。
三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子一定共面。
根据三角形规则[⑤C ,⑥C ,⑦H构成三角形]。
⑦H 也可能在这个平面上。
最多7原子共面。
同理可推出CH 3CH=CHCH 3至少6个原子,至多8个原子共面。
(CH 3)2C=C(CH 3)2至少6个原子(6个碳原子),至多10个原子共面(6个碳原子和4个氢原子),每个甲基可提供一个氢原子在乙烯平面.3.苯的平面结构苯分子所有原子在同一平面内, 键角为120°。
当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯分子所在平面内。
甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的一个碳原子),5个氢原子(苯环上的5个氢原子)这12个原子一定共面。
有机化学空间结构及同分异构体有机化学空间结构及同分异体⼀、基础诊断⼀、写出下列反应的化学⽅程式:1)丙烯通⼊溴⽔中;2)1—丁烯与HCl⽓体进⾏加成;3)2—丁烯发⽣加聚反应;4)⼄烯与丙烯发⽣加聚反应。
5) ⼄炔的实验室制法;6) ⼄炔使溴⽔褪⾊;7) 苯的溴代反应。
⼆、⼄烯、⼄炔、丁⼆烯、甲苯和苯⼄烯五种物质在⼀定条件下与氢⽓充分反应。
(1)若烃与氢⽓反应的物质的量之⽐为1∶3,说明该烃分⼦结构存在,它是。
(2)若烃与氢⽓反应的物质的量之⽐为1∶2,说明该烃分⼦结构存在,它是。
(3)苯⼄烯与H2完全加成的物质的量之⽐是________。
三、有下列各组物质:A.O2和O3,B.126C和136C,C.CH3—CH2—CH2—CH3和E.甲烷和庚烷(1)________组两物质互为同位素;(2)________组两物质互为同素异形体;(3)________组两物质互为同系物;(4)________组两物质互为同分异构体;(5)________组中的物质是同⼀物质四、由⼄烯推测丙烯的结构或性质正确的是()A.分⼦中三个碳原⼦在同⼀条直线上B.分⼦中所有原⼦都在同⼀平⾯上C.与HCl加成只⽣成⼀种产物D.能发⽣加聚反应五、描述CH2-CH=CH-C≡C-CF3分⼦结构的下列叙述中,正确的是()A.6个碳原⼦有可能都在⼀条直线上B.6个碳原⼦不可能都在⼀条直线上C.6个碳原⼦有可能在同⼀平⾯上D.6个碳原⼦不可能都在同⼀平⾯上六、书写已烷的同分异构体并⽤系统命名法加以命名七、书写C8H10属于芳⾹烃的同分异构体并命名。
⼋、含有⼀个叁键的炔烃,氢化后的结构式为:此炔烃可能有的结构简式有A.1种B.2 种C.3种D.4种九、下列烃的⼀氯代物同分异构体数⽬相同的是①甲基环已烷②三连苯③蒽④2,2-⼆甲基丁烷⑤菲A.①②B.③④C.①⑤D.②③⼆、⾃我整理⼀、同系物结构相似,在分⼦组成上相差⼀个或若⼲个CH 2原⼦团的物质物质。
新课标:《新课标》高三化学(人教版)--第二轮复习专题讲座第四讲有机化合物空间结构、认识有机分子中基团之间存在相互影响。
2、了解有机化合物存在同分异构现象,能判断简单有机物的同分异构体(不包括手性异构体)。
3、培养学生的空间想象能力。
一、“基”的空间结构“基”的空间结构是构成有机化合物空间结构的基本要素,不同的“基”相互连接形成了空间各异的有机物。
掌握这些“基”的结构,对了解有机化合物空间结构,培养学生空间想象能力具有指导意义。
常见部分“基”的空间结构如下:H為g- Qr八H阳勺例1、描述■:分子结构的下列叙述中,正确的是A. 6个碳原子有可能都在一条直线上B. 6个碳原子不可能都在同一条直线上C. 6个碳原子有可能都在同一平面上D. 6个碳原子不可能都在同一平面上解析:根据/fx -cm:-H H H的空间结构可确定该分子结构为:可知6个碳原子并非均在同一直线上。
B正确。
但该物质不是所有原子都在同一平面上(-CH3中的3个氢原子,-CF3中的3个氟原子),但6个碳原子都在同一平面上。
C正确。
例2、某期刊封面上有如下一分子的球棍模型图,图中“棍”代表单键或双键或三键。
不同颜色的球代表不同元素的原子,该模型图可代表一种A.卤代羧酸 B •酯C •氨基酸 D •醇钠解析:由“基”的空间结构,可分析出蓝球为氮原子,绿球为碳原子,红球为氧原子,白球为氢原子,其结构简式。
选Co“基”的异构体丙基有2种、丁基有4种同分异构体,一C00若写为一OOCI则成为甲酸酯。
掌握“基”的异构体可使我们快速确定有机物的同分异构体数目,并能准确写出异构体。
例3、化学式是C4H10O的醇可被氧化成醛的有A、二种B、三种C、四种D、五种解析:醇可被氧化成醛,其羟基位置必须在端C上,这是由于-CHO的结构决定的。
化学式为C4H10O的醇的同分异构体取决于丁基异构体,丁基异构体由四种,相应的醇为:CH3 CH3CH2CH2CH2-OH CH3CH2CHCH3 CH3CHCH^H CH3 - C -0H OH CHjCH3其中羟基在端C 上的只有①、③两种,而②只能被氧化成酮,④不能被氧化。
新课标:《新课标》高三化学(人教版)--第二轮复习专题讲座第四讲有机化合物空间结构2、了解有机化合物存在同分异构现象,能判断简单有机物的同分异构体(不包括手性异构体)。
3、培养学生的空间想象能力。
一、“基”的空间结构“基”的空间结构是构成有机化合物空间结构的基本要素,不同的“基”相互连接形成了空间各异的有机物。
掌握这些“基”的结构,对了解有机化合物空间结构,培养学生空间想象能力具有指导意义。
常见部分“基”的空间结构如下:例1、描述分子结构的下列叙述中,正确的是A.6个碳原子有可能都在一条直线上B.6个碳原子不可能都在同一条直线上C.6个碳原子有可能都在同一平面上D.6个碳原子不可能都在同一平面上解析:根据的空间结构可确定该分子结构为:可知6个碳原子并非均在同一直线上。
B正确。
但该物质不是所有原子都在同一平面上(-CH3中的3个氢原子,-CF3中的3个氟原子),但6个碳原子都在同一平面上。
C正确。
例2、某期刊封面上有如下一分子的球棍模型图,图中“棍”代表单键或双键或三键。
不同颜色的球代表不同元素的原子,该模型图可代表一种A.卤代羧酸 B.酯 C.氨基酸 D.醇钠解析:由“基”的空间结构,可分析出蓝球为氮原子,绿球为碳原子,红球为氧原子,白球为氢原子,其结构简式:。
选C。
二、“基”的异构体丙基有2种、丁基有4种同分异构体,-COOH若写为-OOCH则成为甲酸酯。
掌握“基”的异构体可使我们快速确定有机物的同分异构体数目,并能准确写出异构体。
例3、化学式是C4H10O的醇可被氧化成醛的有A 、二种B 、三种C 、四种D 、五种解析:醇可被氧化成醛,其羟基位置必须在端C 上,这是由于-CHO 的结构决定的。
化学式为C4H10O 的醇的同分异构体取决于丁基异构体,丁基异构体由四种,相应的醇为:其中羟基在端C上的只有①、③两种,而②只能被氧化成酮,④不能被氧化。
答案为A。
例4、苯酚环上含有—C4H9基团的同分异构体有A、12种B、9种C、4种D、3种解析:因丁基由四种异构,每一种异构与酚羟基都有间、邻、对三种异构体,所以共4×3=12种。
有机物的空间结构1.判断有机化合物中原子共线与共面的基本类型(1)熟练掌握四种典型结构①甲烷型:四面体结构,碳原子与四个原子形成四个共价键时,空间结构都是四面体结构,五个原子中最多有三个原子共平面。
②乙烯型:平面结构,位于乙烯型结构上的六个原子一定共平面。
③乙炔型:直线形结构,位于乙炔型结构上的四个原子一定在一条直线上,也一定共平面。
④苯型:平面六边形结构,位于苯环上的十二个原子一定共平面,并且处于对角线的四个原子共线。
(2)注意键的旋转①在分子中,形成单键的原子可以绕键轴旋转,而形成双键、三键等其他键的原子不能绕轴旋转。
②若平面间靠单键相连,所连平面可以绕轴旋转,可能旋转到同一平面上,也可能旋转后不在同一平面上。
③若平面间被多个点固定,则不能旋转,一定共面。
如分子中所有环一定共面。
(3)恰当地拆分复杂分子观察复杂分子的结构,先找出类似于甲烷、乙烯、乙炔和苯分子的结构,再将对应的立体构型及键的旋转等知识进行迁移即可解决有关原子共面、共线的问题。
特别要注意的是,苯分子中处于对位的两个碳原子以及它们所连的两个氢原子,这四个原子是在一条直线上的。
[应用举例]有机物分子中最多有________个碳原子在同一平面内,最多有________个原子在同一条直线上,与苯环共面的碳原子至少有________个。
答案1169解析以碳碳双键为中心,根据乙烯、苯、乙炔、甲烷的结构,可以画出如图所示结构。
由于碳碳单键可以绕轴自由旋转,炔直线一定在苯平面内,苯平面和烯平面可能共面,也可能不共面。
因而该有机物分中的所有碳原子均可能共面,最多有5+6=11个碳原子共面,至少有6+2+1=9个碳原子在苯平面内。
由于苯分子、乙烯分子的键角均为120°,炔直线所在苯环正六边形对角线上的碳原子共线,因而5个碳原子和炔基上的1个氢原子共线,即5+1=6。
2.同分异构现象、同分异构体(1)概念分子式相同、结构不同的现象称为同分异构现象。
1.烷、烷基
2.烯
3.醛、酮、羧酸
4.苯、苯的同系物,稠环芳烃
苯是一种平面型分子,当苯环上的H被其它某个原子取代后仍为平面型;当取代基为非平面型,整个分子也就变为非平面型.
5.炔
因为C
2H
2
为一种直线型分子:H-C ≡ C-H. 所以它的卤代物C
2
HX、C
2
X
2
均为
直线型分子:H-C ≡ C-X、X-C ≡ C-X. 丙炔CH
3
-C ≡ C-H分子中3个C
和乙炔基中H共直线整个分子非直线也非平面型(含-CH
3
)
①两个平面型的有机“片断”组合成的分子一定为平面型吗? 如
(不一定)
②平面型“片断”和直线型“片断”组合成的分子一定为平面型吗?
例1 CH
3-CH=CH-C ≡ C-CF
3
分子中,位于同一条直线上最多碳数有_____个,
位于同一平面上的原子数最多可能是________个.
分析由于书写的方便和习惯,结构简式写成直链型.但并不反映原子的空间位置,故不能草率地根据书写的方式来判所有C共直线.
在上述分子内,有单键、双键和叁键.要联想甲烷分子的四面体结构、乙烯分子的平面结构、乙炔分子的直线结构、类此联想.可画出该分子的构型.
例2 下列关于HC≡C CH
2-CH=CHCH
3
的说法正确的是 ( )
A.所有C原子可能共平面
B.除苯环外的C原子共直线
C.最多只有4个C共平面
D.最多只有3个C共直线解析为方便说明,对分子中大部分C编号
联想乙炔和苯的结构,1C、2C、3C、4C、5C共直线,而5C与其它4个原子成键,具有四面体构型,故4C、5C、6C不共直线.6C、7C、8C也不共直线.故最多应有5个C原子共直线.B、D错误.
4C、5C、6C共平面,故平面Ⅰ、Ⅱ又可能共面,所有C可共面. A正确,C 错误.
本题正确答案: A
例3 化合物
中的碳原子不可能都在同一平面上,但有一个平面能包含的碳原子最多,请指出这个平面上的碳原子编号.。