《仪器分析》教案讲义-05.doc
- 格式:doc
- 大小:289.00 KB
- 文档页数:24

《仪器分析》教案绪论本章是《仪器分析》课程的介绍;主要是让同学明白《化学分析》与《仪器分析》的联系与区分,仪器分析方法的分类和它的进展情形,介绍仪器定量分析方法的评判指标;重点在于对分析方法进行评判的几项指标;学时方案为 1 学时;内容提要:仪器分析与化学分析的区分与联系,仪器分析方法的分类及进展趋势;重点难点:仪器分析方法的分类授课方式:讲授一,仪器分析和化学分析⒈化学分析定义⒉仪器分析定义⒊两者的区分在于:①检测才能②样品的需求量③分析效率④使用的广泛性⑤精确度二,仪器分析方法的分类依据测量原理和信号特点,仪器分析方法大致分为四大类⒈光学分析法以电磁辐射为测量信号的分析方法,包括光谱法和非光谱法光谱法:依据物质对电非光谱法:电磁波作用磁辐射的吸取,发射或物质之后,引起反射,拉曼散射折射,衍射等基本性质的变化⒉电化学分析法依据物质在溶液中的电化学性质而建立的分析方法⒊色谱法以物质在两相间(流淌相和固定相)中安排比的差异而进行分别和分析;⒋其它仪器分析方法包括质谱法,热分析法,放射分析等;三,仪器分析的进展概述进展趋势⒈运算机技术在仪器分析中的广泛应用,实现了仪器操作和数据处理自动化;⒉不同方法联用提高仪器分析的功能;⒊各学科的相互渗透第一章光学分析法基础本章是学习光学分析法之前应具备的基础学问;主要介绍光的波粒二象性,原子光谱和分子光谱基础学问;在介绍电磁辐射基础上重点讲解能级跃迁图;本章方案学时为1 学时;第一节电磁辐射的性质一,电磁辐射的性质电磁辐射具有波动性和粒子性;⒈波动性电磁辐射是在空间传播着的交变电磁场,可以用频率参数表征;把握频,波长,波数的定义及之间( υ) ,波长( λ) 和波数( δ) 等波的关系;⒉微粒性h c普朗克方程 E (1 -1)h该方程将电磁辐射的波动性和微粒性联系起来,二,电磁波谱依据波长的大小次序排列可得到电磁波谱,不同的波长属不同的波谱区,对应有不同的光子能量和不同的能级跃迁;能用于光学分析的是中能辐射区,包括紫外,可见光区和红外区;第四节原子光谱和分子光谱内容提要:原子光谱项,原子光谱能收图及原子光谱挑选定就,分子光谱能收分子吸取光谱和分子发光光谱重点,难点:原子光谱项,分子光谱能及跃迁图授课方式:讲授一,原子光谱原子光谱产生于原子外层电子能级的跃迁⒈核外电子的运动状态原子接到电子的运动状态可以用主量数n,角量子数l来描述;2,磁量子数m和自旋量子数s⒉光谱项原子的能量状态需要用 四个量子数为参数的光谱项来表征;N 为主量子数, L -总轨道角量子数, S -总自旋量子数, J -内量子数 原子能级光谱项用 n 2s 1L 表示光谱支项用 L J 表示2s 1 n ⒊原子能级图把原子可能存在的光谱项及能级跃迁用图解的方式表示出来就得到原子能级图; 谱线波长取决于两能级的能量差,不同能级之间跃迁产生的原子光谱是波长确定,相互分隔的谱线,所以原子光谱是线状光谱;⒋光谱挑选定就只有符合光谱挑选定就的跃迁才是答应的:⒌原子光谱 1, s 0 , J 0 , L 1⑴原子发射光谱: 处于激发态原子不稳固, 当返回基态或较低能态时而发射出特点谱线; ⑵原子吸取光谱:当光辐射通过基态原子蒸气时,原子蒸气挑选性地吸取肯定频率的光 辐射,原子基态跃迁到较高能态;⑶原子荧光光谱:气态原子吸取光辐射后,由基态跃迁到激发态,再通过辐射跃回到基 态或较低的能态产生的二次光辐射;三,分子光谱⒈分子光谱分子光谱产生于分子能级的跃迁,分子能级中的电子能级,分子的振动能级以及转动能级;⒉分子吸取光谱和分子发光光谱;⑴分子吸取光谱:分子对辐射的挑选性吸取由基态或较低能级跃迁到较高能级产生的分 子光谱;如紫外——可见吸取光谱,红外吸取光谱;⑵分子发光光谱 光致发光:荧光,磷光 电致发光化学发光⑶拉曼光谱:入射光子与溶液中试样分子间的非弹性碰撞,发生能量交换,产生与入射 光频率不同的散射光;其次章 原子发射光谱分析法本章位置: 原子发射光谱分析法在发觉新元素和推动原子结构理论的建立方面曾做出过重要奉献,在各种无机材料的定性, 半定量及定量分析方面也曾发挥过重要作用;近 20 年来,由于新型光源,色散仪和检测技术的飞速进展,原子发射光谱分析法得到更广泛的应用;学习中应使同学们明白本章学问理论及应用在光分析法中的重要位置;本章内容: 本章主要叙述原子发射光谱法的基本原理,基本仪器以及光谱定性,半定量及定量分析的方法和应用;讲解思路: 第一介绍原子发射光谱的产生,元素的原子和离子所产生的原子线和离子线都是该元素的特点光谱;谱线的波长 λ 和强度 I 是本法对物质进行定性分析和定量分析的依据;之后具体介绍原子产生特点光谱的机理以及影响谱线强度的定义这是本章的重点内容; 介绍原子发射光谱仪器时第一介绍三部分框架,再介绍每部分的具体构成和重点元件,如 ICP 光源和光栅色散原理;最终介绍原子发射光谱的定性,半定量及定量分析方法,其中摄谱法中的乳剂特性曲线,及定量分析中的内标法原理是本章的重难点;6 学时;课时安排: 第一节 基本原理内容提要: 主要介绍原子发生光谱的产生,物质受到外界能量的作用,基态原子被激发到-8 激发态,激发态很不稳固,在 式释放产生原子发射光谱;10 时间内,返回到基态,所受能量以光辐射形hc hC E λ=λ——元素的特点波长 E ,E 1 分别为高能级和低能级 2 E 2 E 1能量谱线的强度 影响谱线强度的因素,从上式可知主要有谱线的波长和强度是两个重要的参数;4 种因素一一进行分析; 重点: 授课方式:讲授,挂图; 其次节 分析仪器内容提要: 原子发射光谱法所用仪器通常包括激发光源,分光系统,及检测系统三部分;激发光源主要有直流电弧,低压沟通电弧,高压电容火花及新型光源 ICP ;各种光源有其不同的性能(激发温度,蒸发温度,热性质,强度,稳固性等)可供各类试样挑选;相比之下, ICP 由于热稳固性好,基体效应小,检出限低,线性范畴宽而被公认为最具活力,前途宽阔的激发光源;分光系统中主要是分光元件,现代仪器多用光栅作分光元件,需介绍光栅分光原理,分光性能(色散率,辨论率)检测系统有摄谱法,光电直读法,分别介绍各自的原理和性能;重,难点:ICP 光源的结构,原理,分析性能是重点,平面反射闪烁光栅的分光原理及结论也较重要;摄谱法中的感光板的乳剂特性曲线及光电光谱法中电压与谱线强度的关系较难懂得,具体介绍;授课方式:讲授,挂图;第三节分析方法内容提要:在原子光谱分析中,依据谱线的波进步行定性分析,依据谱线的强度进行定量分析;主要介绍定性及半定量分析方法;第一介绍光谱定量分析的基本原理,导出定量分析基本关系式lgI=blgC+lgaI=aC,取对数这是光谱定量分析的基本公式;此种方法为肯定强度法,试验中不行能保证为一常数,所以一般分析时不用谱线的肯定强度而用相对强度;引出内标法定量分析原理;a被分析元素中选一分析基体元素中选一内标线线分析线对内标法:在同一试样中在测定分析线对的强度比R~lgC作校正曲线,所求的元素含量排除了试验条件的影响;内标法的使用必需留意分析线对的正确挑选;重难点:(1)内标法定量分析原理(2)摄谱法:分析线对的黑度差关系ΔS=rblgC+rlgAΔS 与试样中被测元素含量的对数值lgC 成线性(3)光电直读光谱法:测量分析线对积分电容器的充电电压就可直接求出被测元素含量;U1b lg C lg AlgU2授课方式:讲授,挂图第三章原子吸取与原子荧光光谱法本章位置:本章内容在仪器分析课程中是较为重要的一章内容,由于该分析方法具有灵敏度高,抗干扰才能强,精密度高,挑选性好,仪器简洁,操作便利等特点;自20 世纪 60 岁月以后,原子吸取光谱分析法得到快速进展,应用极为普及,所以有关本方法的理论课程也特别重要; 本章内容:主要介绍原子吸取光谱法的基本原理,基本仪器装置,定量分析方法,并简介原子荧光光谱法;讲解思路: 在本章之前已分别介绍了紫外-可见吸取光谱法,红外吸取光谱法,原子发 射光谱法等多种光谱法,所以需先将原子吸取光谱法与其它光谱法作大致比 较,找出相同点与不同点;再介绍原子吸取光谱法的特点; 原子吸取光谱的原理是本章的难点,里面涉及到一些较难的概念,如吸取线的 轮廓与变宽,积分吸取测量法,峰值吸取测量法等需重点讲解; 原子吸取光谱仪第一介绍框架图,再介绍各部分功能与原理,原子吸取光谱法 的干扰虽比发射光谱少但仍存在有时甚至较严峻,所以,需介绍干扰效应的类 型,本质及排除方法; 原子吸取光谱定量分析方法中,灵敏度和检测限两项评判指标是难点,应适当 举例介绍; 5 学时 学时安排:第一节 原子吸取光谱法的基本原理 内容提要:第一介绍原子吸取线的产生;当基态原子吸取了肯定辐射能后,基态原子被 激发跃迁到不同的较高能态,产生不同的原子吸取线;原子吸取光谱分析法是 基于元素的基态原子蒸气对同种元素的原子特点谱线的共振吸取作用来进行 定量分析的; 无论是原子发射线仍是原子吸取线都不是一条严格的几何线,谱线有肯定 的轮廓,在肯定条件影响下,谱线会变宽;介绍谱线变宽因素;吸取线变宽主 要受 Δλ D 和ΔλL 影响,锐线光源发射线变宽受 ΔλD 和自吸变宽的影响; 在分析中,谱线的变宽往往会导致原子吸取分析的灵敏度下降,所以要求掌握 外界条件影响;对发射线特殊要保证是锐线光源,以使吸取完全; E jNj No Pj Po 重,难点:(1)基态原子数与原子化温度听从波兹曼公式 关键在于 No 的产生KT e 2 e (2)积分吸取与 No 的关系 k v d v NofmC(3)峰值吸取与被测定元素含量的关系2bv Ko KNoK o k v d v I o K L 峰值测量可依据 v A = K I v I v e C LA lg I v授课方式:讲授,挂图其次节原子吸取光谱法的仪器装置内容提要:原子吸取光谱仪主要由锐线光源,原子化器,分光系统,检测系统和电源同步调制系统五部分组成;产生原理(1)光源——空心阴极灯产生锐线光源影响因素特点应介绍对每一部分的要特殊是火焰的组成和性求质火焰:喷雾器,雾化室,燃烧器,火焰(2)原子化器无火焰:石墨管,炉体原子化,除残;,电源;测定过程:干燥,灰化,辨论率光强度取决于(3)单色器狭缝宽度在AAS中以单色器的通带表示狭缝宽度;通带——光线通过出射狭缝的谱带宽度;(4)检测系统:包括光电倍增长,检波放大器,读数装置留意介绍:放大器采纳和空心阴极灯同频率的脉冲或方波调制光源,以避免火焰发射产生的直流信号对测定的干扰;光谱通带的概念和作用重点:授课方式:讲授,挂图第三节原子吸取光谱定量分析内容提要:重,难点:原子吸取光谱定量分析方法有标准曲线法和标准加入法;元素的特点浓度C c ,特点质量(m c)和检出限(D)是评判原子吸取光谱分析仪器和分析方法的重要指标;As 1C c ( g mL /1%)s v0.0044 (g / 1%)Am c3(s1 )g mLDAm 3(g)DA授课方式:讲授第四节原子荧光光谱法指导同学明白原子荧光光谱法的基本原理,仪器装置以及定量分析方法;第四章紫外,可见吸取与分子荧光光谱法紫外,可见吸取光谱法第一节概述内容提要:介绍紫外-可见吸取光谱法的基本概念;紫外-可见吸取光谱法是依据溶液中物质的分子对紫外和可见光谱区辐射能的吸取来讨论物质的组成和结构的方法;也称作紫外和可见吸取光度法,它包括比色分析和紫外-可见分光光度法;其次节有机物与无机物的紫外,可见吸取光谱内容提要:不同物质具有不同的分子结构,对不同波长的光会产生挑选性吸取,因而具有不同的吸取光谱;无机化合物和有机化合物吸取光谱的产生本质上是相同的,都是外层电子跃迁的结果,但二者在电子跃迁类型上有肯定区分;有机化合物吸取可见光或紫外光,σ,π和n 电子就跃迁到高能态,可能产生的跃迁有σ→σ* ,n→σ*,π→π* 和n→π* ;各种跃迁所需要的能量或吸取波长与有机化合物的基团,结构有亲密关系,依据此原理进行有机化合物的定性和结构分析;无机络合物吸取带主要是由电荷转移跃迁和配位场跃迁而产生的;电荷转移跃迁的摩尔吸取系数很大,依据朗伯-比尔定律,可以建立这些络合物的定量分析方法;重,难点:分子的电子能级和跃迁生色团的共轭作用d-d 配位场跃迁金属离子影响下的配位体π-π* 跃迁;授课方式:讲授,使用挂图;第三节紫外,可见吸取光谱法的应用内容提要:紫外-可见吸取光谱法用于有机化合物的定性,定量和结构分析;由于有机化合物的紫外-可见吸取光谱比较简洁,特点性不强,吸取强度不高,因此应用有肯定的局限性;但它能够帮忙推断未知物的结构骨架,协作红外光谱法,核磁共振波谱法和质谱法等进行定性和结构分析,它是一种有用的帮助手段;重点:化合物的鉴定,结构分析事例;有机化合物的鉴定,一般采纳光谱比较法;将未知纯化合物的吸取光谱特点,如吸取峰的数目,位置,相对强度以及吸取峰的外形与已知标准物的吸取光谱进行比较,以此推断未知化合物的骨架;但大多数有机化合物的紫外-可见光谱比较简洁,特点性不明显,而且很多生色团的吸取峰几乎不受分子中其它非吸取基团的影响,因此,仅利用紫外光谱数据来鉴别未知化合物有较大局限性;结构分析:紫外吸取光谱虽然不能对一种化合物作出精确鉴定,但对化合物中官能团和共轭体系的估量与确定却特别有效;难点:催化动力学光度法原理;所谓催化动力学分析法是指通过测量反应速率来进行定量分析的方法;很多化学反应在催化剂存在下,可以加快反应速率,而催化反应速率在肯定范畴内与催化剂浓度成比例关系,因此以光度法检测催化反应速率就可以实现对催化剂浓度的测定;但影响该法精确度的因素很多,操作严格,精确测定难度较大;授课方式:讲授,协作试验事例;第三节分子荧光光谱法内容提要:荧光产生原理,荧光效率及影响因素,荧光强度与溶液浓度的关系,荧光仪器及荧光的分析应用;重点,难点:荧光的产生气理授课方式:讲授一,概述依据物质的分子荧光光谱进行定性,以荧光强度进行定量公析;荧光分析法的最大优点是灵敏度高,挑选性也较好,应用范畴广;二,基本原理⒈分子荧光的产生 处于各激发态不同振动能级上分子,通过无辐射跃迁,释放一部分能量跃回到第一激 发态的最低振动能级上, 再以辐射跃迁形式回到基态的各振动能极上, 产生分子荧光;⒉荧光效率及其影响因素⑴荧光效率 荧光效率定义为发荧光的分子数目与激发态分子总的比值即发荧光的分子数激发态分子总数 荧光效率 ( (4 - 1)f ) = 如以各种跃迁的速率常数来表示,就K f(4 -2)f = K f K i K f 为荧光发射过程中的速率常数 非辐射跃迁的速率常数之和K i ⑵荧光与分子结构的关系 要具有能够吸取紫外——可见光的分子结构如共轮体系, 被激发而产生荧光; 分子的刚性平面结构有利于荧光的产生⑶环境因素对荧光的影响π电子的离域性越强, 越易 溶剂的极性增加对激发态产生更大的稳固作用,会使荧光强度增强温度也影响到荧光 强度对大多数荧光物质,温度上升,使非辐射跃迁几率增大,荧光效率降低;溶液的 pH 值影响到荧光物质的存在,也影响荧光效率;⒊荧光强度与溶液浓度的关系荧光强度 I ff I a ( I 0 I ) f I 0 I 由于 A = lg I = I 0 AA 2 3 ( )2. ( )3. A I (4 -3)I (1 I ) I f f 0 f 0 如溶液很稀A < , 就 I f f I 0 Af I 0 k b c 当条件肯定时 (4 - 5)I f KC 上式为荧光定量分析的基本关系式荧光猝天:荧光物质分子与溶剂分子或溶质分子之间所发生的导致荧光强度下降的物理或化学作用过程;三,荧光分析仪器 由光源,单色器,液池,检测器和记录系统五部分组成;⒈光源:一般由高压汞灯或氙弧灯供应;⒉单色器:起分光作用,一般为光栅;⒊检测器:采纳光电倍增管;四,荧光分析法的应用⒈无机化合物分析大多数无机化合物不产生荧光,只有与一些有机化合物形成有荧光的络合物才能对其进行测定;⒉有机化合物的分析结一些芳香族化合物基因,具有较强的荧光,可以直接进行分析测定,因此在生物化学,医药,环境,食品等领域有广泛的应用;第五章电分析化学导论本章是电分析化学的基础学问,主要介绍电分析化学的分类,化学电池,电极电位与液体接界电位,电极的种类名称,膜电极等有关电分析化学的基本概念和基础学问;本章的方案学时数为 2 学时;第一节电分析化学方法分类,特点极应用依据所量的电参量的不同,电分析化学方法可分为三类:第一类:在某些特定条件下,通过待试液的浓度与化学电池中某些电参量的关系进行定量分析,如电导,电位,库仑极谱及伏安分析其次类:通过某一电参量的变化来指示终点的电容量分析好电位滴定第三类:通过电极反应把被测物质,转变为金属或其它形式的搓化物,用重量法测定基会量;其次节电分析化学中某些基本术语与概念内容提要:原电池,电解池,电池的表示方法重点,难点:电池的表示方法授课方式:讲授一,原电池能自发的将本身的化学能变成电能,这种化学电池称为原电池;以铜锌原电池为例2锌电极,负极( 阳极) :Z 氧化反应Z 2en n2铜电极,正极( 阴极) :C u 二,电解池仍原反应2e C u实现某种电化学反应的能量由外电源供应就这种化学电池称为电解池仍以铜电极和锌电极为例;2锌电极,负极( 阴极) :Z n仍原反应2e Z n2铜电极,正极( 阳极) :C氧化反应C2eu u应留意:阳极,阴极是对实际发生的反应而言,阳极发生氧化反应,阴极发生仍原反应;正极,负极是对电荷的流向而言,电子流出为负极,电子流入为正极;三,电池的表示方法规定:⒈发生氧化反应的一极( 阳极) 写在左边,发生仍原反应的写在右边;⒉电池组成的每一个接界面用单竖线“∣”隔开,两种溶液通过盐桥连接,用双竖线“‖”表示;⒊电解质溶液位于两电极之间,并应注明浓度,如有气体应注明压力,温度电池电动势E电池=E 右-E1.电极电位与液体接界电位内容提要:电极电位定义,液体接界电位的产生,电极极化的形成重点,难点:液体接界电位的产生授课方式:讲授一,电极电位电极电位的产生是由于金属与溶液交界面发生了电荷交换的结果,在金属与溶液之间产生了肯定的电位差,这种电位差就是电极电位;单个电极的电位值目前尚无法测定,它与标准电极组成电池,规定氢标准电极电位为零,测得的电池电动势即为待测电极的电极电位;P t,H2(101325P a) ∣H (a=1) ‖待测电极二,液体接界电位在不同电解质或浓度不同的同种电解质溶液界面之间,由于离子扩散通过界面的速率不同,在两液体界面之间有微小的电位差产生,这种电位差称为液体接界电位;由于K 和的扩散速度几乎相等,所以在两个溶液界面之间使用盐桥可以减小液接Cl电位;三,极化和过电位极化是指电流通过电极与溶液的界面时,电极电位偏离平稳电位的现象;⒈浓差极化:电解过程中电极表面溶液的浓度与主体溶液存在差别,这种由于浓度差别引起的极化叫浓差极化;减小电流密度,强化机械搅拌可减小浓差极化;⒉电化学极化电化学极化是由于电极反应速率较慢引起的,这种因电极反应迟缓所引起的极化现象称为电化学极化;2.电极种类一,依据电极组成分类依据组成体系和作用机理,可以分成五类 ⒈第一类电极: : 由该金属浸入全有该金属离子的溶液组成,如 Ag Ag⒉其次类电极:由金属,该金属的难溶盐的阴离子组成;如 AgCl AgHg 2 Cl 2 Hg⒊第三类电极2| CaC O | Ca金属与两种具有共同阴离子的难溶盐组成;如 Hg | Hg C O 2 2 4 2 4 ⒋零类电极由惰性金属与全有可溶性的氧化和仍原物质的溶液组成的电极;如23P t | F e , Fe⒌膜电极具有敛威膜并能产生膜电位的电极;如各种离子挑选性电极二,依据电极所起的作用分类⒈指示电极和工作电极 在电化不测量过程中,溶液主体浓度不发生变化的电极称为指示电极;如有较大电流 通过,溶液主体浓度发生显蓍变化的电极称为工作电极; ⒉参比电极 在电化学测量过程中,具有恒定电位的电极称为参比电极;⒊帮助电极或对电极 帮助电极 ( 对电极 ) 与工作电极形成通路,它只供应电子传递的场所;⒋极化电极和去极化电极 电解过程中,插入试样电极的电位完全随外加电压的变化而变化,这类电极称为极化 电极,当电极电位不随外加电压而变化,这类电极称为去极化电极;第六章 电位分析法第一节 离子挑选性电极电位法基本原理电位分析法是依据测量到的电极电位,由能斯特方程式求得被测物质的浓度,电位分 析法通常分为直接电位法和电位滴定法,本章主要内容如下 1. 离子挑选性电极的分类及响 应机理 ,2. 离子挑选性电极的性能参数 ,3. 测定离子活 ( 浓) 度的方法, 4 电位滴定法,要 把握的重点,难点和学问要点是,电位法测定溶液 pH 值的原理, pH 玻璃电极的特性及对-溶液 pH 测定的影响, F 挑选电极的结构,其响应电位与测定液中氟离子活度之间的关系,膜电极的响应没有肯定的专一性,而只有相对的挑选性,在表达电极电位与各组分的浓度 nF关系时可用下述方程式表示: E=k ± a n/a a n/ b ,直接法校正曲线法和标 lg( a k k ) i ij ij j k。

《仪器分析》电子教案第一章:绪论1.1 课程介绍理解仪器分析在现代科学领域的重要性了解仪器分析的基本概念和发展历程1.2 仪器分析的分类与特点掌握仪器分析的主要类型(如光谱、色谱、电化学等)理解各种分析方法的优缺点及适用范围1.3 仪器分析的基本原理学习基本的物理和化学原理,如光的散射、吸收、发射等掌握仪器分析的基本计算方法和数据处理第二章:光谱分析2.1 紫外-可见光谱分析学习紫外-可见光谱的产生原理掌握紫外-可见光谱仪的操作和应用实例2.2 红外光谱分析了解红外光谱的产生原理和仪器结构学习红外光谱图的解析及应用2.3 原子光谱分析掌握原子光谱的基本原理,包括原子发射光谱和原子吸收光谱了解原子光谱在元素分析中的应用第三章:色谱分析3.1 气相色谱分析学习气相色谱的原理、仪器结构及操作方法掌握气相色谱的定性和定量分析技术3.2 液相色谱分析了解液相色谱的原理和类型,如HPLC、UPLC等掌握液相色谱的仪器操作和应用实例3.3 色谱-质谱联用技术学习色谱-质谱联用的基本原理和仪器结构了解其在复杂样品分析中的应用和优势第四章:电化学分析4.1 电化学分析基本原理学习电化学分析的电位、电流、电量等基本概念掌握电化学分析法的种类及其适用性4.2 常见电化学分析方法学习伏安法、极谱法、电位滴定法等分析方法了解电化学分析在实际样品分析中的应用4.3 电化学探针技术掌握电化学探针的工作原理和应用领域学习如何选择合适的电化学探针进行特定分析第五章:现代仪器分析技术5.1 质谱分析理解质谱分析的基本原理和仪器结构学习质谱图的解析和质谱技术在分析中的应用5.2 核磁共振谱分析学习核磁共振谱的产生原理和仪器操作掌握核磁共振谱在有机化合物结构分析中的应用5.3 扫描隧道显微镜分析了解扫描隧道显微镜的工作原理和特点学习扫描隧道显微镜在表面分析和纳米技术中的应用第六章:光学分析技术6.1 激光光谱分析学习激光光谱的原理和特点掌握激光光谱技术在分析中的应用案例6.2 光纤光谱分析了解光纤光谱技术的原理和设备学习光纤光谱在远程分析和生物医学中的应用6.3 光学显微镜分析掌握光学显微镜的原理和操作学习光学显微镜在材料和生物样品分析中的应用第七章:电泳分析7.1 凝胶电泳分析学习凝胶电泳的原理和分类掌握凝胶电泳在生物大分子分析中的应用7.2 毛细管电泳分析了解毛细管电泳的原理和设备学习毛细管电泳在药物分析和生物分子分离中的应用7.3 电泳-质谱联用技术学习电泳-质谱联用的原理和流程掌握其在蛋白质分析和蛋白质组学中的应用第八章:电化学传感器分析8.1 电化学传感器的基本原理理解电化学传感器的工作原理和分类学习电化学传感器的设计和应用8.2 生物电化学传感器学习生物电化学传感器的工作原理和特点掌握生物电化学传感器在生物医学和环境监测中的应用8.3 纳米电化学传感器了解纳米电化学传感器的发展和优势学习纳米电化学传感器在灵敏度和选择性提高中的应用第九章:数据处理与质量控制9.1 数据处理基本方法学习仪器分析数据的基本处理方法,如校准、滤波、平滑等掌握数据曲线拟合和参数估计的技术9.2 质量控制和质保理解质量控制的原则和程序学习如何进行实验室质量管理和确保分析结果的准确性和可靠性9.3 统计分析在仪器分析中的应用学习统计学在数据分析中的应用掌握使用统计方法评估分析结果的可信度和精确度第十章:实验操作与案例分析10.1 实验操作技巧学习实验操作的基本规范和技巧掌握安全操作和实验室事故的处理方法10.2 实验案例分析分析实际案例,理解仪器分析在解决实际问题中的应用学习如何设计实验方案和解读实验结果重点解析本文档详细编写了一个关于《仪器分析》的电子教案,共分为十个章节。

仪器分析讲义绪论(Introduction)仪器分析是化学类专业必修的基础课程之一。
通过本课程的学习,要求学生把握经常使用仪器分析方式的原理和仪器的简单结构;要求学生初步具有依照分析的目的,结合学到的各类仪器分析方式的特点、应用范围,选择适宜的分析方式的能力。
分析化学是研究物质的组成、状态和结构的科学。
它包括化学分析和仪器分析两大部份。
化学分析是指利用化学反映和它的计量关系来确信被测物质的组成和含量的一类分析方式。
测按时需利用化学试剂、天平和一些玻璃器皿。
它是分析化学的基础。
仪器分析是以物质的物理和物理化学性质为基础成立起来的一种分析方式,测按时,常常需要利用比较复杂的仪器。
它是分析化学的进展方向。
仪器分析与化学分析不同,具有如下特点:(1)灵敏度高,检出限量可降低。
如样品用量由化学分析的ml、mg级降低到仪器分析的µL、µg级,乃至更低。
它比较适用于微量、痕量和超痕量成份的测定。
(2)选择性好。
很多仪器分析方式能够通过选择或调整测定的条件,使共存的组分测按时,彼其间不产生干扰。
(3)操作简便、分析速度决,易于实现自动化。
(4)相对误差较大。
化学分析一样可用于常量和高含量成份的分析,准确度较高,误差小于千分之儿。
多数仪器分析相对误差较大,一样为5%,不适于常量和高含量成份的测定。
(5)需要价钱比较昂贵的专用仪器。
§1-1.仪器分析方式的内容和分类(Classification of Instrumental Analysis)分类:1.光学分析法以物质的光学性质为基础的分析方式(1) 分子光谱: 红外吸收可见和紫外分子荧光拉曼光谱(2) 原子光谱: 原子发射AES 原子吸收AAS 原子荧光AFS(3) X射线荧光: 发射吸收衍射荧光电子探针(4) 核磁共振顺磁共振2.电化学分析法溶液的电化学性质用于确信物质化学成份的方式(1)电导法:电导分析法电导确信物质的含量电导滴定法溶液的电导转变确信容量分析的滴定终点。


仪器分析电子教案(一)章节名称:引言教学目标:1. 让学生了解仪器分析的基本概念和重要性。
2. 让学生了解仪器分析的分类和常用仪器。
教学内容:1. 仪器分析的基本概念2. 仪器分析的重要性3. 仪器分析的分类4. 常用仪器简介教学过程:1. 引入话题:介绍仪器分析在科学研究和实际应用中的重要性。
2. 讲解基本概念:解释仪器分析的定义和原理。
3. 讲解重要性:阐述仪器分析在各个领域中的应用和作用。
4. 讲解分类:介绍仪器分析的分类和各种分类的特点。
5. 讲解常用仪器:简要介绍一些常用的仪器及其应用。
教学评估:1. 课堂提问:检查学生对仪器分析基本概念的理解。
2. 作业布置:让学生课后查阅相关资料,了解更多关于常用仪器的信息。
仪器分析电子教案(二)章节名称:光谱分析教学目标:1. 让学生了解光谱分析的基本原理和常用仪器。
2. 让学生了解光谱分析的应用和实例。
教学内容:1. 光谱分析的基本原理2. 常用光谱仪器简介3. 光谱分析的应用4. 光谱分析的实例教学过程:1. 引入话题:介绍光谱分析在科学研究和实际应用中的重要性。
2. 讲解基本原理:解释光谱分析的原理和基本概念。
3. 讲解常用仪器:简要介绍一些常用的光谱仪器及其特点。
4. 讲解应用:阐述光谱分析在各个领域中的应用和实例。
教学评估:1. 课堂提问:检查学生对光谱分析基本原理的理解。
2. 作业布置:让学生课后查阅相关资料,了解更多关于光谱仪器的信息。
仪器分析电子教案(三)章节名称:色谱分析教学目标:1. 让学生了解色谱分析的基本原理和常用色谱仪器。
2. 让学生了解色谱分析的应用和实例。
教学内容:1. 色谱分析的基本原理2. 常用色谱仪器简介3. 色谱分析的应用4. 色谱分析的实例教学过程:1. 引入话题:介绍色谱分析在科学研究和实际应用中的重要性。
2. 讲解基本原理:解释色谱分析的原理和基本概念。
3. 讲解常用仪器:简要介绍一些常用的色谱仪器及其特点。

实验一722 型分光光度计的性能检测一、目的1、学会使用分光光度计2、掌握分光光度计的性能检验方法二、提要1、分光光度计的性能好坏,直接影响到测定结果的准确性,因此新购仪器及使用一定时间后,均需进行检验调整。
2、利用KMnO4溶液的最大吸收峰值来检验波长的精度。
3、用同种厚度的比色皿,由于材料及工艺等原因,往往造成透光率的不一致,从而影响测定结果,故在使用时须加以选择配对。
三、仪器与试剂1、722 型分光光度计;2、小烧杯;3、坐标纸;4、滴管;5、擦镜纸;6、KMnO4溶液;四、操作步骤1、吸收池透光率的检查(测定透光率)吸收池透光面玻璃应无色透明,并应无水、干燥。
检查方法如下:以空气的透光率为100%,则比色皿的透光率应不低于84%,同时在450nm、650nm 处测其透光率,各透吸收池透光率差值应小于5%。
2、吸收池的配对性(测定透光率)同种厚度的吸收池之间,透光率误差应小于0.5%。
检查方法如下:将蒸馏水分别注入厚度相同的几个吸收池中。
以其中任一个比色皿的溶液做空白,在440nm 波长处分别测定其它各比色皿中溶液的透光率,然后选择相差小于0.5% 的吸收池使用。
3、重现性(光度重复性)(测定透光率)仪器在同一工作条件下,用同种溶液连续测定7 次,其透光率最大读数与最小读数之差(极差)应小于0.5%。
检查方法如下:以蒸馏水的透光率为100%,用同一KMnO4溶液连续测定7 次,求出极差,如小于0.5%,则符合要求。
4、波长精度的检查(测定A)为了检查分光系统的质量,可用KMnO4溶液的最大吸收波长525nm 为标准,在待检查仪器上测绘KMnO4溶液的吸收曲线。
检查方法如下:取3.0×10-5mol/L 的KMnO4溶液,以蒸馏水为空白,在460nm~580nm 范围内,分别测定460、480、500、510、520、522、524、525、526、528、530、540、550、560、570、580nm 波长处的吸光度,在坐标纸上绘出吸收曲线。

仪器分析教案目录一、课程概述 (2)1.1 仪器分析的重要性 (2)1.2 课程目标 (3)1.3 课程内容概览 (4)二、仪器分析基础知识 (5)2.1 仪器分析基本概念 (7)2.1.1 定义与分类 (9)2.1.2 仪器分析的基本原理 (10)2.2 仪器的基本结构与性能 (11)2.2.1 常见仪器结构介绍 (13)2.2.2 仪器性能指标及评价方法 (14)三、实验技术与操作规范 (16)3.1 实验前的准备与检查 (17)3.1.1 实验环境准备 (18)3.1.2 实验仪器的检查与校准 (19)3.2 实验操作规范及步骤 (20)3.2.1 仪器的操作使用规程 (21)3.2.2 实验数据处理与分析方法 (21)四、仪器分析实验教程 (22)4.1 实验一 (23)4.1.1 实验目的 (24)4.1.2 实验原理 (24)4.1.3 实验步骤与方法 (25)4.1.4 实验数据分析与总结 (26)4.2 实验二 (28)4.2.1 实验目的 (28)4.2.2 实验原理 (28)4.2.3 实验操作及数据处理 (29)4.2.4 结果分析与讨论 (30)五、仪器维护与故障排除 (31)5.1 仪器的日常保养与维护 (33)5.1.1 清洁与防尘 (34)5.1.2 仪器的存放与运输要求 (34)5.2 仪器故障排查与修复方法 (36)5.2.1 常见故障原因及排除方法 (37)5.2.2 故障诊断与修复技巧 (38)一、课程概述仪器分析是一门综合性应用学科,它涉及使用各种仪器的实验方法来测定物质的成分、结构、性质及其变化规律。
本课程旨在向学生介绍仪器分析的基本原理、仪器设备、操作技能以及在实际中的应用案例。
通过本课程的学习,学生将掌握常见仪器分析方法的基本操作,了解仪器分析在化学、生物、医学、环境科学等领域中的重要作用,并具备运用仪器分析技术解决实际问题的能力。
本课程将围绕仪器分析的基本理论、仪器设备的构造与工作原理、实验技巧及应用实例展开。

仪器分析课程教案一、课程简介1. 课程目的:使学生掌握常用仪器分析方法的基本原理、仪器构造及操作技能,培养学生分析问题和解决问题的能力。
2. 课程内容:涵盖光学分析、电化学分析、色谱分析、质谱分析等常用仪器分析方法。
3. 适用对象:高等院校化学、化工、生化、药学专业本科生。
二、教学目标1. 知识与技能:(1)掌握各类仪器分析方法的基本原理;(2)了解仪器分析方法在实际中的应用;(3)学会使用常见仪器进行分析操作。
2. 过程与方法:(1)通过实验操作,培养学生的动手能力;(2)通过问题讨论,提高学生的分析问题、解决问题的能力。
3. 情感、态度与价值观:(1)培养学生对仪器分析学科的兴趣;(2)树立学生科学探究的精神。
三、教学方法1. 讲授与实验相结合:理论讲授为基础,实验操作作为实践环节,使学生更好地理解仪器分析方法。
2. 问题驱动:引导学生思考实际问题,激发学生的学习兴趣,提高学生的分析问题、解决问题的能力。
3. 小组讨论:鼓励学生相互交流、探讨,培养学生的团队合作精神。
四、教学内容1. 第一章:光学分析法(1)紫外-可见光谱分析;(2)红外光谱分析;(3)拉曼光谱分析。
2. 第二章:电化学分析法(1)电位分析法;(2)电导分析法;(3)库仑分析法。
3. 第三章:色谱分析法(1)气相色谱分析;(2)液相色谱分析;(3)色谱-质谱联用分析。
4. 第四章:质谱分析法(1)质谱仪器的基本原理;(2)质谱图的解析;(3)质谱分析在实际中的应用。
5. 第五章:原子光谱分析法(1)原子吸收光谱分析;(2)原子荧光光谱分析;(3)原子发射光谱分析。
五、教学安排1. 课时:32学时,包括16次理论讲授和16次实验操作。
2. 教学方式:讲授与实验相结合。
3. 教学评价:课堂表现、实验报告、课程论文相结合。
六、第六章:流动分析法(1)溶液的配制与处理;(2)流动分析仪器的构造及操作;(3)流动分析在环境监测中的应用。

《仪器分析》电子教案第一章:绪论1.1 课程介绍了解《仪器分析》课程的基本概念、内容、目标和意义。
强调仪器分析在科学研究和实际应用中的重要性。
1.2 仪器分析方法的分类介绍光学分析法、电化学分析法、色谱分析法等常见仪器分析方法。
解释各种方法的原理和特点。
1.3 实验操作规范强调实验室安全、实验操作规范和数据处理的要求。
第二章:光谱分析2.1 紫外-可见光谱分析解释紫外-可见光谱的原理和应用。
介绍紫外-可见光谱仪的使用方法和操作步骤。
2.2 红外光谱分析解释红外光谱的原理和应用。
介绍红外光谱仪的使用方法和操作步骤。
2.3 拉曼光谱分析解释拉曼光谱的原理和应用。
介绍拉曼光谱仪的使用方法和操作步骤。
第三章:色谱分析3.1 气相色谱分析解释气相色谱的原理和应用。
介绍气相色谱仪的使用方法和操作步骤。
3.2 高效液相色谱分析解释高效液相色谱的原理和应用。
介绍高效液相色谱仪的使用方法和操作步骤。
3.3 色谱数据处理解释色谱数据的处理方法,如峰面积计算、峰高度计算等。
介绍色谱数据处理软件的使用方法和操作步骤。
第四章:电化学分析4.1 电位分析解释电位分析的原理和应用。
介绍电位分析仪的使用方法和操作步骤。
4.2 电化学发光分析解释电化学发光分析的原理和应用。
介绍电化学发光分析仪的使用方法和操作步骤。
4.3 电化学探针技术解释电化学探针技术的原理和应用。
介绍电化学探针技术的使用方法和操作步骤。
第五章:质谱分析5.1 质谱原理和仪器解释质谱分析的原理和应用。
介绍质谱仪的使用方法和操作步骤。
5.2 质谱数据解析解释质谱数据的解析方法和技巧。
介绍质谱数据解析软件的使用方法和操作步骤。
5.3 质谱应用案例分析分析质谱在蛋白质分析、代谢组学等领域的应用案例。
强调质谱在科学研究和实际应用中的重要性。
第六章:原子吸收光谱分析6.1 原子吸收光谱原理解释原子吸收光谱的原理,包括光源、样品原子化、检测器等。
介绍原子吸收光谱仪的使用方法和操作步骤。

(光学分析和色谱分析)山东大学公共卫生学院卫生检验研究室邵丽华仪器分析是根据物质的物理和化学性质来获取物质化学组成、含量、结构及相关信息的科学;它是分析化学的重要组成部分。
随着科学技术的发展,分析化学已由过去的经典分析方法为主转向以仪器分析方法为主。
仪器分析在医学科学和生命科学中,对揭示生命起源、从分子水平上研究生命的过程;临床检验中的配合诊断和治疗疾病;预防医学领域内的环境监测;卫生检验领域的职业中毒检验、营养成分分析等都起着重要作用。
仪器分析是卫生检验专业的重要的专业基础课。
仪器分析课程的特点是基本理论与实践紧密结合,通过严格的实验训练,培养认真的科学态度及独立进行精密科学实验的技巧,提高分析问题和处理问题的能力,为后继课程的学习以及从事医药卫生和科学研究打下良好的基础。
章学时数累计学时数紫外可见分光光度法7 7原子吸收分光光度法 5 12分子荧光分析法 4 16色谱分析导论 4 20气相色谱法 6 26高效液相色谱法 4 30合计30《仪器分析》武汉大学化学系编.高等教育出版社出版2001年3月,第1版《仪器分析》方惠群,于俊生,史坚编. 科学出版社出版2002年2月,第1版《仪器分析》郭永等编. 地震出版社出版2001年4月,第1版1. 本教案源自现山东大学卫生检验专业和预防医学专业使用教材《分析化学》,邹学贤主编.人民卫生出版社出版,第1版. 教案中如有错漏,请以该教材中内容为准。
2. 每章中都备有“基本要点”,共阅读时参考。
3. 为便于阅读,教案目录中的各个条目均与相应章节链接,点击目录中想要阅读的条目,即可跳转至相应位置以供阅读(想要返回目录页时,建议使用word 工具栏的“返回”符号)。
紫外可见分光光度法 (4)光学分析法 (4)电磁波 (4)分子吸收光谱 (6)光的吸收定律 (10)分光光度计 (13)定性及定量分析方法 (16)光度法显色反应条件和测量条件的选择 (18)紫外-可见分光光度法应用 (21)自测题 (21)原子吸收分光光度法 (23)基本原理 (23)原子吸收分光光度计 (30)定量分析方法 (31)原子吸收分光光度法干扰及消除 (32)原子吸收实验技术及应用 (34)自测题 (36)分子荧光分析法 (37)基本原理 (38)溶液的荧光强度 (41)测量荧光的仪器 (43)应用与示例 (44)自测题 (45)色谱分析导论 (46)色谱法及其分类 (46)色谱流出曲线和术语 (48)色谱分析基本原理 (50)自测题 (60)气相色谱法 (62)概述 (62)气相色谱分离条件的选择 (63)色谱柱 (65)气相色谱检测器 (67)气相色谱定性定量分析 (71)毛细管柱气相色谱法 (75)顶空气相色谱法 (76)气相色谱法的应用 (77)自测题 (78)高效液相色谱法 (79)概述 (79)高效液相色谱仪 (80)色谱分离条件选择 (84)液-固色谱法 (85)化学键合相色谱法 (86)离子交换色谱法 (87)尺寸排阻色谱法 (88)高效液相色谱法的应用 (89)自测题 (90)紫外可见分光光度法∙ 光学分析法光学分析法—利用辐射与物质间相互作用进行定性、定量的分析方法。
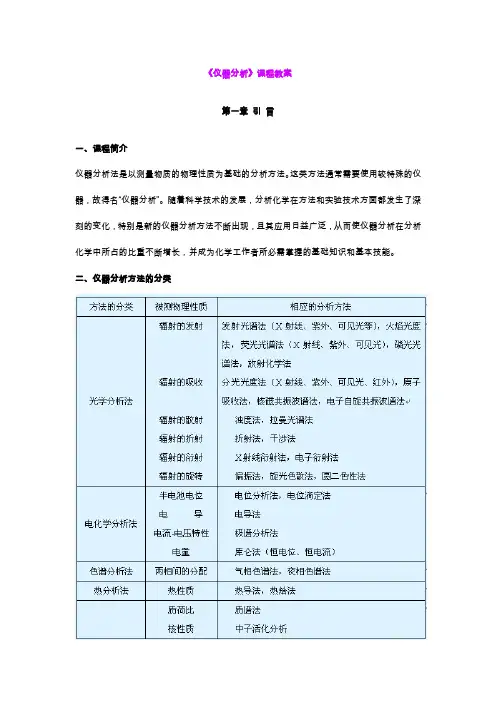
《仪器分析》课程教案第一章引言一、课程简介仪器分析法是以测量物质的物理性质为基础的分析方法。
这类方法通常需要使用较特殊的仪器,故得名“仪器分析”。
随着科学技术的发展,分析化学在方法和实验技术方面都发生了深刻的变化,特别是新的仪器分析方法不断出现,且其应用日益广泛,从而使仪器分析在分析化学中所占的比重不断增长,并成为化学工作者所必需掌握的基础知识和基本技能。
二、仪器分析方法的分类三、仪器分析的特点及发展趋势优点是:1. 操作简便而快速,对于含量很低(如质量分数为10 -8 或10 -9 数量级)的组分,则更具独特之处。
2. 被测组分的浓度变化或物理性质变化能转变成某种电学参数(如电阻﹑电导﹑电位﹑电容﹑电流等),故易于实现自动化和连接电子计算机。
因此,仪器分析具有简便﹑快速﹑灵敏﹑易于实现自动化等特点。
对于结构分析,仪器分析法也是极为重要和必不可少的工具。
生产的发展和科学的进步,不仅对分析化学在提高准确度﹑灵敏度和分析速度等方面提出更高的要求,而且还不断提出更多的新课题。
一个重要的方面是要求分析化学能提供更多﹑更复杂的信息。
现代科学技术发展的特点是学科之间的相互交叉﹑渗透,各种新技术的引人﹑应用等,促进了学科的发展,使之不断开拓新领域﹑新方法。
如电感耦合等离子体发射光谱﹑傅立叶变换红外光谱﹑傅立叶变换核磁共振波谱﹑激光拉曼光谱﹑激光光声光谱等。
另外试样的复杂性﹑测量难度﹑要求信息量及响应速度在不断提高,这就需要将几种方法结合起来,组成连用分析技术,可以取长补短,起到方法间的协同作用,从而提高方法的灵敏度﹑准确度及对复杂混合物的分辨能力,同时还可获得两种手段各自单独使用时所不具备的某些功能,因而连用分析技术以成为当前仪器分析方法的主要方向之一。
计算机技术对仪器分析的发展影响极大。
在分析工作者的指令控制下,仪器自动处于优化的操作条件完成整个分析过程,进行数据采集﹑处理﹑计算等,直至动态CRT 显示和最终曲线报表。
仪器分析课程教案一、课程简介1. 课程目标:使学生掌握常见仪器分析方法的基本原理、仪器构造及操作技巧,培养学生分析问题和解决问题的能力。
3. 课程内容:涵盖光学分析、电化学分析、色谱分析、质谱分析等常见仪器分析方法。
二、教学方法1. 讲授:讲解基本原理、仪器构造及操作方法。
2. 演示:进行仪器操作演示,让学生直观了解仪器使用过程。
3. 实验:安排实验课程,让学生动手操作,巩固理论知识。
4. 讨论:组织学生针对实验结果进行分析讨论,提高分析问题和解决问题的能力。
三、教学内容1. 第一章:光学分析法1.1 紫外-可见光谱分析1.2 红外光谱分析1.3 拉曼光谱分析2. 第二章:电化学分析法2.1 电位分析法2.2 电解分析法2.3 库仑分析法3. 第三章:色谱分析法3.1 气相色谱分析3.2 高效液相色谱分析3.3 薄层色谱分析4. 第四章:质谱分析法4.1 质谱仪原理及构造4.2 质谱图解析4.3 质谱在结构鉴定中的应用5. 第五章:现代仪器分析技术5.1 原子光谱分析5.2 核磁共振光谱分析5.3 扫描隧道显微镜分析四、教学安排1. 授课时间:32课时(每周2课时,共16周)2. 实验时间:16课时(每周1课时,共16周)3. 课程设计:理论教学与实验教学相结合,注重实践操作能力的培养。
五、课程评价1. 平时成绩:课堂表现、作业完成情况,占比30%。
2. 实验报告:实验操作、数据处理及分析,占比30%。
3. 期末考试:闭卷考试,占比40%。
4. 综合评价:考察学生的理论知识、实践操作能力和分析问题解决问题的能力。
六、第四章:质谱分析法(续)4.4 质谱在生物化学领域的应用4.5 质谱在材料科学领域的应用七、第五章:现代仪器分析技术(续)5.4 电化学石英晶体微天平分析5.5 光学相干断层扫描分析八、第六章:数据分析与处理8.1 数据分析基础8.2 数据处理方法8.3 仪器分析数据的可靠性评估九、第七章:仪器分析在科研中的应用9.1 仪器分析在化学研究中的应用9.2 仪器分析在生物医学领域的应用9.3 仪器分析在环境监测领域的应用十、第八章:仪器分析实验技巧与安全10.1 实验基本操作技巧10.2 实验中常见问题及解决方法10.3 实验室安全知识六、教学安排1. 授课时间:32课时(每周2课时,共16周)2. 实验时间:16课时(每周1课时,共16周)七、课程评价1. 平时成绩:课堂表现、作业完成情况,占比30%。
课时安排:2课时教学目标:1. 理解仪器分析的基本概念和分类。
2. 掌握常见的仪器分析方法及其基本原理。
3. 了解仪器分析在科学研究、工农业生产和日常生活中的应用。
教学重点:1. 仪器分析的基本概念和分类。
2. 常见的仪器分析方法及其基本原理。
教学难点:1. 仪器分析方法在实际应用中的选择与优化。
2. 仪器分析结果的准确性和可靠性。
教学过程:第一课时一、导入1. 提问:什么是仪器分析?它与传统的分析方法有什么区别?2. 引导学生思考:仪器分析在科学研究和工农业生产中的作用。
二、基本概念与分类1. 介绍仪器分析的定义、特点和发展历程。
2. 讲解仪器分析的分类:光学分析法、电化学分析法、色谱分析法、质谱法等。
三、常见仪器分析方法及其原理1. 光学分析法:讲解紫外-可见分光光度法、红外光谱法等。
2. 电化学分析法:讲解电位分析法、伏安分析法、库仑分析法等。
3. 色谱分析法:讲解气相色谱法、高效液相色谱法等。
4. 质谱法:讲解质谱的基本原理和常用质谱仪。
四、课堂小结1. 回顾本节课所学内容,强调重点。
2. 布置课后作业,巩固所学知识。
第二课时一、导入1. 提问:仪器分析方法在实际应用中如何选择?2. 引导学生思考:影响仪器分析方法选择的因素。
二、仪器分析方法在实际应用中的选择与优化1. 分析影响仪器分析方法选择的因素:样品性质、分析要求、仪器性能等。
2. 讲解不同仪器分析方法在实际应用中的选择与优化。
三、仪器分析结果的准确性和可靠性1. 介绍提高仪器分析结果准确性和可靠性的方法:校准、质量控制、数据处理等。
2. 讲解实际案例分析,引导学生分析结果误差的来源。
四、课堂小结1. 回顾本节课所学内容,强调重点。
2. 布置课后作业,巩固所学知识。
教学评价:1. 课后作业:检查学生对仪器分析基本概念、分类、原理等知识的掌握程度。
2. 课堂讨论:评估学生对仪器分析方法在实际应用中的选择与优化的理解程度。
3. 实验操作:考察学生运用仪器分析方法解决实际问题的能力。
第六部分仪器分析实验仪器分析方法汇集了化学、物理学、仪表电子学、数学和计算机科学等学科的最新成就,已由单纯提供分析测试数据上升到从原始的分析测试数据或现场分析测试信号中最大限度地获取有价值的静态和动态物质信息,来解决自然科学各个研究领域中的关键问题,已成为自然科学研究领域中物质的信息科学。
因此,仪器分析实验是化学类、生物科学类、环境科学类等本科学生的一门基础课程。
仪器分析实验的主要目的是:通过仪器分析实验,使学生加深对有关仪器分析方法基本原理的理解,掌握常用仪器分析方法(光学、电化学、色谱法等)的基本知识和技能;学会正确地使用分析仪器,合理地选择实验条件;正确处理数据和表达实验结果;培养严谨的科学态度和实事求是、一丝不苟的科学作风和科学工作者应有的基本素质;要求学生了解仪器分析发展的新方法,新动向,从而在解决实际问题时具有会选择适宜测量方法的能力。
为了达到上述目的,在实施仪器分析教学时,要求学生做到:1、课前认真预习,仔细阅读仪器分析实验教材,了解分析方法和分析仪器工作的基本原理、仪器主要部件的功能、操作程序和应注意的事项。
2、正确使用仪器。
未经老师允许不得随意开动或关闭仪器,更不得随意旋转仪器旋钮、改变仪器的工作参数等。
详细了解仪器的性能,防止损坏仪器或发生安全事故。
3、在实验过程中,要认真地学习有关分析方法的基本技术;要细心观察实验现象和仔细记录实验条件和分析测试的原始数据;学会选择最佳的实验条件;积极思考,培养良好的实验习惯和科学作风。
4、爱护实验的仪器设备。
实验中如发现仪器工作不正常,应及时报告老师处理。
5、认真写好实验报告。
实验报告应简明,图表清晰。
实验报告内容包括实验题目、日期、原理、仪器名称及型号、主要仪器的工作参数、简要步骤、实验数据或图谱、实验中的现象、实验数据分析和结果处理、问题讨论等。
实验6-1紫外可见分光光度法检测柔红霉素一、实验目的1、学习UV2550的操作。
2、了解紫外可见分光光度法测定药物的基本原理。
仪器分析教学大纲一、课程简介1.1 教学目的1.2 教学内容1.3 教学方式二、课程目标2.1 知识目标2.2 技能目标2.3 情感目标三、教学内容及安排3.1 仪器分析的基本概念与原理3.1.1 仪器分析的定义与分类3.1.2 仪器分析的基本原理3.1.2.1 信号检测与处理3.1.2.2 信号传递与转换3.2 常见仪器的工作原理与应用3.2.1 分光光度法仪器的原理与应用 3.2.2 色谱仪器的原理与应用3.2.3 质谱仪器的原理与应用3.2.4 核磁共振仪器的原理与应用 3.2.5 电化学仪器的原理与应用3.3 仪器分析常用方法与技术3.3.1 样品制备与前处理技术3.3.2 仪器分析操作步骤与技巧3.3.3 数据分析与结果处理方法3.4 仪器分析实验设计与实施3.4.1 实验设计的要点与方法3.4.2 实验建议与注意事项3.4.3 仪器操作与实验数据记录四、教学方法与手段4.1 授课方法4.2 实验教学方法4.3 讨论与互动4.4 考核评价方式五、教学资源与使用5.1 教材5.2 参考资料5.3 实验设备与仪器六、评价与考核6.1 评价标准6.2 考核方式6.3 考核内容七、参考教学计划7.1 单元教学计划7.2 实验教学计划八、教学团队8.1 教师配置8.2 实验室助教配置九、教学保障措施9.1 实验室安全教育与操作指导 9.2 仪器维护与管理9.3 教学质量监控与评估十、教学改进与创新10.1 教学反馈与改进机制10.2 教学创新与教育研究十一、总结与展望11.1 教学总结11.2 课程发展展望以上为《仪器分析教学大纲》的内容,通过本课程的学习,学生将掌握仪器分析的基本概念、原理和常用方法与技术,能够独立进行仪器分析实验设计与实施,并具备正确的数据分析与结果处理能力。
同时,本课程注重培养学生的实践操作能力、团队合作意识和创新思维,为将来从事仪器分析相关领域的工作打下良好基础。
仪器分析完整版(详细)第一章绪论1.仪器分析是以物质的物理组成或物理化学性质为基础,探求这些性质在分析过程中所产生分析信号与被分析物质组成的内在关系和规律,进而对其进行定性、定量、进行形态和机构分析的一类测定方法,由于这类方法的测定常用到各种比较贵重、精密的分析仪器,故称为仪器分析。
与化学分析相比,仪器分析具有取样量少、测定是、速度快、灵敏、准确和自动化程度高的显著特点,常用来测定相对含量低于1%的微量、痕量组分,是分析化学的主要发展方向。
2.仪器分析的特点:速度快、灵敏度高、重现性好、样品用量少、选择性高局限性:仪器装置复杂、相对误差较大3.精密度:是指在相同条件下对同一样品进行多次测评,各平行测定结果之间的符合程度。
4、灵敏度:仪器或方法的灵敏度是指被测组分在低浓度区,当浓度改变一个单位时所引起的测定信号的该变量,它受校正曲线的斜率和仪器设备本身精密度的限制。
5.准确度:是多次测定的平均值与真实值相符合的程度,用误差或相对误差来描述,其值越小准确度越高。
6.空白信号:当试样中没有待测组分时,仪器产生的信号。
它是由试样的溶剂、基体材质及共存组分引起的干扰信号,具有恒定性,可以通过空白实验扣除。
7.本底信号:通常将没有试样时,仪器所产生的信号主要是由随机噪声产生的信号。
它是由仪器本身产生的,具有随机性,难以消除,但可以通过增加平行测定次数等方法减小;、8.仪器分析法与化学分析法有何异同:相同点:①都属于分析化学②任务相同:定性和定量分析不同点:①与化学分析相比,仪器分析具有取样量少、测定快速、灵敏、准确和自动化程度高等特点②分析对象不同:化学分析是常量分析,而仪器分析是用来测定相对含量低于1%的微量、衡量组分,是分析化学的主要发展方向9.仪器分析主要有哪些分类:①光分析法:分为非光谱分析法和光谱法两类。
非光谱法:是不涉及物质内部能级跃迁的,通过测量光与物质相互作用时其散射、折射、衍射、干涉和偏振等性质的变化,从而建立起分析方法的一类光学分析法。
第五章紫外一可见分光光度法%1.教学内容1.紫外一可见吸收光谱的产生(分子的能级及光谱、有机物及无机物电了能级跃迁的类型和特点)2.吸收定律及其发射偏差的原因3.仪器类型、各部件的结构、性能以及仪器的校正4 . 分析条件的选择5. 应用(定性及结构分析、定量分析的各种方法、物理化学常数的测定及其它方面的应用%1.重点与难点1.比较有机化合物和无机化合物各种也子跃迁类型所产生吸收带的特点及应用价值2.进行化合物的定性分析、结构判断3.定量分析的新技术(双波长法、导数光谱法、动力学分析法)4.物理化学常数的测定%1.教学要求1.较为系统、深入地掌握各种电了跃迁所产生的吸收带及其特征、应用2.熟练掌握吸收定律的应用及测量条件的选择3.较为熟练仪器的类型、备组件的工作原理4.运用各种类型光谱及人岫的经验规则,判断不同的化合物5.掌握定量分析及测定物理化学常数的常见基本方法6.一般掌握某些新的分析技术%1.学时安排5学时研究物质在紫外、可见光区的分子吸收光谱的分析方法称为紫夕卜■可见分光光度法。
紫外一可见分光光度法是利用某些物质的分子吸收200〜800 nm光谱区的辐射来进行分析测定的方法。
这种分子吸收光谱产生于价电子和分子轨道上的电子在电子能级间的跃迁,广泛用于无机和有机物质的定性和定量测定。
第一节紫外一可见吸收光谱一、分子吸收光谱的产生在分子中,除了电子相对于原子核的运动外,还有核间相对位移引起的振动和转动。
这三种运动能量都是量子化的,并对应有一定能级。
在每一电了能级上有许多间距较小的振动能级,在每一振动能级上又有许多更小的转动能级。
若用△ E电子、△ E振动、△ E转动分别表小电子能级、振动能级转动能级差,即有△ E电子〉△ Em> △E转动。
处在同一电子能级的分子,可能因其振动能量不同,而处在不同的振动能级上。
当分子处在同一电子能级和同一振动能级时,它的能量还会因转动能量不同,而处在不同的转动能级上。
所以分子的总能量可以认为是这三种能量的总和:E分子=£电子+ E振动+ E转动当用频率为v的电磁波照射分子,而该分子的较高能级与较低能级之差左E 恰好等于该电磁波的能量hv时,即有△ E = hv (h为普朗克常数)此时,在微观上出现分子由较低的能级跃迁到较高的能级;在宏观上则透射光的强度变小。
若用一连续辐射的电磁波照射分子,将照射前后光强度的变化转变为电信号,并记录下来,然后以波长为横坐标,以电信号(吸光度A)为纵坐标,就可以得到一张光强度变化对波长的关系曲线图——分子吸收光谱图。
二、分子吸收光谱类型根据吸收电磁波的范围不同,可将分子吸收光谱分为远红外光谱、红外光谱及紫外、可见光谱三类。
分子的转动能级差一般在0.005〜0.05cVo产生此能级的跃迁,需吸收波长约为250〜25pm的远红外光,因此,形成的光谱称为转动光谱或远红外光谱。
分子的振动能级差一般在0.05〜1 eV,需吸收波长约为25〜1.25|im的红外光才能产生跃迁。
在分子振动时同时有分子的转动运动。
这样,分子振动产生的吸收光谱中,包括转动光谱,故常称为振■转光谱。
由于它吸收的能量处于红外光区,故又称红外光谱。
电子的跃迁能差约为1〜20 eV,比分子振动能级差要大几十倍,所吸收光的波长约为12.5〜0.06|im,主要在真空紫外到可见光区,对应形成的光谱,称为电子光谱或紫外、可见吸收光谱。
通常,分子是处在基态振动能级上。
当用紫外、可见光照射分子时,电子可以从基态激发到激发态的任一振动(或不同的转动) 能级上。
因此,电子能级跃迁产生的吸收光谱,包括了大量谱线,并由于这些谱线的重叠而成为连续的吸收带,这就是为什么分子的紫外、可见光谱不是线状光谱,而是带状光谱的原因。
又因为绝大多数的分子光谱分析,都是用液体样品,加之仪器的分辨率有限,因而使记录所得电子光谱的谱带变宽。
由于氧、氮、二氧化碳、水等在真空紫外区(60〜200 nm) 均有吸收,因此在测定这一范围的光谱时,必须将光学系统抽成真空,然后充以一些惰性气体,如氮、氧、氯等。
鉴于真空紫外吸收光谱的研究需要昂贵的真空紫外分光光度计,故在实际应用中受到一定的限制。
我们通常所说的紫外一可见分光光度法,实际上是指近紫外、可见分光光度法。
第二节化合物紫外一可见光谱的产生在紫外和可见光谱区范围内,有机化合物的吸收带主要由 bTb*、兀T71*、n->b*、nTTT*及电荷迁移跃迁产生。
无机化合物的一、有机化合物的紫外一可见收光谱吸收带主要由电荷迁移和配位场跃迁(即d —d 跃迁和f —f 跃迁)产 生.由于电子跃迁的类型不同,实现跃迁需要的能量不同,因此吸收光的波长范围也不相同。
其中跃迁所需能量最大,n-»7u* 及配位场跃迁所需能量最小,因此,它们的吸收带分别落在远紫外 和可见光区。
从图中可知,兀T71* (电荷迁移)跃迁产生的谱带强 度最大,bTb*、n — TT*、nTb*跃迁产生的谱带强度次之,(配位跃迁的谱带强度最小)。
(一)、跃迁类型基态有机化合物的价电子包括成键。
电子、成键兀电子和非键 电子(以n 表示)。
分子的空轨道包括反键 L 轨道和反键兀*轨道, 因此,可能的跃迁为。
->。
*、兀-»兀*、n-»b* n — 兀*等。
1, bTb*跃迁 它需要的能量较高,一般发生在真空紫 外光区。
饱和炷中的一c 一 c 一键属于这类跃迁,例如乙烷的最大吸 收波长人max 为1 35nm 。
2, nrcy*跃迁 实现这类跃迁所需要的能量较高,其吸收光谱落于远紫外光区和近紫外光区,如CH3OH 和CH 3NH2的nTb*跃 迁光谱分别为1 83nm 和2 1 3nm 。
3 ,兀->兀*跃迁 它需要的能量低于bTb*跃迁,吸收峰一般 处于近紫外光区,在200 nm 左右,其特征是摩尔吸光系数大,一般 £max>104,为强吸收带。
如乙烯(蒸气)的最大吸收波长无max 为162 nm on□ *7T 反键。
*轨道反键丸*轨道n 非键轨道 成键曲道 成键。
轨道4,跃迁这类跃迁发生在近紫外光区。
它是简单的生色团如能基、硝基等中的孤对电子向反键轨道跃迁。
其特点是谱带强度弱,摩尔吸光系数小,通常小于100,属于禁阻跃迁。
5,电荷迁移跃迁所谓电荷迁移跃迁是指用电磁辐射照射化合物时,电子从给予体向与接受体相联系的轨道上跃迁。
因此,电荷迁移跃迁实质是一个内氧化一还原的过程,而相应的吸收光谱称为电荷迁移吸收光谱。
例如某些取代芳炷可产生这种分子内电荷迁移跃迁吸收带。
电荷迁移吸收带的谱带较宽,吸收强度较大,最大波长处的摩尔吸光系数fax可大于10,(二)、常用术语1,生色团从广义来说,所谓生色团,是指分子中可以吸收光子而产生电子跃迁的原子基团。
但是,人们通常将能吸收紫外、可见光的原子团或结构系统定义为生色团。
2,助色团助色团是指带有非键电子对的基团,如・OH、-OR. ・NHR、.SH、・C1、・Br、・I等,它们本身不能吸收大于200nm的光,但是当它们与生色团相连时,会使生色团的吸收峰向长波方向移动,并且增加其吸光度。
3,红移与蓝移(紫移)某些有机化合物经取代反应引入含有未共享电子对的基团(・OH、・OR、・NH2、-SH 、・C1、・Br、・SR、- NR2)之后, 吸收峰的波长将向长波方向移动,这种效应称为红移效应。
这种会使某化合物的最大吸收波长向长波方向移动的基团称为向红基团。
在某些生色团如供基的碳原子一端引入一些取代基之后,吸收峰的波长会向短波方向移动,这种效应称为蓝移(紫移)效应。
这些会使某化合物的最大吸收波长向短波方向移动的基团(如-CH2. -CH2CH3> -OCOCH3)称为向蓝(紫)基团。
(三)有机化合物紫外.可见吸收光谱1,饱和炷及其取代衍生物饱和炷类分子中只含有b键,因此只能产生bTb*跃迁,即。
电子从成键轨道(Q)跃迁到反键轨道(b*)。
饱和炷的最大吸收峰一般小于150nm,已超出紫外、可见分光光度计的测量范围。
饱和炷的取代衍生物如卤代炷,其卤素原子上存在n电子,可产生n->b*的跃迁。
nTb*的能量低于bTb*。
例如,CHgCl'CHgBr 和CH3I的nTb*跃迁分别出现在173、204和258nm处。
这些数据不仅说明氯、漠和碘原子引入甲烷后,其相应的吸收波长发生了红移,显示了助色团的助色作用。
直接用烷炷和卤代炷的紫外吸收光谱分析这些化合物的实用价值不大。
但是它们是测定紫外和(或)可见吸收光谱的良好溶剂。
2,不饱和烷及共辗烯谿在不饱和炷类分子中,除含有b键外,还含有兀键,它们可以产生和兀T71*两种跃迁。
兀T71*跃迁的能量小于跃迁。
例如,在乙烯分子中,兀->兀*跃迁最大吸收波长为1 80nm在不饱和炷类分子中,汽有两个以上的双键共辗时,随着共辄系统的延长,兀T7T*跃迁的吸收带将明显向长波方向移动,吸收强度也随之增强。
在共辗体系中,兀T7T*跃迁产生的吸收带又称为K带。
3,族基化合物供基化合物含有〉C = O基团。
〉C = O基团主要可产生兀T7T*、nr。
*、nm*三个吸收带,n->;r*吸收带又称R带,落于近紫外或紫外光区。
醛、酮、短酸及短酸的衍生物,如酯、酰胺等,都含有残基。
由于醛酮这类物质与梭酸及梭酸的衍生物在结构上的差异,因此它们nTTT*吸收带的光区稍有不同。
短酸及梭酸的衍生物虽然也有n->TU*吸收带,但是,梭酸及短酸的衍生物的残基上的碳原子直接连结含有未共用电子对的助色团,如・0H、・C1、-OR等,由于这些助色团上的n电子与靛基双键的兀电子产生nr兀共辄,导致兀*轨道的能级有所提高,但这种共辗作用并不能改变n轨道的能级,因此实现nm*跃迁所需的能量变大,使n->7c*吸收带蓝移至2 1 Onm左右□4,苯及其衍生物苯有三个吸收带,它们都是由71T71*跃迁引起的。
E]带出现在180nm(£MAX= 60,000); E2 带出现在204nm( 《MAX = 8, 000 ); B带出现在255nm (8M AX = 200)。
在气态或非极性溶剂中,苯及其许多同系物的B谱带有许多的精细结构,这是由于振动跃迁在基态电子上的跃迁上的叠加而引起的。
在极性溶剂中,这些精细结构消失。
当苯环上有取代基时,苯的三个特征谱带都会发生显著的变化,其中影响较大的是E2带和B谱带。
5,稠环芳烷及杂环化合物稠环芳炷,如奈、蕙、花等,均显示苯的三个吸收带,但是与苯本身相比较,这三个吸收带均发生红移,且强度增加。
随着苯环数目的增多,吸收波长红移越多,吸收强度也相应增加。
当芳环上的・CH基团被氮原子取代后,则相应的氮杂环化合物 (如毗嚏、喳哧)的吸收光谱,与相应的碳化合物极为相似,即毗噬与苯相似,喳I#与奈相似。