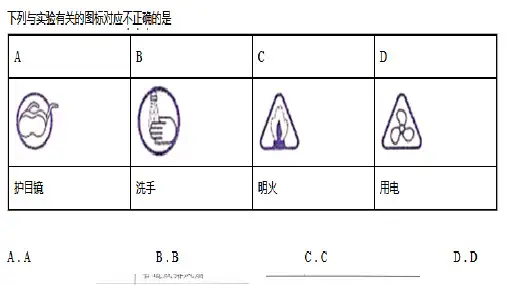
第二章分散系及其分类 胶体
- 格式:ppt
- 大小:1.43 MB
- 文档页数:17

课时2 分散系及其分类目标与素养:1.了解分散系的含义和分类;知道胶体是一种分散系。
(宏观辨识)2.了解胶体的本质性质及应用。
(社会责任)一、分散系及其分类1.分散系的含义(1)(2)示例分散系分散质分散剂烟固体小颗粒空气雾小液滴空气碘酒碘酒精食盐水NaCl 水(1)按分散质和分散剂的状态不同,共有9种分散系。
具体如图:(2)当分散剂是水或者其他液体时,根据分散质粒子直径的大小,分散系可分为三类:①分散质粒子直径小于1 nm的分散系是溶液;②分散质粒子直径大于100 nm的分散系是浊液;③分散质粒子直径在1~100 nm 之间的分散系是胶体。
二、胶体的制备和基本性质 1.氢氧化铁胶体的制备及检验(1)制备实验:在小烧杯中加入25 mL 蒸馏水,加热至沸腾,向沸水中慢慢滴入5~6滴饱和FeCl 3溶液,继续煮沸至溶液呈红褐色,停止加热。
即可得到氢氧化铁胶体。
(2)反应原理:FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
(3)性质与检验用激光笔照射Fe(OH)3胶体,在与光束垂直的方向观察,可看到一条光亮的“通路”,这种现象是由于胶体粒子对光线散射形成的。
这种现象叫做丁达尔效应。
2.胶体的基本性质1.判断正误(正确的打“√”,错误的打“×”) (1)所有分散系均为混合物。
( ) (2)分散质粒子直径介于1~100 nm 的分散系为胶体。
( ) (3)将饱和FeCl 3溶液滴入NaOH 溶液中可形成Fe(OH)3胶体。
( ) (4)Fe(OH)3胶体与Fe 2(SO 4)3溶液可利用丁达尔效应鉴别。
( )[答案] (1)√ (2)√ (3)× (4)√ 2.下列分散系最不稳定的是( )A .向CuSO 4溶液中加入NaOH 溶液得到的分散系B .向水中加入食盐得到的分散系C .向沸水中滴入饱和的FeCl 3溶液得到的红褐色液体D .向NaOH 溶液中通入CO 2得到的无色溶液 [答案] A3.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。