血浆蛋白质检查
- 格式:doc
- 大小:153.50 KB
- 文档页数:13

血浆蛋白结合率测定方法概述血浆蛋白结合率测定方法是一种常用的方法,用于测定药物在血浆中与蛋白结合的程度。
通过测定药物在游离态和结合态的浓度,可以评估药物在体内的运输、分布和代谢情况。
本文将详细介绍血浆蛋白结合率测定方法的原理、步骤和常见应用。
原理血浆蛋白结合率是指药物与血浆中蛋白质结合的比例。
药物结合蛋白后,其在体内的分布和活性会受到影响。
通常,药物结合蛋白的能力由血浆蛋白结合率来衡量,该值可以在体外通过离体试验进行测定。
血浆蛋白结合率的测定方法基于药物与血浆中蛋白质结合形成的平衡。
平衡时,药物分子在游离态和结合态之间动态转化。
测定方法通常采用离体试验,将药物与血浆混合,使其达到平衡。
然后,通过分离游离态和结合态的药物,测量它们的浓度,计算血浆蛋白结合率。
步骤血浆蛋白结合率的测定方法包括以下步骤:1.准备血浆样本:从动物或人体中采集血液样本,并离心制备血浆。
血浆应在低温下保存,避免离心后的样本冻结。
2.混合血浆和药物:将已知浓度的药物与血浆混合,制备不同药物浓度的混合液。
应根据所需测定的药物浓度范围合理选择浓度。
3.平衡:将混合液置于适当的平衡条件下,如恒温摇床或恒温水浴中。
平衡时间取决于药物的特性,一般为数小时。
4.分离游离态和结合态:平衡后,使用适当的方法分离游离态和结合态的药物。
常用的分离方法包括离心、超滤和凝胶过滤等。
5.测量药物浓度:分离后的样品可以通过高效液相色谱法、串联质谱法或放射性测定等方法测量药物浓度。
对于放射性标记的药物,还可以使用放射计数方法。
6.计算血浆蛋白结合率:根据游离态和结合态药物的浓度,计算血浆蛋白结合率。
结合率计算公式为结合态药物浓度除以总药物浓度的百分比。
应用血浆蛋白结合率是评估药物相互作用、药物代谢和毒性的重要指标。
它可以帮助理解药物在体内的活性、分布和排泄情况,为药物的临床应用提供依据。
以下是血浆蛋白结合率测定方法的一些常见应用:1.药物相互作用研究:药物与其他药物或生物分子的相互作用可能影响其结合蛋白能力。

血液生化元素的分析测定方法血液是构成人体的一个非常重要的组成部分,它包含了多种生化元素,如蛋白质、脂肪、糖分、细胞等,这些元素可以反映出身体的健康状态。
因此,血液生化元素的分析测定方法非常重要,可以帮助医生及时发现疾病,对健康的评估和预防也有很大的意义。
一、血液生化元素的分类血液生化元素包括蛋白质、脂肪、糖分、胆红素、酶等,这些元素可以通过化学分析、生物学检测等方法进行分析和测定。
其中,蛋白质是人体中最重要的生化元素之一,它包括多种种类,如白蛋白、球蛋白、免疫球蛋白等。
脂肪是体内储存能量的最主要的物质之一,包括胆固醇、甘油三酯、磷脂等。
糖分是人体能量的主要来源,主要指葡萄糖和果糖等。
胆红素是红细胞的主要代谢产物之一,酶则是人体各种生化反应的催化剂。
二、(一)血浆蛋白质的分析测定血浆蛋白质的分析测定是血液生化分析的基础。
目前,血浆蛋白质的测定方法主要有凝胶电泳、免疫扩散和免疫电泳等三种。
凝胶电泳是测定血浆蛋白质最常用的方法之一,它可以将血浆中的蛋白质分离出来,并根据分离出的蛋白条带比较血浆蛋白的分布情况,从而判断蛋白质异常的类型和数量。
免疫扩散法是一种基于免疫学原理的测定方法,它通过在琼脂凝胶中作用抗原和抗体,使它们互相结合沉淀。
通过比较形成的沉淀带的形态和大小,可以判断血浆蛋白质的种类和数量。
免疫电泳是凝胶电泳和免疫扩散法的结合,它将两种方法相结合,既可以准确分离出不同种类的蛋白质,又可以用染料染色,从而得到更清晰的检测结果。
(二)血液脂质的分析测定血液脂质的分析测定是血液生化分析中的又一重要部分,主要包括胆固醇、甘油三酯等测定。
目前,血浆脂质的测定方法主要有化学测定法和光度法两种。
化学测定法是一种比较常见的测定方法,它利用化学药剂作用于血浆样品中的脂质,转化为可测定的物质,然后通过比色、比重等方法测定样品中的脂质含量。
光度法是一种应用比色法或荧光法测定血脂含量的方法,它可以直接测定比色或荧光度数与标准浓度之间的关系,从而得到血液中脂质的含量。
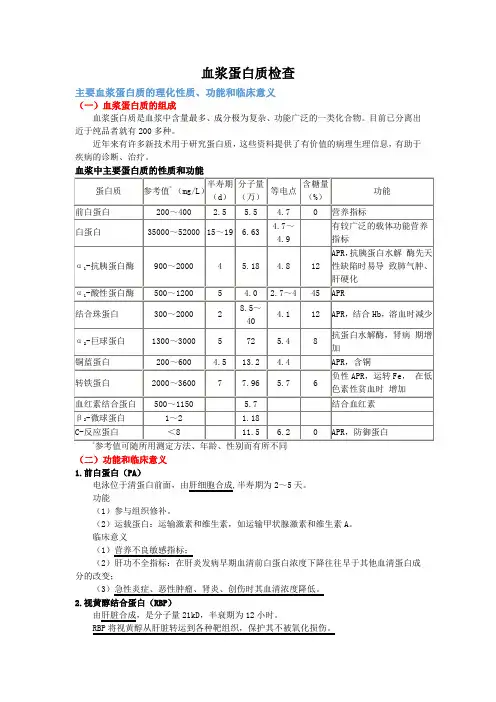
血浆蛋白质检查主要血浆蛋白质的理化性质、功能和临床意义(一)血浆蛋白质的组成血浆蛋白质是血浆中含量最多、成分极为复杂、功能广泛的一类化合物。
目前已分离出近于纯品者就有200多种。
近年来有许多新技术用于研究蛋白质,这些资料提供了有价值的病理生理信息,有助于疾病的诊断、治疗。
参考值可随所用测定方法、年龄、性别而有所不同(二)功能和临床意义1.前白蛋白(PA)电泳位于清蛋白前面,由肝细胞合成,半寿期为2~5天。
功能(1)参与组织修补。
(2)运载蛋白:运输激素和维生素,如运输甲状腺激素和维生素A。
临床意义(1)营养不良敏感指标;(2)肝功不全指标:在肝炎发病早期血清前白蛋白浓度下降往往早于其他血清蛋白成分的改变;(3)急性炎症、恶性肿瘤、肾炎、创伤时其血清浓度降低。
2.视黄醇结合蛋白(RBP)由肝脏合成,是分子量21kD,半衰期为12小时。
RBP将视黄醇从肝脏转运到各种靶组织,保护其不被氧化损伤。
在血浆中RBP与TTR(甲状腺素转运蛋白)以1:1结合,可避免小分子RBP从肾小球滤过。
在靶细胞内,随TTR-RBP复合物的降解,视黄醇被摄入细胞。
3.白蛋白(Alb)Alb由肝细胞合成。
白蛋白是血浆中含量最多的蛋白质,占总蛋白的57%~68%。
功能(1)内源性氨基酸营养源;(2)维持血浆的胶体渗透压;(3)具有酸碱缓冲能力,维持血浆的正常pH;(4)运输和储存作用:是血浆中主要的非特异性载体。
可运输许多水溶性差的物质如胆红素、胆汁酸盐、前列腺素、类固醇激素、金属离子、多种药物等。
因分子量较小,它在血管外体液中的浓度可作为各种膜屏障完整性的良好指标。
临床意义(1)个体营养状态的评价指标。
(2)血浆蛋白质浓度明显下降时,可以影响一些内源性的代谢物、激素和外源性的药物在血液循环中的存在形式。
(3)血浆的清蛋白增高较少见,血液浓缩如严重脱水、休克、饮水不足等。
(4)浓度降低见于①白蛋白合成降低,如急、慢性肝病;②营养或吸收不良;③组织损伤或炎症引起的白蛋白分解代谢增加如大面积组织损伤;④消耗性疾病(恶性肿瘤,严重感染等);⑤白蛋白异常丢失,如肾病综合征、慢性肾炎等;⑥白蛋白分布异常,如有门静脉高压腹水时;⑦遗传性疾病等。

血浆蛋白质检查题库1-1-8问题:[单选,A2型题,A1A2型题]下列关于前清蛋白的描述,正确的是()A.是维持血浆渗透压最主要的蛋白质B.血清中的参考范围为200~400mgmlC.对T4的亲和力比T3大D.在醋酸纤维素薄膜电泳中显示在清蛋白的阳极侧E.半寿期很长维持血浆渗透压最主要的蛋白质是清蛋白;参考范围为200~400mgmL;对T4的亲和力比T3大;半寿期很短。
选项A、B、C、E都错,就是因为前清蛋白电泳在清蛋白之前(即阳极侧),故称之前清蛋白。
问题:[单选,A2型题,A1A2型题]下列关于清蛋白生理功能的描述,错误的是()A.具有运输胆红素的功能B.维持血浆胶体渗透压C.作为组织修补材料D.也可运输青霉素E.在血液偏酸性时,其氨基和羧基分别以-NH2和-COO-形式存在在血液偏碱性时,其氨基和羧基分别以-NH2和-COO-形式存在。
问题:[单选,A2型题,A1A2型题]下列关于清蛋白的描述,正确的是()A.具有运输胆红素的功能B.分子结构中含氨基酸残基的个数为850个C.分子结构中含二硫键的个数为13个D.不能运输青霉素E.在血液偏酸性时,其氨基和羧基以-NH2和-COO-形式存在清蛋白分子结构中含氨基酸残基的个数为580个;含二硫键的个数为17个;能运输青霉素;在血液偏碱性时,其氨基和羧基以-NH2和-COO-形式存在。
选项B、C、D、E都错误。
在胆红素代谢中,间接胆红素的运输主要靠清蛋白,这也是清蛋白功能之一,即载体蛋白。
(安徽11选5 )问题:[单选,A2型题,A1A2型题]下列对血清蛋白质正常范围叙述错误的是().A.白蛋白正确范围为35~50gLB.球蛋白正确范围为大于60gLC.总蛋白正确范围为60~80gLD.白蛋白/球蛋白比值为1.5~2.5:1E.α1抗胰蛋白酶范围为小于500gL球蛋白的含量是通过血清总蛋白测定值减去血清清蛋白测定值计算的。
临床通常用AG比值来衡量肝脏疾病的严重程度。

血浆蛋白电泳血浆蛋白电泳是一种常用的临床检查方法,用于检测血浆中蛋白质的种类和数量,以帮助医生诊断疾病。
血浆蛋白电泳的原理是利用电泳技术将血浆中的蛋白质分离出来,然后根据它们的电荷、大小和形状等特性进行分类和定量。
血浆蛋白是人体内最重要的蛋白质之一,它们在维持人体内环境平衡、免疫防御、输送营养物质等方面发挥着重要作用。
血浆蛋白分为五种:白蛋白、α1球蛋白、α2球蛋白、β球蛋白和γ球蛋白。
每种蛋白质的含量和比例都有一定的范围,如果出现异常,就可能提示某些疾病的存在。
血浆蛋白电泳的操作步骤比较简单,首先需要采集患者的血液样本,然后将血浆分离出来。
接着,将血浆样本加入到电泳胶中,然后通过电场作用,将蛋白质分离出来。
最后,使用染色剂对蛋白质进行染色,然后通过观察染色带的位置和强度,来判断血浆中蛋白质的种类和数量。
血浆蛋白电泳在临床上有着广泛的应用,可以用于诊断多种疾病,如肝病、肾病、免疫系统疾病、恶性肿瘤等。
例如,如果血浆中γ球蛋白含量增高,就可能提示患者患有恶性肿瘤或免疫系统疾病。
如果血浆中白蛋白含量降低,就可能提示患者患有肝病或肾病等。
需要注意的是,血浆蛋白电泳虽然是一种常用的检查方法,但它并不能确定具体的疾病诊断,只能作为辅助诊断手段。
因此,在进行血浆蛋白电泳检查时,医生还需要结合患者的病史、体征和其他检查结果来进行综合分析和判断。
总之,血浆蛋白电泳是一种简单、快速、准确的临床检查方法,可以帮助医生诊断多种疾病。
但需要注意的是,它只能作为辅助诊断手段,不能单独用于诊断疾病。
因此,在进行血浆蛋白电泳检查时,需要结合其他检查结果进行综合分析和判断,以确保诊断的准确性和可靠性。

血浆蛋白质检查一、主要血浆蛋白质的理化性质、功能和临床意义(一)血浆蛋白质的组成包括前白蛋白、白蛋白、α1-抗胰蛋白酶、α1-酸性糖蛋白、结合珠蛋白、α2-巨球蛋白、铜蓝蛋白、转铁蛋白、β2-微球蛋白、C-反应蛋白。
(二)功能和临床意义1.前清蛋白(PA):又称前白蛋白。
由肝细胞合成,其半寿期很短,仅约2~5天。
(1)功能1)参与组织修补。
2)运载蛋白:运输激素和维生素,如运输甲状腺激素和维生素A。
(2)临床意义1)营养不良指标。
2)肝功不全指标:在肝炎发病早期血清前白蛋白浓度下降往往早于其他血清蛋白成分的改变。
3)急性炎症、恶性肿瘤、肾炎时其血清浓度降低。
2.清蛋白(Alb)由肝实质细胞合成,是血浆中含量最多的蛋白质,占血浆总蛋白的57%~68%。
(1)功能①内源性氨基酸营养源;②维持血液正常pH;③血浆中主要的非特异性载体,可运输许多水溶性差的物质如胆红素、胆汁酸盐、前列腺素、类固醇激素、金属离子、多种药物等;④维持血液胶体渗透压。
(2)临床意义1)个体营养状态的评价指标:医学认定水平:Alb>35g/L时正常(人卫教材有误,按此数值记忆);28~34g/L轻度缺乏;21~27g/L 中度缺乏;<21g/L严重缺乏。
当清蛋白浓度低于28g/L时,会出现水肿。
2)在血浆蛋白质浓度明显下降的情况下,可以影响许多配体在血循环中的存在形式,包括内源性的代谢物、激素和外源性的药物。
3)浓度升高:严重脱水、休克、饮水不足时。
4)浓度降低摄入不足(营养不良)合成障碍(慢性肝病)消耗增大(恶性肿瘤、甲亢、重症结核等)丢失增多(肾病综合征、严重烧伤、急性失血、组织炎症等)白蛋白分布异常(门静脉高压腹水)先天性白蛋白缺乏症(罕见)3.α1-酸性糖蛋白(AAG):又称血清类黏蛋白,包括等分子的己糖、己糖胺和唾液酸。
临床意义:主要作为急性时相反应的指标。
增高:风湿病、恶性肿瘤及心肌梗死患者常增高。
降低:在营养不良、严重肝损害等情况下。

蛋白s检测结果解读
蛋白S检测结果是根据实验室对蛋白S水平进行测量得出的。
蛋白S是一种血浆蛋白质,它在凝血过程中起着重要的作用。
蛋白S的水平通常用于评估凝血功能和深静脉血栓形成的风险。
检测结果一般以数字或者百分比的形式呈现,可以分为正常范围、偏低或偏高。
如果蛋白S的水平在正常范围内,意味着凝血功能正常,并
且深静脉血栓形成的风险较低。
如果蛋白S的水平偏低,可能表示存在一些疾病或病理状态,如蛋白S缺乏症、自身免疫疾病等。
蛋白S偏低可能会增加
深静脉血栓形成的风险。
如果蛋白S的水平偏高,可能是由于一些炎症性疾病、使用
雌性激素药物等引起。
蛋白S偏高一般没有临床意义,但在
某些特定情况下可能需要进一步的评估。
需要注意的是,蛋白S的水平受到许多因素的影响,例如年龄、性别、孕期、药物治疗等,因此需要结合临床病史和其他检查结果来综合评估。
如果有任何疑问或需要进一步解读,请咨询相关医生或专业人士。


血浆蛋白检测的简介1.急性炎症(Lp(a)、CRP、α1酸性糖蛋白AAG、触珠蛋白HPT、铜兰蛋白CER、α1抗胰蛋白酶、纤维蛋白原、血清淀粉样蛋白A)在炎症和组织坏死时,血浆某些蛋白质会出现特征性变化,称为急性时相反应蛋白。
分为五类:1。
参与抑制蛋白酶作用的急性时相反应蛋白(如α1抗胰蛋白酶)。
2。
参与血凝与纤溶的急性时相反应蛋白(如凝血因子VIII、纤维蛋白原、纤溶酶原等)。
3。
属于补体成分的急性时相反应蛋白。
4。
参与转运的急性时相反应蛋白(如血浆铜兰蛋白等)。
5。
其他多种急性时相反应蛋白(如CRP、纤维连接蛋白、血清淀粉样蛋白A等)Lp(a)被认为是最敏感的急性时相反应蛋白,在急性心肌梗塞、外科手术和炎症时呈高值。
高浓度Lp(a)是动脉硬化(AS)性心血管病的独立危险因素。
肾病患者高Lp(a)促进肾病的发展,是肾病患者动脉粥样硬化发生的危险指标。
CRP是一种急性期反应蛋白,能激活补体,促进吞噬并具有其他免疫调控作用。
在各种急性和慢性感染、组织损伤、恶性肿瘤、心肌梗塞、手术创伤、放射性损伤等时,CRP在病后数小时迅速升高,病变好转又迅速降至正常。
此反应不受放疗、化疗及皮质激素治疗影响。
HPT在肝功能损伤致合成障碍时其含量明显下降。
烧伤、组织坏死和因肾病综合征引起的大量蛋白丢失时,CPT可增高。
CER严重低蛋白症、肾病综合征、严重肝病、原发性胆汁性肝硬化及原发性胆闭锁时,CER含量会明显下降。
肝豆状核变性患者CER明显降低是一项有价值的诊断指标。
在感染炎症时,CER增高,但在炎症受到控制后,此种增高会导致一过性的低水平,必要时作一系列测定。
CER增高也见于转移性肝癌、胆石症、肿瘤引起的胆道阻塞,妊娠后3个月及口服避孕药。
2.类风湿性关节炎的检测(抗O、类风湿因子RF、CRP、Adnase B)类风湿因子是抗变性的IgG的抗体。
常见于类风湿性关节炎病人的血清和滑膜液中。
其定量测定是判断类风湿性关节炎病人免疫应答和观察抗风湿治疗效果的一个重要指标。

血浆蛋白电泳的临床意义
血浆蛋白电泳是一种常见的临床检验方法,用于评估血液中不同种类蛋白质的含量和分布情况。
这些蛋白质包括白蛋白、球蛋白、β-球蛋白、γ-球蛋白等等。
血浆蛋白电泳可以通过检查这些蛋白质在血液中的比例和分布情况,来确定患者的健康状况和疾病诊断。
以下是血浆蛋白电泳在临床中的一些常见应用:
1. 诊断血液病和肿瘤:血浆蛋白电泳可以检测血液中的蛋白质含量和分布情况,有助于诊断血液病和肿瘤。
例如,多发性骨髓瘤患者的γ-球蛋白含量通常会升高。
2. 评估肝功能:肝脏是合成蛋白质的重要器官,血浆蛋白电泳可以评估肝功能。
例如,白蛋白是肝脏合成的主要蛋白质,肝功能不良时白蛋白含量会降低。
3. 检测感染和炎症:感染和炎症会导致血液中蛋白质含量和分布的改变。
因此,血浆蛋白电泳也可以用于检测感染和炎症的存在和程度。
4. 评估营养状态:营养不良会导致血液中蛋白质含量的降低,血浆蛋白电泳可以用于评估患者的营养状况。
总之,血浆蛋白电泳是一种简单而有效的临床检验方法,可以用于诊断疾病、评估健康状况和监测治疗效果。
- 1 -。

第八章血浆蛋白质的测定第一节概述一、血浆蛋白质的组成及功能血浆蛋白质是血浆固体成份中含量最多、组成复杂、功能广泛的一类化合物。
占血浆固体成份90%左右,目前已经研究的血浆蛋白质有300多种,分离出的纯品约100来种,除免疫球蛋白外,主要由肝细胞合成,主要功能。
1. 维持血浆胶体渗透压;清蛋白。
2. 作为某些物质的载体,起运输作用;如清蛋白能与多种物质结合(FA、胆红素),某些球蛋白具特异地运输某些物质的功能,运铁蛋白、运皮质醇蛋白。
3. 维持体液pH恒定;血浆蛋白pI一般都小于7.4是弱酸,一部分以弱酸盐形式存在,构成缓冲对。
4. 免疫功能;血浆中许多具有免疫功能的球蛋白,主要由浆细胞合成,电泳时位于γ区带,如IgG、IgA、IgM、IgD、IgE,此外,还有具有免疫作用的非特异球蛋白,如补体。
5. 凝血与纤溶作用;凝血与纤溶是一对矛盾的统一、凝血因子与纤溶因子绝大部分是血浆蛋白质,它们促进血液凝固,防止血液流失和溶解血栓,防止重要脏器的动脉栓塞。
6. 营养作用;血浆蛋白质可分解成AA,用于合成组织蛋白或氧化供能。
7. 催化作用;血浆中有许多酶类,其中部分在血浆中发挥作用,称血浆功能性酶,如凝血酶原、纤溶酶原、铜蓝蛋白、LPL、LCAT、肾素等。
二、个别血浆蛋白质(一)前白蛋白(prealbumin,PA)分子量5.4万,由肝细胞合成,电泳时移动速度较白蛋白快,位于其前方面得名,半寿期短12h,PA是一类运载蛋白,一种能与甲状腺素结合,称为甲状腺结合蛋白,一种能与VitA结合,称为VitA 结合蛋白,常用测定方法是免疫学方法,正常参与范围0.2~0.4g /L,急性炎症,恶性肿瘤,肝硬化或肾炎时下降。
(二)白蛋白(albumin,Alb)分子量66458,由肝实质细胞合成,半寿期15~19天,是血浆中含量最多的蛋白质,占40%~60%,主要功能,维持血浆胶体渗透性,缓冲作用,运输作用,营养作用,调节某些激素或药物活性。
血浆蛋白结合率测定方法引言血浆蛋白结合率是指药物在血浆中与蛋白质结合的比例,它对药物的药效、药代动力学和药物相互作用等方面具有重要的影响。
因此,准确测定血浆蛋白结合率对于药物研发、药物治疗和临床用药具有重要意义。
本文将介绍常用的血浆蛋白结合率测定方法。
方法一:离体血浆蛋白结合率测定法离体血浆蛋白结合率测定法是最常用的方法之一。
该方法利用离体血浆,即从人体采集血液样本后,在离体条件下进行实验测定。
具体步骤如下:1. 采集血液样本:在严格的无菌条件下,采集人体血液样本,并将其离心分离得到血浆。
2. 加入药物:将待测药物加入血浆中,使其与血浆中的蛋白质结合。
3. 分离游离药物:通过离心等方法,将游离的药物与结合的药物分离开来。
4. 测定结合率:测定分离得到的游离药物和总药物的浓度,计算血浆蛋白结合率。
方法二:体外血浆蛋白结合率测定法体外血浆蛋白结合率测定法是在体外条件下进行的实验测定。
相比于离体法,该方法更接近实际体内情况。
具体步骤如下:1. 准备血浆样本:将采集的血液样本离心分离得到血浆。
2. 加入药物:将待测药物加入血浆中,使其与血浆中的蛋白质结合。
3. 分离游离药物:通过超滤或离心等方法,将游离的药物与结合的药物分离开来。
4. 测定结合率:测定分离得到的游离药物和总药物的浓度,计算血浆蛋白结合率。
方法三:体内血浆蛋白结合率测定法体内血浆蛋白结合率测定法是在活体动物体内进行的实验测定。
该方法可以更真实地反映药物在体内的结合情况。
具体步骤如下:1. 给予药物:将待测药物给予实验动物,使其进入动物体内。
2. 采集血液样本:在一定时间内,采集动物的血液样本,并分离得到血浆。
3. 分离游离药物:通过超滤或离心等方法,将游离的药物与结合的药物分离开来。
4. 测定结合率:测定分离得到的游离药物和总药物的浓度,计算血浆蛋白结合率。
方法比较与应用以上三种方法各有优缺点,适用于不同的研究目的和实验条件。
离体法操作简单,适用于初步筛选药物结合率;体外法更接近体内情况,适用于药物代谢动力学研究;体内法最贴近实际情况,适用于药物临床前研究。
低蛋白血症诊断标准低蛋白血症是指血浆蛋白质含量低于正常范围的一种疾病,通常包括白蛋白和球蛋白两种蛋白质。
低蛋白血症可能是由于营养不良、肝功能不全、肾脏疾病、炎症或其他慢性疾病引起的。
正确诊断低蛋白血症对于治疗和预防并发症至关重要。
本文将介绍低蛋白血症的诊断标准,帮助临床医生准确诊断和治疗这一疾病。
1. 临床表现。
低蛋白血症患者通常会出现全身性水肿、浮肿、肌肉萎缩、疲劳、贫血等症状。
这些症状是由于血浆蛋白质含量不足,导致血管内外液体平衡失调所致。
临床医生可以通过患者的症状来初步判断是否存在低蛋白血症。
2. 实验室检查。
诊断低蛋白血症的关键是通过实验室检查来确定血浆蛋白质含量。
通常情况下,正常成年人的血浆总蛋白质浓度应该在60-80 g/L之间,而白蛋白的含量应该占总蛋白质的60-65%。
如果患者的血浆蛋白质含量低于正常范围,且伴有相关症状,就可以初步诊断为低蛋白血症。
3. 病因诊断。
除了确定血浆蛋白质含量低于正常范围之外,临床医生还需要进行进一步的检查,以确定低蛋白血症的具体病因。
这可能包括肝功能检查、肾功能检查、炎症指标检查等。
通过这些检查,可以确定低蛋白血症是由于营养不良、肝肾功能不全还是其他慢性疾病引起的。
4. 诊断标准。
根据临床和实验室检查的结果,可以初步诊断低蛋白血症。
但为了进一步明确病因和制定治疗方案,临床医生需要综合考虑患者的临床表现和实验室检查结果,结合病史和病因诊断,最终确定诊断。
总之,低蛋白血症的诊断需要综合临床表现和实验室检查结果,通过排除其他可能的疾病,最终确定诊断。
正确的诊断对于治疗和预防低蛋白血症及其并发症至关重要。
希望本文能够帮助临床医生更好地诊断和治疗低蛋白血症。
血浆纤维蛋白原的检测方法引言:血浆纤维蛋白原是一种重要的血液凝血因子,在人体中起着至关重要的作用。
检测血浆纤维蛋白原的水平可以帮助医生判断炎症、凝血功能异常、心血管疾病等疾病的风险,从而指导临床诊断和治疗。
本文将介绍几种常见的血浆纤维蛋白原检测方法。
一、免疫测定法免疫测定法是一种常用的血浆纤维蛋白原检测方法。
该方法利用特异性抗体与纤维蛋白原结合,形成抗原-抗体复合物,然后通过染色、荧光或酶标记等方式进行定量分析。
免疫测定法的优点是灵敏度高、结果准确可靠,但也存在一定的局限性,如受到其他因素的影响可能导致假阳性或假阴性结果。
二、凝血时间测定法凝血时间测定法是一种简单而常用的血浆纤维蛋白原检测方法。
该方法通过观察血浆样品在特定条件下的凝血时间来判断纤维蛋白原的水平。
通常采用的方法是添加活化的凝血酶,观察血浆样品凝固的时间。
凝血时间的延长可能意味着纤维蛋白原水平的降低。
三、电泳测定法电泳测定法是一种能够分离不同蛋白质的方法,也可以用于血浆纤维蛋白原的检测。
该方法通过在电场中对血浆样品进行分离,根据纤维蛋白原在电泳过程中的迁移速度来确定其水平。
电泳测定法可以提供纤维蛋白原的定量分析,但需要复杂的设备和操作技术。
四、DNA测定法近年来,一种新的血浆纤维蛋白原检测方法——DNA测定法逐渐被应用于临床实践。
该方法利用纤维蛋白原与DNA相互作用的特性,通过测定DNA与纤维蛋白原结合后的信号变化来确定纤维蛋白原的水平。
相比传统的免疫测定法,DNA测定法具有更高的灵敏度和准确性。
五、质谱测定法质谱测定法是一种高分辨率的检测方法,可以用于血浆纤维蛋白原的定量和定性分析。
该方法通过将血浆样品中的纤维蛋白原分离和离子化,然后根据质量-电荷比对其进行测定。
质谱测定法具有高灵敏度和高特异性的特点,可以同时检测多种蛋白质。
结论:血浆纤维蛋白原的检测方法多种多样,每种方法都有其独特的优点和适用范围。
在临床实践中,医生根据具体情况选择合适的检测方法进行血浆纤维蛋白原的检测,以辅助疾病的诊断和治疗。
血浆纤维蛋白原检测方法引言:血浆纤维蛋白原是一种由肝脏合成的蛋白质,它在血液凝固过程中起着重要的作用。
血浆纤维蛋白原检测是一种常见的临床检验方法,用于评估凝血功能和检测凝血系统疾病。
本文将介绍血浆纤维蛋白原检测的方法和意义。
一、血浆纤维蛋白原的生理功能血浆纤维蛋白原是血液凝固过程中的关键因子之一,它参与形成血栓的过程。
当血管受损时,血浆中的纤维蛋白原被激活,转变为纤维蛋白,形成血栓,起到止血的作用。
同时,血浆纤维蛋白原还可以参与炎症和免疫反应等生理过程。
二、血浆纤维蛋白原检测的方法1. 免疫测定法免疫测定法是目前常用的血浆纤维蛋白原检测方法之一。
该方法利用特异性抗体与纤维蛋白原结合,形成免疫复合物,再利用酶标记法或放射免疫测定法进行定量分析。
免疫测定法可以准确、快速地检测血浆纤维蛋白原水平,是临床上常用的检测方法。
2. 凝血时间法凝血时间法是一种常见的血浆纤维蛋白原定性检测方法。
该方法通过观察血浆与凝血试剂的凝固时间来判断纤维蛋白原水平。
通常,凝血时间延长表明纤维蛋白原水平降低,凝血功能异常。
三、血浆纤维蛋白原检测的意义1. 评估凝血功能血浆纤维蛋白原检测是评估凝血功能的重要指标之一。
纤维蛋白原水平的变化可以反映凝血系统的活性和功能状态,有助于判断凝血异常的原因和程度。
2. 检测凝血系统疾病血浆纤维蛋白原水平的异常可以提示凝血系统疾病的存在。
例如,纤维蛋白原水平降低可能与出血性疾病相关,而纤维蛋白原水平升高可能与血栓性疾病相关。
3. 指导临床治疗血浆纤维蛋白原检测结果可以为临床治疗提供有价值的参考。
例如,在手术前进行血浆纤维蛋白原检测可以评估患者的凝血功能,指导手术方案的选择和术后抗凝治疗的监测。
四、血浆纤维蛋白原检测的注意事项1. 标本采集血浆纤维蛋白原检测需要抽取静脉血标本,因此需要正确采集和保存血液样本。
采集时应注意避免血液污染和凝血,避免对结果的影响。
2. 结果解读血浆纤维蛋白原检测结果应结合临床病史和其他检查结果进行综合分析和解读。
血浆总蛋白测定方法
血浆总蛋白的测定方法有多种,以下列举其中一些常用的方法:
1. 凯氏定氮法:血清中蛋白质及非蛋白含氮化合物经硫酸作用后变成铵,后者用酚-次氯酸盐试剂显色后测定总氮。
总氮减去非蛋白氮,最后再换算成蛋白含量。
2. 比色法:
双缩脲比色法:通过双缩脲比色法来测定血清总蛋白含量,目前是临床实验室的常规方法。
方法操作简便,主要是根据蛋白质中的肽键在碱性溶液中能与铜离子作用产生紫红色络合物,这种颜色反应强度在一定浓度范围内与蛋白质含量成正比,经与同样处理的蛋白质标准液比较,即可求得蛋白质含量。
酚试剂比色法:主要基于蛋白分子中含有酪氨酸和色氨酸而使用的测定方法。
由于各种蛋白质分子中上述两种氨基酸的组成比例不同,因此灵敏度较高,适用于测定蛋白质含量较少的标本(如脑脊液),但试剂反应易受还原性化合物糖类、酚类及多种药物如水杨酸、氯丙嗪和某些磺胺药的干扰。
3. 紫外分光光度法:主要采用280nm和215/225紫外吸收值,计算蛋白质含量。
4. 散射比浊法:用某些酸类(如二氯醋酸、磺基水杨酸等)和血清蛋白质结合产生沉淀,然后测定其浊度,与同样处理的蛋白标准液比较,即可求得蛋白质含量。
以上方法仅供参考,实际应用时需根据具体的实验条件和要求选择合适的方法。
一、概述血浆蛋白是人体内非常重要的一类物质,它包括白蛋白、球蛋白等多种成分,对于人体的生理功能具有重要作用。
血浆蛋白的生物化学检测方法显得尤为重要,它可以为临床诊断和治疗提供重要的参考依据。
本文将重点介绍常用的血浆蛋白质生物化学检测方法,以期为相关领域的专业人士提供参考。
二、选择适当的生物化学检测方法1. 蛋白质定量实验:蛋白质定量实验是血浆蛋白检测的基础性实验,常用的方法有比色法、紫外吸收法等。
在进行蛋白质定量实验时,需要选择适合的方法,确保获得准确的检测结果。
2. SDS-PAGE分离技术:SDS-PAGE分离技术是一种常用的蛋白质检测方法,它可以将蛋白质按照大小分离出不同的条带,通过电泳移动速度的差异来鉴定不同蛋白质的分子量和浓度。
3. Western blotting技术:Western blotting技术可以用于检测特定蛋白质在血浆中的表达情况,通过特定抗体的结合来对目标蛋白进行定性和定量分析。
三、生物化学检测方法的步骤和注意事项1. 样品的准备:在进行血浆蛋白质生物化学检测前,需要对样品进行合理的处理和储存,避免蛋白质的降解和变性,从而影响检测结果的准确性。
2. 选择合适的实验条件:不同的血浆蛋白质生物化学检测方法需要在不同的实验条件下进行,包括温度、pH值、电泳缓冲液等,选择合适的实验条件对于获得准确的结果至关重要。
3. 控制实验质量:实验过程中需要严格控制各项实验条件,避免实验误差对结果产生不良影响,同时需要进行多次重复实验以确保结果的可靠性。
四、常见问题及解决方法1. 实验中出现异常条带:在进行SDS-PAGE分离实验时,有时会出现异常的条带,可能是由于样品处理不当或实验条件设置不当造成的,解决方法是重新处理样品或调整实验条件,进行再次实验。
2. Western blotting实验结果不稳定:Western blotting实验结果不稳定可能是由于抗体稀释不当或膜的处理不当造成的,解决方法是重新稀释抗体并进行实验前对膜的处理进行严格控制。
本章考点1.主要血浆蛋白质的理化性质、功能和临床意义2.血浆蛋白质测定、参考值及其临床意义3.急性时相反应蛋白(1)概念、种类(2)急性时相反应蛋白在急性时相反应进程中的变化特点及临床意义第一节主要血浆蛋白质的理化性质、功能和临床意义一、蛋白质的一般理化性质(一)两性电离和等电点蛋白质是两性电解质,其解离程度取决于所处溶液的酸碱度。
1.等电点(pI):使蛋白质解离成阴、阳离子趋势相等时溶液的pH值称为该蛋白质的等电点。
2.电泳带电粒子在电场中向电性相反的电极移动的现象称为电泳。
因不同蛋白质等电点不同,放在同一pH溶液中带电不同,电泳时速度不同,所以电泳是分离蛋白质常用的方法。
体内血浆蛋白pI多在4-6之间,在pH7.4±的血液中带负电荷电泳时从负极向正极移动。
血清蛋白电泳不属于沉淀反应。
(二)蛋白质的胶体性质1.蛋白质是亲水胶体2.蛋白质不能透过半透膜3.扩散与沉降(三)蛋白质的变性1.概念:在某些理化因素作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质改变和生物活性的丧失的现象。
2.造成变性的因素如加热、乙醇尿素等有机溶剂、强酸、强碱、重金属离子及生物碱试剂等。
3.变性特点(1)生物学活性丧失;(2)容易消化;(3)溶解度下降(容易沉淀,但并非所有都沉淀,沉淀并非都变性,如盐析不变性)4.紫外吸收由于蛋白质分子中含有酪氨酸和色氨酸,因此在280nm波长处有特征性吸收峰。
二、血浆蛋白质的组成血浆蛋白质是血浆中含量最多、成分极为复杂、功能广泛的一类化合物。
目前仅已分离出近于纯品者就有200多种。
近年来有许多新技术用于研究蛋白质,这些资料提供了有价值的病理生理信息。
有助于疾病的诊断、治疗。
现将血浆中主要蛋白质的性质及功能列于下表3-4-1。
参考值可随所用测定方法、年龄、性别而有所不同三、功能和临床意义(一)前白蛋白(PA)1.概况分子量为5.4万,电泳时位于清蛋白前面,由肝细胞合成,不含糖。
等电点pI=4.7 半寿期为12小时。
2.功能(1)参与组织修补(2)运载蛋白:运输激素和维生素:如运输甲状腺激素和维生素A。
3.临床意义(1)营养不良指标;(2)肝功不全指标:在肝炎发病早期血清前白蛋白浓度下降往往早于其他血清蛋白成分的改变;(3)急性炎症、恶性肿瘤、肾炎、创伤时其血清浓度降低。
(二)白蛋白(Alb)1.概况Alb由肝实质细胞合成,是不含糖的单链多肽。
白蛋白是血浆中含量最多的蛋白质,占血浆蛋白质总量的40%~60%。
分子量为66.4KD,由585个氨基酸残基构成的。
半寿期约15 -19天。
2.功能(1)营养作用;(2)维持血浆的胶体渗透压;(3)维持血浆的正常pH;(4)运输和储存作用:是血浆中主要的非特异性载体。
可运输许多水溶性差的物质如胆红素、胆汁酸盐、前列腺素、类固醇激素、金属离子、多种药物等等因分子量较小,它在血管外体液中的浓度可作为各种膜屏障完整性的良好指标。
3.临床意义(1)浓度降低摄入不足(营养不良)合成障碍(慢性肝病)消耗增大(恶性肿瘤、甲亢、重症结核等)丢失增多(肾病综合症、严重烧伤、急性失血、组织炎症等)各种原因导致的血液稀释及分布异常先天性白蛋白缺乏症(罕见)(2)浓度升高一般为假性升高:血液浓缩如严重脱水、休克、饮水不足等。
(3)个体营养状态的评价指标:Alb>35g/L正常;28~34g/L轻度缺乏;21~27g/L中度缺乏;<21g/L严重缺乏。
当清蛋白浓度低于28g/L时,会出现水肿。
在血浆蛋白质浓度明显下降的情况下,可以影响许多配体在血循环中的存在形式,包括内源性的代谢物、激素和外源性的药物。
已发现有20种以上白蛋白的遗传性变异。
习题1.血浆白蛋白不具有的功能是A.维持胶体渗透压B.参与维持血浆的正常pHC.运输某些物质D.营养作用E.免疫功能[答疑编号111040101:针对该题提问]『正确答案』E(三)α1-酸性糖蛋白(AAG)α1-酸性糖蛋白包括等分子的己糖、己糖胺和唾液酸是主要的急性时相反应蛋白,与抗体的免疫防御功能有关。
临床意义:α1-酸性糖蛋白的测定目前主要作为急性时相反应的指标。
增高:在风湿病、恶性肿瘤及心肌梗死患者亦常;降低:在营养不良、严重肝损害等情况下。
在急性时相反应或用类固醇皮质激素治疗时,由于α1-酸性糖蛋白含量升高,结合以上药物的能力增强而干扰药物的有效作用。
(四)α1-抗胰蛋白酶(AAT)1.概况肝脏合成,含糖12%。
α1-抗胰蛋白酶是α1-区带显色的主要成份,占90%左右。
2.功能是血液中最主要的蛋白酶抑制剂,可抑制多种蛋白酶的活性.,占血清中抑制蛋白酶活力的90%左右。
一般认为α1-抗胰蛋白酶的主要功能是对抗由多形核白细胞吞噬作用时释放的溶酶体蛋白水解酶。
3.临床意义(1)浓度升高:见于急性炎症、外科手术(急性时相反应蛋白)。
长期服用可的松、雌激素等药物也可升高。
(2)降低:可见于胎儿呼吸窘迫症。
α1-抗胰蛋白酶缺陷可引起肝细胞的损害而致肝硬化,严重的遗传性缺陷常伴有早年(20~40岁)肺气肿。
(五)血红素结合蛋白(Hp)1.概况:血红素结合蛋白也称结合珠蛋白、触珠蛋白。
为一种含糖量12%的糖蛋白。
是肝脏合成的一种急性时相反应蛋白。
半寿期为5天。
2. 功能:在血浆中结合游离的血红蛋白,防止其由肾脏丢失,有效的保留铁。
一分子Hp结合两分子Hb,结合不可逆。
Hb-Hp复合物半寿期90分钟,Hp是5天,肝细胞能迅速将复合物从血浆中清除。
3.临床意义:(1)急性时相反应时浓度增加。
(2)烧伤、肾病综合症引起大量Alb丢失,可使其含量升高。
(3)溶血性疾病如溶血性贫血、输血反应、疟疾时,Hp含量明显下降。
正常参考范围宽,连续观察用于监测急性时相反应,如溶血是否处于进行状态。
(4)严重肝病患者Hp合成降低。
(六)α2-巨球蛋白(α2-MG或AMG)1.概况:分子量为62.5~80万,是血浆中分子量最大的蛋白质。
由肝细胞与单核吞噬细胞系统合成。
含糖量为8%。
半寿期为5天。
2.功能:与不少蛋白水解酶结合影响这些酶的活性,选择性保护某些蛋白酶的活性,可能与免疫反应有关,与淋巴网状系统细胞的发育和功能有关。
3. 临床意义:升高:见于低白蛋白血症(代偿,保持血浆渗透压);妊娠、口服避孕药也可使其升高。
降低:胰腺炎及前列腺癌时含量降低。
婴幼儿及儿童血浆α2-巨球蛋白含量约为成人的2倍~3倍,这可能是一种保护机制。
(七)铜蓝蛋白(CER/Cp)1.概况:肝合成的含铜α2-糖蛋白,有基因多型性。
半寿期为4.5天。
2.功能:(1)具有氧化酶的功能(也叫亚铁氧化酶,属血浆功能酶)参与铁代谢,使Fe2+→ Fe3+。
利于Fe3+和运铁蛋白结合,参与体内铁的运输和动员。
也可催化多酚及多胺类物质氧化。
(2)作为铜的载体和代谢库血清中的铜95%存在于CER中,5%以扩散态存在。
细胞可利用血中CER中的铜合成多种含铜的酶。
3. 临床意义:(1)协助诊断Wilson病(肝豆状核变性)Wilson病患者血清总铜浓度不变,铜蓝蛋白含量降低(10ml/dl以下),而伴有血浆可透析的铜(游离铜)含量增加,这是本病的特征。
此病为常染色体隐性遗传,主要由于体内铜代谢障碍所致。
CER也是一种急性时相反应蛋白。
(2)感染、创伤、肿瘤时升高。
(3)肝癌(转移性)、胆石症、肿瘤引起的胆道阻塞、妊娠、口服避孕药时含量升高。
(4)减低见于肾病综合征、严重肝病。
(八)转铁蛋白(TRF)1.概况:转铁蛋白是血浆中主要的含铁蛋白质。
分子量:7.7万。
含糖量:6%。
肝脏合成,半寿期7天。
2.功能:以TRF–Fe3+的形式运输内源性与外源性铁,与成熟红细胞的生成有关。
一分子TRF 可以结合2个Fe3+(1mg运铁蛋白可结合1.3μg铁)。
TRF的浓度受Fe供应的调节,缺铁时TRF升高。
自由铁对机体有害,与TRF结合,还可防止Fe从肾丢失。
3. 临床意义:(1)TRF用于贫血的诊断和治疗监测100ml血清具有结合338μgFe的能力,但通常结合铁仅100μg即铁饱和度为30-38%。
缺铁性低血色素贫血:TRF升高,但铁饱和度降低;再生障碍性贫血:RBC对Fe利用低,TRF下降或正常,但铁饱和度高。
(2)急性时相反应TRF下降,炎症、恶性病变随Alb、PA同时下降。
(3)肾病综合症、营养不良、慢性肝病下降,可作为营养状态指标。
(4)妊娠、口服避孕药或注射雌激素可使TRF升高。
(九)β2-微球蛋白(BMG)1.概况:由淋巴细胞合成的单链多肽,是分子量较低的蛋白质(分子量1.1万)。
不含糖,半寿期为107分钟。
2. 功能:是淋巴细胞表面抗原β链部分,存在于所有有核细胞表面,特别是淋巴细胞和肿瘤细胞表面并由此释放入血。
β2-微球蛋白可透过肾小球,在肾小管几乎全部被重吸收并被完全降解。
3.临床意义:(1)血中浓度升高,见于肾衰、炎症、肿瘤。
(2)临床用于监测肾小管功能:如肾移植后如有排斥反应影响肾小管功能时, 尿中BMG排出量增多。
(3)脑脊液中浓度升高,见于急性白血病和淋巴瘤有神经系统浸润。
(十)C-反应蛋白(CRP)1.概况:C-反应蛋白是一种能与肺炎链球菌细胞壁C多糖体反应的急性时相反应蛋白。
由肝细胞合成,电泳分布β区带。
广泛分布于人体体液中,如胸腹水、心包液、关节液、血液等处。
2.功能:能激活补体,促进吞噬和其他免疫调控。
可抑制血小板凝集和血块收缩。
3.临床意义:是第一个被发现的急性时相反应蛋白。
是急性时相反应的一个极灵敏的指标。
浓度升高:急性心肌梗死、创伤、感染、炎症、外科手术、肿瘤浸润、风湿病时血浆C-反应蛋白浓度在迅速地显著升高可达正常浓度的数千倍。
由于CRP升高是非特异性的,结合临床症状有助于某些疾病病程随访。
特别在炎症过程中,随访风湿病、系统性红斑狼疮、白血病等。
习题2下列不属于运载体类的血浆蛋白质是A.转鉄蛋白B.铜蓝蛋白C.清蛋白D.免疫球蛋白E.前清蛋白[答疑编号111040201:针对该题提问]『正确答案』D第二节血浆蛋白质的测定、参考值、方法评价及其临床意义许多疾病可引起血浆蛋白变化,分析这些变化在临床上有重要价值。
蛋白质测定方式大体可分为:1.用化学法定量测定血清(浆)总蛋白、白蛋白和球蛋白的含量及白蛋白与球蛋白的比例;2.电泳方法将血浆蛋白初步分离,半定量检测主要组分及图谱,并用相对百分比表示;3.用免疫化学法特异测定个别蛋白,如用免疫比浊法测前清蛋白。
通过制备特异的抗血清,测定Ag-Ab复合物,多用试剂盒。
一、血清总蛋白测定方法及临床意义(一)测定方法测定方法较多有:凯氏定氮法:是血浆总蛋白测定的参考方法;双缩脲反应:是推荐方法;紫外吸收法:需要纯度较高;染料结合法、比浊法等。
临床一般采用双缩脲比色法,是蛋白质定量的推荐方法,用于常规检测。