山东省沂源县沂河源学校2020年中考化学《质量守恒定律》复习学案(无答案)
- 格式:doc
- 大小:123.50 KB
- 文档页数:3

《质量守恒定律》复习课教学设计一、教学内容分析本节课选自九年级化学鲁教版教材第五单元化学方程式课题1质量守恒定律。
本节的核心内容即质量守恒定律及其在化学中的应用。
质量守恒定律是初中化学的一个重要化学规律,是分析物质在化学反应中的质量关系的理论依据,其相关知识是书写化学方程式、对化学反应进行定量研究,它的应用贯穿于整个中学化学。
二、复习目标知识与技能:1、理解质量守恒定律,能说明化学反应中的质量关系。
2、能正确书写简单的化学方程式。
3、能根据化学反应方程式进行简单的计算。
过程与方法:在复习中体验科学探究的过程,通过归纳总结形成知识网络。
情感态度价值观:认识定量研究对于化学科学发展的重大作用。
三、复习重难点复习重点:质量守恒定律的探究及应用复习难点:质量守恒定律在具体题型中的应用四、教法:提问、讨论、探究等五、教学过程:《质量守恒定律的应用》复习课导学案知识梳理:一、质量守恒定律的概念:化学反应的各物质的质量总和等于反应后--------的各物质的质量总和。
二、质量守恒的原因(即化学反应的实质):从微观上看不发生改变的是_____________、___________、____________;一定发生改变的是_____________。
举例:从宏观上看不发生改变的是____________、__ ____、___________;一定发生改变的是__________________。
举例:化学反应前后可能发生改变的是。
举例:三、化学方程式书写原则:(1);(2)。
化学方程式的简单计算的解题步骤:(1)设未知量;(2)写出;(3)找出;(4)列出;(5)检查无误后简明写出答案。
探索新知:(质量守恒定律的应用)电解水制取氧气可以用两种方法求解得到氧气质量,为何实验室制取氧气只能用一种方法求解得到氧气质量呢?例如:电解18g水可以得到多少克氧气?用5%68g过氧化氢溶液可以制得多少例1:1.6g某物质在氧气中完全燃烧生成4.4g二氧化碳和3.6g水,关于该物质的组成。

5.1 化学反应中的质量守恒(第1课时)[预习导航]在这我要悄悄地告诉你…… 其实你早就知道了1.镁条燃烧的实验现象:剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体。
2.水分解的微观分析:⑴每个过氧化氢分子由2个氢原子和2个氧原子构成⑵过氧化氢的化学式为H2O2⑶过氧化氢是由过氧化氢分子构成的⑷在化学变化中分子可以再分。
⑸原子是化学变化中的最小粒子⑹化学反应中,原子的种类、个数不变⑺化学反应前后,元素的种类不变。
3.化学反应的实质:化学反应中,构成物质的分子分解成原子,原子重新组合成新分子或直接构成新物质的过程。
在化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有改变。
4.质量守恒定律 (法国化学家拉瓦锡建立了质量守恒定律)⑴内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
⑵关键词:“化学反应”、“参加”、“各物质”、“生成”、“质量总和”;①“化学反应”:质量守恒定律是自然界的一个普遍规律,因此是一切化学反应必然遵守的一个定律,一个变化如果不是化学变化,就无法说明是否遵循质量守恒定律。
物理变化不属于此定律的范畴,因为物理变化前后各物质的种类和质量都没有改变。
②“参加”:是指真正参加了反应的那一部分质量;并不是各物质质量的简单相加,不参加反应的或反应后剩余物质的质量不能计算在内。
③“各物质”:不能遗漏任一反应物或生成物④“生成”:不是反应生成的物质不能算。
生成的不管是气体还是沉淀都包括在内,包括固、液、气三种状态的物质,不要因为生成了气体而误认为质量减小,不符合质量守恒定量⑤“质量总和”是指反应物的质量总和或生成物的质量总和;可知化学变化只能改变物质的种类而不能改变物质的总质量。
⑥“守恒”是指反应前后质量守恒;而不是体积或分子个数;⑶意义:对于定量认识化学反应,合理进行化工生产有重要作用。
⑷质量守恒定律解释现象:①蜡烛燃烧越烧越少,是否违背质量守恒定律,为什么?解析:蜡烛燃烧是蜡烛和氧气反应生成CO2和水,两者进入空气中,所以质量减小②镁带完全燃烧后质量变大,是否违背质量守恒定律,为什么?解析:镁带燃烧,是金属镁和氧气反应生成氧化镁,即参加反应的镁和氧气的质量等于生成物氧化镁的质量,所以氧化镁的质量大于镁的质量。

《质量守恒定律》复习课教案[复习目标]1、知道质量守恒定律的内容,能说明常见化学反应中的质量关系。
2、能从宏观和微观正确理解质量守恒定律,并能用它解释一些简单的现象。
3、能正确进行一些简单的计算。
[复习重点]1、知道质量守恒定律的内容,能说明常见化学反应中的质量关系.2、能从宏观和微观正确理解质量守恒定律,并能用它解释一些简单的现象.[教学过程]一、揭示复习目标导入:议一议目前,全世界都在关注能源问题.有人曾经宣布可以直接把水变成油,一时间引起广泛的关注和争论,你认为水可能变成油吗?为什么?(学生回答)信息交流:在前面,我们学习了“质量守恒定律”,你有什么收获?还有什么不懂的地方?请尽情地、大胆地说出来.提出复习目标:1、知道质量守恒定律的内容,能说明常见化学反应中的质量关系。
2、能从宏观和微观上,正确理解质量守恒定律,并能用它解释一些简单的现象。
3、能正确进行一些相关计算。
二、复习指导复习提纲:1、质量守恒定律的内容是什么?你是怎样理解的?为什么物质在发生化学反应前后,各物质的质量总和相等?2、怎样用实验探究质量守恒定律?3、利用质量守恒定律能正确进行一些相关计算。
三、学生讨论、更正,教师点拨1、学生自由更正,让他们各抒己见.2、引导学生讨论,说出错因和更正的道理。
3、引导学生归纳,上升为理论,指导以后的运用。
对所有学生在自学后都已懂的问题,原则上不教,只有部分学生能解答的问题,先让学生讨论交流,再由教师补充、更正、点评,对于学生不能够解答的问题,可在典型启发的前提下进行精当讲解。
四、考点归纳:质量守恒定律:二变:1、物质种类2、分子种类五不变:1、物质总质量2、元素种类、质量 3、原子种类 4、原子数目5、原子质量应用:1、判断反应物是否全部参加反应2、推断反应物或生成物的组成3、在溶质质量分数计算中的应用五、例题解析(一)、判断反应物是否全部参加反应1、下列叙述正确的是().A、由于“质量守恒",煤燃烧后产生的煤渣的质量一定和所用煤的质量相等。

《质量守恒定律及其应用》复习导学案一、复习目标1.认识质量守恒定律2.能说明化学反应中的质量关系二、知识梳理1. 内容:的各物质的,等于反应后生成的各物质的。
2. 原因:(1)宏观:反应前后的种类、质量不变。
(2)微观:反应前后的种类、数目、质量不变。
3. 应用:(1)根据反应前后物质总质量相等,确定反应中某物质的质量。
(2)根据反应前后元素的种类和质量不变,确定物质的元素组成。
(3)根据反应前后原子的种类和个数不变,确定物质的化学式。
(4)解决化学反应的微观图形题。
(5)解决图表数据分析题。
【特别注意】1. 质量守恒定律只能用来解释化学变化,不能解释物理变化。
2. 质量守恒定律说的是“质量守恒”,不适用于其他方面的守恒。
3. 化学反应中,各物质之间要按一定的质量比相互作用,因此参加反应的各物质的质量总和不是任意比例的反应物质量的简单加和。
4. 牢记在化学反应前后“五个一定不变,两个一定改变,两个可能变”:原子的种类、数目、质量、元素的种类和物质的总质量一定不变;分子的种类、物质的种类一定改变;分子的个数、元素的化合价可能变。
三、重难点突破1.利用反应前后物质总质量相等,确定反应中某物质的质量例1.在反应 A+B=C+D中,10gA和20gB恰好反应生成 5gC,反应生成 D的质量为。
变式训练1.在反应 A+2B=2C+D中,10gA和20gB恰好反应生成 5gC,反应生成 D的质量为。
2.根据反应前后元素的种类和质量不变,推测物质的元素组成:(1)根据反应前后元素种类保持不变例2.(1)某纯净物X在隔绝空气后,分解生成的产物是二氧化碳和水,由此推断该物质一定含有的元素是。
(2)某纯净物Y在氧气中燃烧,产物是二氧化碳和水,由此推断该物质一定含有的元素是。
变式训练2. Al与NaOH溶液反应会生成NaAlO2和一种气体,该气体可能是()A.CO2B.NH3C.H2D.SO2(2)根据反应前后元素种类和质量保持不变例3. 某物质1.6g在足量氧气中完全燃烧后,生成4.4g二氧化碳和3.6g水,通过计算可知,这种物质由元素组成。
《化学方程式》复习学案一、质量守恒定律1、内容参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
【特别提醒】(1)质量守恒定律只能解释化学变化不能解释物理变化。
(2)质量守恒是指物质的“质量”守恒,而非“体积”守恒、“分子个数”守恒。
(3)质量守恒是指参加化学反应的各物质的质量总和与生成的各物质的质量总和相等,不包括未反应的质量,也不包括杂质。
2、微观解释化学反应的过程是参加反应的各物质(反应物)的原子重新组合生成其他物质(生成物)的过程。
在化学反应中,反应前后原子的种类没有改变,数目没有增减,质量也没有变化。
【思考感悟】有气体参加或生成的反应,在探究质量守恒定律时,应注意什么问题?提示:有气体参加或生成的反应在探究质量守恒定律时,需在密闭容器中进行。
3、对质量守恒定律的解读(1)宏观、微观方面的理解可总结为“五个不变”,“两个肯定变”,“两个可能变”。
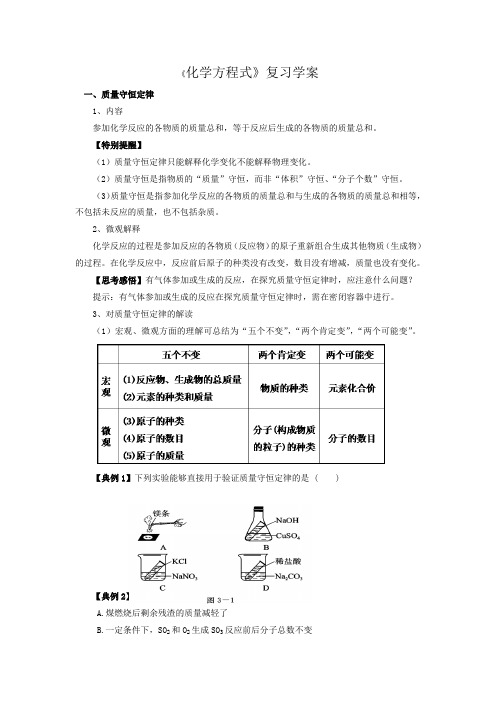
【典例1】下列实验能够直接用于验证质量守恒定律的是 ( )【典例2】下列观点符合质量守恒定律的是( )A.煤燃烧后剩余残渣的质量减轻了B.一定条件下,SO2和O2生成SO3反应前后分子总数不变C.8 g CH4完全燃烧生成8 g CO2D.某有机物在空气中燃烧只生成CO2和H2O,则该有机物一定含有碳、氢、氧元素【典例3】判断下列说法是否正确:1、燃烧的镁带和生成的白色粉末质量相等。
2、3g碳在10g氧气中充分燃烧,生成13g二氧化碳。
二、化学方程式1、定义:用化学式来表示化学反应的式子。
2、意义(1)质的方面:表示反应物、生成物和反应条件。
(2)量的方面宏观:反应物、生成物各物质的质量比;微观:反应物、生成物各物质的微粒个数比。
如反应2H2O2 MnO2 2H2O + O2↑表示的意义为:①宏观:a.质的方面:过氧化氢在催化剂二氧化锰的作用下反应生成水和氧气。
b.量的方面:每68份质量的过氧化氢在催化剂作用下反应生成36份质量的水和32份质量的氧气。

4.3质量守恒定律复习学案【导课】请你辨真伪:汽油、煤油、柴油等燃料油都是从石油中提炼出来的。
其中都含碳元素。
一些人声称他们发明了一种催化剂,只要在水中加入少量这种物质,就可以使普通的水变成燃料油,从而解决世界性的能源问题,这是真的吗?【知识回顾】1.质量守恒定律的内容:在反应中,参加反应的物质质量总和等于2.质量能守恒的原因:微观上原子的、、不变,宏观上元素的、不变;一定变的有、;可能变的有【定律把握】下列叙述完全符合质量守恒定律的是()A.水结成冰前后,质量保持不变B.50mL水和50mL乙醇混合后总体积小于100mLC.在100g过氧化氢溶液中,含有30g过氧化氢和70g水D.煤燃烧后剩余残渣的质量减轻了解析:【应用一】1、在一次化学实验时,小巍发现镁条表面是灰黑色,通过查阅资料,他知道了这层灰黑色物质是碱式碳酸镁【Mg2(OH)2C03】根据所学知识,请你推测镁条一定和空气中的和发生了化学反应,参加该反应的还可能有空气中的。
2. 某可燃物在适量的氧气中燃烧后,生成二氧化碳和水,由此判断该可燃物中一定含有______元素,可能含有______ 元素。
变型(1)(小组讨论完成变型1、2)3。
0克某可燃物在适量的氧气中燃烧后,生成8.8 克二氧化碳和5.4克水,由此判断该可燃物中一定含有___ ___元素。
化学式中各原子个数比为_ __(写出解题过程)变型(2)4.6克某可燃物在适量的氧气中燃烧后,生成8.8 克二氧化碳和 5.4克水,由此判断该可燃物中一定含有___ ___元素。
化学式中各原子个数比为___ _,,测得该可燃物相对分子质量为46,其化学式可能为____________。
这类题型共同的解题依据是:【应用二】(1)反应后D 的质量X 为 g 。
(2)参加反应的物质是 ,反应后生成的物质质量比是 。
A .反应后物质M 的质量为l3gB .物质Q 可能是该反应的催化剂 C.该变化的基本反应类型是分解反应 D .反应中N 、P 的质量比为5:4 3. 将20克甲、5克乙、8克丙三种纯净物混合,在密闭容器中加热发生化学反应,经分析可知:反应后混合物中含有5克甲、16克丙,还含有一种新物质丁,则丁物质的质量是 ( )A. 12gB.9gC.4gD. 17g解析:这类题型共同的解题依据是: 【应用三】1.判断正误:如下图所示反应中参加反应的各物质分子个数比为 4:1:4 ( )2.下图形象表示了A 与 B 反应生成的 C 反应前后分子及其数目的变化,则参加该反应的A B C 的个数之比为( )A .2:1:2B .1:2:2C .1:1:1D .2:2:33 .火箭推进器中盛有液态肼(用X 表示)和双氧水,当它们混合时, 放出大量的热,有关反应可表示为 X+2 H 2O 2 ═N 2 +4 H 2O ,据此判断肼的化学式X 为( ) A .CH 4O B . NH 2 C .N 2H 4O 2 D . N 2H 44、雅安地震发生后,为确保大灾之后无大疫,灾区使用了大量的消毒剂Cl O 2。
《质量守恒定律》专题复习学案【中考考纲要求】1、认识质量守恒定律:能说明常见化学反应中各物质的质量关系2、能用质量守恒定律解释一些常见的化学问题。
3、学会利用质量守恒定律进行定量探究【知识梳理】质量守恒定律1.内容:参加化学反应的各物质的等于反应后生成的各物质的。
2.质量守恒原因:微观:原子的___________、_______________、_____________不变宏观:___________种类不变3.理解质量守恒定律要抓住“四个不变”,“两个一定改变”和“两个可能改变”⑴四个一定不变:原子、原子、原子不变、元素种类不变。
⑵两个一定改变: ______的种类、 _________的种类一定改变。
⑶两个可能改变: ______________、元素的化合价可能改变。
4.质量守恒定律使用时注意的事项:(1)“化学反应”是前提。
质量守恒定律的适用范围是变化,不适用于物理变化,任何化学变化都遵循质量守恒定律。
(2)“参加反应”是基础。
概念中明确指出是“参加反应”的各物质的质量总和,不参加反应的物质质量不能计算在内。
如蜡烛燃烧剩余的石蜡不算在内。
(3)“质量总和”是核心。
无论是参加反应的物质,还是反应后生成的物质,计算时不能漏掉任何一项。
如肉眼看不见的气体也应考虑在内。
(4)“质量守恒”是目的。
定律只适用于“”守恒,不包括体积守恒、分子数守恒等。
5.验证实验:当有气体参加反应或反应有气体生成时,该反应必须在__________容器内进行才能验证质量守恒定律。
【巩固训练】一、求物质的质量[例题1]在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反反应后,甲的“待测”值应为()A.10B.8C.4D.0[对应练习]1、在2A+B=C+2D 的反应中8gA 和6gB 恰好完全反应生成2gC ,则同时得到D 的质量是( )A 、7gB 、14gC 、12gD 、4g: (1) 反应后D 物质的质量是 g 。
质量守恒定律【学习目标】:知识与技能:知道质量守恒定律并初步了解其实质;会用质量守恒定律解释一些简单的现象;过程与方法:通过化学反应实质的分析,发展研究问题的能力和逻辑推理能力;情感态度与价值观:通过对化学反应中反应物及生成物的质量的实验测定,树立辩证唯物主义世界观。
【知识回顾】:1、镁条在空气中燃烧的现象是。
该反应的文字表达式是,此反应属于的基本反应类型是。
2、写出水通电分解的文字表达式属于反应。
从微观上看,在这个化学反应前后,不变的是,变化的是。
〖自学指导〗(一)看课本102页“双氧水的电解”,思考图中两位同学哪位说的对。
(结合图示,提出自己的看法)〖自学指导〗(二)看课本103页,认真观察双氧水分解的图示,并判断哪个更合适?你的依据是____________________________.此反应中,元素种类___________,原子种类_______,原子数目______故原子的总质量,由此可推测,化学反应前后,物质的总质量会_______。
(填“增大”或“减少”或“不变”)〖实验探究〗课本103页,思考如何设计实验方案,掌握设计思路。
〖自学指导〗(三)阅读课本104页,并完成下列内容。
1、质量守恒定律就是化学反应的各物质的质量总和,等于反应后 ______的各物质的。
2、化学反应的过程就是重新组合的过程,在化学反应前后,没有改变,没有增减,也没有改变,所以化学反应前后各物质的质量总和必然。
这就是质量守恒定律的本质。
【小结】:从宏观和微观角度来理解质量守恒定律,并总结一下化学反应前后的“不变”“一定变”“可能变”:元素的种类(),元素的质量(),反应物和生成物的总质量();原子的种类(),原子的质量(),原子的数目();物质的种类()分子的种类();分子的总数(),元素的化合价()。
〖跟踪练习〗:1、 6g碳和16g氧气恰好完全反应生成二氧化碳 g。
4g氢气与 g氧气恰好完全反应生成36g水。
3.2 质量守恒定律【回归教材】知识清单考点1质量守恒定律的理解(5年2考)1.内容:参加化学反应的__________的质量总和,等于反应后____________________。
2.适用范围:一切化学变化(或化学反应),不包括物理变化。
3.实质:化学反应的过程,就是分子分裂成原子,原子重新组合成分子的过程。
在化学反应中,反应前后原子的________没有改变,________没有增减,原子的________也没有改变。
4.理解: 六个“一定不变”{宏观{反应前后物质总质量不变 元素的种类不变 元素质量不变微观{ 原子的种类不变 原子的数目不变原子的质量不变两个“一 定改变” {宏观:物质种类改变微观: 分子的种类改变两个“可 能改变”{宏观:元素的化合价可能改变微观: 分子总数可能改变【易错易混】(1)“参加化学反应的物质的质量”≠“加入的物质的质量”,即没有参加反应的物质的质量不能计入“质量总和”中;同理生成的各物质也不包含最初有的部分。
(2)计算“各物质的质量总和”时注意应把参加反应或生成的物质中气体或沉淀的质量计算在内。
【参考答案】1.各物质生成的各物质的质量总和3.种类数目质量4.元素的种类不变元素质量不变原子的种类不变原子的数目不变原子的质量不变分子的种类改变分子总数可能改变考点2质量守恒定律的应用(5年5考)应用依据1.推断物质的元素组成化学反应中,元素的种类、质量不变2.推断物质的化学式化学反应前后,原子的种类不变、数目不变3.推断反应中的化学计量化学反应前后,原子的数目不变数4.根据质量守恒定律进行参加反应各物质的质量之和,等于生成各物质的质量之和简单计算5.对有关实验现象的解释化学反应前后,物质的总质量不变核心突破重难点、质量守恒定律的应用例题“梦天”实验舱燃烧科学柜采用a作燃料成功实施首次在轨点火实验。
a完全燃烧的微观示意图如图所示。
下列说法错误的是()A.反应前后元素种类不变B.反应前后分子个数不变C.a分子中C、H原子的个数比为1∶4D.反应生成c、d的质量比为22∶9【参考答案】D思维破冰根据给出的原子种类,写出每一种物质的化学式,进而写出完整的化学方程式。
物质组成的表示【复习目标】:1、通过复习掌握化学式、化合价及化学式周围数字含义的所有知识。
2、熟练运用化合价、化学式进行有关计算!【知识梳理】:(合上课本独立做→小组交流,明确答案→若存在疑问→加强记忆、背诵!)1、以“H2O”为例,回答化学式的意义:(1)宏观:①②(2)微观:①②2、化学用语周围数字的意义(1)元素符号前的数字表示:________________如:2Fe表示(2)化学式前的数字表示:_________________(由分子构成的物质)如:3 H2O表示(3)化学式中元素符号右下角的数字表示_____________________________ ______________.2 H2O中,前面的“2”表示后面的“2”表示(4)元素符号右上角的数字表示,如Mg2+中“2”表示(5)元素符号正上方的数字表示。
如:表示氧化镁中镁显+2价(注:化学式或元素符号前加上计量数后,就失去了宏观意义,只有微观意义)3、(1)、在化合物中氢元素通常显价,氧元素通常显价。
(2)、由金属元素和非金属元素组成的化合物中,金属元素通常显价,非金属元素通常显价。
(3)、同种元素在不同的化合物中有时显示的化合价。
如:CO CO2求出碳元素的化合价分别为、;有时同种元素在一种化学式中化合价也,如:NH4NO3中的氮元素。
(4)、在化合物中正负化合价代数和为。
(5)、单质中元素的化合价为。
(6)、元素的化合价标在元素符号的,在前,在后。
4、写出下列元素的常见化合价并熟记!K:;Na:;Cl:; H:; Ag:; O:;Ca:; Mg:; Zn:; Cu:; Al:;Fe:、;C 、;N:、;S:、、。
5、有关化学式的计算常用的计算公式(以化合物A m B n为例)(1)、相对分子质量=A的相对原子质量×m + B的相对原子质量×n(注:计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
质量守恒定律
【复习目标】:记住质量守恒定律的内容,会应用解决实际问题。
【考点梳理】:(合上课本独立做→小组交流,明确答案→若存在疑问→加强记忆)
⒈质量守恒定律:参加的各物质的等于反应后的各物质的。
⒉质量守恒定律内容的分析归纳:
原子的不变
原子的不变物质一定改变六不变原子的不变两个一定改变
元素的不变分子一定改变
元素的不变
反应物和生成物不变
一个可能改变:分子可能改变
⒊关键词的理解:(1)“参加”(2)“生成”(3)“质量总和”
⒋适用范围:所有的变化。
⒌探究质量守恒定律的实验:当有参加反应或有生成时,该反应必须在
内进行才能验证质量守恒定律。
【典例精析】:(2020·昆明)
(1)某同学按右图装置对质量守恒定律进行实验探究,观
察到反应后天平不平衡,该反应质量守恒定律(填“符
合”或“不符合”),
理由是。
(2)由质量守恒定律可知,化学反应前后,一定不变的是
(填序号)。
①原子种类②原子数目③分子种类
④分子数目⑤元素种类⑥物质种类
(3)硝酸在工业生产中且有广泛的应用.工业上制取硝酸的关键反应为:
,其中R的化学式为。
【答案】(1) 符合;反应生成的CO2气体逸出,导致天平不平衡。
(2) ①②⑤ (3)H2O
【解析】盐酸与碳酸钠反应生成了二氧化碳,二氧化碳逸出,致使天平不平衡。
反应前后原子的种类、数目,及元素种类不会发生改变,但分子的种类,分子数目,及物质的种类,可能会发生变化,根据这条原则,可求出R的化学式为H2O。
【规律小结】化学反应是构成反应物分子的原子重新组合转变成生成物分子的过程。
在化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有改变。
【跟踪练习】:
小刚和小洁以“化学反应中,反应物与生成物的质量关系”为课题进行科学探究。
请填写以下探究过程中的空格:
【提出假设】化学反应中,反应物与生成物的质量;
【确定研究方法】分析推理、查阅资料、实验探究;
【设计并进行实验】小刚设计实验装置和选用药品如A图所
示,小洁设计的实验装置和选用药品如B图所示,他们在反应前后
都进行了规范的操作、准确的称量和细致的观察;
【实验结论】小刚认为:在化学反应中,生成物的总质量与反应物的总质量不相等。
小洁认为:在化学反应中,生成物的总质量与反应物的总质量相等;
你认为结论正确,请谈谈导致另一种结论错误的原因:。
【结论分析】请从原子的角度,简要分析你认为正确的结论:。
【查阅资料】小刚和小洁通过查阅材料了解到:法国伟大科学家拉瓦锡,早在18世纪就围绕这个问题,进行了准确、缜密的研究,并做出了科学结论。
【交流表达】请简要谈一下,你认为这条科学结论有什么重大意义?(不超过30字)。
【结论应用】环保部门用I2O5测定空气受CO污染的程度,发生反应的化学方程式为:
I2O5+5CO====I2+5X,根据生成X的多少,可以判断CO的含量,X的化学式为。
【中考演练】:通过研做中考试题,感受中考意境!(独立完成→小组代表板演→小组交流,解决疑惑→针对板演提出小组疑问并解决疑问)
1.(2020.东营市)化学反应前后,下列各项中,肯定没有变化
....的是()
①原子数目②原子的种类③分子数目④分子的种类⑤元素的种类⑥物质的总质量⑦物
质的种类
A.①②⑤⑥B.①②③⑤C.①②⑤⑦D.③④⑥⑦
2.(2020.鸡西市)氯气是一种有毒的气体,实验室制取氯气时,可以用氢氧化钠溶液来吸收尾气,其反
应原理为Cl2 + 2NaOH = X + NaClO + H2O, 则X 的化学式为()
A. NaCl
B. H2
C. HCl
D. HClO
3.(2020.日照市)甲烷在一定量的氧气中燃烧,测得反应前后各物质的质量如下表所示:
物质甲烷氧气水二氧化碳X
反应前质量/g 3.2 11.2 0 0 0
反应后质量/g 0 0 7.2 4.4 a 下列判断正确的是()
A.表中a的值为2.6 B.X一定是该反应的催化剂
C.X可能含有氢元素 D.X一定含有氧元素
4.(2020•济宁)某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行
反应过程反应前反应后
质量变化(不含容器质量)34.3g 32.7g
若反应后,双氧水分解完全且氧气全部逸出,该同学得出的结论中,不合理的是()A.反应速率逐渐加快B.最多得到氧气的质量为1.6g
C.催化剂二氧化锰的质量为0.3g D.反应得到水和氧气的质量比为9:8
【达标检测】像真正参加中考一样完成每一道题!
分数:
1.(2020.青岛市)以下是某化学反应的微观示意图(、分别表示不同元素的原子),下列对图示反应的理解中,正确的是
A.反应物和生成物中共含有三种元素 B.参加反应的物质分子个数之比为1:1
C.反应物和生成物中只有一种单质 D.该反应属于化合反应
2.(2020.潍坊市)在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。
则关于此反应的认识正确的是()
物质X Y Z W
反应前的质量(g) 2 1 16 16
反应后的质量(g)17 m 6 11
A.该反应用化学方程式表示为:3X+Y=2Z+W
B.该反应的基本类型为复分解反应
C.m=1
D.反应后容器中Z与Y的质量比为1:6
3.(2020.日照市)下图表示治理汽车尾气所涉及反应的微观过程。
下列说法不正确的是
A.图中单质的化学式为N2 B.该反应使有毒气体转化为无毒气体
C.反应物都属于氧化物 D.反应前后原子、分子个数都不变
4.(2020.临沂)在做“白磷在盛有空气的锥形瓶中燃烧探究质量守恒定律”的实验中,需要在锥形瓶里预先加少量的细沙。
这样做的目的是______________________________________
5.(2020.青岛市)某同学在敞口容器中做了两个实验:一是氧化汞(HgO)受热分解生成汞和氧气;二是铝粉在氧气中燃烧生成固体氧化铝。
他准确称量了反应前后容器及所盛物质的质量,发现反应前后质量都发生了变化。
请填空:
(1)铝粉燃烧生成氧化铝的质量比参加反应铝粉的质量______(选填“大”、“小”或“不变” )。
(2)你认为这两个反应是否遵循质量守恒定律?______(选填“是”或“否”)
(3)请写出氧化汞受热分解的化学方程式:_______________________________
6.(2020.东营市)纯净物A可用作气体燃料。
在一定条件下,将一定质量的A与160g B按下图所示充分反应,当B反应完全时,生成132gC和72gD
(1)参加反应的A物质的质量是。
(2)已知A的相对分子质量为44,该反应的化学方程式是。
+。