SOP-FF-9-015-C 非水溶液滴定法标准操作规程
- 格式:doc
- 大小:40.50 KB
- 文档页数:5

非水溶液滴定法一、定义质子传递反应为基础的在水以外的溶剂中滴定的方法称为非水溶液滴定法二、原理非水介质中酸碱滴定,主要以质子理论的酸碱概念为基础,凡能放出质子的物质是酸,能接受质子的物质是碱,它们的关系可用下式表示:HZ →←A-+H+酸碱质子在非水溶液中,游离的质子(H+)不能单独存在,而是与溶剂分子结合成溶剂合质子,酸碱中和反应的实质是质子的转移,而质子转移是通过溶剂合质子实现的。
溶剂对酸碱的强度影响很大,非水溶液中的酸碱滴定利用这个原理,使原来在水溶液中不能滴定的某些弱酸弱碱,经选择适当溶剂,增强其酸碱性后,便可以进行滴定。
二、溶剂的均化和区分效应1.均化效应常见的矿酸如高氯酸、盐酸、硫酸、硝酸等,都是强酸,在水中存在着下列酸碱平衡:HClO4+H2O→←H3O++ClO4-HCl+H2O→←H3O++Cl-H2SO4+H2O→←H3O++HSO4-HNO3+H2O→←H3O++NO3-在水中,矿酸是强酸,水则是碱。
水接受了矿酸的质子而形成另一种酸——水合质子(H3O+);矿酸放出质子后则转变成相应的共轭碱(ClO4-、Cl-、HSO4-、NO3-等)。
这一酸碱反应向右进行得十分完全。
即不论上述矿酸的酸度多强,溶于水后,其固有的酸强强度已不能表现出来,而统统都被均化到水合质子(H3O+)的强度水平,结果使它们的酸强度都相等。
溶剂的这种均化作用叫均化效应或称调平效应。
具有均化效应的溶剂叫均化性溶剂。
水是上述矿酸的均化性溶剂。
2.区分效应但水不能调平盐酸和醋酸,因为对醋酸来说,水的碱性太弱,质子转移反应很不完全,HAc+H2O→←H3O++Ac-溶液中存在大量的醋酸分子,而水合质子极少。
由于盐酸和醋酸在溶剂水中反应进行的程度不同,故显示出二者酸强度的差别。
这种能区分酸(碱)强弱的作用叫区分效应。
具有区分效应的溶剂称为区分性溶剂。
对于盐酸和醋酸来说,水是一个很好的区分性溶剂。
3.举例例如,某一弱碱B,在水中CK b<10-8,由于B的碱性太弱,而溶剂H2O的酸性又不够强,碱B在水溶液中的质子转移反应很不完全,即溶剂H2O对碱B不能起均化作用,故不能被滴定。
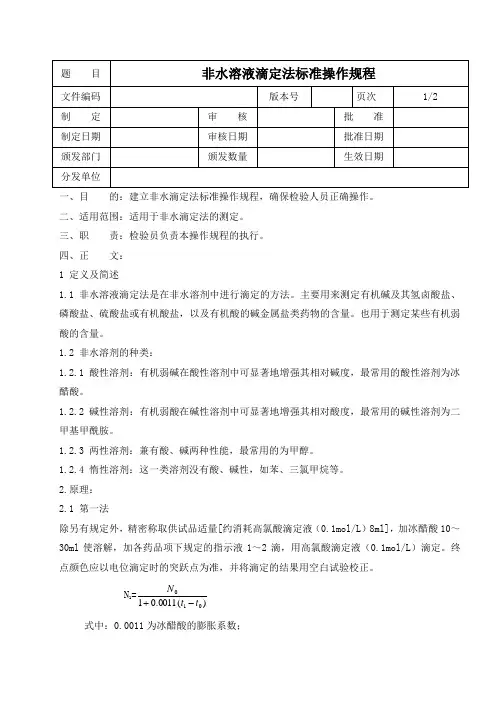
一、目的:建立非水滴定法标准操作规程,确保检验人员正确操作。
二、适用范围:适用于非水滴定法的测定。
三、职责:检验员负责本操作规程的执行。
四、正文:1 定义及简述1.1 非水溶液滴定法是在非水溶剂中进行滴定的方法。
主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐,以及有机酸的碱金属盐类药物的含量。
也用于测定某些有机弱酸的含量。
1.2 非水溶剂的种类:1.2.1 酸性溶剂:有机弱碱在酸性溶剂中可显著地增强其相对碱度,最常用的酸性溶剂为冰醋酸。
1.2.2 碱性溶剂:有机弱酸在碱性溶剂中可显著地增强其相对酸度,最常用的碱性溶剂为二甲基甲酰胺。
1.2.3 两性溶剂:兼有酸、碱两种性能,最常用的为甲醇。
1.2.4 惰性溶剂:这一类溶剂没有酸、碱性,如苯、三氯甲烷等。
2.原理:2.1 第一法除另有规定外,精密称取供试品适量[约消耗高氯酸滴定液(0.1mol/L)8ml],加冰醋酸10~30ml使溶解,加各药品项下规定的指示液1~2滴,用高氯酸滴定液(0.1mol/L)滴定。
终点颜色应以电位滴定时的突跃点为准,并将滴定的结果用空白试验校正。
N 1=)(0011.011ttN-+式中:0.0011为冰醋酸的膨胀系数;t为标定高氯酸液时的温度,℃;t1为滴定样品时的温度,℃;N 0为t时高氯酸液的浓度,mol/L;N 1为t1时高氯酸液的浓度,mol/L。
供试品溶液中如有氢卤酸盐,除另有规定外,可在加入醋酸汞试液3-5ml后,再进行滴定(因醋酸汞试液具有一定毒性,故在方法建立时,应尽量减少使用);供试品如为磷酸盐,可以直接滴定;硫酸盐也可直接滴定,但滴定至其成硫酸氢盐为止;供试品如为硝酸盐时,因硝酸盐可使指示剂褪色,终点极难观察,遇此情况应以电位滴定法指示终点为宜。
电位滴定时用玻璃电极为指示电极,饱和汞电极(玻璃套管内装氯化钾的饱和无水甲醇溶液)或银-氯化银电极为参比电极,或复合电极。
2.2 第二法除另有规定外,精密称取供试品适量[约消耗碱滴定液(0.1mol/L)8ml],加各品种项下规定的溶剂使溶解,再加规定的指示液1-2滴,用规定的碱滴定液(0.1mol/L)滴定。

非水溶液滴定标准操作程序
、引用标准:中华人民共和国药典(2010 年版二部附录)。
二、目的:为规定非水溶液滴定法的检验方法和操作要求,特制定本操作规程。
三、适用范围:适用于公司检品采用非水溶液滴定法的质量检测。
主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐,以及有机酸、碱金属盐药物的含量,也用于测定某些有机弱酸的含量。
四、责任者:质量检验员。
五、正文:
1 试剂:
高氯酸(AR)
冰醋酸(AR)
结晶紫(AR)
2 仪器和用具:
滴定管(10ml)
带塞锥形瓶
分析天平(万分之一)
3定义:非水溶液滴定法是在非水溶剂中进行滴定的方法。
4原理:非水介质中酸碱滴定,主要以质子理论的酸碱概念为基础,凡能放出质子的物质是酸,能接受质子的物质是碱,它们的关系可用下式
表示:
HE=A-+H+
酸碱质子
在非水溶液中,游离的质子(H+)不能单独存在,而是与溶剂分子结合成溶剂合质子,酸碱中和反应的实质是质子的转移,而质子转移是通过溶剂合质子实现的。
溶剂对酸碱的强度影响很大,非水溶液中的酸碱滴定利用这个道理,使原来在水溶液中不能滴定的某些弱酸弱碱,经选择适当溶剂,增强其酸碱性后,便可以进行滴定。
5操作步骤:除另有规定外,精密称取供试品适量[约消耗高氯酸滴定(0.1mol/L)8ml],加冰醋酸 10~30ml使溶解,加各保健品项下规定的
指示液 1~2 滴,用高氯酸滴定液(0.1mol/L)滴定。
并将滴定的结果
用将滴定的结果用空白试验校正。

非水溶液滴定法
生物碱类药物一般具有弱碱性,通常可在冰醋酸或醋酐等酸性溶液中,用高氯酸滴定液直接滴定,以指示剂或电位法确定终点。
(1)氢卤酸盐的滴定:
在滴定生物碱的氢卤酸盐时,一般均预先在冰醋酸中加入醋酸汞
的冰醋酸溶液,使氢卤酸生成在冰醋酸中难解离的卤化汞,从而消除
氢卤酸对滴定反应的不良影响。
加入的醋酸汞量不足时,可影响滴定终点而使结果偏低,过量的
醋酸汞(理论量的1~3倍)并不影响测定的结果。
(2)硫酸盐的测定:
硫酸为二元酸,在水溶液中能完成二级电离,生成SO42-,但在冰
醋酸介质中,只能离解为HSO4-,不再发生二级离解。
因此,生物碱的
硫酸盐,在冰醋酸的介质中只能被滴定至生物碱的硫酸氢盐。
硫酸阿托品的含量测定。
溶剂:冰醋酸和醋酐,指示剂:结晶紫,滴定液:高氯酸。
至溶液显纯蓝色。
硫酸奎宁的含量测定。
1摩尔的硫酸奎宁可消耗3摩尔的高氯酸。
硫酸奎宁片的含量测定。
硫酸奎宁经强碱溶液碱化,生成奎宁游
离碱,在与高氯酸反应,因此1摩尔的硫酸奎宁可消耗4摩尔的高氯酸。
(3)硝酸盐的测定:
硝酸在冰醋酸介质中虽为弱酸,但是他具有氧化性,可以使指示剂变色,所有采用非水溶液滴定法测定生物碱硝酸盐时,一般不用指示剂而用电位法指示终点。
如硝酸士的宁。
(4)磷酸盐的测定:
磷酸在冰醋酸介质中的酸性极弱,不影响滴定反应的定量完成,可按常法测定。


第五章 非水滴定法第一节 概 述在非水溶剂中进行的滴定分析方法称为非水滴定法。
该法可用于酸碱滴定、氧化还原滴定、配位滴定及沉淀滴定等,在药物分析中,以非水酸碱滴定法应用最为广泛,故本章重点讨论非水酸碱滴定法。
适用:① 难溶于水的有机物② 在水中不能直接被滴定的弱酸(C a K a <10-8)或弱碱(C b K b <10-8)③ 在水中不能被分步滴定的强酸或强碱特点:扩大滴定分析的应用范围。
第二节 基本原理一、溶剂的分类根据酸碱的质子理论分类:酸性溶剂 如:冰醋酸、丙酸等质子溶剂 碱性溶剂 如:乙二胺、乙醇胺等两性溶剂 如:醇类等偶极亲质子溶剂 如:酰胺类、酮类等无质子溶剂惰性溶剂 如:氯仿、苯等二、溶剂的性质1. 溶剂的质子自递常数SH = H + + S - ][]][[SH S H K SH a -+= 固有酸度常数 SH + H + = SH 2+]][[][2SH H SH K SH b ++= 固有碱度常数−−−−−−−−−− SH + SH = SH 2+ + S - SH b SH a K K ⋅[SH] 2 =[SH 2+][S -] = K S溶剂的质子自递常数K S 对滴定突跃范围的影响:溶剂 H 2O (pK S =14) C 2H 5OH (pK S =19.1)碱 NaOH C 2H 5ONa↓ ↓ ↓酸 H 3O + C 2H 5OH 2+化学计量点前 pH=4 pH *=4化学计量点后 pH=14-4=10 pH *=19.1-4=15.1∆pH 6 11.1结论:K S ↓ ⇒ 突跃范围 ↑, 终点敏锐。
例如,在甲基异丁酮介质中(pK S >30),用氢氧化四丁基铵作为滴定剂,可分别滴定HClO 4和H 2SO 4。
2. 溶剂的酸碱性现以HA 代表酸,B 代表碱,根据质子理论有下列平衡存在:HA = H + + A - ][]][[HA A H K HA a -+= B + H + = BH + ]][[][++=H B BH K B b若酸碱溶于质子溶剂SH 中,则发生下列质子转移反应,HA + SH = SH 2+ + A - SH bHA a HA K K SH H HA SH A H SH HA A SH K ⋅===++-+-+]][][[]][][[]][[]][[22 B + SH = S - + BH + SH a B b B K K SH B BH S K ⋅==+-]][[]][[ 其中,K HA 、K B 分别为酸HA 、碱B 的表观离解常数。


非水溶液滴定法一、定义质子传递反应为基础的在水以外的溶剂中滴定的方法称为非水溶液滴定法二、原理非水介质中酸碱滴定,主要以质子理论的酸碱概念为基础,凡能放出质子的物质是酸,能接受质子的物质是碱,它们的关系可用下式表示:HZ →←A-+H+酸碱质子在非水溶液中,游离的质子(H+)不能单独存在,而是与溶剂分子结合成溶剂合质子,酸碱中和反应的实质是质子的转移,而质子转移是通过溶剂合质子实现的。
溶剂对酸碱的强度影响很大,非水溶液中的酸碱滴定利用这个原理,使原来在水溶液中不能滴定的某些弱酸弱碱,经选择适当溶剂,增强其酸碱性后,便可以进行滴定。
二、溶剂的均化和区分效应1.均化效应常见的矿酸如高氯酸、盐酸、硫酸、硝酸等,都是强酸,在水中存在着下列酸碱平衡:HClO4+H2O→←H3O++ClO4-HCl+H2O→←H3O++Cl-H2SO4+H2O→←H3O++HSO4-HNO3+H2O→←H3O++NO3-在水中,矿酸是强酸,水则是碱。
水接受了矿酸的质子而形成另一种酸——水合质子(H3O+);矿酸放出质子后则转变成相应的共轭碱(ClO4-、Cl-、HSO4-、NO3-等)。
这一酸碱反应向右进行得十分完全。
即不论上述矿酸的酸度多强,溶于水后,其固有的酸强强度已不能表现出来,而统统都被均化到水合质子(H3O+)的强度水平,结果使它们的酸强度都相等。
溶剂的这种均化作用叫均化效应或称调平效应。
具有均化效应的溶剂叫均化性溶剂。
水是上述矿酸的均化性溶剂。
2.区分效应但水不能调平盐酸和醋酸,因为对醋酸来说,水的碱性太弱,质子转移反应很不完全,HAc+H2O→←H3O++Ac-溶液中存在大量的醋酸分子,而水合质子极少。
由于盐酸和醋酸在溶剂水中反应进行的程度不同,故显示出二者酸强度的差别。
这种能区分酸(碱)强弱的作用叫区分效应。
具有区分效应的溶剂称为区分性溶剂。
对于盐酸和醋酸来说,水是一个很好的区分性溶剂。
3.举例例如,某一弱碱B,在水中CK b<10-8,由于B的碱性太弱,而溶剂H2O的酸性又不够强,碱B在水溶液中的质子转移反应很不完全,即溶剂H2O对碱B不能起均化作用,故不能被滴定。

非水溶液滴定法操作规程一、范围:本标准规定了非水溶液滴定法的检验方法和操作要求;适用于本公司检品采用非水溶液滴定法的质量检测。
二、引用标准:中华人民共和国药典(2000年版)附录ⅦB。
三、试剂:1、高氯酸(AR)2、冰醋酸(AR)3、结晶紫(AR)四、仪器和用具1、滴定管(10ml)2、具塞锥形瓶3、分析天平(万分之一)五、定义:非水溶液滴定法是在非水溶剂中进行滴定的方法。
六、适用范围:主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐,以及有机酸碱金属盐灰药物的含量,也用于测定某些有机弱酸的含量。
七、原理:非水介质中酸碱滴定,主要以质子理论的酸碱概念为基础,凡能放出质子的物质是酸,能接受质子的物质是碱,它们的关系可用下式表示:HE A-+H+酸碱质子在非水溶液中,游离的质子(H+)不能单独存在,而是与溶剂分子结合成溶剂合质子,酸碱中和反应的实质是质子的转移,而质子转移是通过溶剂合质子实现的。
溶剂对酸碱的强度影响很大,非水溶液中的酸碱滴定利用这个道理,使原来在水溶液中不能滴定的某些弱酸弱碱,经选择适当溶剂,增强其酸碱性后,便可以进行滴定。
八、操作步骤:除另有规定外,精密称取供试品适量[约消耗高氯酸滴定液(0.1mol/L)8ml],加冰酸酸10~30ml使溶解,加各药品项下规定的指示液1~2滴,用高氯酸滴定液(0.1mol/L)滴定。
并将滴定的结果用空白试验校正。
九、注意事项:1、配制高氯酸时,若用于易乙酰化的供试品测定,必须测定本液的含水量,再用水或乙酐调节至本液的含水量为0.01%~0.2%。
2、若滴定样品与标定高氯酸滴定液时的温度差别超过100C ,则应重新标定;若未超过100C ,则可根据下式将高氯酸滴定液的浓度加以校正。
)t -0.0011(t 10101+=N N式中:0.0011为冰醋酸的膨胀系数;t 0:标定高氯酸液时的温度,0C ;t 1:滴定样品时的温度,0C ;N 0:t 0时高氯酸液的浓度,mol/L ;N 1:t 1时高氯酸液的浓度,mol/L 。

一、概述1.定义:非水溶液滴定法即在非水溶剂中进行的滴定分析方法。
一些很弱的酸或碱以及某些盐类,在水溶液中进行滴定时,没有明显的滴定突跃,难于掌握滴定终点;另外还有一些有机化合物,在水中溶解度很小,因此,以水作溶剂的滴定分析受到一定的限制。
所以,滴定分析法逐渐采用了各种非水溶剂(包括有机溶剂与不含水的无机溶剂)作为滴定分析的介质,不仅能增大有机化合物的溶解度,而且能改变物质的化学性质(例如酸碱性及其强度),使在水中不能进行完全的滴定反应能够顺利进行。
2.分类非水溶液滴定法除有酸碱滴定外,尚有氧化还原滴定、络合滴定及沉淀滴定等,而在药物分析中,以非水溶液酸碱滴定分析法用得最为广泛。
3.非水溶液酸碱滴定法:是利用非水溶剂的特点来改变物质的酸碱相对强度,即在水溶液中呈弱酸性或弱碱性的化合物,由于酸碱度太弱,不可能得到滴定的终点。
如果选择某些适当的非水溶剂为溶剂使化合物增加相对的酸度成为强酸,或者增加相对的碱度成为强碱,就可以顺利地进行滴定的分析方法。
4.应用:本法主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐以及有机酸碱金属盐类药物的含量,也用于测定某些有机弱酸含量。
二、原理:酸碱质子理论(一)有关酸碱的定义有三种学说1.Arrhenius 的电离学说凡化合物溶于水中能电离生成H+离子的是酸,能电离生成OH-离子的是碱。
H+ + OH-=== H2O酸碱反应即为中和,这种学说在水溶液中很适用,但在非水溶液中考虑离子平衡问题就受到限制。
2.刘易斯(Lewis)的电子理论把酸碱反应看成是电子对转移共享的反应,认为酸是一个电子对的接受者,它接受一对电子以构成配位鍵;碱是一个电子对的供给者,它供给酸一对电子以构成配位鍵。
A + :B → A:B任何物质,凡能从其它的分子或离子接受电子对组成一个安定生成物的,都是酸。
任何物质,凡能供给它种分子或离子以电子对而组成一个安定生成物的,都是碱。
中和反应是酸和碱形成配位鍵的反应。

SOP-FF-9-013-C pH 值测定法标准操作规程 第1页 共3页 题目:pH 值测定法标准操作规程 编码:SOP-FF-9-013-C 起草: 日期: 审核: 日期:批准:日期:生效日期: 颁发部门:质管部分发部门:检验室依据:《中国药典》2015年版四部通则0631 第77页 目的:建立pH 值测定法的标准操作规程 范围:适用于pH 值测定法的检查职责:检验室主任、检验者对本规程的实施负责 规程: 1.简述pH 值是水溶液中氢离子活度的方便表示方法。
pH 值定义为水溶液中氢离子活度(以每升中摩尔数计算)的负对数,以公式表示为:+-=H a pH lg ,但氢离子活度却难以由实验准确测定。
为实用方便,溶液的pH 值规定为由下式测定:κ/)(S S E E pH pH --=E 与E S 分别为电池中含有供试液与标准液时测得的电动势。
pH S 为标准液的已知pH 值。
Κ为与温度(t ,℃)有关的常数。
K=0.05916+0.000198(t-25)。
由于待测物的电离常数、介质的介电常数和液接界电位等诸多因素均可影响pH 值的准确测量,所以实验测得的数值只是溶液的表观pH 值,它不能作为溶液氢离子活度的严格特征。
尽管如此,只要待测溶液与标准缓冲液的组成足够接近,由上式测得的pH 值与溶液的真实pH 值还是颇为接近的。
溶液的pH 值使用酸度计测定。
水溶液的pH 值通常以玻璃电极为指示电极、饱和甘汞电极或银-氯化银电极为参比电极进行测定。
酸度计应定期进行计量检定,并符合国家有关规定。
测定前,应采用下列标准缓冲液校正仪器,也可用国家标准物质管理部门发放的标示pH 值准确至0.01pH 单位的各种标准缓冲液校正仪器。
2.仪器校正用的标准缓冲液2.1 草酸盐标准缓冲液:精密称取在54℃±3℃干燥4~5小时的草酸三氢钾12.71g ,加水使溶解并稀释至1000ml 。
SOP-FF-9-013-C pH值测定法标准操作规程第2页共3页2.2 苯二甲酸盐标准缓冲液精密称取在115℃±5℃干燥2~3小时的邻苯二甲酸氢钾10.21g,加水使溶解并稀释至1000ml。
SOP-FF-9-020-C 硒检查法标准操作规程第 1 页共 3 页题目:硒检查法标准操作规程编码:SOP-FF-9-020-C 起草:日期:审核:日期:批准:日期:生效日期:颁发部门:质管部分发部门:检验室依据:《中国药典》2015年版四部通则0804 第99页目的:建立硒检查法的标准操作规程。
范围:适用于药品中微量硒的限量检查。
职责:检验室主任、检验者对本规程的实施负责。
规程:1.简述1.1 硒检查法系用于检查某些药物在生产工艺中未能除尽的微量硒杂质的一种限度检查方法。
1.2 本法原理为采用氧瓶燃烧法将供试品经燃烧分解,使结合在骨架上或被吸附的微量硒成为硒的氧化物,利用盐酸羟胺,将Se6+还原为Se4+,在pH2.0±0.2的条件下与二氨基萘作用,生成4,5-苯并苯硒二唑,用环已烷提取后,照紫外-可见分光光度法标准操作规程(SOP-FF-9-002-A),在378nm处测定其吸光度,并与硒对照溶液同法测得的吸光度相比较。
2.仪器与用具燃烧瓶1000ml(见氧瓶燃烧法)紫外-可见分光光度计3.试药与试液3.1 亚硒酸钠分析纯;亚硒酸钠易风化,使用前应按本文最后的附注项下所附方法测定含量。
3.2 盐酸羟胺溶液(1→2)取盐酸羟胺10g,加水溶解使成20ml,即得。
本液应临用新配。
3.3 二氨基萘试液取2,3-二氨基萘0.10g与盐酸羟胺0.50g,加0.1mol/L盐酸溶液100ml必要时加热使溶解,放冷,滤过,即得。
本液应临用新配,避光保存。
3.4 标准硒溶液的配制取已知含量的亚硒酸钠适量,精密称定,加硝酸溶液(1SOP-FF-9-020-C 硒检查法标准操作规程第 2 页共 3 页→30)制成每1ml中含硒1.00mg的溶液;精密量取5ml臵250ml量瓶中,加水稀释至刻度,摇匀后,再精密量取5ml,臵100ml量瓶中,加水稀释至刻度,摇匀,即得(每1ml 相当于1µg的Se)。
⾮⽔溶液滴定法
在⾮⽔溶剂(有机溶剂与不含⽔的⽆机溶剂)中进⾏滴定分析的⽅法称为⾮⽔滴定法。
⽔中不能顺利滴定:溶解性、酸碱性→增⼤
考点1:⾮⽔碱量法
溶剂:冰醋酸溶剂(加醋酐除去⽔分)
滴定液:⾼氯酸滴定液——标定⽤邻苯⼆甲酸氢钾
终点判断:结晶紫指⽰剂、电位法
考点2:⾮⽔酸量法
溶剂:⼆甲基甲酰胺、⼄⼆胺
滴定液:甲醇钠滴定液——标定⽤基准物质苯甲酸
终点判断:麝⾹草酚蓝指⽰剂
考点3:⾮⽔碱量法的应⽤
(1)⽤⾮⽔碱量法分析的药物:
肾上腺素、盐酸氯丙嗪、地西泮、氟康唑、盐酸⿇黄碱、硫酸阿托品、盐酸吗啡、磷酸可待因、硫酸奎宁、维⽣素B1
(2)分析有机碱的盐酸盐(氢卤酸盐)——滴定前加⼊醋酸汞的冰醋酸溶液,防⽌⽣成盐酸(氢卤酸)对滴定的⼲扰。
代表药物:盐酸氯丙嗪、盐酸⿇黄碱、盐酸吗啡
(3)⽤电位法指⽰终点,代表药物:氟康唑、维⽣素B1.有机碱的硝酸盐(防⽌⽣成的硝酸氧化破坏指⽰剂)
(4)分析有机碱的硫酸盐——只能滴定⾄HS04-的程度。
代表药物:硫酸阿托品、硫酸奎宁。
之迟辟智美创作非水溶液滴定法一、概述1.界说:非水溶液滴定法即在非水溶剂中进行的滴定分析方法.一些很弱的酸或碱以及某些盐类,在水溶液中进行滴按时,没有明显的滴定突跃,难于掌握滴定终点;另外还有一些有机化合物,在水中溶解度很小,因此,以水作溶剂的滴定分析受到一定的限制.所以,滴定分析法逐渐采纳了各种非水溶剂(包括有机溶剂与不含水的无机溶剂)作为滴定分析的介质,不单能增年夜有机化合物的溶解度,而且能改变物质的化学性质(例如酸碱性及其强度),使在水中不能进行完全的滴定反应能够顺利进行.非水溶液滴定法除有酸碱滴定外,尚有氧化还原滴定、络合滴定及沉淀滴定等,而在药物分析中,以非水溶液酸碱滴定分析法用得最为广泛.3.非水溶液酸碱滴定法:是利用非水溶剂的特点来改变物质的酸碱相对强度,即在水溶液中呈弱酸性或弱碱性的化合物,由于酸碱度太弱,不成能获得滴定的终点.如果选择某些适当的非水溶剂为溶剂使化合物增加相对的酸度成为强酸,或者增加相对的碱度成为强碱,就可以顺利地进行滴定的分析方法.4.应用:本法主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐以及有机酸碱金属盐类药物的含量,也用于测定某些有机弱酸含量.二、原理:酸碱质子理论(一)有关酸碱的界说有三种学说1.Arrhenius 的电离学说凡化合物溶于水中能电离生成H+离子的是酸,能电离生成OH-离子的是碱.H+ + OH- === H2O酸碱反应即为中和,这种学说在水溶液中很适用,但在非水溶液中考虑离子平衡问题就受到限制.2.刘易斯(Lewis)的电子理论把酸碱反应看成是电子对转移共享的反应,认为酸是一个电子对的接受者,它接受一对电子以构成配位鍵;碱是一个电子对的供给者,它供给酸一对电子以构成配位鍵.A + :B → A:B任何物质,凡能从其它的分子或离子接受电子对组成一个安宁生成物的,都是酸.任何物质,凡能供给它种分子或离子以电子对而组成一个安宁生成物的,都是碱.中和反应是酸和碱形成配位鍵的反应.电子理论从物质的自己去了解物质的酸碱性质,不依靠溶剂来说明.在非水溶液滴定中应用惰性溶剂(非极性溶剂)时,即以此学说为基础.3.劳莱-勃伦斯(Lowry-Bronsted)的质子理论(1)界说:凡能给出质子的物质是酸凡能接受质子的物质是碱暗示方程:HA === A- + H+从这个方程式可以知道:酸和碱既可以是中性分子,也可以是阴离子或阳离子(2)共轭酸碱对一种酸给出质子后,所余的部份即是该酸的共轭碱一种碱接受质子以后,即成为该碱的共轭酸HA === A- + H+HA和A-称为共轭酸碱对.(3)强度界说越容易给出质子的物质酸性越强,越容易接受质子的物质碱性越强.强酸的共轭碱是弱碱,而强碱的共轭酸肯定是弱酸.如: HCl是一强酸,它的共轭碱Cl-则为弱碱.(二)相对酸碱度任何一种溶质溶于给定的溶剂中,其酸碱性都将受到溶剂的离解水平、溶剂的酸碱性及溶剂的极性等因素的影响. 所以,酸碱强弱不单决定于物质自己的酸碱性,也决定于溶剂的性质.分歧的酸溶解在相同的溶剂中,供给质子能力愈年夜的,显的酸性越强;一种酸在分歧的溶剂中,溶剂接受质子能力愈强的,显的酸性愈强.因此,某些物质在水溶液中,其酸性或碱性很弱,不能进行滴定,便选择适当的碱性(或酸性)溶剂以增强其酸性(或碱性)来进行滴定.例如:可以把在水溶液中显弱碱性的胺类溶于冰醋酸中,以增强其相对碱性,然后可用高氯酸滴定液滴定.同样在水中呈弱酸性的物质,可以选择适当的碱性溶剂.如乙二胺或甲醇使其酸性增强后,用标准碱溶液甲醇钠滴定. 总之,酸碱强弱不能脱离溶剂而言.溶剂对酸碱的强弱影响很年夜,一个弱酸溶解在碱性溶液中,可以增强其酸性,一个弱碱溶解在酸性溶剂中,可以增强其碱性.非水溶液中的酸碱滴定即是利用这一事实,使原来在水溶液中不能滴定的弱酸弱碱,在选择适当的溶剂增强其酸碱性后,就可以滴定了.(三)溶剂合质子在水溶液中,H+离子不能独自存在,它与溶剂水分子结合成水合质子(H3O+),习惯上以H+暗示.在非水溶液中,游离的质子(H+)也不能独自存在,而是与溶剂分子结合成溶剂合质子.(四)酸碱反应的实质酸碱中和反应的实质是质子的转移,而质子转移是通过溶剂合质子实现的.按质子论的酸碱中和反应并没有盐的生成.在非水溶剂中,酸碱反应可用下式暗示:三、碱的滴定(一)适用范围:.非水溶液滴定法,主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐,以及有机酸碱金属盐类药物的含量,也用于测定某些有机弱酸的含量.非水溶液滴定法,年夜多用于原料药品的含量测定.(二)方法1.滴定系统:一般,弱碱性化合物在酸性溶剂中能增强其碱性,即可用强酸进行滴定.上述各类药物多半可以在冰醋酸或醋酐中进行滴定,有时也可在一些惰性溶剂(苯、四氯化碳、氯仿等)或在能影响溶质的解离情况和能显著影响酸碱度的溶剂(硝基甲烷、二氧六环、丙酮等)中进行滴定.滴定液多采纳高氯酸的冰醋酸溶液.2.指示终点的方法:电位法和指示剂法,一般按电位法指示终点,如采纳指示剂时,终点颜色的变动应以电位法终点时指示剂的颜色的变动为准.实际把持中多用指示剂法.以冰醋酸作溶剂,用酸滴定液滴定碱时,最经常使用的指示剂为结晶紫,还有α-萘酚苯甲醇(0.2%冰醋酸溶液,其碱式色为黄色,酸式色为绿色)和喹哪啶红(0.1%甲醇液,其碱式色为红色,酸式色为无色)结晶紫指示液(0.5%冰醋酸溶液):其碱式色为紫色,酸式色为黄色.在分歧的酸度下变色较为复杂,由碱区到酸区的颜色变动有:紫色→蓝色→蓝绿色→绿色→黄绿色→黄色在滴定分歧的碱时,终点颜色变动分歧:(1)滴定较强的碱时,应以蓝色或蓝绿色为终点;(2)滴定较弱的碱时,应以蓝绿色或绿色为终点.在非水溶液酸碱滴定中,除用指示剂指示终点外,电位滴定法是测定终点的基本方法.因为在非水溶液滴定中,有许多物质的滴定,目前还没有找到合适的指示剂,而且在选择指示剂和确定指示剂终点颜色时都需要以电位滴定法作为对比.(三) 酸根对碱滴定的影响由HClO4滴定碱的反应式可知,滴定有机酸的盐生成相应的酸HA.当滴定生成的酸HA比HClO4的酸性强度差的越远,反应就越易进行.根据实验知道,某些强的无机酸(冰醋酸溶液)比力其酸性强度为:HClO4>HBr>H2SO4>HCl>HNO3>其他酸所以HClO4在冰醋酸中是很强的酸.有机碱的氢卤酸盐则由于HX在冰醋酸中酸性比力强,反应不能进行完全,所以不能直接滴定,可加入过量的醋酸汞试液所以HClO4在冰醋酸中是很强的酸,使与有机碱的氢卤酸盐发生复分解反应.2BHX + Hg(Ac)2 → 2BHA c + HgX2HgX2和Hg(Ac)2都是络合物,而HgX2 比Hg(Ac)2更加稳定,难于电离,所以这时即可用HClO4直接去滴定.其反应式可综合如下:2BHX +Hg(Ac)2 → 2BHAc + HgX2HClO4 +HAc → H2Ac+ + ClO4-H2Ac+ +BHAc→BH++ 2 HAcHClO4 +BHAc → BH+ + ClO4- + HAc滴定生成的HAc比HClO4的酸度要弱很多,故反应可进行完全.如:盐酸环丙沙星、盐酸左旋咪唑原料的含量测定方法,即以上述方法排除氢卤酸盐的影响.非水溶液滴定主要用来测定有机碱及其盐、有机酸的碱金属盐等.惯例的选择醋酸体系,如含有一定的结晶水(或水分)需要加醋酐消除结晶水(水分)的影响,每反应1g水需醋酐5.22ml,具体醋酐的加入量需要考虑,我的经验是分歧量的醋酐对突跃的影响较年夜,尤其是有第二胺的时候,考虑过量醋酐可能第二胺发生乙酰化反应.建议摸索时逐渐减少冰醋酸的量增加醋酐的量,直至全是醋酐,找到更好的突跃电势. 分别考察分歧配比的冰醋酸-醋酐混合溶剂对用高氯酸滴定液(0.1mol/L)滴按时终点突跃的影响. 尤其在你不方便测定冰醋酸中水分的时候.如为氢卤酸盐,需加醋酸汞消除氢卤酸影响,CL(卤离子)-与Hg2+按2比1介入反应形成难以解离的卤化汞,需计算约需要醋酸汞试液(0.156942mol/L)的量,考虑到反应的完全性,一般加入2倍量排除氢卤酸的影响.2.1结晶紫指示液取结晶紫0.5g,加冰醋酸100ml使溶解,即得. 药典呈现194次(约数,年夜概统计,下同)年夜部份的有机碱碱以冰醋酸作滴定介质,高氯酸为滴定剂滴定,结晶紫是最经常使用的指示剂,必需首先考虑.结晶紫分子中的氮原子能键和多个质子而暗示为多元碱.其接受第一个质子时,变色敏锐,从第二个质子开始,亲和力变弱,变色缓慢.在滴定中,随着溶液酸度的增加,结晶紫由碱式体(紫色)转酿成酸式体(黄色),对分歧强度的碱时,终点颜色变动分歧.滴定较强的碱应一般蓝色或天蓝色为终点;滴定较弱的碱一般蓝绿或绿色为终点.需要以电位滴定法作确定重点的颜色.2.2萘酚苯甲醇指示液取α-萘酚苯甲醇0.5g,加冰醋酸100ml使溶解,即得. 9次萘酚苯甲醇有两个相离很远的变色区,酸性范围为黄至绿色,碱性范围为蓝绿色.适用于在冰醋酸-四氯化碳、醋酐、乙腈中做滴定弱碱的指示剂.2.3喹哪啶红指示液取喹哪啶红0.1g,加甲醇100ml使溶解,即得.变色范围ph1.4~3.2(无色-红)7次在冰醋酸中其碱性较结晶紫为强,年夜大都胺及中等强度的碱在冰醋酸中滴按时,喹哪啶红是经常使用的指示剂.喹哪啶红是单色指示剂,终点颜色由红色至无色.2.4二甲基黄指示液取二甲基黄0.1g,加乙醇100ml使溶解,即得. 3次变色范围ph2.9~ 4.0(红-黄)二甲基黄,其酸式体为肉红色,碱式体为黄色.适用于做冰醋酸-醋酐中滴定碱的指示剂.2.5甲基橙-二甲苯蓝FF混合指示液取甲基橙、二甲苯蓝FF各0.1g,加乙醇100ml使溶解,即得. 1次二甲苯蓝FF又称二甲苯蓝.经常使用其与甲基橙的混合液(乙醇),含量各0.1%,在丙二醇、异丙醇及二氧六环混合液中用高氯酸滴定有机酸的碱金属盐.2.6橙黄IV指示液取橙黄IV 0.5g,加冰醋酸500ml使溶解,即得. 0次橙黄IV适用于含醋酐或苯的冰醋酸溶液中滴定弱碱的指示剂.2.7苏丹IV指示液取苏丹IV0.5g,加三氯甲烷100ml使溶解,即得.0次苏丹IV又叫猩红,经常使用其0.5%的冰醋酸-醋酐(10:1)溶液,在氯仿与醋酐混合液中用高氯酸滴定嘌呤生物碱.2.8亮绿指示液取亮绿0.5g,加乙醇100ml使溶解,即得. 0次亮绿与孔雀绿结构相类似,变色发生在较低的ph值范围,适用于在冰醋酸中滴定中等强度的碱或在醋酐中滴定弱碱.总结:我们为什么要选择指示剂呢,不是可以使用电位滴定么?是的绝年夜部份的都可以使用电位滴定,可是电位滴定把持麻烦、计算麻烦、原始记录书写麻烦、*数麻烦.因为我们如果能选择到一个好的指示剂,在用电位确定重点颜色后,就可以一劳永逸,万事方便,因此选择一个合适的指示剂是很重要的,固然变色不明显的仍然建议使用电位滴定,有机碱的硝酸盐则不再选择指示剂,直接采纳电位滴定法.一般选择结晶紫、萘酚苯甲醇、喹哪啶红进行比力即可,其他的药药典尚无品种使用或者很少,可是其实不代表他们没用,我就有幸使用过亮绿作为指示剂取得了显著的效果.采纳醋酸(-醋酐)体系的均可采纳上述各种指示剂.试验需在熟读药典和把持规范的前提下进行,滴定液的配制、滴定液的贮存要求,试验温度的记录,否则可能突跃不明显,没有滴定重终点.。
SOP-FF-9-015-C 非水溶液滴定法标准操作规程第1页共5页题目:非水溶液滴定法标准操作规程
编码:SOP-FF-9-015-C 起草:日期:
审核:日期:批准:日期:
生效日期:颁发部门:质管部
分发部门:检验室
依据:《中国药典》2015年版四部通则0702 第87页
目的:建立非水溶液滴定的标准操作规程。
范围:适用于原料药品的含量测定。
职责:检验室主任、检验者对本规程实施负责。
规程:
1.简述
本法是在非水溶剂中进行滴定的方法。
主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸盐或有机酸盐,以及有机酸碱金属盐类药物的含量。
也用于测定某些有机弱酸的含量。
2.非水溶剂的种类
2.1 酸性溶剂有机弱碱在酸性溶剂中可显著地增强其相对碱度,最常用的酸性溶剂为冰醋酸。
2.2 碱性溶剂有机弱酸在碱性溶剂中可显著地增强其相对酸度,最常用的的碱性溶剂为二甲基甲酰胺。
2.3 两性溶剂兼有酸、碱两种性能,最常用的为甲醇。
2.4 惰性溶剂这一类溶剂没有酸、碱性,如三氯甲烷等。
3.仪器与用具
3.1 滴定管用10ml滴定管(建议选用分度值为0.05ml者)。
3.2 电位滴定时用玻璃电极为指示电极,饱和甘汞电极(玻璃套管内装氯化钾的饱和无水甲醇溶液)为参比电极;在滴定氢卤酸盐供试品时,氯化物干扰滴定。
可用硝酸钾盐桥将甘汞电极与滴定液分开。
3.3 选用全自动滴定仪时,可用复合非水pH电极;使用前,在饱和氯化钾溶液中浸泡过夜。
SOP-FF-9-015-C 非水溶液滴定法标准操作规程第2页共5页
3.4 用甲醇钠滴定液滴定时应有密闭的装置。
3.5 所用的仪器用具均应干燥
4.试药与试液
4.1 滴定液
4.1.1 滴定液的配制、标定与贮藏均应符合滴定液配制、标定注意事项标准操作规程通则(SOP-DDY-9-001-C)的规定。
4.1.2 甲醇钠滴定液的标定与贮藏均应在密闭的装置中,避免与空气中的二氧化碳及水蒸汽接触而产生干扰,亦避免溶剂的挥发。
4.1.3 酸碱滴定液的标定同一操作者标定不得少于3份,酸滴定液标定和复标的相对平均偏差不得超过0.1%,不同操作者标定的平均值的相对偏差不得超过0.1%;碱滴定液的标定和复标的相对偏差不得超过0.2%,不同操作者平均值的相对偏差不得超过0.2%。
4.2 试液及试剂
4.2.1 醋酸汞试液及非水溶液滴定用的各种指示液均按《中国药典》规定配制。
4.2.2 高氯酸滴定液中的含水量应为0.01%~0.20%。
5.操作方法
5.1 第一法本法是用高氯酸滴定液(0.1mol/L)滴定碱性药物。
5.1.1 除另有规定外,精密称取供试品适量[约消耗高氯酸滴定液(0.1mol/L)8ml],置50~100ml小锥形瓶中,加冰醋酸10~30ml使溶解,加各品种项下规定的指示液1~2滴,用高氯酸滴定液(0.1mol/L)滴定。
终点颜色应以电位滴定时的突跃点为准,并将滴定的结果用空白试验校正。
5.1.2 取供试品测定时所用的试剂,在同条件下作空白试验,用高氯酸滴定液(0.1mol/L)滴定至相同的终点,其读数用于校正供试品滴定的读数结果。
5.1.3 供试品如为有机碱的氢卤酸盐,需先按理论量加入醋酸汞试液使与氢卤酸形成不离解的卤化汞,其用量按醋酸汞与氢卤酸的摩尔比(1:2)计算,可稍过量,一般加3~5ml以消除氢卤酸的干扰,如供试品为磷酸盐,可以直接滴定,如供试品为硫酸盐,
)也可直接滴定,但由于硫酸酸性较强,用高氯酸滴定液滴定时只能滴至硫酸氢盐(HSO
4
为止,必要时还必须提高滴定介质的碱性,才能使滴定终点突跃增大,终点明显。
如供试品为硝酸盐,因硝酸可使指示剂褪色,无法观察终点,应以电位滴定法指示终点。
SOP-FF-9-015-C 非水溶液滴定法标准操作规程 第3页 共5页 5.2 第二法 本法是用碱滴定液如甲醇钠滴定液(0.1mol/L )或氢氧化四丁基铵滴定液(0.1mol/L )滴定酸性药物。
5.2.1 除另有规定外,精密称取供试品适量〖约消耗碱滴定液(0.1mol/L )8ml 〗,按该药品项下规定溶解,滴定至终点(指示剂终点颜色是以电位滴定时的突跃点为准)。
5.2.2 取供试品测定时所用的试剂,在同条件下作空白试验,用碱滴定液(0.1mol/L )滴定液滴定至相同的终点,其读数用于校正供试品滴定的读数结果。
5.2.3 滴定应在密闭装置中进行,应注意防止溶剂和滴定液吸收空气中的二氧化碳和湿气,以及滴定液中溶剂的挥发,装置中需要通气的部位应连接硅胶及钠石灰管以及吸收水蒸气和二氧化硅。
6.注意事项
6.1 高氯酸有腐蚀性,配制时要注意防护,并应将高氯酸先用冰醋酸稀释,在搅拌下缓缓加入醋酐。
如高氯酸滴定液颜色变黄,即说明高氯酸部分分解,不能应用。
配制高氯酸滴定液和溶剂所用的冰醋酸,或非水滴定用的其他溶剂,含有少量水分时,对滴定突跃和指示剂变色敏锐程度均有影响,因此,常加入计算量的醋酐,使与水反应后生成醋酸,以除去水分。
1mol 水(18.02g)与1mol 醋酐(102.09g )反应,每1g 水需要加醋酐(相对密度1.082)的体积为:
ml 24.5082
.102.1809.102≈⨯ 高氯酸含量为70%相对密度为1.75。
配1000ml 高氯酸滴定液(0.1mol/L )取高氯酸
8.5ml;除去其中水分,应加醋酐的体积为:
ml 23082
.102.18%)3075.15.8(09.102≈⨯⨯⨯⨯ 为了避免高氯酸滴定液(0.1mol/L )中有过剩的醋酐,应测定含水量后加醋酐,并使配成的高氯酸滴定液含水量为0.01%~0.20%。
6.2 配制甲醇钠滴定液(0.1mol/L )称量金属钠时,应先将其表面的无金属光泽的氧化物切除干净,置已知重量的煤油中称取,切碎后分次放入甲醇中,放入前应用滤纸将其表面煤油尽量吸干,配制时,由于甲醇与金属钠反应,放出大量热,反应剧烈,故宜将无水甲醇置于冰浴中冷却,分次加入金属钠,切金属钠时要谨慎操作,决不能让金属钠屑与水接触,以免爆炸燃烧,为了防止羧酸类被测定物在苯中形成缔合物和适当降
SOP-FF-9-015-C 非水溶液滴定法标准操作规程 第4页 共5页 低溶剂的极性,故常采用甲醇-苯混合溶剂;对甲醇-苯的水分限度有一定要求,但用一级试剂,则不必经过脱水,可直接配制,甲醇钠滴定液(0.1mol/L )应临用前标定。
6.3 供试品一般宜用干燥样品,含水分较少的样品也可采用在最后计算中除去水分的方法。
对含水量高的碱性样品,应干燥后测定,必要时亦可加适量醋酐脱水,但应注意避免试样的乙酰化。
6.4 指示剂不宜多加,以1~2滴为宜,指示终点的颜色是由电位滴定突跃来确定。
6.5 滴定操作应在18℃以上室温进行,因冰醋酸流动较慢,滴定到终点后应稍待一会再读数。
6.6 电位滴定用玻璃电极为指示电极,使用前在冰醋酸中浸泡过夜;甘汞电极为参比电极。
实验用过的甘汞电极与玻璃电极先用水或与供试品溶液互溶的溶剂清洗,再用与水互溶的溶剂清洗,最后用水洗净保存;玻璃电极可浸在水中保存备用,供试品溶液中含有醋酐时应尽量减少玻璃电极与之接触的时间,并要及时清洗,避免玻璃电极的损坏。
6.7 用全自动滴定仪时,装置中储备滴定液部分应避光。
6.8 滴定样品与标定高氯酸滴定液的温度差别超过10℃时,应重新标定;未超过10℃时,高氯酸液浓度可按下式校正:
)
(0011.010101t t N N -+= 式中:0.0011为冰醋酸的膨胀系数;
t 0为标定高氯酸滴定液时的温度;
t 1为滴定样品时的温度;
N 0为t 0时高氯酸滴定液的浓度;
N 1为t 1时高氯酸滴定液的浓度。
7.记录与计算
7.1 记录
7.1.1 除按规定做好称量等实验记录外,必须记录滴定液标定时的温度、浓度,测定供试品时的温度,并由测定供试品温度时计算得的滴定液浓度。
7.1.2 如滴定液需重新标定,则应有标定滴定液的全部记录。
7.1.3 记录所用滴定管的编号、供试品及空白试验消耗滴定液的读数及校正值。
SOP-FF-9-015-C 非水溶液滴定法标准操作规程 第5页 共5页 7.2 计算
供试品含量%%100)(21⨯⨯⨯-=M
E F V V 式中 V 1为供试品消耗滴定液(0.1mol/L )的量(ml);
V 2为空白试验消耗滴定液(0.1mol/L )的量(ml );
F 为滴定液浓度的校正因子;
E 为每1ml 滴定液(0.1mol/L )相当被测物质的重量(mg );
M 为取样量(mg)。
8.测定结果的判断
8.1 供试品每次测定应不少于2份。
8.2 原料药作高氯酸滴定液直接滴定者,相对偏差不得过0.2%;用碱滴定液直接滴定者,相对偏差不得过0.3%。