5.1层流火焰传播机理和传播速度
- 格式:pdf
- 大小:2.25 MB
- 文档页数:16


实验二-层流火焰传播速度的测定实验实验二层流火焰传播速度的测定实验一、预备知识1、火焰传播和化学反应燃烧发生了一系列化学反应,在这些反应中,燃料在一些自由基例如O、OH、H碰撞下发生反应,产生更多的H或者是分解成更小的碎片。
例如,CH4被连续地转化成CH3,CH2,CH。
最初形成的各种氧化的中间产物与燃料中的碳结合而首先变为CO,并且燃料中的氢基变为H2,所有的中间产物将接着进一步氧化,再一次通过自由基的作用,而变为CO2和H2O。
总热量的一大部分释放都是发生在第二阶段。
这个次序使燃烧具有自持性,且只能够发生在高温下(如1500K以上)。
因为只有在高温下,才能是自由基产生的速率比消耗的速率快,而这对燃料完全变形以及中间产物的氧化是有必要的。
当点燃预混燃料时,局部温度将提高到一个非常高的值,提高了反应速率,从而也引起燃料的燃烧,并且释放出热量。
通过热传导把热量引导到了未燃的相邻区域,相邻区域的温度以及反应率都提高了,因此燃烧就在那里发生了。
我们知道,热量的扩散是火焰传播的原因,燃烧波传播的速度取决于燃烧后的温度以及未燃混合物的热扩散性。
为了把高温区域的自由基传递到与之接触的低温的未燃混合物中,质量扩散也是很重要的;通常质量和热扩散率是相同的。
在本实验中,未燃混合物的压力和温度与环境大气一致。
火焰传播速度只依赖于混合物中的燃料/氧化剂的数量,它们反过来又控制着火焰的温度。
贫油(Φ<1)和富油(Φ>1)的火焰温度比化学恰当比(Φ=1)时更低因为偏离化学恰当比时多余的物质吸收了由可燃燃料燃烧所产生的热量。
实际上,温度最大值出现在当量比比1稍大一些的地方,因为产物的比热容比化学恰当比时稍低。
如果混合物过贫,燃气温度将太低,而不能产生大量的自由基,因此火焰传播变得不可能。
如果混合物过富,大量的燃料将吸收自由基,因此使燃烧第二阶段不能进行。
因此,火焰传播只在某个当量比范围内才有可能,这被称为可燃极限。



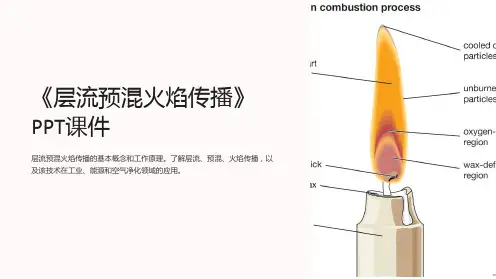
实验二 层流预混火焰传播速度的测定一、实验的理论基础许多工业设备都应用预混气燃烧作为热和能量的生成方式。
如火花点火发动机(汽油机),煤气炉内的燃烧,灾害性的火灾和爆炸都涉及到预混气的燃烧和火焰传播问题。
研究预混气燃烧的最重要参数是层流火焰传播速度。
火焰速度是预混气的基本特性,是研究火焰稳定性以及湍流预混气燃烧的基础。
层流火焰速度定义为给定可燃预混气的一维平面预混火焰在没有热损失时相对于未燃气的移动速度。
用S 0表示。
该定义给出的火焰速度是预混气的单一的固有特性,而与外界流动条件无关,在某些精心设计的实验设备,如相向流火焰设备上,采用激光多普勒速度仪,可以精确测定S 0。
普通的预混火焰设备很难完成满足上述定义中的所有条件。
如采用本生灯测定火焰速度,由于火焰面呈锥形,不是一维火焰,顶端和底部火焰有弯曲。
不可避免地有热损失。
因此测到的是被测点当地的火焰速度或称局部火焰速度,用S 表示。
S 除与可燃预混气的气/油比有关外,还受热损失,火焰拉伸等动力学因素影响。
用其它的实验方法,如平面火焰法,火焰推进法,肥皂泡法,球弹法和圆管法都是只能测定局部火焰速度。
层流火焰理论指出,预混火焰的稳定位置总是位于预混气在火焰面的法向速度分量与火焰速度(总与火焰面垂直)大小相等,方向相反的地方。
当这两个速度不相等时,火焰面就要移动,而扩散火焰总是驻定在燃料与氧化剂为化学计量值的位置上。
在这一位置,燃料与氧化剂混合最均匀,反应率最快。
偏离这一位置,不可能组织起燃烧,扩散火焰没有火焰传播速度的概念,这是预混火焰和扩散火焰最主要的区别之一。
二、实验原理实验采用本生灯测定(局部)火焰传播速度,实验设备与实验二相同。
设计良好的本生灯火焰呈锥形,除顶端和底部火焰弯曲外,中间有较长一段的平直火焰,假定预混气速度沿出口截面分布均匀,火焰前沿各处的气流法向速度相等,把驻定在管口的火焰面简化为正锥形,如图3-1所示。
预混气的速度为u 0,火焰面平直的上点P 的火焰速度为S 。





实验五火焰传播速度测定实验一、实验目的1. 理解火焰传播速度的概念,掌握静压法(管子法)测量火焰传播速度的原理和方法。
2. 测定液化石油气的层流火焰传播速度。
3. 掌握不同的气/燃比对火焰传播速度的影响,测定出不同燃料百分数下火焰传播速度的变化曲线。
二、实验原理层流火焰传播速度是燃料燃烧的基本参数。
正常法向火焰传播速度定义为在垂直于层流火焰前沿面方向上,火焰前沿面相对于未燃混合气的运动速度。
在一定的气流量、浓度、温度、压力和管壁散热情况下,当点燃一部分燃气-空气混合物时,在着火处形成一层极薄的燃烧火焰面。
这层高温燃烧火焰面加热相邻的燃气-空气混合物,使其温度升高,当达到着火温度时,就开始着火形成新的焰面。
这样,焰面就不断向未燃气体方向移动,使每层气体都相继经历加热、着火和燃烧过程,即燃烧火焰锋面与新的可燃混合气及燃烧产物之间进行着热量交换和质量交换。
层流火焰传播速度的大小由可燃混合物的物理化学特性所决定,所以它是一个物理化学常数。
测量火焰传播速度的方法很多,如静压法(管子法)、本生灯法、定容球法、肥皂泡法和粒子示踪法等。
本试验装置是用静压法(管子法)进行测定。
二、实验设备图1 静压法(管子法)测定火焰传播速度装置图图2 实验设备零件四、实验步骤根据步骤操作:11.打开主开关(1)。
打开气体供应源。
12.打开空气控制阀(2),确保空气流进燃烧混合元件(18)。
13.把脚放置在开关板上,打开气体控制阀(3)。
14.使用手动点火器(19),在燃烧器内点燃混合物。
注意:当操作者把脚从脚踏开关移开,燃气电磁阀会自动关闭,一者可以起到安全的作用,二者可以立即关闭气体进行火焰传播速度的测量。
15.当火焰产生后,调节控制元件来得到想要的空气/燃料比。
气体的流速可以通过流速计(5)或(6)测量。
16.当设置好比例后,等待5秒左右直到火焰稳定,然后完全关闭空气和气体控制阀,从脚踏开关移开脚。
同时按下点火按钮(在远程点火箱上)。
实验二-层流火焰传播速度的测定实验实验二层流火焰传播速度的测定实验一、预备知识1、火焰传播和化学反应燃烧发生了一系列化学反应,在这些反应中,燃料在一些自由基例如O、OH、H碰撞下发生反应,产生更多的H或者是分解成更小的碎片。
例如,CH4被连续地转化成CH3,CH2,CH。
最初形成的各种氧化的中间产物与燃料中的碳结合而首先变为CO,并且燃料中的氢基变为H2,所有的中间产物将接着进一步氧化,再一次通过自由基的作用,而变为CO2和H2O。
总热量的一大部分释放都是发生在第二阶段。
这个次序使燃烧具有自持性,且只能够发生在高温下(如1500K以上)。
因为只有在高温下,才能是自由基产生的速率比消耗的速率快,而这对燃料完全变形以及中间产物的氧化是有必要的。
当点燃预混燃料时,局部温度将提高到一个非常高的值,提高了反应速率,从而也引起燃料的燃烧,并且释放出热量。
通过热传导把热量引导到了未燃的相邻区域,相邻区域的温度以及反应率都提高了,因此燃烧就在那里发生了。
我们知道,热量的扩散是火焰传播的原因,燃烧波传播的速度取决于燃烧后的温度以及未燃混合物的热扩散性。
为了把高温区域的自由基传递到与之接触的低温的未燃混合物中,质量扩散也是很重要的;通常质量和热扩散率是相同的。
在本实验中,未燃混合物的压力和温度与环境大气一致。
火焰传播速度只依赖于混合物中的燃料/氧化剂的数量,它们反过来又控制着火焰的温度。
贫油(Φ<1)和富油(Φ>1)的火焰温度比化学恰当比(Φ=1)时更低因为偏离化学恰当比时多余的物质吸收了由可燃燃料燃烧所产生的热量。
实际上,温度最大值出现在当量比比1稍大一些的地方,因为产物的比热容比化学恰当比时稍低。
如果混合物过贫,燃气温度将太低,而不能产生大量的自由基,因此火焰传播变得不可能。
如果混合物过富,大量的燃料将吸收自由基,因此使燃烧第二阶段不能进行。
因此,火焰传播只在某个当量比范围内才有可能,这被称为可燃极限。
解释用本生灯法测试层流火焰传播速度的机理本生灯法是一种常用于测试层流火焰传播速度的实验方法。
其基本原理是通过观察火焰在可燃气体中的传播速度,来确定可燃气体的燃烧特性。
在本生灯法中,可燃气体通过本生灯的喷嘴喷出,形成一个层流火焰。
火焰的传播速度可以通过测量火焰前锋在可燃气体中的移动速度来确定。
具体来说,本生灯法通常包括以下步骤:
1. 准备可燃气体和本生灯:选择需要测试的可燃气体,并将其装入实验装置中。
本生灯通常由一个喷嘴和一个储气罐组成,可以通过调节储气罐的压力来控制可燃气体的流量。
2. 点燃本生灯:将本生灯的喷嘴对准可燃气体,点燃本生灯,形成一个层流火焰。
3. 观察火焰传播速度:通过观察火焰前锋在可燃气体中的移动速度,可以确定火焰的传播速度。
在本生灯法中,火焰的传播速度取决于可燃气体的性质、压力、温度和流量等因素。
通过改变这些因素,可以研究不同条件下火焰传播速度的变化规律,从而深入了解可燃气体的燃烧特性。
本生灯法是一种实验室方法,需要在安全的条件下进行操作。
在实验过程中,应该遵循相关的安全规定,确保实验人员的安全。
火焰传播速度的通俗讲解一、火焰传播速度1. 定义:火焰传播速度是指火焰前锋沿其法线方向相对于未燃可燃混合气的推进速度。
火焰传播速度表征了进行燃烧过程的火焰前锋在空间的移动速度(360百科)的燃烧速度。
2. 解释:其实将火焰传播速度,限定在未燃可燃混合气太局限了,把其定义为火焰在燃烧物表面移动速度(定义2),就容易理解的多。
如图:现在换一种物质很明显燃烧物不同,火焰的的传播速度不同,同样草坪的干湿、荗密程度也会影响到火焰的传播速度,有哪些因素影响火焰传播速度,有关这些我们留待后面再谈,我们现在的着重点是准确的理解火焰传播速度这个概念,我们讨论了处于静态的可燃物的火焰传播速度,现在我们看下处于运动中的可燃物的火焰传播速度:如图,有一股流动着燃气流(也可是我们的煤粉流)m,我们先假设它相对静止,注意仅仅是假设,当我们在这股气流的端点用明火点燃,燃气流m1经过2秒达到B处,如果AB距离是3米,我们就说火焰传播速度是1.5米/秒,燃汽流m2经过2秒到达C处,如AC间的距离是4.80米,我们就说它的火焰传播速度是2.4米/秒。
很明显,因为燃气流总是流动的,而且流速是可变的多样的,我们的燃汽流不动只是为使这个概念更加直观,那么处在流动中的燃汽又有什么变化?我们假设燃汽流以2米/秒同样的速度向前移动,当燃烧经过2秒,燃气流m1的B点的介质实际上到达了B1的位置,而且燃气流m2的c点只到达c1点的位置,B1和C1是火焰的实际位置。
很明显m1燃气流经过2秒的燃烧,火焰前锋从A处,进到了B1处,前移了1米,而m2燃气流的火焰前锋则落到C1处,落后了0.8米,这就是说如果燃料的流动速度高于将使火焰不断前移,最后的结果是熄火;如果燃料的流动速度低于火焰传播速度,将形成回火。
【品味一下气割的割枪和气体打火机的的现象】,【燃烧稳定的条件是:火焰的传播速度等于燃料的流动速度】,有关进一步的原因,我们后面再说,现在我们的主要任务是通过一个动静结合的演示,进步牢固在燃料速度与火焰传播速度不一致时,火焰确实会出现向前或向后移动。