软胶囊车间厂房与设施方案
- 格式:docx
- 大小:41.96 KB
- 文档页数:17

厂区配套工程方案模板范本一、前言随着我国工业化进程的不断加快,越来越多的企业开始规划建设厂区。
在厂区规划建设过程中,配套工程是非常重要的一环,它不仅关系到厂区的正常运转和生产效率,还直接关系到员工的生活质量和环境保护。
因此,编制一份全面、科学、合理的厂区配套工程方案显得尤为重要。
二、厂区基本情况分析1. 厂区位置:厂区位于XX市XX区,距离市中心XX公里,交通便利,地理位置优越。
2. 厂区规模:厂区占地面积XXX平方米,建筑面积XXX平方米,总投资额XX亿元。
3. 厂区环境:周围环境整洁,空气清新,适宜生产和生活。
4. 产业类型:主要从事XXX产业,生产规模大,技术含量高,对配套工程要求较高。
三、厂区配套工程方案1. 厂房建设:根据生产生活需要,厂区规划建设主要包括生产车间、办公楼、员工宿舍、仓储库房等。
厂房建设需符合国家相关标准和规定,确保使用安全。
2. 道路交通:在厂区规划中必须充分考虑道路交通布局,包括内部道路、停车场、货车通道等,保障货物运输和员工出行的顺畅。
3. 环境治理:对厂区周边环境进行治理,包括绿化工程、污水处理设施、垃圾处理设施等,保护周边环境和生态平衡。
4. 综合管网:编制综合管网规划,包括供水、供气、供电、通讯等配套设施,确保生产和生活所需资源的供应。
5. 安全设施:设置消防设施、安全出口、紧急处理设施等,保障员工和厂区安全。
6. 绿化工程:在厂区规划中充分考虑绿化工程,增加绿地面积,提高环境舒适度和美观度。
7. 餐饮服务:提供员工餐厅和饮水设施,保障员工的正常生活需求。
8. 健康服务:设置医务室、体检中心等,保障员工健康和安全。
四、实施方案1. 配套工程实施要求:根据配套工程方案,制定实施计划,确保施工质量和进度。
2. 技术标准:遵循国家相关技术标准和规范,确保工程质量,提高工程效益。
3. 施工组织:合理组织施工队伍,合理安排施工作业,确保施工安全和质量。
4. 环保工程:加强工程环境监测和治理,确保施工期间环境保护。

医药净化车间工程方案范本一、工程项目概述医药净化车间工程是指对医疗器械、药品和相关产品的生产制造工艺进行净化,保证产品质量和生产过程的卫生安全的一项工程。
该工程方案旨在通过设计和建设符合GMP要求的医药净化车间,确保医药产品的生产环境符合标准,保障产品质量和患者用药安全。
二、工程项目内容1.建设地点:工程项目位于XX省XX市,需根据当地环境和土地利用规划选址。
2.建设规模:医药净化车间建设总面积约XX平方米,包括生产区、辅助区、办公区等。
3.建设内容:包括净化车间装修、设备采购、动力系统建设、通风空调系统等。
三、工程建设标准1.符合GMP要求:车间设计和建设符合药品生产质量管理规范的要求,确保生产环境符合GMP标准。
2.符合环保要求:建设过程符合环保标准,产品生产过程不会对环境造成污染。
3.符合安全要求:车间设计和建设符合安全生产标准,保障工作人员和产品的安全。
四、工程建设方案1.车间设计:根据GMP要求,合理划分生产区、辅助区和办公区,确保生产流程清晰、物料分离,同时便于管理和监控。
2.装修材料:选择符合GMP要求的装修材料,包括墙面涂料、地板材料等,确保其耐腐蚀、易清洁、无细菌滋生等特性。
3.设备采购:选购符合GMP标准的生产设备和生产线,确保生产过程可控、无污染。
4.动力系统:医药净化车间应配置可靠的电力、水、气等动力系统,确保设备正常运转和生产工艺所需的各种动力。
5.通风空调系统:医药净化车间需配置高效的通风系统和空调系统,确保车间内温度、湿度、洁净度等符合生产要求。
五、工程建设进度安排1.项目立项:筹备工作、选址、项目立项等,拟在XX年XX月完成。
2.设计方案:进行车间设计、方案确认、施工图设计等,拟在XX年XX月完成。
3.设备采购:选购生产设备、动力设备、通风空调设备等,拟在XX年XX月完成。
4.工程施工:进行车间装修、设备安装、动力系统建设等,拟在XX年XX月完成。
5.竣工验收:车间建设完成后进行竣工验收并取得相关资质,拟在XX年XX月完成。

年产3亿粒复方氨酚烷胺胶囊制剂车间设计摘要:本设计遵照课程设计和GMP有关药厂设计的有关规定,选取复方氨酚烷胶囊为主要产品,完成了年产3亿粒胶囊车间设计。
本设计主要内容包括:制备方法、工艺流程、物料衡算、设备选型、厂房布局,工艺管道流程设计以及“三废”的处理。
在本设计中采用的仍是传统的制备方法,其主要包括制粒、干燥、整粒、灌装、抛光等工序。
物料衡算根据设计任务年产量逆推,分别计算了每年、每天、每批以及每小时的任务量及相应待处理物料质量。
设备选型则主要是根据物料衡算所计算的各步骤生产能力要求,且满足设计中的选择的各项技术要求,选择的各个设备的型号。
在车间平面布置上,遵循了人流、物流相互分开,避免交叉污染的原则,同时兼顾方便生产,完成了车间布局设计。
工艺管道流程图根据工艺流程图的要求,以工艺介质为主线,考虑满足正常生产操作、开停工,安全、环境保护和事故处理的要求,并考虑维修需要和操作灵活的原则进行设计的。
在“三废”的处理上面本设计主要突出了环保、节能、经济的特点,在本设计中提供了运用生物处理的解决方案。
通过上述思路完成了本次设计,该设计的完成极大地提高了我们综合运用各种知识的能力,极大地丰富了对胶囊剂车间的相关认识。
目录1.前言 (3)1.1设计任务书 .................................................................................. 错误!未定义书签。
1.2 研究背景和意义 (4)2. 工艺流程设计 (6)2.1 生产工艺流程示意图 (6)3.物料衡算 (9)3.1 药物颗粒质量计算 (9)3.2 包装材料计算 (12)4. 设备的选型 (13)4.1 粉碎设备 (14)4.2 筛分设备 (15)4.3 制粒设备 (16)4.4 干燥设备 (16)4.5 整粒设备 (17)4.6 胶囊填充设备 (18)4.7 抛光机 (19)4.8 包装机 (19)4.9工艺主要设备一览表 (20)5.设备详述 (21)5.1WFJ-15微粉碎机 (21)5.2 ZS-365型振荡筛 (23)5.3 SL-50型高效湿法制粒器 (26)5.4 XF50型卧式沸腾干燥器 (27)5.5 NJP-3500全自动胶囊填充机 (28)6. 厂房布局 (30)6.1 车间布置的主要依据和要求 (30)6.2车间布置平面图 (31)6.3车间产尘的处理 (31)6.4车间排热、排湿及臭味的处理 (32)6.5参观走廊的设置 (32)6.6 安全门的设置 (32)7. 洁净区的设计 (33)7.1 车间净化措施 (33)8.“三废”处理及其综合利用 (36)8.1 废水的处理 (37)8.2 废气的处理 (38)8.3 废渣的处理和综合利用 (38)1.前言设计内容和要求:1、确定工艺流程及净化区域划分;2、每人详细叙述一个胶囊生产工艺设备的工作原理、结构组成及关于此设备国内外的现状、研究前沿。

保健食品良好生产规范(修订稿)第一章总则第一条为规范保健食品生产质量管理,根据《中华人民共和国食品安全法》及其实施条例,制定本规范。
第二条本规范是保健食品生产质量管理的基本准则,规定了保健食品生产企业的机构与人员、厂房与设施、设备、物料与成品、生产管理、质量管理和文件管理等方面的基本要求。
第三条企业应当严格执行本规范,坚持诚实守信,禁止任何虚假、欺骗行为,确保产品质量安全。
第二章机构与人员第四条企业应当建立与保健食品生产相适应的管理机构,各机构和人员职责应当明确。
第五条企业应当设立独立的质量管理部门,履行质量保证和质量控制的职责。
第六条企业应当配备与保健食品生产相适应的具有专业知识、生产经验及组织能力的管理人员和技术人员,专职技术人员的比例应不低于职工总数的5%。
第七条企业负责人是保健食品质量安全的主要责任人,全面负责企业日常管理,应当熟悉保健食品相关的法律法规,对本规范的实施负责。
第八条生产管理负责人和质量管理负责人必须是专职人员,并且不得互相兼任。
应当具有与所从事专业相适应的大专以上学历,或中级技术职称,具有至少三年从事保健食品生产和质量管理的实践经验,接受过与所生产产品相关的专业知识培训。
第九条生产管理负责人主要职责:(一)确保保健食品按照批准的工艺规程生产、贮存,以保证保健食品质量;(二)批准与生产操作相关的各种岗位操作规程并确保严格执行;(三)确保生产记录在提交质量管理部门之前经指定人员审核,生产偏差已经报告、调查、评价并得到处理;(四)确保厂房和设备的维护保养,以保持其良好的运行状态;(五)确保完成各种必要的验证工作;(六)协助质量管理部门审核和监督物料的供应商;(七)确保生产人员都已经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容。
第十条质量管理负责人主要职责:(一)审核并放行物料、中间产品和成品;(二)确保在成品放行前完成对批生产记录和检验记录的审核;(三)确保完成所有必要的检验;(四)批准质量标准、取样方法、检验方法和其他质量管理规程;(五)审核和批准所有与质量有关的变更;(六)确保所有重大偏差已经过调查并得到及时处理;(七)批准并监督委托检验;(八)监督厂房和设备的维护情况,以保持其良好的运行状态;(九)确保完成各种必要的验证工作,审核和批准验证方案和报告;(十)确保完成生产和质量内部评审;(十一)审核和监督物料供应商;(十二)确保所有与安全性监测和质量有关的投诉都经过调查,并得到及时正确的处理和上报;(十三)确保质量管理人员经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容。

五酯软胶囊生产工艺验证文件验证编号:VM-212-02目录一、验证方案:1.验证的组织和职责2.验证方案验证目的验证范围验证方案说明2.1概述2.2背景资料2.3工艺流程图3.验证内容3.1生产系统要素的评价3.1.1目的3.1.2标准操作规程文件3.1.3评价3.2生产工艺变量的评价3.2.1目的3.2.2标准操作规程文件3.2.3评价二、验证实施记录、结果1.生产系统要素评价实施记录及结果2.生产工艺变量评价实施记录及结果三、验证报告1.验证报告的起草、审核与批准2.验证报告概要3.验证结果小结3.1生产系统要素评价结果小结3.2生产工艺变量评价结果小结4.验证结论、总体评价及建议5.验证报告四、验证合格证书1.验证合格证书批准、发放程序2.验证合格证书验证申请表申请人:年月日验证方案1.验证组织和职责1.1组织机构:验证负责人验证领导小组(质量、生产、工程部负责人)验证工作小组1.2职责:1.2.1验证负责人:全面负责验证工作的组织实施,审批各验证项目、验证方案、验证报告、批准发放验证合格证书。
1.2.2验证领导小组:负责公司验证管理日常工作,制定验证计划,确立验证项目,审核验证方案和验证报告,组织协调和监督各项验证工作实施,起草发放验证合格证书,管理验证文件档案。
1.2.3验证工作小组:负责验证方案的起草、设计、经批准后组织力量执行。
负责收集、整理验证数据,起草阶段性和最终结论文件,上报验证领导小组及负责人审批。
验证工作小组成员及职责2.验证方案验证目的:保证按照产品工艺规程和各种标准操作程序所要求的系统要素和工艺条件所生产的产品符合其质量标准。
验证范围:按照验证方案提供的系统的验证计划,评价五酯软胶囊生产系统要素和生产过程中可能影响产品质量的各种生产工艺变化因素。
验证方案说明:五酯软胶囊产品是我公司在2005年8月通过定期再验证,经过1年时间的正常生产,在生产系统、设备正常运行,未进行大修和工艺未改变的情况下,对本产品工艺进行定期再验证,旨在证明该工艺的稳定性和生产系统的可靠性,以确保产品生产过程的质量稳定。


目录0 概述部分 (1)1 总论 (2)2 总图运输 (6)3 工艺工程设计 (6)4.公用工程设计 (9)5土建 (13)6 环境保护 (15)7消防 (16)8节水措施 (21)9劳动安全卫生 (21)10附图 (21)0 概述部分0.1项目名称:纯爷们药厂一期工程0.2设计规模:本项目建成后生产正常运行时生产能力为年产口服液6亿瓶。
0.3建设地点:地球村经济技术开发区也门路10086号0.4建设性质:新建0.5建设范围厂区总体规划(生产区、辅助区、办公区、生活区)。
综合生产车间及其辅助工程(包括循环水站、变电站、换热站、机修车间)等的工艺设备、土建、采暖通风、电气设备、给排水、自控设施、电信专业的工程设计。
0.6设计原则本工程遵循设计方案优化、项目投资合理、满足工程建设规模的原则,采用国内先进的生产技术和装备,使车间符合GMP要求,项目建成后能取得较高的经济效益。
本工程按照国家药品监督管理局办法的《药品生产管理规范》98年修订版及96年发布的《医药工业洁净厂房设计规范》的要求进行设计。
土建、消防、电气设备、环境保护、劳动保护等均按国家有关规范规定进行设计。
本工程的关键生产设备立足国际先进、成熟、自动化程度搞的设备,其他设备立足国内先进水平,以达到高起点、高标准的目的。
0.7工厂组成综合生产车间:内含有前处理车间、软胶囊车间、口服液车间、;仓库及检验中心。
另含有循环水站、换热站、纯化水站、空压站、变电所等。
0.8门卫:两个门卫室。
其中:一个人流门卫室、一个物流门卫室。
0.9建设规模:本次工程建设综合车间为5490m20.10产品方案1 总论1.1项目概况1.1.1项目名称:纯爷们药厂一期建设工程1.1.2企业概况企业名称:纯爷们药厂法人代表:制药四12爷们企业概况:本药厂是由广东工业大学06级制药四班12为爷们研究设计的,所以取名叫纯爷们药厂,主要生产清热解毒口服液。
年产量为6亿瓶。
1.1.3项目概况拟建地点:地球村经济技术开发区也门路10086号设计规模:本项目建成后生产正常运行时生产能力为年产口服液6亿瓶。

年产2.5亿粒胶囊GMP车间工艺设计第一章工艺概述1.1硬胶囊概述胶囊剂分为硬胶囊、软胶囊(胶丸)、肠溶胶囊、缓释胶囊与控释胶囊。
硬胶囊剂系指将药物,或加辅料制成的粉末、颗粒、速释或缓控释小球,充填于空心胶囊中制成;软胶囊剂系指将一定量的药液包封于球形或椭圆形的软质囊中,可用滴制法或压制法制备;肠溶胶囊剂系指硬胶囊或软胶囊用适宜肠溶材料制备而得,或用肠溶材料包衣的颗粒或小丸充填于胶囊制得,不溶于胃液,但能在肠液中崩解而释放活性成分。
胶囊剂一般供口服用,也可供其他部位如直肠、阴道、植入等使用。
胶囊剂的主要特点有:①可掩盖药物不良臭味和刺激性,外形整洁、便于识别、携带,使用方便;②药物分散、溶出快,血药浓度达峰时间比片剂短,有较高的生物利用度;③不稳定的药物,如维生素、抗生素等,装入胶囊后可提高稳定性;④药物可以不同形态装入胶囊,以适应不同性质药物的吸收和使用;⑤可制成速释、缓释、控释、肠溶等多种类型的胶囊剂,以满足各种医疗用途的需要。
但有些药物不能制成胶囊剂,如药物的水溶液或乙醇溶液、易溶性的刺激性药物、易风化的药物、吸湿性药物等。
药品标准规定胶囊剂应整洁,不得有粘结、变形、渗漏或破裂现象,并应无异臭;应按照《中国药典》进行装量差异、崩解时限、微生物限度及其他项目检查,应符合规定。
胶囊剂应密封贮存,存放环境温度不应过高,湿度适宜,以防止发霉、变质。
硬胶囊一般性质量要求(1)硬胶囊内容物的含水量中国药典2000版规定内容物含水量不得超过9.0﹪。
(2)空胶囊的质量根据GB 13731—92,对药用明胶囊的技术要求包括:外观质量、理化性能、微生物检查三大方面。
(3)装量差异硬胶囊的装量差异与所填充颗粒的流动性、黏性等有关,最主要的还是所用的充填工艺,手工、半机械、全自动三种充填工艺中以者的充填量为最准确。
1.2设计目的首先满足药品的工业化生产要求,按照药品的生产工艺流程提供最佳布置。
其次《药品生产质量管理规范》(GMP)是药品生产和质量管理的基本准则,其中心思是:任何药品质量的形成是生产出来的,而不是检验出来的。
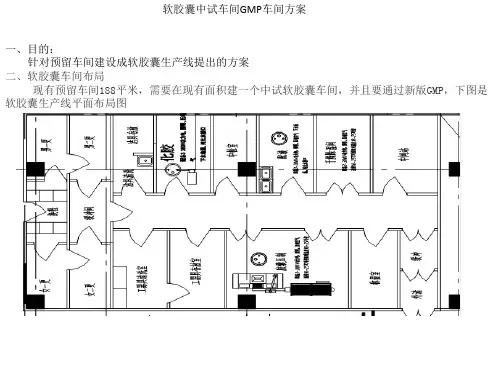
制药车间批量扩大改造项目实施方案一、项目概况、背景二、项目目标三、放大工艺设计四、设备投入必要性五、经济效益分析六、项目职责分工七、可行性方案7.1设备调研7.2项目变更内容7.3项目风险评估八、项目进度九、项目停产实施计划一、项目概况X车间软胶囊最大年产能4万件左右,已达产能上限,不能满足逐年增长的销售需求。
计划在目前洁净区通过场地改造、部分设备更换,把批量扩大至2倍,产能提升至约8万件/年。
项目总投入292万,其中设备采购282万,占总投入96.57%;改造投入10万,占比3.43%。
主要投入用在设备扩能。
结合项目实际情况和疫情影响,项目建设周期7个月,其工作内容包括:设备前期调研、立项设计、招投标、设备制造、施工改造、调试验证。
预计在2020.10月完成验收。
二、项目目标1.1292万实现产能提高2倍(8万件/年);1.2选用先进设备、保证质量稳定;1.3符合安全环保消防职业健康要求;1.4车间停产施工总时间40天内,10月验证完成。
三、批量放大工艺设计更换配料化胶罐实现批量扩大;同时压丸延长生产时间、干燥增加设备、拣丸增加人员、内包更换设备实现工序产能同步放大。
四、设备投入必要性五、经济效益分析都折算成400件计。
六、项目职责分工七、可行性方案7.1设备调研设备调研详细信息见附表1.7.2项目变更内容7.3项目风险评估八、项目总时间进度九、项目停产实施计划(40天)40天停产计划:进度风险评估:1.厂房改造:打防爆墙预计7天完成;拆墙工具质量、人数;2.设备进场:拆装配料罐、化胶罐、内包线大型设备,需提前方案考虑充分、移动工具到位;3.安装调试:配料化胶罐设计辅机房、内包线联动复杂,必须5年以上的工程师调试;4.验证检验数据及时出报告;5.药政合规性,变更类型确定,验证结束后是否需等备案批准、现场检查批准再生产;附表:1、厂房改造设计布局图2、空调改造设计图3、扩产设备调研4、停产改造40天进度表5、验证计划表6、改造前布局图。

保健食品生产企业厂房设计与设施要求首先,厂房设计要满足生产工艺的需求,包括原料储存、生产线布局、生产工艺的流畅性等。
原料储存区需要有充足的空间,能够储存各种原料,并且要具备合适的温湿度控制设施。
生产线布局要合理,能够确保生产流
程的连续性和高效性。
其次,厂房要具备适当的通风设施,以确保室内空气的流通和空气质
量的良好。
特别是在生产过程中产生的尘埃、异味、有害气体等应及时排除。
核心的设施包括生产设备、工艺设备和质检设备。
生产设备要按照食
品生产的要求进行选型和设置,并且要定期进行维护和保养。
工艺设备包
括混料机、制粒机、包装设备等,要保持设备的良好工作状态,确保产品
的质量。
质检设备包括检测仪器、试剂等,要具备准确、灵敏的检测能力,以确保产品的安全性和有效性。
此外,厂房的卫生设施也是非常重要的。
卫生设施包括洗手间、休息室、更衣室等,要建设完善,并且要保持干净整洁。
员工在厂房内工作时,要有舒适、安全的工作环境。
最后,厂房的消防设施也是必不可少的。
要根据厂房的面积和布局,
设置消防器材和消防通道,确保在发生火灾等突发事件时,能够及时报警、疏散人员和扑灭火灾。
保健食品生产企业的厂房设计与设施要求是非常严格和细致的,必须
符合国家有关食品安全和卫生标准的要求。
同时,企业自身也应该加强对
厂房的管理和维护,确保生产环境的整洁和卫生,以生产出高质量、安全
的保健食品。
目录目录 (1)第1章胶囊剂工艺设计概述 (3)1.1项目概述 (3)1.2设计依据 (3)1.3设计内容 (4)1.4设计指导思想和设计原则 (4)第2章工艺流程及净化区域划分 (5)2.1生产方案、建设规模及包装方式 (5)2.1.1 生产方案 (5)2.1.2 生产制度 (5)2.1.3 生产规模 (5)2.1.4 胶囊剂的包装 (6)2.2生产工艺流程 (6)2.2.1生产工艺流程制定的原则 (6)2.2.2硬胶囊剂的常见生产工艺 (6)2.2.3工艺简介 (7)2.2.4工艺流程 (9)2.3胶囊剂洁净区域划分 (11)2.3.1厂房的洁净级别的划分以及洁净厂房的要求 (11)2.3.2洁净室(区)空气洁净度级别表 (11)2.3.3胶囊剂洁净区域划分 (11)第3章物料衡算 (12)3.1物料质量衡算 (12)3.2胶囊数量计算 (12)第4章工艺机械设备选择与说明 (14)4.1工艺设备选型的步骤 (14)4.1.1工艺设备选型依据 (14)4.1.2制药设备GMP设计通则的具体内容 (14)4.1.3设备选型说明 (15)4.2设备简介 (15)4.3设备的选型 (20)4.3.1粉碎设备 (20)4.3.2筛分设备 (20)4.3.3一步制粒设备 (20)4.3.4混合设备 (21)4.3.5整粒设备 (21)4.3.6全自动胶囊填充机 (21)4.3.7抛光机 (22)4.3.8铝塑包装机 (22)第5章工艺主要原材料及公用系统消耗 (23)5.1原料的技术规格 (23)5.2主要原材料消耗 (23)5.3公用系统消耗 (23)第6章车间(设备)布置 (25)6.1车间设计原则 (25)6.2车间平面布置 (25)6.2.1车间布置平面图 (25)6.2.2车间产尘的处理 (26)6.2.3车减排热、排湿及臭未处理 (26)6.2.4参观走廊的设置 (27)6.2.5安全门的设置 (27)6.3设备的安装 (27)6.4车间定员 (29)第7章采暖通风与空调公用工程 (31)7.1设计要求 (31)7.2设计参数 (31)7.3洁净室换气次数 (31)7.4洁净室压力 (32)7.5噪声 (32)7.6通气量 (32)第8章结束语 (33)参考文献 (34)附录 (35)第1章胶囊剂工艺设计概述1.1 项目概述胶囊剂(capsules)系指将药物填装于空心硬质胶囊中或密封于弹性软质胶囊中而制成的固体制剂;是目前临床应用最广泛的剂型之一。
第一章绪论工艺过程:利用劳动工具改变劳动对象的形状、大小、成分、性质、位置或表面形状,使之成为预期产品的过程设备:一般指内部发生化学反应或某种场(如热、电、重力)作用于加工对象,如反应釜机械:用机械功改变劳动对象的外形、状态等,如压片机制药机械/设备:用于制药工艺过程的机械/设备制药机械分类(8类)1原料药设备及机械,发酵罐、离心机2制剂机械,压片机、胶囊灌装机3药用粉碎机械,球磨机、气流粉碎机4饮片机械,选药机,洗药机,烘干机5药用纯水设备,电渗析设备,多效蒸馏水器6药品包装机械,印字机、装盒机7药物检测设备,药物溶出仪、崩解仪8制药辅助设备,空气净化设备,泵制剂机械——14类←片剂机械,注射剂机械←西林瓶粉、水针剂机械←大输液剂机械,硬胶囊剂机械←软胶囊剂机械,丸剂机械←软膏剂机械,栓剂机械←口服液剂机械,药膜剂机械←气雾剂机械,滴眼剂机械←糖浆剂机械第二章药物制剂工程技术粉碎度:粉碎前粒度与粉碎后粒度之比低温粉碎:物料在低温时脆性增加、韧性、延伸性降低。
优点:粉碎效果好混合粉碎:两种以上的物料同时粉碎。
优点:可避免物料单独粉碎时粘性物料或热塑性物料黏壁或附聚,粉碎、混合可同时进行湿法粉碎:在药物中加入适量的水或其它液体进行研磨。
原理:液体对物料有渗透力和劈裂作用,可以降低粘附性。
优点:避免粉尘,减轻有毒药物或刺激性药物的危害开路粉碎:进料和出粉都是连续进行循环粉碎:经粉碎机粉碎的物料通过分子筛或分级设备使粗颗粒重返粉碎机粉碎目的:1提高难溶性药物的溶出度和生物利用度2提高制剂质量3促进制剂中各成分的混匀4有利于天然药物有效成分的提取.粉碎方式及设备←粉碎方式:1闭塞粉碎和自由粉碎2开路粉碎和循环粉碎(图)3干法粉碎和湿法粉碎4低温粉碎5混合粉碎粉碎设备:球磨机,冲击式粉碎机(也叫万能粉碎机,锤式粉碎机,冲击柱式粉碎机,气流式粉碎机),常用小型粉碎机,微粉碎,辊式粉碎机,振动磨影响筛分的因素1物料粒度越接近分界直径(筛孔直径)越不易分离2粒子形状。
软胶囊车间厂房与设施验证方案编号:SVP-CF-006-00目录1. 概述2. 验证标准3. 文件检查4. 仪器仪表的校准5. 洁净室装修6. 空气净化系统安装确认7. 空气净化系统运行确认8.洁净度测定9. 附件一、概述1.1简介软胶囊车间位于综合制剂楼的二楼东边,框架结构厂房,层高 5.4m,洁净区吊顶高度2.7m,沸腾制粒区域局部吊顶抬高,技术夹层安装用于保证洁净要求的空调系统和工艺管线,水电气(汽)管道等。
此车间主要用于生产桂枝茯林软胶囊。
整个生产区域面积2058m2,其中洁净区约1643m2,洁净级别为10万级,独立空气净化送排风系统,该车间设有高效过滤器450*450型32个,630*630型33个,780*780型17个。
此车间由安徽机械设计院设计,净化区由江苏姑苏净化科技有限公司施工,彩钢板隔断。
1.2验证范围此次验证主要涉及工艺布局、空气净化系统、土建、洁净区装修等。
1.3验证目的检查并确认生产厂房符合设计要求,空气净化系统符合GMP生产要求。
1.4验证职责:1.5验证计划:验证工作时间安排如下:二.验证标准:三、文件检查结论:执行人:日期复核人:日期四、仪器仪表的校准在空气净化系统的测试、调整及监控过程中,需要对空气的状态参数、冷热介质的物理参数、空调设备的性能、房间的洁净度等进行大量的测定工作。
以便将测得的数据与设计数据进行比较、判断。
此次验证所涉及的仪器仪表校准工作由于公司暂不具备校准条件与相关人员,全部送交安徽省长江计量局进行统一校准并出具计量局校验合格证。
本次验证只需对校准后的仪器仪表进行检查,确保在有效期内使有。
仪器仪表的校准包括空气净化系统测试用仪器仪表校准和空气净化系统包含的仪器仪表校准校准情况见附录3校准结论:检查人:日期复核人:日期五、洁净室装修5.1 建筑装修检查目的:根据GMP及本公司建筑物检查要点的要求,对地面、墙、门窗、吊顶、地漏、管道、照明设施进行检查。
年产8000万盒盐酸左氧氟沙星胶囊(规格0.1g*12粒/盒)的车间工艺设计摘要:近年来,无论是国际市场还是国内市场,左氧氟沙星都呈热销态势,销售额连年大幅增长,制成胶囊剂能掩盖药物不良气味,提高药物稳定性。
盐酸左氧氟沙星的主要作用机制为抑制细菌DNA旋转酶的活性,阻碍细菌DNA复制,具有抗菌谱广、抗菌作用强的特点。
适用于敏感细菌引起的轻、中度感染,如呼吸系统感染、泌尿系统感染、生殖系统感染、皮肤软组织感染等。
本设计主要从车间设计原则与指导思想、生产工艺流程、物料衡算、设备的选型、车间平面布置、空调净化系统和环境保护等多方面体现盐酸左氧氟沙星胶囊的车间工艺设计。
本次设计的生产工艺简单,比较适合中小型企业生产。
关键词:左氧氟沙星胶囊剂工艺流程车间布置Annual output of 80 million boxes of levofloxacin hydrochloride capsules in the workshop Process design(specification:0.1g*12/box) Abstract:I n recent years, both in the international market and domestic market, levofloxacin is sell like hot cakes, sales growth for years, made into capsule drugs can cover up the bad smell, improve drug stability.The main effect of levofloxacin hydrochloride mechanism for inhibiting bacterial DNA gyrase activity, inhibiting bacterial DNA replication, has the characteristics of wide antimicrobial spectrum, strong antibacterial activity.Suitable for light, moderate infections caused by sensitive bacteria, such as respiratory system infection, urinary tract infection, infection of the reproductive system, skin and soft tissue infection, etc.The design principles and guiding ideology, mainly from the workshop production process, material balance, equipment selection, shop layout, air conditioning purification system and environmental protection and other aspects of levofloxacin hydrochloride capsules workshop process design.The design of simple production technology, suitable for small and medium-sized enterprise production.Keywords: levofloxacin; capsule; process; workshop layout目录引言 (1)1、胶囊剂的概述 (6)2、盐酸左氧氟沙星胶囊 (7)第一章指导思想和设计原则 (9)1.1 指导思想 (9)1.2 设计原则 (9)1.2.1 厂区的选择和布置 (9)1.2.2 工艺流程 (9)1.3 设备的选型 (10)1.4 制剂车间的布置 (10)1.5 空调净化系统 (10)第二章工艺流程设计 (11)2.1 工艺设计参数 (11)2.1.1 产品方案 (11)2.1.2 生产计划 (11)2.2生产工艺设计 (11)2.2.1粉碎筛分 (11)2.2.2混合 (12)2.2.3 制粒 (12)2.2.4 干燥 (12)2.2.5 填充 (12)2.2.6包装 (12)2.3 工艺流程示意图 (13)第三章物料衡算 (14)3.1 初步物料衡算 (14)3.2 质量守恒定律 (14)3.2.1质量守恒定律 (14)3.2.2衡算基准 (15)3.3物料衡算流程方框图 (17)第四章设备的选型 (19)4.1、粉碎设备 (19)4.1.1 粉碎设备的类型 (19)4.1.2 粉碎设备的选型 (20)4.2筛分设备及选型 (21)4.2.1筛分设备 (21)4.2.2筛分机选型 (22)4.3混合设备 (22)4.3.1 混合设备的类型 (22)4.3.2混合设备的选型 (23)4.4 制粒和干燥 (24)4.4.1制粒设备 (24)4.4.3设备的选型 (25)4.5填充设备 (26)4.5.1填充设备的类型 (26)4.5.2填充设备的选型 (28)4.6 辅助包装设备及其他 (29)4.6.1铝塑自动泡罩包装机 (29)4.6.2装盒机 (29)4.6.3装箱机 (30)4.6 主要工艺设备 (32)第五章车间的平面布置设计 (33)5.2 车间平面布置图 (34)5.3车间布置GMP要求 (34)第六章空调系统设计 (36)6.1 空气净化要求 (36)6.2生产车间空调净化系统的设计 (36)6.2.1设计参数 (36)6.2.2 洁净室空调洁净化方案 (37)6.2.3空气过滤器 (39)6.2.4风量计算 (39)第七章环境保护及污染处理 (41)7.1 废水的处理 (41)7.2 废气的处理 (41)7.3 废渣的处理 (42)7.4 噪声的控制 (42)参考文献 (43)引言1、胶囊剂的概述胶囊剂[1]是一种常见的固体剂型,药用成分以及辅料被填封于空心的软质胶囊中或硬质胶囊中而制成。