5种叶绿素荧光参数
- 格式:docx
- 大小:14.88 KB
- 文档页数:1

部分叶绿素荧光动力学参数的定义:F0:固定荧光,初始荧光(minimalfluorescence)。
也称基础荧光,0水平荧光,是光系统Ⅱ(PSⅡ)反应中心处于完全开放时的荧光产量,它与叶片叶绿素浓度有关。
Fm:最大荧光产量(maximalfluorescence),是PSⅡ反应中心处于完全关闭时的荧光产量。
可反映经过PSⅡ的电子传递情况。
通常叶片经暗适应20 min后测得。
F:任意时间实际荧光产量(actualfluorescence intensity at any time)。
Fa:稳态荧光产量(fluorescence instable state)。
Fm/F0:反映经过PSⅡ的电子传递情况。
Fv=Fm-F0:为可变荧光(variablefluorescence),反映了QA的还原情况。
Fv/Fm:是PSⅡ最大光化学量子产量(optimal/maximal photochemical efficiency of PSⅡin the dark)或(optimal/maximalquantum yield of PSⅡ),反映PSⅡ反应中心内禀光能转换效率(intrinsic PSⅡefficiency)或称最大PSⅡ的光能转换效率(optimal/maximalPSⅡefficiency),叶暗适应20 min后测得。
非胁迫条件下该参数的变化极小,不受物种和生长条件的影响,胁迫条件下该参数明显下降。
Fv’/Fm’:PSⅡ有效光化学量子产量(photochemicalefficiency of PSⅡin the light),反映开放的PSⅡ反应中心原初光能捕获效率,叶片不经过暗适应在光下直接测得。
(Fm’-F)/Fm’或△F/Fm’:PSⅡ实际光化学量子产量(actual photochemical efficiency of PSⅡin the light)(Bilger和Bjrkman,1990),它反映PSⅡ反应中心在有部分关闭情况下的实际原初光能捕获效率,叶片不经过暗适应在光下直接测得。

第一节 叶绿素荧光参数及其意义韩志国,吕中贤(泽泉开放实验室,上海泽泉科技有限公司,上海,200333)叶绿素荧光技术作为光合作用的经典测量方法,已经成为藻类生理生态研究领域功能最强大、使用最广泛的技术之一。
由于常温常压下叶绿素荧光主要来源于光系统II 的叶绿素a ,而光系统II 处于整个光合作用过程的最上游,因此包括光反应和暗反应在内的多数光合过程的变化都会反馈给光系统II ,进而引起叶绿素a 荧光的变化,也就是说几乎所有光合作用过程的变化都可通过叶绿素荧光反映出来。
与其它测量方法相比,叶绿素荧光技术还具有不需破碎细胞、简便、快捷、可靠等特性,因此在国际上得到了广泛的应用。
1 叶绿素荧光的来源藻细胞内的叶绿素分子既可以直接捕获光能,也可以间接获取其它捕光色素(如类胡萝卜素)传递来的能量。
叶绿素分子得到能量后,会从基态(低能态)跃迁到激发态(高能态)。
根据吸收的能量多少,叶绿素分子可以跃迁到不同能级的激发态。
若叶绿素分子吸收蓝光,则跃迁到较高激发态;若叶绿素分析吸收红光,则跃迁到最低激发态。
处于较高激发态的叶绿素分子很不稳定,会在几百飞秒(fs ,1 fs=10-15s )内通过振动弛豫向周围环境辐射热量,回到最低激发态(图1)。
而最低激发态的叶绿素分子可以稳定存在几纳秒(ns ,1 ns=10-9 s )。
波长吸收荧光红B蓝荧光热耗散最低激发态较高激发态基态吸收蓝光吸收红光能量A图1 叶绿素吸收光能后能级变化(A )和对应的吸收光谱(B )(引自韩博平 et al., 2003)处于最低激发态的叶绿素分子可以通过几种途径(图2)释放能量回到基态(韩博平 et al., 2003;Schreiber, 2004):1)将能量在一系列叶绿素分子之间传递,最后传递给反应中心叶绿素a ,用于进行光化学反应;2)以热的形式将能量耗散掉,即非辐射能量耗散(热耗散);3)放出荧光。
这三个途径相互竞争、此消彼长,往往是具有最大速率的途径处于支配地位。
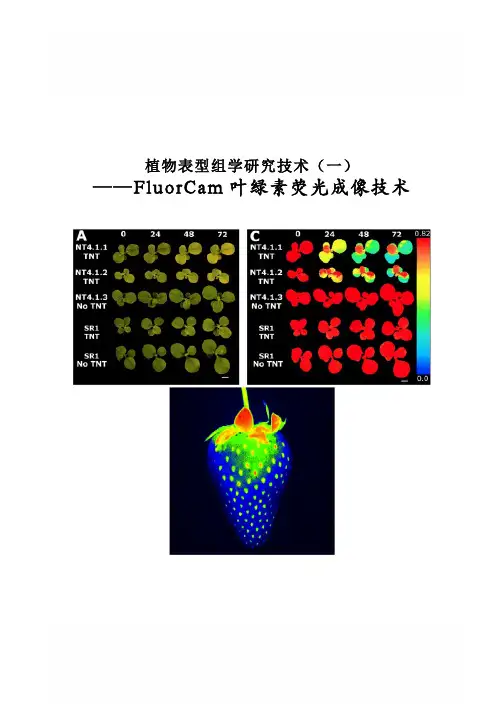
植物表型组学研究技术(一) ——FluorCam叶绿素荧光成像技术FluorCam叶绿素荧光成像技术Rousseau等(High throughput quantitative phenotyping of plant resistance using chlorophyll fluorescence image analysis.Plant Methods, 2013, 9:17),利用FluorCam开放式叶绿素荧光成像系统作为高通量表型分析平台,采用图像阈值分割等分析方法,对植物病原体感染进行了定量分析检测,根据Fv/Fm将感染分为不同阶段/等级,特别是可以将用其它方法难以分辨出来的感染前期加以分辨,并对5个品种的菜豆对普通细菌性疫病的抗性进行了定量分析评价。
PSI公司首席科学家Nedbal教授与公司总裁Trtilek博士等首次将PAM叶绿素荧光技术(Pulse Amplitude Modulated technique——脉冲调制技术)与CCD技术结合在一起,于1996年在世界上成功研制生产出FluorCam叶绿素荧光成像系统(Heck等,1999;Nedbal等,2000;Govindjee and Nedbal, 2000)。
FluorCam叶绿素荧光成像技术成为上世纪90年代叶绿素荧光技术的重要突破,使科学家对光合作用与叶绿素荧光的研究一下子进入二维世界和显微世界,广泛应用于植物生理生态、植物胁迫与抗性监测、作物育种、植物表型分析等。
不同于其它成像分析技术,FluorCam叶绿素荧光成像只对叶绿素荧光波段敏感,可以有效避免环境光的干扰,特异性、高灵敏度反映植物生理生态状况。
主要功能特点如下:1)高灵敏度CCD,时间分辨率可达50帧/秒,有效抓取叶绿素荧光瞬变;可选配高分辨率CCD,分辨率1392x1040像素,用于气孔功能成像分析、稳态荧光如GFP荧光测量等2)具备完备的自动测量程序(protocol),可自由对自动测量程序进行编辑:a)Fv/Fm:测量参数包括Fo,Fm,Fv,QY等b)Kautsky诱导效应:Fo,Fp,Fv,Ft_Lss,QY,Rfd等荧光参数c)荧光淬灭分析:Fo,,Fm,Fp,Fs,Fv,QY,ΦIINPQ,Qp,Rfd,qL等50多个参数d)光响应曲线LC:Fo,Fm,QY,QY_Ln等荧光参数e)PAR吸收f)GFP等静态荧光测量g)OJIP与JIP-test(FKM与封闭式荧光成像系统):Fo,Fj,Fi,P 或Fm,Mo(OJIP曲线初始斜率)、OJIP固定面积、Sm(对关闭所有光反应中心所需能量的量度)、QY、PI等26个参数3)自动重复实验功能,可无人值守自动循环完成选定的实验程序,重复次数及间隔时间客户自定义,成像测量数据自动按时间日期存入计算机4)FluorCam成像分析软件:具在线功能(Live)、实验程序选配功能(Protocols)、成像预处理功能(Pre-processing)及成像分析结果展示报告功能(Result)四大功能模块a)在线功能(live):可对仪器和样品进行在线测试调试、快照、显示实验进度、在线显示荧光瞬变动态视频等b)实验程序选配功能(protocols):可选配不同的实验程序,并可对实验程序进行编辑、设置、储存(以备以后使用同样的实验程序)等c)成像预处理功能:可浏览整个测量视频及任何点、任何区域的荧光动态变化曲线,可进行“选区操作”或“分级操作”(图像阈值分割功能);选区操作可对成像进行自动或手动选区(ROI),还可使用“模具”包括多孔板模具、培养皿模具、桌面模具进行模具选区;分级操作具备荧光强度刻度标尺和四个“游标”,通过移动4个游标可以将成像按不同强度划分成不同的荧光范围组进行分析处理,可设置不同的阈值进行图像阈值分割d)结果展示报告功能:可展示所有选区(ROI)的叶绿素荧光参数值及其图像、每个参数的频率直方图及每个ROI的荧光动态图等,可对原数据(kinetic)、叶绿素荧光参数等导出到excel表,还可对每个参数成像图存储成位图5)数据分析具备“信号计算再平均”模式(算数平均值)和“信号平均再计算模式”两种功能模式,在高信噪比的情况下选用“信号计算再平均”模式,在低信噪比的情况下选择“信号平均再计算”模式以过滤掉噪音带来的误差FluorCam叶绿素荧光参数:参数符号概念描述Size 面积(像素值),经校准可测量实际面积Fo 暗适应后的最小荧光Fo_Dn 暗松弛最小荧光,红外光诱导PSIFo_Ln 光适应后的最小荧光,红外光诱导PSIFo_Lss 光适应后稳态最小荧光,红外光诱导PSIFm 暗适应后最大荧光Fm_Dn 暗松弛最大荧光Fm_Ln 光适应最大荧光Fm_Lss 光适应稳态最大荧光Fp Kautsky诱导效应最大荧光Ft_Dn 暗松弛即时荧光Ft_Ln 光适应即时荧光Ft_Lss 光适应稳态荧光Fv Fm-FoNPQ_Dn 暗松弛非光化荧光淬灭,=(Fm-Fm_Dn)/Fm_DnNPQ_Ln 光适应非光化荧光淬灭,=(Fm-Fm_Ln)/Fm_LnNPQ_Lss 稳态非光化荧光淬灭,=(Fm-Fm_Lss)/Fm_LssqP_Dn 暗松弛光化学荧光淬灭,=(Fm_Dn−Ft_Dn)/Fm_Dn−Fo_DnqP_Ln 光适应光化学淬灭,=(Fm_Ln−Ft_Ln)/(Fm_Ln−Fo_Ln)qP_Lss 稳态光适应光化学淬灭,=(Fm_Lss−Ft_Lss)/(Fm_Lss−Fo_Lss)qL_Ln 基于“Lake”模型的光适应光化学淬灭qL_Lss 基于“Lake”模型的稳态光适应光化学淬灭QY_Dn 暗松弛光量子效率,=(Fm_Dn−Ft_Dn)/Fm_DnQY_Ln或ΔF/Fm 光适应光量子效率,=(Fm_Ln−Ft_Ln)/Fm_LnQY_Lss 稳态光量子效率,=(Fm_Lss−Ft_Lss)/Fm_LssFv/Fm或QY_max 最大光量子效率Fv/Fm_Ln 光适应光量子效率,=(Fm_Ln−Fo_Lss)/Fm_LnFv/Fm_Lss 稳态光量子效率,=(Fm_Lss−Fo_Lss)/Fm_LssRfd_Ln 光适应荧光衰减率,用于评估植物活力,=(Fp−Ft_Ln)/Ft_LnRfd_Lss 稳态荧光衰减率,用于评估植物活力,=(Fp−Ft_Lss)/Ft_Lss除上述叶绿素荧光参数外,还可以成像测量PAR吸收、植物光谱反射指数NDVI等,叶片大小(或植物大小)可以反映植物的生长等。




Fo 当PSII 反应中心都处于开放状态时的最小荧光。
Fm 暗适应后执行饱和脉冲当PSII 反应中心都处于关闭状态时的最大荧光产量Fo’ 光下最小荧光Fo’ = 1/(1/Fo-1/Fm+1/Fm’)Fm’光下执行饱和脉冲当PSII 反应中心都处于关闭状态时的最大荧光产量F’ 执行饱和脉冲前的实时荧光产量。
Fv/Fm and Y(II) PSII 的最大量子产量(Fv/Fm)和实际量子产量(Y(II))这两个参数表示的都是PSII 将吸收的光能转化成化学能的效率。
测Fv/Fm 前,样品必需经过充分的暗适应以确保PSII 所有的反应中心都处于开放状态并且非光化学淬灭达到最小。
不同植物的暗适应时间不同,阴生叶片和阳生叶片的暗适应时间也不相同。
Y(II)反映的是光下叶片的实际光能转化效率。
只有当照光强度(光化光)达到一定水平时Y(II)的信息才能真实的反映光合的状态,因为在光强很弱时卡尔文碳同化过程可能无法正常运转而Y(II)可能会比较高。
qP and qL 光化学淬灭系数这两个参数表示的是PSII 中处于开放状态的反应中心所占的比例。
其中qP 是基于沼泽模型的(puddle model,Schreiber et al. 1986 as formulated by van Kooten and Snel, 1990)。
qL 是基于湖泊模型的(lake model, Kramer et al. 2004)。
qN and NPQ 非光化学淬灭参数这两个参数都和基于跨膜质子梯度和玉米黄质的非光化学淬灭相关。
Y(NO) and Y(NPQ) 非光化学淬灭的量子产量这两个是Kramer 等在2004 年提出的新参数。
Y(NPQ)是指PS II 处调节性能量耗散的量子产量。
若Y(NPQ)较高,一方面表明植物接受的光强过剩,另一方面则说明植物仍可以通过调节(如将过剩光能耗散为热)来保护自身。
Y(NPQ)是光保护的重要指标。

叶绿素荧光分析方法叶绿素荧光分析具有观测手续简便,获得结果迅速,反应灵敏,可以定量,对植物无破坏、少干扰的特点。
它既可以用于叶绿体、叶片,也可以遥感用于群体、群落。
它既是室内光合基础研究的先进工具,也是室外自然条件下诊断植物体内光合机构运转状况、分析植物对逆境响应机理的重要方法。
现在人们可以通过叶绿素荧光分析估计量子效率、光合能力,利用荧光参数计算光合电子传递速率、胞间CO2浓度,并且试图利用荧光参数快速筛选遗传变异的植物。
有人甚至预言,将来荧光分析可能会代替气体交换测定。
20世纪80年代以来,调制荧光仪,特别是便携式荧光仪的商品化,使荧光分析在光合作用研究中得到这样广泛的应用,以至如果不懂荧光分析技术,便很难看懂近年的光合作用研究文献。
1.基本原理光合机构吸收的光能有三个可能的去向:一是用于推动光化学反应,引起反应中心的电荷分离及后来的电子传递和光合磷酸化,形成用于固定、还原二氧化碳的同化力(ATP和NADPH);二是转变成热散失;三是以荧光的形式发射出来。
由于这三者之间存在此消彼长的相互竞争关系,所以可以通过荧光的变化探测光合作用的变化(图4-1)。
实际上,以荧光形式发射出来的光能在数量上是很少的,还不到吸收的总光能的3%。
在很弱的光下,光合机构吸收的光能大约97%被用于光化学反应,2.5%被转变成热散失,0.5%被变成红色(在体内,叶绿京的荧光发射峰在685nm左右)的荧光发射出来;在很强的光下,当全部PSII反应中心关闭时,吸收的光能95%~97%被变成热,而2.5%~5.0%被变成荧光发射[l]。
在体内,由于吸收的光能多被用于光合作用,叶绿素a荧光的量子产额(即量子效率)仅仅为0.03~0.06。
但是,在体外,由于吸收的光能不能图4-1叶绿素分子的光激发被用于光合作用,这一产额增加到0.25~0.30[2]。
在室温条件下,绝大部分荧光来自PS II 天线[1,3],而不是反应中心的叶绿素a分子[4,5]。

第四章 叶绿素荧光技术应用第一节 叶绿素荧光参数及其意义韩志国,吕中贤(泽泉开放实验室,上海泽泉科技有限公司,上海,200333)叶绿素荧光技术作为光合作用的经典测量方法,已经成为藻类生理生态研究领域功能最强大、使用最广泛的技术之一。
由于常温常压下叶绿素荧光主要来源于光系统 II 的叶绿素 a ,而光系统 II 处于整个光合作用过程的最上游,因此包括光反应和暗反应在内的多数光合过程的变化都会反馈给光系统 II ,进而引起叶绿素 a 荧光的变化,也就是说几乎所有光合作用过程的变化都可通过叶绿素荧光反映出来。
与其它测量方法相比,叶绿素荧光技术还具有不需破碎细胞、简便、快捷、可靠等特性,因此在国际上得到了广泛的应用。
1 叶绿素荧光的来源藻细胞内的叶绿素分子既可以直接捕获光能,也可以间接获取其它捕光色素(如类胡萝卜素)传递来的能量。
叶绿素分子得到能量后,会从基态(低能态)跃迁到激发态(高能态)。
根据吸收的能量多少,叶绿素分子可以跃迁到不同能级的激发态。
若叶绿素分子吸收蓝光,则跃迁到较高激发态;若叶绿素分析吸收红光,则跃迁到最低激发态。
处于较高激发态的叶绿素分子很不稳定,会在几百飞秒(fs ,1fs=10-15 s )内通过振动弛豫向周围环境辐射热量,回到最低激发态(图 1)。
而最低激发态的叶绿素分子可以稳定存在几纳秒(ns ,1 ns=10-9 s )。
A 较高激发态 B 热耗散吸收蓝光 吸收红光 最低激发态 能量荧光 基态蓝波长红荧光图 1 叶绿素吸收光能后能级变化(A )和对应的吸收光谱(B )(引自韩博平 et al., 2003)处于最低激发态的叶绿素分子可以通过几种途径(图 2)释放能量回到基态(韩博平 et al., 2003; Schreiber, 2004):1)将能量在一系列叶绿素分子之间传递,最后传递给反应中心叶绿素 a ,用于进行光化学反应;2)以热的形式将能量耗散掉,即非辐射能量耗散(热耗散);3)放出荧光。

叶绿素荧光动力学参数作为植物抗盐性评价指标的有效性刘强;王庆成;王占武【摘要】为探讨叶绿素荧光动力学参数作为植物抗盐性评价指标的有效性,以4个抗盐性不同的树种白榆、新疆枸杞、南蛇藤、小叶丁香的1年生实生苗为试验材料,测定几种抗盐性不同的植物盐胁迫下叶绿素荧光动力学参数最大荧光(Fm)、可变荧光(Fv)、初始荧光(Fo)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(φPSⅡ)和非光化学猝灭(NPQ)的变化.结果表明:盐碱胁迫对不同树种苗木PSⅡ的功能产生了抑制,随胁迫强度的增加,4个树种苗木Fm、Fv、Fv/Fm、φPSⅡ总体表现出下降的趋势;Fo表现出上升的趋势;NPQ有的树种呈下降的趋势,有的先升后降.研究表明,盐胁迫下几个树种Fm、Fv、F/Fm的变化与其抗盐性关系较为一致,因此,Fm、Fv、Fv/Fm可以作为不同木本植物抗盐性可靠的评价指标;盐胁迫下Fm、NPQ和φPSⅡ的变化与几个树种抗盐性之间没有普遍联系,不能作为评价木本植物抗盐性的有效指标.【期刊名称】《广东农业科学》【年(卷),期】2014(041)021【总页数】5页(P37-40,74)【关键词】叶绿素荧光参数;抗盐性;评价指标;有效性【作者】刘强;王庆成;王占武【作者单位】吉林师范大学生命科学学院,吉林四平 136000;吉林师范大学生命科学学院,吉林四平 136000;吉林师范大学生命科学学院,吉林四平 136000【正文语种】中文【中图分类】Q945.78一些生长或生理指标可以很好地评价植物的抗盐性,但它们通常耗时很长且工作量大,并且不同处理间的显著差异只有等到不可修复的伤害发生时才能被发现。
而且当需要从大量的繁殖体中筛选出优秀基因型时,这样的有伤害性的、复杂的方法可能就不适用了[1]。
如果某项指标可以在可能导致不可逆伤害的症状出现前就能发现盐分对生理系统的影响,那么这种指标无疑是有效的,叶绿素荧光正是这样的指标。

叶绿素荧光叶绿素荧光作为光合作用研究的探针,得到了广泛的研究和应用。
叶绿素荧光不仅能反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程,而且与电子传递、质子梯度的建立及ATP合成和CO2固定等过程有关。
几乎所有光合作用过程的变化均可通过叶绿素荧光反映出来,而荧光测定技术不需破碎细胞,不伤害生物体,因此通过研究叶绿素荧光来间接研究光合作用的变化是一种简便、快捷、可靠的方法。
目前,叶绿素荧光在光合作用、植物胁迫生理学、水生生物学、海洋学和遥感等方面得到了广泛的应用。
1叶绿素荧光的研究历史叶绿素荧光现象是由传教士Brewster首次发现的。
1834年Brewster发现,当一束强太阳光穿过月桂叶子的乙醇提取液时,溶液的颜色变成了绿色的互补色¬¬——红色,而且颜色随溶液的厚度而变化,这是历史上对叶绿素荧光及其重吸收现象的首次记载。
后来,Stokes(1852)认识到这是一种光发射现象,并使用了“fluorescence”一词。
1874年,Müller发现叶绿素溶液稀释后,荧光强度比活体叶子的荧光强得多。
尽管Müller提出叶绿素荧光和光合作用之间可能存在相反的关系,但由于他的实验没有对照,实验条件控制不严格,因此人们并没有将叶绿素荧光诱导(瞬变)现象的发现归功于Müller。
Kautsky是公认的叶绿素荧光诱导现象的发现者。
1931年,Kautsky和Hirsch用肉眼观察并记录了叶绿素荧光诱导现象(Lichtenthaler,1992;Govindjee,1995)。
他们将暗适应的叶子照光后,发现叶绿素荧光强度随时间而变化,并与CO2的固定有关。
他们得到的主要结论如下:1)叶绿素荧光迅速升高到最高点,然后下降,最终达到一稳定状态,整个过程在几分钟内完成。
2)曲线的上升反映了光合作用的原初光化学反应,不受温度(0℃和30℃)和HCN处理的影响。
光合荧光参数
光合荧光是评价植物光合作用效率和光能利用效率的一种重要指标。
以下是一份光合荧光参数的制作示例(请注意,以下参数是用于示例目的,并不是真实数据):
1. 初始荧光(F0):在光合作用系统关闭状态下,叶片受弱光照射时所测得的荧光强度。
2. 最大荧光(Fm):在光合作用系统完全关闭状态下,叶片受强光照射时所测得的荧光强度。
3. 叶绿素荧光量子产量(ϕPSII):PSII(光系统II)单位时间内所转化光能的比例,可通过以下公式计算:
ϕPSII = (Fm - F)/Fm
F为光合作用系统处于光合状态下的荧光强度。
4. 电子转运速率(ETR):通过光合作用系统传递电子的速率,是表征光合效率的重要参数。
可以通过以下公式计算:
ETR = ϕPSII × PAR × 0.5
PAR为单位面积光照强度。
5. QY(量子产量):单位面积光合产物的比例,可以通过以下公式计算:
QY = ETR / PAR
ETR为电子转运速率,PAR为单位面积光照强度。
通过对光合荧光参数的测量和分析,可以评估植物的光合效率和光能利用效率,并进一步研究植物对环境变化的响应和适应能力。
这些参数对于研究光合作用机制、优化农业生产以及保护生态环境都具有重要意义。
5种叶绿素荧光参数:1.Fv/Fo 2.PSI Light 3.ETR 3.Y(II) 4.Act Light 5.Means Light
目前主要研究的小分子RNA 1.miRNA(微小RNA) 2.siRNA(小分子干扰RNA) 3.piRNA(PIWI结合RNA)
5种常见的植物胁迫形式:低温干旱盐碱高温洪涝
十种常见的激素; 茉莉酸生长素细胞分裂素赤霉素脱落酸水杨酸乙烯油菜素内酯萘乙酸吲哚乙酸吲哚丁酸
常见的组蛋白修饰乙酰化甲基化泛素化糖基化羰基化等
什么叫做组蛋白密码?组蛋白在翻译后的修饰中会发生改变,从而提供一种识别标志,为其他蛋白与DNA结合产生协同或拮抗效应,它是一种动态转录调控成分,
活性氧常见的5种形式:超氧自由基超氧阴离子过氧化氢含氧自由基过氧阴离子
蛋白质翻译后修饰的意义:是指mRNA被翻译成蛋白质后,对蛋白质上个别氨基酸残基进行共价修饰的过程。
他可以使蛋白
质的结构更加复杂,功能更加完善,调节更为精细,作用更专一。
正式蛋白质的翻译后修饰使得一个基因并不只对应一种蛋白质,增加了蛋白质的结构和功能的多样性,从而赋予生命更多复杂的过程。
常见的修饰方式:泛素化,磷酸化,糖基化,脂基化,甲基化,乙酰化
9、植物防御反应的生化原理:1.病原体的侵入可以激活所有细胞中的多种防御反应;2.超敏反应使局部细胞迅速死亡;3.在植物抗性反应的早期常常会产生有反应活性的氧化物;4.在植物不相容相互作用过程中,诱导生成了一种哺乳动物的信号分子——一氧化氮;5.细胞壁加固和细胞外酶活有助于植物的抗病反应;6.苯甲酸和水杨酸可能参与了大量的植物防御反应;7.防御
坏死营养型真菌以及诱导某些植物防御基因时所需的茉莉酮酸和乙烯可能会加剧病症;8.致病相关蛋白和其他防御相关蛋白包
括真菌细胞壁降解酶类、抗维生素多肽和信号转导级联途径中的组分;9.植物抗生素包括有机次生代谢物和无机次生代谢物;10.蛋白酶的抑制剂由食草的靶昆虫诱导;11.转录后基因沉默是植物应对治病病毒的一种特异性防御反应;12.平行的信号途径协调复杂而高度局域化的植物防御反应;
10.植物体内ROS(活性氧)与NO在植物防御反应中的作用及二者的协同关系
1.ROS在植物防御中的作用,H2O2可能直接对病原体有毒,在铁存在时,H2O2会产生活性极强的羟基自由基。
另一种看法是,它或者通过各种富含羟脯氨酸或脯氨酸的糖蛋白与多糖基质交联,或者通过过氧化物酶的作用提高木质素多聚物的合成速率,从而加固植物细胞壁的结构,这两种作用都可以提高植物细胞壁对微生物穿透和酶促降解的抵抗能力。
某些ROS还可能有信号转导功能。
2.NO是哺乳动物用以调控免疫,神经和血管系统中多种生物过程的一种信号分子。
植物在识别无病毒病原菌的同时,即迅速
从头合成NO.
局部发生的超敏反应是遗传不相容相互作用的一贯特征,但是ROS大量的生成不足以诱导植物细胞的死亡,而可能可以抑制病原体的生长。
NO可以加强ROS诱导植物细胞死亡的能力。
已知NO可以与血红素结合,因此可以抑制用以解除H2O2毒性的
过氧化氢酶和抗坏血酸盐过氧化物酶。
植物细胞悬浮培养物和叶子中加入可以产生NO的化合物,会使好几个与防御和细胞保
护相关基因的mRNA的积累。
NO诱导ROS的大量积累导致细胞死亡。
NO和活性氧共同提高植物病原体过程中提高协同作用。