讲义五:2015年版中国药典四部增修订情况
- 格式:doc
- 大小:36.50 KB
- 文档页数:6


《中华人民共和国药典(2015年版)》中中药部分的增、修订情况简介作者:陈佳钱琛陈桂良来源:《上海医药》2016年第07期摘要本文简要介绍《中华人民共和国药典(2015年版)》中中药部分的增、修订情况及技术特点。
本版药典不仅中药收载品种数大幅增加,而且进一步加强了多药味(成分)的检测、活性成分的控制和杂质(有害物质)的检查,更注重现代分析技术的应用,包括广泛应用了指纹(特征)图谱技术,对提高中药的安全性及其质量整体控制水平具有重要作用。
关键词《中华人民共和国药典(2015年版)》中药药品标准中图分类号:R921.2 文献标识码:C 文章编号:1006-1533(2016)07-0003-02A brief introduction to quality standards of traditional Chinese medicines in the Pharmacopoeia of the People’s Republic of China (2015 version)CHEN jia*, QIAN Chen, CHEN Guiliang* *(Division of Quality Assurance, Shanghai Institute for Food and Drug Control, shanghai 201203, China)ABSTRACT The main changes and the technical characteristics related to the quality standards of traditional Chinese medicines (TCM)in the Pharmacopoeia of the People’s Republic of China (2015 version) was briefly introduced. Not only was the content related to the collection of TCM substantially increased but also the detection of multi-composition, the control of active ingredients and the examination of harmful impurity (or substances) were strengthened, and furthermore,the application of modern analysis technology including the wide use of feature/fingerprint technology was more focused on in this new pharmacopoeia. We believe that these will play an important role in improving the safety of TCM and strengthening their quality control.KEY WORDS Pharmacopoeia of the People’s Republic of China (2015 version); traditional Chinese medicines; drug standards《中华人民共和国药典(2015年版)》(以下简称为“2015年版《中国药典》”)已自2015年12月1日起正式实施。

1、《中国药典》2015年修订情况介绍。
答:“中国药典”是国家为保证药品质量可控和人民群众用药安全有效而制定的药品法典。
是药品开发、生产、经营、使用、管理的法律依据,是国家药品标准体系的核心。
2015年版《中国药典》是新中国成立以来的第10版。
2010年3月,第十届药典委员会成立,历时5年完成新版药典编制工作。
编写期间,将修订后的药典内容全部在网上公示并征求意见,共收到网上反馈意见4000余条,远远超过前几版药典收到的反馈意见数量,体现了社会和公众对新版药典编写的关注度和参与度不断提高。
针对各种反馈意见,药典委员会各专业委员会逐一研究讨论,组织召开标准评审会700余次,向社会反馈意见。
可以说,2015年版《中国药典》不仅凝聚了第十届药典委员会全体委员、广大专家学者、药品检验机构、科研院所、高校和药品生产企业的心血,更蕴含着社会公众的共同智慧。
2、2015年版药典实施细则。
答:新版《中国药典》于2015年12月1日起施行,新版《药典》每5年发布一次。
自实施之日起,上市药品质量标准应符合2015年版《中国药典》品种质量标准。
该品种已列入2015年版药典但未收录的质量标准,也应符合《中国药典总则》的相关要求。
对于那些已提交注册、未获批准的品种,在批准时也要符合2015年版药典标准的相关要求。
3、2015年版《中国药典》主要有哪些变化?答:首先,收到的品种数量增加了27.4%。
2015年版药典计划收录5800个品种,比2010年版药典增加1200多个品种,修订品种751个。
二是通过对《药典》总则、总则、总则的全面增补和修订,整体上进一步提高了对药品质量控制的要求,完善了《药典》标准的技术规定,使《药典》标准更加系统化、规范化。
三是完善了药品标准体系。
特别是药用辅料品种增加到260种,增加了相关指导原则;在归纳、验证、规范的基础上,实现了《中国药典》不同部分常用检测方法的协调统一。
四是2015年版药典附录(总则)和辅料独立卷成册,构成《中国药典》四个部分的主要内容。


2015版《中国药典》四部介绍及其在中药分析鉴定中的应用D和容器”等指导原则,进一步完善了药用辅料和药包材通用性要求,从影响药品质量的等各方面,包括原料药及其制剂、药品标准物质、药用辅料和药包材的制定控制要求,形成了全面、完善的药典标准体系。
2.3 药典附录整合和编号制定2015年版《中国药典》四部本着求同存异、统一规范的原则,将各部药典附录统一整合。
2015年版《中国药典》四部通用性附录整合后,除生物制品收载个性通则外,一部、二部不再单独收载通则,对中药和生物制品的特殊性检定方法通则予以单列。
鉴于生物制品特性检定通则较多,为方便使用,2015年版《中国药典》三部将同步收载生物制品个性检测方法。
整合后的药典附录统一更名为通则。
按照原理、目的、属性、作用、方法、特性等将药典通则分为十五大类,实现了通则编码的唯一性、科学性、扩展性和稳定性。
新编后的编码更加规范、合理、扩展性更强,更加适应药典在检测技术发展的需要。
2.4 检测方法进一步完善在参考美国、欧洲、英国药典等国际标准的基础上,2015年版《中国药典》不断借鉴和采用国际先进检测技术,完善检测方法,提高检测方法的专属性、灵敏度和稳定性。
通过检测方法的完善,为进一步建立严格的质量标准,提高药品安全性和有效性奠定基础。
2015年版《中国药典》在保留常规检测方法的基础上,进一步扩大了对新技术、新方法的应用,提高检测的灵敏度、专属性和稳定性。
采用液相色谱法-串联质谱法、分子生物学检测技术、高效液相色谱法-电感耦合等离子质谱法应用于中药的质量控制。
采用超临界流体色谱、临界点色谱法、粉末X射线衍射法等用于蒙脱石的结构分析以及滑石粉中石棉的检测。
采用毛细管电泳分析用于重组单克隆抗体产品分子大小异构体,采用高效液相色谱法用于测定抗毒素抗血清制品分子大小分布等;建立了中药材DNA条形码分子鉴定等指导方法,为加强药品质量控制提供检测技术储备。
2.5 药品质控进一步加强检验方法的完善是实现提高药品安全性和有效性的基础,2015年版《中国药典》在完善检验方法的同时,重点加强对药品安全性及有效性方面加强检验方法的建立和质控要求的制定。


《中华人民共和国药典(2015年版)》(四部)通则中有关生物测定部分的增、修订情况介绍唐黎明;陈桂良【摘要】《中华人民共和国药典(2015年版)》将前版药典一、二、三部分别收载的附录整合归为四部,作为药典的通用要求。
四部中有关生物测定部分除整合了热原检查法、异常毒性检查法等原附录外,还新增了组胺物质检查法等,同时对部分原附录进行了修订。
本文介绍相关情况。
%The appendices in the Pharmacopoeia of the People’s Republic of China (ChP) (2010 version) volume I, II and III were integrated into volume IV in ChP (2015 version), which can be served as the common requirement for pharmacopoeia standards. The histamine test and so on were added in the biological test of volume IV besides the intergradation of pyrogens test and abnormal toxicity test and meanwhile some appendices on bioassay were revised as well. In this paper, the relevant information is introduced for reference.【期刊名称】《上海医药》【年(卷),期】2016(037)007【总页数】3页(P9-10,15)【关键词】《中华人民共和国药典(2015年版)》;生物测定;通则;增;修订【作者】唐黎明;陈桂良【作者单位】上海市食品药品检验所药理毒理室上海 201203;上海市食品药品检验所药理毒理室上海 201203【正文语种】中文【中图分类】R921.2《中华人民共和国药典(2015年版)》(以下简称为“2015年版《中国药典》”)已自2015年12月1日起正式实施。


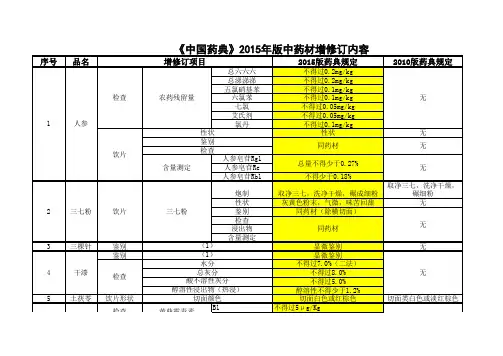
2015版《药典》中药材标准的变化情况新药典变化概述:1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2.重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3.完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4.制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5.中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6.不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
新药典增减药材情况:删除:紫河车新药典“来源”修订情况:新药典“性状”修订情况新药典“显微鉴别”增加品种三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、豨莶草、暴马子皮、薤白、瞿麦、翻白草新药典“检查”修订情况二氧化硫残留量通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量注:•总六六六(α-BHC、β-BHC、γ-BHC、δ-BHC之和)不得过0.2mg/kg;•总滴滴涕(pp’-DDE、pp’-DDD、op’-DDT、pp’-DDT之和)不得过0.2mg/kg;•五氯硝基苯不得过0.1mg/kg;•六氯苯不得过0.1mg/kg;•七氯(七氯、环氧七氯之和)不得过0.05mg/kg;•艾氏剂不得过0.05mg/kg;•氯丹(顺式氯丹、反式氯丹、氧化氯丹之和)不得过0.1mg/kg。

2015 年版《中国药典》四部介绍及其在中药分析鉴定中得应用李峰2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大得变动之一就是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便得问题。
2015年版《中国药典》四部就是保证《中国药典》执行得重要基础,就是2015年版《中国药典》水平与特色得重要体现,也就是系统阐述药品检测技术、传播药典知识得良好教科书,对于强化药品监管手段,保障药品质量不断提高,促进先进检测技术应用与行业健康必将发挥积极得作用。
一、2015年版《中国药典》四部介绍2015年版《中国药典》四部内容包括凡例、通则与药用辅料。
药典通则涵盖了通用性要求、检验方法、指导原则以及试剂与标准物质等药品标准得共性要求,就是药典标准得基础,不但反映了我国药品质量控制整体状况与药品检验技术水平;同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1、2015年版《中国药典》四部增修订整体情况2015年版《中国药典》四部收载通则总数317个,将药典一部、二部、三部制剂整合后共计38个,检测方法附录287个,其中新增通则28个 (检定方法通则27个、制剂通则1个),整合通则63个,修订通则 67 个;新增生物制品总论3个;指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2、2015年版《中国药典》四部主要特点2、1 整体提升质控水平《中国药典》凡例、通则、总论就是药典得重要组成部分,对药品标准得检测方法与限度进行总体规定,对药典以外得其她药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容得全面增修订,全面完善了药典标准基本共性规定,从整体上提升对药品质量控制得要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求得药典标准体例。
讲义五:2015年版版中国药典四部增修订情况第一篇:讲义五:2015年版版中国药典四部增修订情况2015 年版《中国药典》四部增修订概况2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大的变动之一是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便的问题。
2015年版《中国药典》四部内容包括凡例、通则和药用辅料,药典通则涵盖了通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的共性要求,是药典标准的基础,不但反映了我国药品质量控制整体状况和药品检验技术水平;同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1.2015 年版《中国药典》四部增修订整体情况2015 年版《中国药典》四部收载通则总数317个;将药典一部、二部、三部制剂整合后共计38个;检测方法附录287个,其中新增通则28个(检定方法通则27个、制剂通则1个),整合通则63个,修订通则67 个;新增生物制品总论3个;指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2.2015 年版《中国药典》四部主要特点2.1 整体提升质控水平《中国药典》凡例、通则、总论是药典的重要组成部分,对药品标准的检测方法和限度进行总体规定,对药典以外的其他药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容的全面增修订,全面完善了药典标准基本共性规定(表2),从整体上提升对药品质量控制的要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求的药典标准体例。
药品标准控制更加全面化、系统化、规范化。
2.2 药典标准体系更加完善 2015年版《中国药典》四部首次纳入“国家药品标准物质通则”以及“国家药品标准物质制备指导原则”、“药包材通用要求”和“药用玻璃材料和容器”等指导原则,进一步完善了药用辅料和药包材通用性要求,从影响药品质量的等各方面,包括原料药及其制剂、药品标准物质、药用辅料和药包材的制定控制要求,形成了全面、完善的药典标准体系。
2015 年版《中国药典》四部介绍及其在中药分析鉴定中的应用峰2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大的变动之一是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规,给药品检验实际操作带来不便的问题。
2015年版《中国药典》四部是保证《中国药典》执行的重要基础,是2015年版《中国药典》水平和特色的重要体现,也是系统阐述药品检测技术、传播药典知识的良好教科书,对于强化药品监管手段,保障药品质量不断提高,促进先进检测技术应用和行业健康必将发挥积极的作用。
一、2015年版《中国药典》四部介绍2015年版《中国药典》四部容包括凡例、通则和药用辅料。
药典通则涵盖了通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的共性要求,是药典标准的基础,不但反映了我国药品质量控制整体状况和药品检验技术水平;同时也对规药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1.2015年版《中国药典》四部增修订整体情况2015年版《中国药典》四部收载通则总数317个,将药典一部、二部、三部制剂整合后共计38个,检测方法附录287个,其中新增通则28个 (检定方法通则27个、制剂通则1个),整合通则63个,修订通则 67 个;新增生物制品总论3个;指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2.2015年版《中国药典》四部主要特点2.1 整体提升质控水平《中国药典》凡例、通则、总论是药典的重要组成部分,对药品标准的检测方法和限度进行总体规定,对药典以外的其他药品国家标准具同等效力。
通过对2010年版《中国药典》相关容的全面增修订,全面完善了药典标准基本共性规定,从整体上提升对药品质量控制的要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求的药典标准体例。
2015 年版《中国药典》四部增修订概况2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大的变动之一是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便的问题。
2015年版《中国药典》四部内容包括凡例、通则和药用辅料,药典通则涵盖了通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的共性要求,是药典标准的基础,不但反映了我国药品质量控制整体状况和药品检验技术水平; 同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1. 2015 年版《中国药典》四部增修订整体情况2015 年版《中国药典》四部收载通则总数317个; 将药典一部、二部、三部制剂整合后共计38个; 检测方法附录287个,其中新增通则28个(检定方法通则27个、制剂通则1个) ,整合通则63个,修订通则67 个; 新增生物制品总论3个; 指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2. 2015 年版《中国药典》四部主要特点2. 1 整体提升质控水平《中国药典》凡例、通则、总论是药典的重要组成部分,对药品标准的检测方法和限度进行总体规定,对药典以外的其他药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容的全面增修订,全面完善了药典标准基本共性规定(表2),从整体上提升对药品质量控制的要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求的药典标准体例。
药品标准控制更加全面化、系统化、规范化。
2. 2 药典标准体系更加完善2015年版《中国药典》四部首次纳入“国家药品标准物质通则”以及“国家药品标准物质制备指导原则”、“药包材通用要求”和“药用玻璃材料和容器”等指导原则,进一步完善了药用辅料和药包材通用性要求,从影响药品质量的等各方面,包括原料药及其制剂、药品标准物质、药用辅料和药包材的制定控制要求,形成了全面、完善的药典标准体系。
2015 年版《中国药典》四部增修订概况2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大的变动之一是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便的问题。
2015年版《中国药典》四部内容包括凡例、通则和药用辅料,药典通则涵盖了通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的共性要求,是药典标准的基础,不但反映了我国药品质量控制整体状况和药品检验技术水平; 同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1. 2015 年版《中国药典》四部增修订整体情况2015 年版《中国药典》四部收载通则总数317个; 将药典一部、二部、三部制剂整合后共计38个; 检测方法附录287个,其中新增通则28个(检定方法通则27个、制剂通则1个) ,整合通则63个,修订通则67 个; 新增生物制品总论3个; 指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2. 2015 年版《中国药典》四部主要特点2. 1 整体提升质控水平《中国药典》凡例、通则、总论是药典的重要组成部分,对药品标准的检测方法和限度进行总体规定,对药典以外的其他药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容的全面增修订,全面完善了药典标准基本共性规定(表2),从整体上提升对药品质量控制的要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求的药典标准体例。
药品标准控制更加全面化、系统化、规范化。
2. 2 药典标准体系更加完善2015年版《中国药典》四部首次纳入“国家药品标准物质通则”以及“国家药品标准物质制备指导原则”、“药包材通用要求”和“药用玻璃材料和容器”等指导原则,进一步完善了药用辅料和药包材通用性要求,从影响药品质量的等各方面,包括原料药及其制剂、药品标准物质、药用辅料和药包材的制定控制要求,形成了全面、完善的药典标准体系。
2. 3 药典附录整合和编号制定2015年版《中国药典》四部本着求同存异、统一规范的原则,将各部药典附录统一整合。
2015年版《中国药典》四部通用性附录整合后,除生物制品收载个性通则外,一部、二部不再单独收载通则,对中药和生物制品的特殊性检定方法通则予以单列。
鉴于生物制品特性检定通则较多,为方便使用,2015年版《中国药典》三部将同步收载生物制品个性检测方法。
整合后的药典附录统一更名为通则。
按照原理、目的、属性、作用、方法、特性等将药典通则分为十五大类,实现了通则编码的唯一性、科学性、扩展性和稳定性。
新编后的编码更加规范、合理、扩展性更强,更加适应药典在检测技术发展的需要。
2. 4 检测方法进一步完善在参考美国、欧洲、英国药典等国际标准的基础上,2015年版《中国药典》不断借鉴和采用国际先进检测技术,完善检测方法,提高检测方法的专属性、灵敏度和稳定性。
通过检测方法的完善,为进一步建立严格的质量标准,提高药品安全性和有效性奠定基础。
2015年版《中国药典》在保留常规检测方法的基础上,进一步扩大了对新技术、新方法的应用,提高检测的灵敏度、专属性和稳定性。
采用液相色谱法-串联质谱法、分子生物学检测技术、高效液相色谱法-电感耦合等离子质谱法应用于中药的质量控制。
采用超临界流体色谱、临界点色谱法、粉末X射线衍射法等用于蒙脱石的结构分析以及滑石粉中石棉的检测。
采用毛细管电泳分析用于重组单克隆抗体产品分子大小异构体,采用高效液相色谱法用于测定抗毒素抗血清制品分子大小分布等; 建立了中药材DNA 条形码分子鉴定等指导方,为加强药品质量控制提供检测技术储备。
2. 5 药品质控进一步加强检验方法的完善是实现提高药品安全性和有效性的基础,2015 年版《中国药典》在完善检验方法的同时,重点加强对药品安全性及有效性方面加强检验方法的建立和质控要求的制定。
通过完善和优化检测方法、扩大成熟、先进的检测技术的应用,对药品检验的能力大幅提升。
2. 6 加强药品全过程控制2015 年版《中国药典》进一步强化药品质量全过程控制理念,加强对药品生产源头和工艺过程控制,通过完善相关技术指南,加强对药品的研发、生产、质控环境、药用辅材和药用包材等涉及药品质量的各环节的全过程控制要求,加强产品批间一致性和稳定性控制,丰富了药品标准的内涵,对全面提升药品质量意义重大。
2. 7 中药安全性控制进一步加强2015年版《中国药典》在2010年版《中国药典》的基础上,既突出了中药整体质量控制的特点,又增加和完善了安全性控制方面的要求。
主要体现在对中药材及其饮片在种植、流通、储藏等环节存在的主要风险因素如二氧化硫残留、重金属及有害元素、农药残留、真菌毒素、色素、内源性有害物质、微生物以及相关致病菌等进行控制,在相关控制方法方面,2015 年版《中国药典》增加了专属性优、灵敏度高、检测效率好的检测技术。
如二氧化硫检测增加了离子色谱法和气相色谱法、农药残留量测定建立了气相色谱法串联质谱法和液相色谱串联质谱法,真菌毒素检查建立了高相液相- 质谱联用方法等。
2. 8 制剂通则相关要求更加完善2015 年版《中国药典》实现了药典一部、二部和三部制剂通则的全部统一。
在整合的基础上,完善了制剂要求以及新型制剂的收载。
2. 8. 1 制剂要求更加规范制剂整合在按照求同存异的原则,同一剂型下的检查项应尽量统一,尤其是涉及安全性和有效性指标,例如: 眼用制剂和注射剂下可见异物、不溶性微粒、无菌、细菌内毒素等检测项目;对于难以统一者,在相应项下分别作出规定。
如胶囊剂的重量差异、中药硬胶囊剂要求水分检查、中药注射剂有关物质检查等。
通过完善制剂要求,进一步提高药品的安全性和有效性。
对以动物、植物、矿物质来源的非单体成分制成的,生物制品片剂、颗粒剂、丸剂、胶囊剂,黏膜或皮肤炎症或腔道等局部用片剂(如口腔贴片、外用可溶片、阴道片、阴道泡腾片等)检查项下应进行微生物限度检查,并应符合规定。
生物制品进行杂菌检查的可不进行微生物限度检查。
眼用制剂,如加入抑菌剂的,应要求标示所使用抑菌剂的种类和标示量; 供雾化用吸入溶液制剂由微生物限度要求为无菌制剂;对于烧伤用软膏剂、乳膏剂、气雾剂、喷雾剂、凝胶剂、散剂、涂膜剂等,除用于轻度烧伤I或浅II外,应为无菌制剂。
为保证制剂的有效性,对于来源于动、植物多组分且难以建立测定方法的以外,溶出度、释放度、含量均匀度均应合要求。
2. 8. 2 完善制剂通则共性要求制剂通则规定适用于中药、化学药和治疗用生物制品,不适用于预防类制品;各剂型、亚剂型并不适用于所有原料药物,而应取决于原料药物特性、临床给药需求以及药品的安全性、有效性和稳定性;在确定制剂处方时,应根据抑菌效力检查法确定抑菌剂的添加剂量等。
2.8.3 增加新剂型的收载2015 年版《中国药典》增加了吸入制剂和口崩片亚剂型的收载。
吸入制剂是对发挥局部或全身作用的液体或固体制剂做出统一要求,包括吸入气雾剂、吸入粉雾剂、吸入鼻用制剂、供雾化用吸入溶液和可转化为蒸汽的制剂,在符合原相应剂型的基础上,还应符合吸入制剂的相关要求;取消外用制剂,原按照外用溶液剂命名的制剂名称可不变,检查项下应按其使用适应证和用途归属相应的制型,并应符合相关制剂的要求。
制剂或可转化为蒸汽的制剂。
2.9 微生物检定要求与国际接轨2015 年版《中国药典》进一步完善了微生物检验标准体系,将药品微生物控制从简单的终产品控制向药品生产和检定全过程的微生物风险调查和控制方向发展。
为提高药品微生物控制,2015年版《中国药典》无菌检查法和微生物限度法参照ICH标准进行了修订,并与国际要求相统一,即无菌检查法修订了培养基种类。
修订后的微生物限度检查方法提高了灵敏度、检查项目分类更加合理2.10 药品标准物质进一步规范国家药品标准物质作为实物标准,是国家药品标准的重要组成部分。
2015 年版《中国药典》对国家药品标准物质的制备做出规范和指导,是为保证国家药品标准的执行、保障药品安全、有效和质量可控。
同时,对树立《中国药典》作为国家药品标准管理体系中的核心地位具有十分重要的意义。
2015年版《中国药典》收载中药对照品、对照药材、对照提取物504个,标准品32个; 化学药对照品832个,生物制品标准品62个。
2. 11 药用辅料标准水平显著提高2.11.1 药用辅料标准体得到完善2015年版《中国药典》完善了药用辅料标准体系,加强了凡例中有关药用辅料通用性要求和药用辅料通则的增修订,强化药用辅料源头和过程控制的要求,特别是对可供注射用辅料,过程控制尤为重要。
同时,鉴于制剂的多样性和复杂性,以及药用辅料用途的广泛性,强化了药用辅料标准的适用性验证要求。
2.11.2 品种收载大幅增加2015年版《中国药典》四部新增药用辅料品种139 个,修订95个,收载总数达270个,收载品种增长105% 。
可供注射用辅料品种由2010 年版得2个增加至23个,增加了聚乙二醇300、聚乙二醇400、聚山梨酯80、活性炭等常用的可供注射用辅料标准的制定,对提升药用辅料质量,特别是高风险药品的安全性、弥补我国药用辅料标准短缺、提高药用辅料监管能力、推进药用辅料的行业发展具有重要作用。
2.11.3 辅料质量控制更加严格2015年版《中国药典》加强对药用辅料鉴别、有关物质、杂质、残留溶剂等全兴控制要求。
同时增订药用辅料功能性指标研究指导原则,更加注重对辅料功能性控制;如增订多孔性、粉末细度、粉末流动、比表面积、黏度等检查项等; 并根据辅料的功能性指标的不同,形成系列化,规格化,以满足制剂生产的需求。
3 结语2015 年版《中国药典》四部是保证《中国药典》执行的重要基础,是2015 年版《中国药典》水平和特色的重要体现,也是系统阐述药品检测技术、传播药典知识的良好教科书,对于强化药品监管手段,保障药品质量不断提高,促进先进检测技术应用和行业健康必将发挥积极的作用。