化学计算部分
- 格式:doc
- 大小:121.50 KB
- 文档页数:8

化学计算题(通用15篇)化学计算题第1篇化学反应过程中各物质的物理量往往是符合一定的数量关系的,这些数量关系就是通常所说的反应规律,表现为通式或公式,包括有机物分子通式,燃烧耗氧通式,化学反应通式,化学方程式,各物理量定义式,各物理量相互转化关系式等,甚至于从实践中自己总结的通式也可充分利用.熟练利用各种通式和公式,可大幅度减低运算时间和运算量,达到事半功倍的效果.[例11]120℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是()A、1B、2C、3D、4本题是有机物燃烧规律应用的典型,由于烃的类别不确定,氧是否过量又未知,如果单纯将含碳由1至4的各种烃的分子式代入燃烧方程,运算量大而且未必将所有可能性都找得出.应用有机物的燃烧通式,设该烃为CXHY,其完全燃烧方程式为:CXHY+(X+Y/4)O2==XCO2+Y/2H2O,因为反应前后温度都是120℃,所以H2O为气态,要计体积,在相同状况下气体的体积比就相当于摩尔比,则无论O2是否过量,每1体积CXHY只与X+Y/4体积O2反应,生成X体积CO2和Y/2体积水蒸气,体积变量肯定为1-Y/4,只与分子式中氢原子数量有关.按题意,由于反应前后体积不变,即1-Y/4=0,立刻得到分子式为CXH4,此时再将四个选项中的碳原子数目代入,CH4为甲烷,C2H4为乙烯,C3H4为丙炔,只有C4H4不可能.化学计算题第2篇物质在参加反应时,化合价升降的总数,反应物和生成物的总质量,各物质中所含的每一种原子的总数,各种微粒所带的电荷总和等等,都必须守恒.所以守恒是解计算题时建立等量关系的依据,守恒法往往穿插在其它方法中同时使用,是各种解题方法的基础,利用守恒法可以很快建立等量关系,达到速算效果.[例10] 已知某强氧化剂[RO(OH)2]+能被硫酸钠还原到较低价态,如果还原含×10-3mol[RO(OH)2]+的溶液到低价态,需的亚硫酸钠溶液,那么R元素的最终价态为+3 +2 +1因为在[RO(OH)2]-中,R的化合价为+3价,它被亚硫酸钠还原的同时,亚硫酸钠被氧化只能得硫酸钠,硫的化合价升高了2价,根据×10-3mol[RO(OH)2]-与12mlו的亚硫酸钠完全反应,亚硫酸钠共升×价,则依照升降价守恒,×10-3mol[RO(OH)2]-共降也是价,所以每摩尔[RO(OH)2]-降了2价,R原为+3价,必须降为+1价,故不需配平方程式可直接选C。

高中化学常见化学计算方法总结在高中化学学习中,化学计算是一个至关重要的部分。
通过化学计算,我们可以根据实验数据或化学反应方程式来推导出一些未知的化学量,进而解决化学实验和理论问题。
下面将总结高中化学中常见的化学计算方法。
一、摩尔计算在化学计算中,常用的一个基本单位是摩尔(mol)。
摩尔计算是指根据物质的摩尔之间的关系来进行计算。
摩尔计算最常见的应用是计算物质的质量、体积、浓度等。
例如,根据化学方程式计算反应物质的摩尔比,从而确定生成物的摩尔量;或者根据物质的摩尔量和摩尔质量计算质量之间的关系等。
二、质量计算质量计算是高中化学中常见的一种计算方法。
根据物质的质量和化学式来计算摩尔数或质量之间的关系。
例如,通过质量和化学方程式计算出反应物质的摩尔量,从而确定生成物的质量;或者通过已知的摩尔量计算出物质的质量等。
三、体积计算在溶液稀释、气体体积比计算等化学实验中,体积计算是一种常见的计算方法。
通过体积计算可以了解不同溶液浓度之间的关系,或者根据气体体积的变化来推导出化学反应的结果。
例如,根据浓度计算出一定体积溶液所含的溶质的质量;或者通过气体体积比计算出气体在不同条件下的压力等。
四、浓度计算浓度计算是高中化学中常见的一种计算方法。
浓度是指溶液中溶质的质量或摩尔数与溶剂的体积之比。
通过浓度计算可以推导出溶液中溶质的质量、溶质的摩尔数等重要信息。
例如,通过浓度计算出一定体积溶液所含溶质的摩尔量,从而进一步计算出质量等。
通过以上四种常见的化学计算方法,我们可以更好地理解化学实验和理论问题,提高化学学习的效率。
希望以上内容对您的化学学习有所帮助。
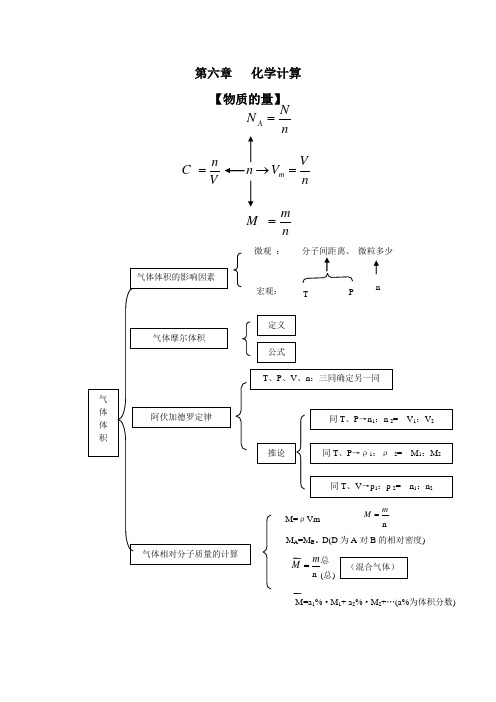
第六章 化学计算 【物质的量】nVV n m =→nm M =V n C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数)知识点1:有关物质的量、气体摩尔体积、阿伏加德罗常数、物质的量浓度等基本量的计算。
1、下列说法正确的是A.6.02×1023个12C 原子数,就是阿伏加德罗常数B.1摩尔原子的质量等于它的原子量C.氢原子的摩尔质量为1.008gD.1摩尔12C 原子的质量是12g 答案:D2、下列结论正确的是A.摩尔是七个基本物理量之一B.每摩尔物质含有1mol 即N A 个指定微粒C.1molCl就是指1mol氯D.氢氧化钠的摩尔质量为40g答案:B3、某中性溶液中含有0.2molNa+、0.25molMg2+、0.4molCl-,则SO42-为A. 0.1molB. 0.3molC. 0.5molD. 0.15mol答案:D4、下列各组物质物质的量相同的是A.标准状况下11.2升CO和7gN2B.1molCO2和非标准状况下32克氧气C.在标准状况下22.4升水和1molHCl D.6.02×1022个CO2分子和32克O2答案:B5、下列说法错误的是A.1mol任何物质都含有约6.02×1023个原子B.0.012kg碳-12含有约6.02×1023个碳原子C.阿伏加德罗常数的数值约等于6.02×1023D.使用摩尔时必须指明微粒的名称答案:A6、对相同质量的SO2和SO3来说,下列关系正确的是A.含氧原子个数比为2:3B.含硫元素质量比为5:4C.含氧元素质量比为6:5D.含硫原子个数比为1:1答案:B7、下列数量的物质中含原子个数最多的是A.0.4mol氧气 B.4℃时5.4mLH2O C.标况下5.6L二氧化碳 D.10 g氖答案:B8、在相同的条件下,两种物质的量相同的气体必然A.体积均为22.4LB.具有相同的体积C.是双原子分子D.具有相同的原子数目答案:B9、同温、同压下,H2和He两种气体单质的,如果质量相同,下列说法错误的是A.体积比为2 :1B.原子个数之比为2 :1C.密度之比为1 :2D.质子数之比为1 :1答案:BD10、下列叙述正确的是A.在标准状况下,2mol氧所占的体积为22.4LB.0.5mol H2和1mol Cl2光照条件下,完全化合生成的物质中约有6.02×1023个HCl分子C.若两种物质的物质的量相同,则所含的微粒数相同,在同温同压下,所占的体积也相同D.在标准状况下,4.48L HCl溶解于100mL水里,所得溶液的物质的量浓度为2mol· L-1 答案:B11、若N A表示阿伏加德罗常数,下列说法正确的是A.1molCl2作为氧化剂得到电子数为N AB.在0℃,101KPa时,22.4L氢气中含有N A个氢原子C.14g氮气含有7N A个电子D.N A个一氧化碳分子和0.5mol甲烷的质量比为7:4答案:C12、.某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)A.0.4mol/L B.0.6mol/L C.0.8mol/L D.1.0mol/L答案:C13、将20gNaOH溶于水后,制成100mL的碱溶液,则此溶液的物质的量浓度为A.0.5mol/L B.5mol/L C.1mol/L D.10mol/L答案:B14、在标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液的密度为dg/cm3,则此溶液的物质的量浓度为答案:B15、在标准状况下,用一充满氯化氢气体的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内盐酸溶液的物质的量浓度是()A.0.045mol/L B.1mol/LC.0.1mol/L D.缺少数据无法计算答案:A16、把70%HNO3(密度为1.40g/cm3)加到等体积的水中,稀释后硝酸溶液中溶质的质量分数是A 0.35B <0.35C >0.35D ≤0.35答案:C17、把一定质量的10%的NaOH溶液250mL,加热蒸发掉8g水后,浓度为12%,则浓缩前NaOH溶液的物质的量浓度为A.1.2 B.3 C.0.48 D.4.8答案:C18、VL硫酸钠溶液中含mgNa+离子,则溶液中SO42-的物质的量浓度为()答案:C19、有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol·L-1,SO42-的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度为A.0.1 mol·L-1B.0.15 mol·L-1C.0.2 mol·L-1D.0.3 mol·L-1答案:C20、在三个密闭容器中分别充入N e、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是A.P(N e)>P(H2)>P(O2) B.P(O2)>P(N e)>P(H2)C.P(H2) >P(O2)>P(N e) D.P(H2)>P(N e)>P(O2)答案:D21、下列叙述正确的是A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等C.常温常压下28 g CO与22.4 L O2所含分子数相等D.16 g CH4与18 g NH4+所含质子数相等答案:B22、下列叙述正确的是A.48 g O3气体含有6.02×1023个O3分子B.常温常压下,4.6g NO2气体含有1.81×1023个NO2分子C.0.5mol/LCuCl2溶液中含有3.01×1023个Cu2+D.标准状况下,33.6L 水含有9.03×1023个H2O分子答案:A23、用N A代表阿伏加德罗常数,下列说法正确的是A.标准状况下,22.4LCHCl3中含有的氯原子数目为3N AB.7gC n H2n中含有的氢原子数目为N AC.18gD2O中含有的质子数目为10N AD.1L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5N A答案:B24、设N A为阿伏加德罗常数,下列叙述中正确的是A.常温下,11.2L甲烷气体含有甲烷分子数为0.5N AB.14g乙烯和丙烯的混合物中总原子数为3N AC.0.1mol/L的氢氧化钠溶液含钠离子数为0.1N A个D.5.6g 铁与足量稀硫酸失去电子数为0.3N A答案:B25、阿伏加德罗常数约为6.02×1023,下列叙述正确的是A.2.24LCO2中含有的原子数为0.3×6.02×1023B.0.1L 3 mol/L NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023C.5.6g 铁粉与硝酸反应失去电子数一定为0.3×6.02×1023D.4.5 g二氧化硅晶体中含有的硅氧键数目为0.3×6.02×1023答案:D26、对相同状况下的12C18O和14N2两种气体,下列说法正确的是A.若质量相等,则质子数相等B.若原子数相等,则中子数相等C.若分子数相等,则体积相等D.若体积相等,则密度相等答案:C27、设NA表示阿伏加德罗常数,下列叙述中正确的是A.常温常压下,11.2L氧气所含的原子数为N AB.1.8g的NH4+离子中含有的电子数为N AC.常温常压下,48gO3含有的氧原子数为3N AD.2.4g金属镁变为镁离子时失去的电子数为0.1N A答案:C28、(2001-16)设N A为阿佛加德罗常数,下列说法不正确的是A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8N AB.18g水中含有的电子数为10N AC.46g 二氧化氮和46g四氧化二氮含有的原子数均为3N AD.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4N A答案:A29、(2002-8)N A为阿佛加德罗常数,下述正确的是A.80g硝酸铵含有氮原子数为2N AB.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为N AC.标准状况下,11.2L四氯化碳所含分子数为0.5 N AD.在铜与硫的反应中,1mol铜失去的电子数为2 N A答案:A30、(2003-3)以N A表示阿佛加德罗常数,下列说法中正确的是A.53g碳酸钠中含N A个CO32-B.0.1molOH-含N A个电子C.1.8g重水(D2O)中含N A个中子D.标准状况下11.2L臭氧中含N A个氧原子答案:B31、设NA为阿佛加德罗常数,下列叙述中正确的是A.46 g NO2和N2O4混合气体中含有原子数为3N AB.标准状况下22.4 L H2中含中子数为2N AC.1L 1mol/L醋酸溶液中离子总数为2N AD.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2N A个电子答案:AD32、N A代表阿伏加德罗常数,下列说法正确的是A.9gD2O中含有的电子数为5N AB.1molMgCl2中含有的离子数为2N AC.1molCH4分子中共价键总数为4N AD.7.1g C12与足量NaOH溶液反应转移的电子数为0.2N A答案:C33、设阿伏加德常数为N A。

化学计算公式大全
1.摩尔质量计算公式:用于计算化合物的摩尔质量,即分子量或原子
量的总和。
M=m/n
其中,M表示摩尔质量,m表示化合物的质量,n表示摩尔数。
2.摩尔浓度计算公式:用于计算溶液中溶质的摩尔浓度。
C=n/V
其中,C表示摩尔浓度,n表示溶质的摩尔数,V表示溶液的体积。
3.溶解度计算公式:用于计算固体在一定温度下溶解于水中的最大量。
S=m/V
其中,S表示溶解度,m表示固体的质量,V表示水的体积。
4.离子积计算公式:用于判断弱电解质的离解程度。
Kw=[H+][OH-]
其中,Kw表示水的离子积,H+表示氢离子浓度,OH-表示氢氧根离子
浓度。
5.酸碱滴定计算公式:用于计算酸或碱的浓度。
Ma某Va=Mb某Vb
其中,Ma表示酸的浓度,Va表示酸的体积,Mb表示碱的浓度,Vb表
示碱的体积。
6.摩尔反应比计算公式:用于计算化学反应中不同物质的摩尔比。
aA+bB→cC+dD
其中,a、b、c、d表示化学计量数。
7.计算氧化还原反应的氧化态变化:用于计算氧化还原反应中氧化态的变化。
O某idation number (ON) = 元素的原子数 + 元素的电荷数
其中,原子数指元素在分子中的数量,如O在H2O中有2个原子,电荷数指元素的形成原子离子时的电荷数,如O2-的电荷数为-2。
8.燃烧反应的化学计量数计算公式:用于计算燃烧反应中产生的CO2和H2O的化学计量数。
CaHb+(a+b/4)O2→aCO2+b/2H2O
其中,a、b为化学计量数。


化学计算公式大全总结
由于化学计算公式种类繁多,下面仅列举一些常见的计算公式大全:
1. 摩尔质量计算公式
摩尔质量 = 分子量/ Avogadro常数
2. 摩尔浓度计算公式
摩尔浓度 = 物质的量 / 溶液体积
3. 质量分数计算公式
质量分数 = 溶质质量 / 溶液质量
4. 体积分数计算公式
体积分数 = 溶质体积 / 溶液体积
5. 溶液的稀释计算公式
C1V1 = C2V2 (C为浓度,V为体积)
6. 化学反应的平衡常数计算公式
Kc = [C]c[D]d/[A]a[B]b (方括号内的字母代表反应物或产物的浓度)
7. 酸碱滴定计算公式
NaVa = NbVb (Na和Nb为酸和碱的摩尔浓度,Va和Vb为滴定体积)
8. 晶体中离子配位数计算公式
CN = n + m - 1 (n为金属离子电荷数,m为配位基团中可提供一个孤对电子的原子数)
9. 气态反应速率常数计算公式
k = Ae^(-Ea/RT) (A为指前因子,Ea为活化能,R为气体常数,T为温度)
以上仅是部分常见的化学计算公式,实际上还有很多其他类型的计算公式需要掌握。
在学习过程中,建议结合具体题目进行练习,以加深对各种计算公式的理解和掌握。
化学计算公式总结化学计算公式是化学中常用的计算工具,可以通过计算物质的量、质量、体积等来研究各种化学现象和反应。
在化学计算中,常用的公式包括摩尔质量计算、摩尔配比计算、质量与物质的量之间的转化关系计算等。
下面是对常用的化学计算公式进行总结。
1.摩尔质量计算公式:摩尔质量是指一个物质的质量与这个物质的物质的量之间的关系。
它的计算公式为:摩尔质量=质量/物质的量其中,摩尔质量的单位是g/mol,质量的单位是g,物质的量的单位是mol。
2.摩尔配比计算公式:摩尔配比是指在一个化学反应中,不同物质之间的摩尔数比值。
它的计算公式为:摩尔配比=物质的量比=物质A的物质的量/物质B的物质的量其中,物质A和物质B可以是元素、化合物或反应物与生成物等。
3.反应物与生成物的质量转化关系计算公式:在化学反应中,反应物与生成物之间的质量存在一定的转化关系,可以通过知道其中一个物质的质量来计算其他物质的质量。
根据化学反应的化学方程式,可以得到质量转化关系的计算公式。
质量转化关系的计算公式可以通过以下示例来说明:假设有一个化学反应方程式:A+B→C+D已知物质A的质量为m1 g,物质A的摩尔质量为M1 g/mol,物质B的摩尔质量为M2 g/mol,物质C的摩尔质量为M3 g/mol,物质D的摩尔质量为M4 g/mol。
根据质量转化关系的定义,可以得到以下公式:物质A的物质的量 = m1 / M1 mol根据化学方程式中物质的量的比例关系,可以得到以下公式:物质B的物质的量=物质A的物质的量×物质B的摩尔配比物质C的物质的量=物质A的物质的量×物质C的摩尔配比物质D的物质的量=物质A的物质的量×物质D的摩尔配比根据物质的摩尔质量和物质的物质的量的关系物质B的质量=物质B的物质的量×物质B的摩尔质量物质C的质量=物质C的物质的量×物质C的摩尔质量物质D的质量=物质D的物质的量×物质D的摩尔质量通过以上公式,可以计算出反应物与生成物的质量之间的转化关系。
化学计算公式大全总结化学是一门基础科学,而计算在化学领域中也起到了举足轻重的作用。
化学计算公式是化学研究和实验工作中常常用到的数学公式,它们能够帮助化学家进行物质性质的计算和预测。
下面将对常见的化学计算公式进行总结和介绍。
1. 摩尔质量的计算公式:摩尔质量是物质单位摩尔内的质量,可以通过化学式中各元素的相对原子质量相加得到。
例如,化学式H2O表示水分子,其中氢原子的相对原子质量为1,氧原子的相对原子质量为16,因此水分子的摩尔质量为2*1 + 16 = 18。
2. 摩尔浓度的计算公式:摩尔浓度是溶液中的溶质的摩尔数与溶液体积之比,可以通过以下公式计算:摩尔浓度 = 溶质的摩尔数 / 溶液的体积例如,如果有100 mL体积的溶液中含有0.1 mol氯化钠(NaCl),则其摩尔浓度为0.1 mol / 0.1 L = 1 mol/L。
3. 溶解度积的计算公式:溶解度积是指在一定温度下,溶液中饱和溶解度的离子乘积,可以通过以下公式计算:溶解度积 = 溶质离子的浓度 * 溶质离子的浓度例如,对于化学式为AgCl的溶液,在25℃下,溶解度积(Ksp)为1.8 x 10^-10 mol^2/L^2,表示在饱和状态下,溶液中Ag+和Cl-离子的浓度乘积为该数值。
4. 碳水化合物的计算公式:碳水化合物的计算公式可以用来确定化合物的糖分子数、醣链长度等。
例如,对于化学式为(C6H10O5)n的多糖,其中n 表示醣链重复单元的个数,可以通过核磁共振(NMR)等实验手段来确定。
5. 热力学公式:热力学公式用于计算化学反应的热力学参数,如焓变、自由能变化等。
其中,焓变(ΔH)可以通过以下公式计算:ΔH = ∑(反应物的生成物的摩尔数 * 反应物之间的热化学反应焓变)自由能变化(ΔG)可以通过以下公式计算:ΔG = ΔH - TΔS其中ΔS为反应物到生成物的熵变,T为温度。
以上是化学计算中常用的一些公式,它们可以帮助化学家计算反应物质的性质、溶液的浓度、溶解度积等参数。
化学计算方法化学计算方法是化学领域中非常重要的一部分,它可以帮助化学家们进行各种复杂的计算,从而更好地理解化学现象和进行实验设计。
化学计算方法主要包括化学方程式的平衡计算、物质的摩尔质量计算、溶液浓度计算、化学反应速率计算等内容。
下面我们将逐一介绍这些计算方法的具体步骤和应用。
首先,化学方程式的平衡计算是化学计算方法中的基础部分。
在化学方程式中,反应物和生成物的摩尔比需要保持一定的比例,这就是化学方程式的平衡。
平衡计算的步骤包括编写化学方程式、列出反应物和生成物的摩尔数、根据摩尔比进行平衡计算等。
通过平衡计算,我们可以确定反应物的摩尔数和生成物的摩尔数,从而更好地理解化学反应的过程。
其次,物质的摩尔质量计算也是化学计算方法中的重要内容。
物质的摩尔质量是指单位物质的质量所含有的摩尔数,通常用符号M表示。
摩尔质量计算的步骤包括查找元素的原子质量、计算分子或离子的摩尔质量、根据化学式计算化合物的摩尔质量等。
通过摩尔质量计算,我们可以准确地确定化合物的质量和摩尔数,为实验设计和数据分析提供重要参考。
此外,溶液浓度计算也是化学计算方法中的重要内容之一。
溶液的浓度是指单位溶液中溶质的质量或摩尔数,通常用符号C表示。
溶液浓度计算的步骤包括确定溶质的质量或摩尔数、计算溶液的体积、根据公式计算溶液的浓度等。
通过溶液浓度计算,我们可以准确地控制溶液的浓度,从而满足实验的需要。
最后,化学反应速率计算也是化学计算方法中的重要内容之一。
化学反应速率是指单位时间内反应物消耗或生成物产生的摩尔数,通常用符号v表示。
化学反应速率计算的步骤包括确定反应物的摩尔数变化、计算反应物的浓度变化、根据反应速率公式计算反应速率等。
通过化学反应速率计算,我们可以了解化学反应的速率规律,为实验设计和反应机理研究提供重要参考。
总之,化学计算方法是化学研究和实验设计中不可或缺的一部分,它可以帮助化学家们更好地理解化学现象和进行实验设计。
通过化学方程式的平衡计算、物质的摩尔质量计算、溶液浓度计算和化学反应速率计算,我们可以准确地进行各种复杂的化学计算,为化学研究和实验设计提供重要参考。
化学工程专业计算方法与公式大全化学工程是一门综合性较强的学科,涉及到许多复杂的计算和公式。
在化学工程实践中,准确的计算和使用适当的公式是非常重要的。
本文将介绍一些常用的化学工程计算方法和公式,以帮助化学工程专业的学生和从业人员更好地理解和应用这些知识。
一、物质的量和摩尔质量计算1. 物质的量计算公式:物质的量(mol)= 质量(g)/ 相对分子质量(g/mol)2. 摩尔质量计算公式:摩尔质量(g/mol)= 质量(g)/ 物质的量(mol)二、浓度计算1. 溶液浓度计算公式:浓度(mol/L)= 物质的量(mol)/ 溶液体积(L)2. 质量浓度计算公式:质量浓度(g/L)= 质量(g)/ 溶液体积(L)三、气体的状态方程1. 理想气体状态方程:PV = nRT其中,P为气体的压力(Pa),V为气体的体积(m³),n为气体的物质的量(mol),R为气体常数(J/(mol·K)),T为气体的温度(K)。
2. 范德瓦尔斯方程:(P + a(n/V)²)(V - nb) = nRT其中,a和b分别为范德瓦尔斯常数,根据不同气体的性质而定。
四、反应速率计算1. 反应速率计算公式:反应速率= Δ物质的量/ Δ时间其中,物质的量可以是物质的摩尔数、质量或体积等。
2. 反应级数计算公式:反应级数= Δ物质的量B / Δ物质的量A其中,A和B分别为反应物和生成物。
五、能量计算1. 热容计算公式:热容(C)= 热量(Q)/ 温度变化(ΔT)2. 燃烧热计算公式:燃烧热(Q)= 质量(m)×燃烧热值其中,燃烧热值是物质燃烧时释放出的热量。
六、反应平衡计算1. 平衡常数计算公式:平衡常数(K)= 反应物浓度的乘积 / 生成物浓度的乘积其中,浓度可以根据实验数据或计算得出。
2. 平衡浓度计算公式:平衡浓度(mol/L)= 初始浓度(mol/L)×反应系数七、传质计算1. 质量传递速率计算公式:质量传递速率(mol/(m²·s))= 质量传递系数(mol/(m²·s))×浓度差(mol/m³)2. 热传导计算公式:热传导速率(W)= 热传导系数(W/(m·K))×温度梯度(K/m)以上仅为化学工程中部分常用的计算方法和公式,根据具体情况还有其他更多的计算方法和公式可供使用。
化学计算部分一、基本概念计算1、溶液浓度例题1:密度为1.45g·cm-3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止,已知沉淀物的质量与原硫酸溶液的质量相等,则原硫酸溶液的浓度为()A、29. 6%B、42.1%C、14.8mol/LD、6.22mol/L2、溶解度计算例题2:t℃时,将某硝酸钾溶液,第一次蒸发掉10g水,冷却到原温度无晶体析出;第二次蒸发掉10g水,冷却到原温度析出晶体3g,第三次蒸发掉10g水,冷却到原温度时析出晶体质量应为()A、等于3gB、大于或等于3gC、小于或等于3gD、无法确定3、溶液稀释例题3:密度为0.91g/cm3的氨水,质量百分比浓度为25%(即质量分数为25%),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度()A、等于12.5%B、大于12.5%C、小于12.5%D、无法确定例题4:将质量分数分别为5X%和X%的硫酸等体积混合后,其质量分数为()A、大于3X%B、等于3X%C、小于3X%D、无法确定例题5:质量分数相同的浓氨水和浓氢氧化钠溶液,各取等体积分别与等体积水混合,所得氨水质量分数为a%,所得氢氧化钠溶液质量分数为b%,问a与b关系。
二、化学计算方法(一)守恒法例题6:体积比是3:2:1、同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液,溶液中Cl-浓度比是()A、3:2:1B、1:2:3C、1:1:1D、3:4:3例题7:在S+2KNO3+3C=3CO2+K2S+N2↑的反应中,若有32g S被还原,则被S氧化的C质量是()A、36gB、24gC、12gD、6g例题8:在150℃时,加热高氯酸铵发生分解反应:2NH4ClO4 N2↑+Cl2↑+2O2↑+4H2O ↑其气态生成物组成的混合气的平均相对分子质量为()A、40.75B、29.375C、14.69D、无法计算例题9:将Na2CO3·10H2O和NaHCO3组成的混合物5.38g,溶于水制成100mL溶液,其中Na+的浓度为0.4mol/L,若将等质量的该混合物加热至恒重,计算所得固体的质量为。
例题10:某混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-,另一种离子为SO42-,则SO42-为()A、0.1 molB、0.3 molC、0.5 molD、0.15 mol例题11:现有一定质量露置于空气中的KOH样品,测得其含KOH为90%,K2CO3为8%,H2O为2%,现向里加100g质量分数为14.6%的盐酸溶液恰好完全反应,问把溶液蒸干可得晶体多少g?例题12:有某种浓度的盐酸,将一定量的该盐酸分成三等份A、B、C。
往A中加入适量蒸馏水稀释,往B中滴加少许AgNO3溶液,过滤后保留原溶液,C保持原样,现以相同浓度的NaOH溶液中和以上三种溶液至中性,消耗NaOH溶液的体积分别为V A、V B、V C,则它们的大小关系正确的是()A、V A=V C>V BB、V A<V B<V CC、V A>V C>V BD、V A=V B=V C(二)、极限法例题13:向10g不纯净的碳酸钙(杂质可能是①SiO2 ②MgCO3③Na2CO3 ④KHCO3中的一种)中,加入过量的稀盐酸,充分反应并将所产生的CO2全部收集,体积为2.22L(标准状况),则这种杂质可能是()A、②B、④C、①或③D、①或④例题14:常温下,向20升真空容器内通入a mol H2S和b mol SO2(a和b都是正整数,且a ≤5,b≤5)。
反应(2H2S+SO2=3S+H2O)完全后,容器内气体可能达到的最大密度约是()A、24.5g/LB、14.4g/LC、8g/LD、5.1g/L(三)、差量法例题15:二硫化碳(CS2,液态)能够在氧气中完全燃烧生成CO2和SO2,若将0.228g CS2在448mLO2(标准状况)中充分燃烧后,所得的混合气体在标准状况下的体积为()A、112mLB、224mLC、336mLD、448mL例题16:将过量的铁粉投入到H2SO4和CuSO4的混和溶液中,充分反应后把溶液过滤,称得滤渣的质量跟投入铁粉的质量相等,求原混和液中H+的物质的量浓度与Cu2+的物质的量浓度之比。
例题17:一定量的碳酸氢钠和铜的混合物在空气中加热至质量不再变化,发现前后质量相等,求碳酸氢钠质量分数。
例题18:88.5gNa和K混合物投入水中,完全反应后将气体还原氧化铜,反应后称量固体质量减轻24g,求钠和钾的物质的量之比。
(四)、观察法:例题19:由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是()A、29:8:13B、21:1:14C、13:8:29D、26:16:17例题20:120℃时,将0.2gH2和2.8gCO的混合气体与足量O2充分燃烧后,立即将所得混合气体通过足量Na2O2粉末,固体质量将增加()A、2.8gB、3.0gC、7.2gD、无法确定化学计算部分例题1:H2SO4+BaCl2=BaSO4↓+2HClw(H2SO4)=m(H2SO4)/m(H2SO4溶液)=m(H2SO4)/m(BaSO4)=98/233=0.421C=1000ρw/M=1.45 g/mL×1000 mL×0.421/98 g/mol=6.22 mol/L答案:BD例题2:第二步溶液由不饱和(也可能饱和)蒸发10g水变为饱和时析出3g晶体,说明10g水能溶解的溶质大于或等于3g。
答案:B例题3、4、5这三道题均为溶液稀释问题中的等体积混合与等质量混合所得溶液浓度比较问题。
需要明确以下几点:①若溶液密度>1(水的密度),如硫酸溶液、氢氧化钠溶液等,则浓度越大,密度越大;若溶液密度<1,如氨水,则浓度越大,密度越小;②若溶液密度>1,则(与水或与同种溶液)混合所得溶液浓度:等体积>等质量;若溶液密度<1,则(与水或与同种溶液)混合所得溶液浓度:等体积<等质量;③对于同种溶液,物质的量浓度与溶质的质量分数均表示一定量的溶液中所含溶质的多少,所以物质的量浓度越大,溶质质量分数必然越大。
答案:C、A、b>a例题6:三种溶液溶质的物质的量浓度相同,则Cl-的浓度之比为1:2:3,与溶液体积无关。
答案:B例题7:根据电子守恒,1 mol S 被还原必有0.5 molC被S氧化,即32g S 能氧化6gC。
答案:D注意:该反应中被KNO3氧化的C不能计算在内。
例题8:M=m总/n总假设有2mol NH4ClO4分解,根据质量守恒m总=2×M (NH4ClO4)=2×117.5g=235gn总=8 mol∴M=235g/8mol =29.375 g/mol答案:B注意:本题分析时要从平均分子质量的基本概念入手,根据生成物均为气态产物,善用假设,再利用质量守恒从而将题解出。
例题9:该混合物加热至恒重后为Na2CO3,根据原子守恒,Na原子物质的量等于0.04mol,所以Na2CO3固体物质的量必为0.02mol即2.12g。
答案:2.12g例题10:根据电荷守恒,n(正电荷总数)=n(负电荷总数)0.2mol×1+0.25mol×2=0.4mol×1+2xNa+Mg2+Cl-SO42-x=0.15mol答案:D例题11:本题看似复杂,计算量大,实际只要抓住最终固体为NaCl,根据Cl元素守恒:n(NaCl)=n(HCl)=100 g×14.6%/36.5 g/mol=0.4molm(NaCl)=58.5 g/mol×0.4mol=23.4g答案:23.4g例题12:根据H+守恒,消耗等浓度的NaOH体积必为1:1:1。
答案:D例题13:本题利用平均值的思想,采用假设法。
假设10g均为CaCO3,与过量盐酸反应产生的CO2体积恰好为2.24L>2.22L;假设10g均为杂质,与过量盐酸反应生成的CO2必小于2.22L,则①③满足题意。
答案:C例题14:由于容器体积固定,气体密度最大即气体质量最大,即气体物质的量与式量的乘积最大。
假设H2S剩余:2H2S+SO2=3S+H2O2b bn(H2S)剩余=(a-2b)molρ=m/V=〔(a-2b)×34 〕/20 g/La=5、b=1时ρ达到最大值5.1g/L假设SO2剩余:2H2S + SO2 = 3S+H2Oa0.5an(SO2)剩余=(b-0.5a)molρ=m/V=〔(b-0.5a)×64 〕/20g/La=1、b=5时ρ达到最大值14.4g/L答案:B例题15:CS2(l)+3O2(g)=CO2(g)+2SO2(g)该反应为反应前后气体分子数不变的反应,根据阿伏加得罗定律,反应前后气体体积不变,所以最后混合气体的体积仍为448mL。
答案:D例题16:设与酸反应的Fe的物质的量为a mol ,与CuSO4溶液反应的Fe为b mol。
滤渣质量与投入的铁粉质量相等,则析出的铜的质量与消耗的铁的质量相等,即:m(Cu)=m(Fe)64b=56(a+b)a:b=1:7根据题意:Fe ~2H+Fe ~Cua2a b bC(H+):C(CuSO4)=n(H+):n(Cu2+)=2a:b=2:7例题17:设混合物中NaHCO3物质的量为a,Cu物质的量为b。
2NaHCO3~H2O~CO2△m=m(CO2+H2O)Cu~CuO△m=m(O)根据题意:m(CO2+H2O)=m(O)31a=16bNaHCO3%=84a/(84a+64b)=21/52×100% = 40.38%例题18:CuO ~Cu ~H2 ~2M1mol1mol2mol△m=16gxmol△m=24g∴x=3mol混合金属平均式量=88.5g/3mol=29.5g/mol设混合金属中Na物质的量为a mol,K物质的量为bmol,23a+39b=29.5(a+b)a:b=19:13例题19:CO与N2的式量相等,所以同温同压下混合气体中CO的存在不影响混合气体的密度。
则题目简化为CO2和H2的二元混合气。
根据阿伏加得罗定律推论,CO2和H2的平均式量为28,利用十字交叉或二元一次方程组解得混合气体中CO2与H2的体积比为13:8,CO为任意比。
答案:CD注意:三元混合物的题目必然存在内在联系,解题时要注意观察化学式的组成、式量、化学方程式的化学计量数等信息,找出联系,简化解题步骤。
例题20:根据关系式,H2和CO在先被氧化再被Na2O2吸收的过程中先得氧,再失去等量的氧,所以固体增加的就是H2和CO的质量。