-第四章 配合物的电子光谱复习过程
- 格式:ppt
- 大小:1.53 MB
- 文档页数:66




配位化学基础一、基础知识:①定义:配合物是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。
如[Cu(NH3)4]2+、[Ag(CN)2]—离子等均为配离子。
配离子与带有异电荷的离子组成的中性化合物,如配盐[Cu(NH3)4]SO4、[Cu(H2O)4]SO4·H2O,配酸H2PtCl6],配碱[Cu(NH3)4](OH)2等都称为配合物。
不带电荷的中性分子如Ni(CO)4,[Co(NH3)3C13],就是中性配合物,或称配位分子。
②组成:中心离子(原子)、配体、配位原子,内界、外界,配位数。
③命名:(配体数)配体名称+ 合+ 中心原子名称(氧化数)配体多种时,一般先简单后复杂,先离子后分子,先无机后有机。
同类配体按配位原子元素符号的英文字母顺序。
一些常见的配合物,也可用简称或俗名。
④配合物的立体化学:a.中心离子的配位数:b.中心离子的杂化及空间立体构型c. 配合物的异构现象:因空间排列方式不同所引起的异构的现象——立体异构现象(几何异构及旋光异构等)。
因原子间连接方式不同所引起的异构现象——化学结构异构现象(键合异构、电离异构、配位异构、水合异构、配体异构及聚合异构等)。
⑤类型:※从中心离子分:单核、双核、多核※从配体中的配位原子数目分:普通(简单)配合物:中心原子一个,配体为单基(单齿);螯合物:多基(多齿)配体形成的环状配合物。
成环对配合物稳定性起增强作应(螯和合效应,ΔS<0 。
理想的螯合剂要求配位原子多(环多稳定性好);配位原子间要有二至三个原子间隔(形成五、六元环稳定)。
※从配体类型分:普通配合物、N2分子配合物、羰基配合物、大环配合物等※⑥磁性:忽略轨道对磁矩的贡献时:μ= n(n+2)⑦化学键理论价键理论(VBT):a配位键的本质b杂化与配离子的空间构型:配位数 2 3 4 5 6杂化方式sp sp2sp3dsp2dsp3sp3d d2sp2d2sp3sp3d2空间构型实例c内轨型外轨型d高自旋低自旋配体电子进入中心离子的外层空轨道ns np nd 时,中心离子的电子不发生重排,电子按自旋最大的状态排布,称为外轨型或高自旋。



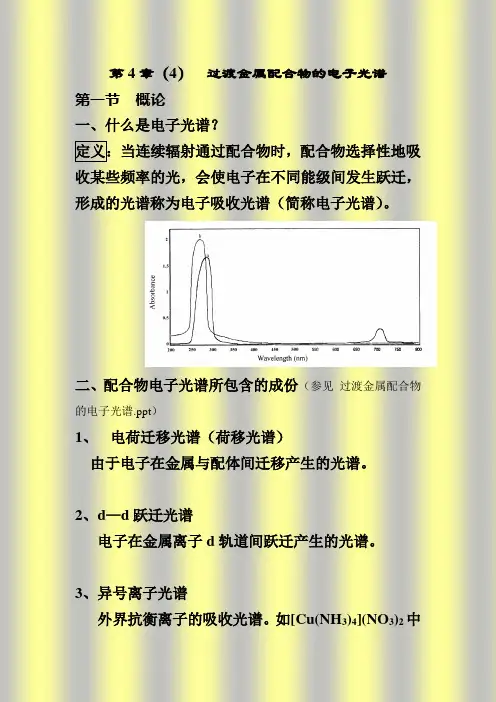
二、配合物电子光谱所包含的成份(参见过渡金属配合物.ppt)电荷迁移光谱(荷移光谱)由于电子在金属与配体间迁移产生的光谱。
—轨道角量子数注*矢量用黑体字母表示。
*角动量:就是质量乘以角速度(单位角度/秒)。
自旋角动量:角动量是由物体自旋产生的,而不是外力给它的。
轨道角动量:角动量是由轨道运动产生的2、电子间相互作用在多电子体系中,l i与l j主要是通过电性相互作用;而s i与l i或s j之间则主要通过磁性作用。
s i s jl i l j对轻元素(原子序数<30),电子间偶合强于电子内偶合,即:l i——l js i——s j的作用要大于s i——l i的作用。
此时电子间相互作用,可用L—S偶合方案处理:(参见L—S偶合方案.pdf)Σl L (总轨道角动量)Σs S (总自旋角动量)即可用L、S描述多电子体系的状态。
│S│=[S(S+1)]1/2(h/2π) │L│=[L(L+1)] 1/2(h/2π)S——总自旋角量子数L——总轨道角量子数如何求S、L见“物质结构”。
3、d n组态金属离子的谱项多电子体系的能量状态可用谱项符号表示:2S+1L L 0 1 2 3 4 5符号S P D F G H(2S+1)为谱项的自旋多重度。
如S=1/2,L=2时,为2D谱项。
组态谱项d1 d92Dd2 d83F,3P,1G,1D,1Sd3 d74F,4P,2H,2G,2F,2x2D,2Pd4d65D,3H,3G,2x3F,3D,2x3P,1I,2x1G,1F,2x1D,2x1Sd56S,4G,4F,4D,4P,2I,2H,2x2G,2x2G,2x2F,3x2D,2P,2S* d n体系,不考虑电子间作用时,只有一种能量状态。
考虑电子间作用后,产生多个能量状态(谱项)。
d1体系除外,因其只含一个电子。
4、基态谱项1)定义:能量最低的谱项称为基态谱项(基谱项)。
1)如何确定基谱项?A、同一电子组态的各谱项中,自旋多重度最大者能量最低。


